
- •1Врач-анестезиолог, отделение общей анестезиологии, Кливлендский клинический фонд, Кливленд, Огайо, сша.
- •Классификация нервных волокон
- •Электромиография и исследование нервно-мышечной проводимости
- •1Вместо лидокаина можно использовать хлоропрокаин.
- •1В состав гидрокодонсодержащих препаратов входит также и ацетаминофен (викодин, др.).
- •1В состав оксикодонсодержащих препаратов может входить ацетаминофен (перкоцет) или аспирин (перкодан).
- •1В состав некоторых пропоксифенсодержащих препаратов входит ацетаминофен (дарвоцет).
- •1В большинстве случаев авторы не рекомендуют проведение постоянной поддерживающей инфузии.
- •Раздел IV
- •1. Частота сердечных сокращений
- •2. Ударный объем
- •1. Функциональные кривые желудочка
- •2. Оценка систолической функции
- •Фракция выброса
- •3. Оценка диастол ической функции
- •Эндотелиальные факторы
- •Анатомия и физиология коронарного кровообращения
- •1. Анатомия
- •2. Факторы, определяющие величину коронарного кровотока
- •3. Кислородный баланс в миокарде
- •Потребность миокарда в кислороде
- •I. Наджелудочковые аритмии
- •II. Желудочковые аритмии
- •2. Выбор анестетиков и вспомогательных средств:
- •1. Общие принципы
- •2. Премедикация
- •1. Митральный стеноз
- •2. Митральная недостаточность
- •3. Пролапс митрального клапана
- •4. Аортальный стеноз
- •5. Гипертрофическая кардиомиопатия
- •6. Аортальная недостаточность
- •7. Трикуспидальная недостаточность
- •Гипоплазия левых отделов сердца
- •1. Обструктивные поражения
- •2. Простые шунты
- •3. Сложные шунты
- •Внесердечные заболевания
- •Гипогликемия
- •1Частота импульсов автоматически изменяется в зависимости от потребности в сердечном выбросе.— Примеч. Пер.
- •1. Преиндукционный период
- •2. Индукция анестезии
- •3. Предперфузионный период
- •4. Перфузионный период
- •5. Завершение ик
- •6. Постперфузионный период
- •7. Послеоперационный период
- •Анестезия при трансплантации сердца
- •1. Тампонада сердца
- •2. Констриктивныи перикардит
- •Расслаивание аорты
- •1. Аэробный метаболизм
- •2. Анаэробный метаболизм
- •3. Влияние анестезии на клеточный метаболизм
- •1. Грудная клетка и дыхательная мускулатура
- •2. Трахеобронхиальное дерево
- •3. Кровообращение и лимфоток в легких
- •4. Иннервация
- •1.Эластическое сопротивление
- •2. Легочные объемы
- •3. Неэластическое сопротивление
- •4. Работа дыхания
- •5. Влияние анестезии на механику дыхания
- •1. Вентиляция
- •2. Легочный кровоток
- •3. Шунты
- •4. Влияние анестезии на газообмен
- •Напряжение газов в альвеолах, артериальной и венозной крови
- •1.Кислород
- •Высокий альвеолярно-артериальный градиент по кислороду
- •2. Углекислый газ
- •1.Кислород
- •2. Углекислый газ
- •1. Дыхательные центры
- •2. Центральные рецепторы
- •3. Периферические рецепторы
- •4. Влияние анестезии на регуляцию дыхания
- •Состояния, при которых необходима раздельная вентиляция легких
- •Тяжелая гипоксемия при заболевании одного легкого
- •1. Опухоли
- •2. Легочные инфекции
- •3. Бронхоэктазы
- •1. Предоперационный период
- •2. Интраоперационный период
- •3. Послеоперационный период
- •Анестезия при торакоскопических операциях
- •Легочный лимфангиоматоз
- •1. Предоперационный период
- •2. Интраоперационный период
- •3. Послеоперационный период
- •1. Церебральное перфузионное давление
- •2. Ауторегуляция мозгового кровообращения
- •3. Внешние факторы
- •Внутричерепное давление
- •Влияние анестетиков и вспомогательных средств на цнс
- •1. Испаряемые анестетики
- •Мк и внутричерепной объем крови
- •2. Закись азота
- •1.Для индукции анестезии
- •2. Вспомогательные средства
- •3. Вазопрессоры
- •4. Вазодилататоры
- •5. Миорелаксанты
- •Патологическое пристрастие к алкоголю и наркотическим препаратам
- •Как проводят эст?
- •Неосмотическая секреция адг
- •Гиперосмоляльность и гипернатриемия
- •Гипернатриемия при низком содержании натрия в организме
- •Гипоосмоляльность и гипонатриемия
- •Гипонатриемия с повышенной осмоляльностью плазмы
- •Застойная сердечная недостаточность
- •Внепочечные потери
- •Тяжелая физическая нагрузка
- •Изолированное снижение секреции калия в дистальном отделе нефрона
- •Повышенное поступление калия
- •Гиперкальциемия
- •Клинические проявления гиперкальциемии
- •1.Гемолитические реакции
- •2. Негемолитические иммунные реакции
- •Нитропруссид
- •Кислоты и основания
- •Сопряженные пары и буферы
- •Клинические нарушения
- •Компенсаторные механизмы
- •Нервно-мышечные нарушения
- •Травмы и заболевания грудной клетки
- •Болезни плевры
- •Обструкция дыхательных путей
- •Наследственные нарушения обмена веществ
- •Центральная стимуляция дыхания
- •Хлоридчувствительный метаболический алкалоз
- •1. Антагонисты альдостерона
- •2. Неконкурентные калийсберегающие диуретики
- •Сердечно-сосудистая система
- •Предоперационное обследование
- •Миорелаксанты
- •Предоперационный период
Раздел IV
Анестезиологическое пособие
Физиология кровообращения и анестезия 19
Анестезиолог должен иметь фундаментальные знания по физиологии кровообращения, которые необходимы как для понимания научных основ специальности, так и для практической работы. В этой главе обсуждаются вопросы физиологии сердца и большого круга кровообращения, а также патофизиологии сердечной недостаточности. Малый (легочный) круг кровообращения рассматривается в главе 22, физиология крови и обмен веществ — в главе 28.
Система кровообращения состоит из сердца и кровеносных сосудов. Она предназначена для снабжения тканей кислородом и питательными веществами и удаления продуктов метаболизма. Сердце перекачивает кровь через две сосудистые системы. В малом круге кровообращения кровь обогащается кислородом и избавляется от углекислого газа. В большом круге — доставляет кислород к тканям и поглощает продукты метаболизма, которые затем элиминируются через легкие, почки или печень.
Сердце
Анатомически сердце представляет собой единый орган, но функционально оно делится на правый и левый отделы, каждый из которых состоит из предсердия и желудочка. Предсердия служат как проводниками для крови, так и вспомогательными насосами для заполнения желудочков. Желудочки выполняют роль главных насосов, перекачивающих кровь. Правый желудочек получает дезоксигенированную кровь из большого круга кровообращения и перекачивает ее в малый круг. Левый желудочек получает оксигенированную кровь из малого круга кровообращения и перекачивает ее в большой круг. Четыре клапана обеспечивают однонаправленный поток крови через каждую камеру. Насосная функция сердца обеспечивается сложной последовательностью электрических и механических явлений.
Сердце состоит из специализированной поперечнополосатой мышечной ткани, заключенной в соединительнотканный каркас. Клетки сердечной мышцы — кардиомиоциты — подразделяются на предсердные, желудочковые, водителей ритма и проводящей системы. Способность кардиомиоцитов к самовозбуждению и их уникальная организация позволяют сердцу функционировать как высокоэффективному насосу. Последовательные соединения между отдельными кардиомиоцитами (вставочные диски), имея низкое сопротивление, обеспечивают быстрое и упорядоченное распространение электрического импульса в каждой камере сердца. Волна возбуждения распространяется от одного предсердия к другому и от одного желудочка к другому по проводящим путям. Связь между предсердиями и желудочками осуществляется не непосредственно, а через АВ-узел, поэтому возбуждение передается с задержкой. За счет этого происходит наполнение желудочка при сокращении предсердия.
Потенциалы действия кардиомиоцитов
Мембрана кардиомиоцита проницаема для ионов К+, но относительно непроницаема для ионов Na+. Мембраносвязанная Ка+/К+-зависимая АТФ-аза перекачивает ионы К+ внутрь клетки, а ионы Na+ из клетки (глава 28). Концентрация К+ внутри клетки выше, чем во внеклеточном пространстве. Концентрация Na+, наоборот, выше во внеклеточном пространстве, чем внутри клетки. Относительная непроницаемость мембраны для кальция поддерживает высокий градиент концентрации кальция между внеклеточным пространством и цитоплазмой. Выход К+ из клетки по градиенту концентрации приводит к потере суммарного положительного заряда внутри клетки. Анионы не сопровождают ионы К+, поэтому возникает электрический потенциал, причем внутренняя поверхность клеточной мембраны заряжается отрицательно по отношению к наружной. Таким образом, мембранный потенциал покоя формируется в условиях равновесия между двумя противоположными силами: движением К+ по градиенту концентрации и электрическим притяжением отрицательно заряженным внутриклеточным пространством положительно заряженных ионов К+.
В норме мембранный потенциал покоя кардиомиоцита желудочка варьируется от -80 до -90 мВ. Если мембранный потенциал становится менее отрицательным и достигает пороговой величины, то в кардиомиоците, как и в клетках других возбудимых тканей (нерв, скелетная мышца), возникает потенциал действия, т. е. происходит деполяризация (рис. 19-1 и табл. 19-1). Потенциал действия вызывает преходящее увеличение мембранного потенциала кардиомиоцита до +20 мВ. В отличие от потенциала действия нейрона (гл. 14), в потенциале действия кардиомиоцита за пиком следует фаза плато, которая длится 0,2-0,3 с. Потенциал действия скелетной мышцы и нерва обусловлен лавинообразным открытием быстрых натриевых каналов мембраны, потенциал действия кардиомиоцита вызывается открытием как быстрых натриевых каналов (фаза начальной быстрой репо-ляризации), так и медленных кальциевых каналов (фаза плато). Кроме того, деполяризация сопровождается преходящим уменьшением проницаемости мембраны для калия. В последующем проницаемость мембраны для калия восстанавливается, натриевые и кальциевые каналы закрываются и мембранный потенциал возвращается к исходному уровню.
После деполяризации клетки рефрактерны (невосприимчивы) к деполяризующим стимулам до наступления 4-й фазы. Эффективный рефрактерный период равен минимальному интервалу между двумя импульсами, вызвавшими распространение возбуждения. В быстропроводящих кардиомиоцитах эффективный рефрактерный период практически равен продолжительности потенциала действия. В медленнопроводящих кардиомиоцитах, напротив, эффективный рефрактерный период может превышать продолжительность потенциала действия.
Возникновение и распространение сердечного импульса
В норме электрические импульсы в сердце вырабатываются синусовым узлом — группой специализированных клеток, расположенных в стенке правого предсердия впереди от отверстия верхней полой вены. Мембрана этих клеток характеризуется повышенной проницаемостью для натрия и, возможно, кальция. Медленный ток натрия приводит к снижению потенциала покоя клеток синусового узла (-50— -60 мВ против -80— -90 мВ в кардиомиоцитах желудочков) и имеет три важных следствия: постоянную инактивацию быстрых натриевых каналов; потенциал действия с порогом -40 мВ, обусловленный в первую очередь движением ионов через медленные кальциевые каналы; регулярную спонтанную деполяризацию. В диастолу поступление натрия в клетку приводит к тому, что мембрана клетки постепенно становится все менее отрицательной; когда достигается пороговый потенциал, то открываются кальциевые каналы, уменьшается проницаемость мембраны для калия и развивается потенциал действия. Восстановление нормальной проницаемости для калия возвращает клетки синусового узла в состояние покоя.
ТАБЛИЦА 19-1. Потенциал действия кардиомиоцита
|
Фаза |
Название |
Событие |
Движение ионов |
|
0 |
Деполяризация |
Активация (открытие) быстрых Nа+-каналов и снижение проницаемости мембраны для К+ |
Na+ поступает в клетку |
|
1 |
Начальная быстрая |
Инактивация Na+-каналов и преходящее увеличение реполяризация проницаемости мембраны для К+ |
К+ выходит из клетки |
|
2 |
Плато |
Активация медленных Са2+-каналов |
Са2+ поступает в клетку |
|
3 |
Конечная быстрая |
Инактивация Са2+-каналов и увеличение реполяризация проницаемости мембраны для K+ |
К+ выходит из клетки |
|
4 |
Потенциал покоя или |
Восстановление исходной проницаемости мембраны кардиомиоцитов предсердий и желудочков |
К+ выходит из клетки |
|
|
Диастолическая деполяризация |
Медленный ток Na+ и, возможно, Са2+ внутрь клеток, приводящий к спонтанной деполяризации |
Na+ поступает в клетку ? Ca2+ поступает в клетку |
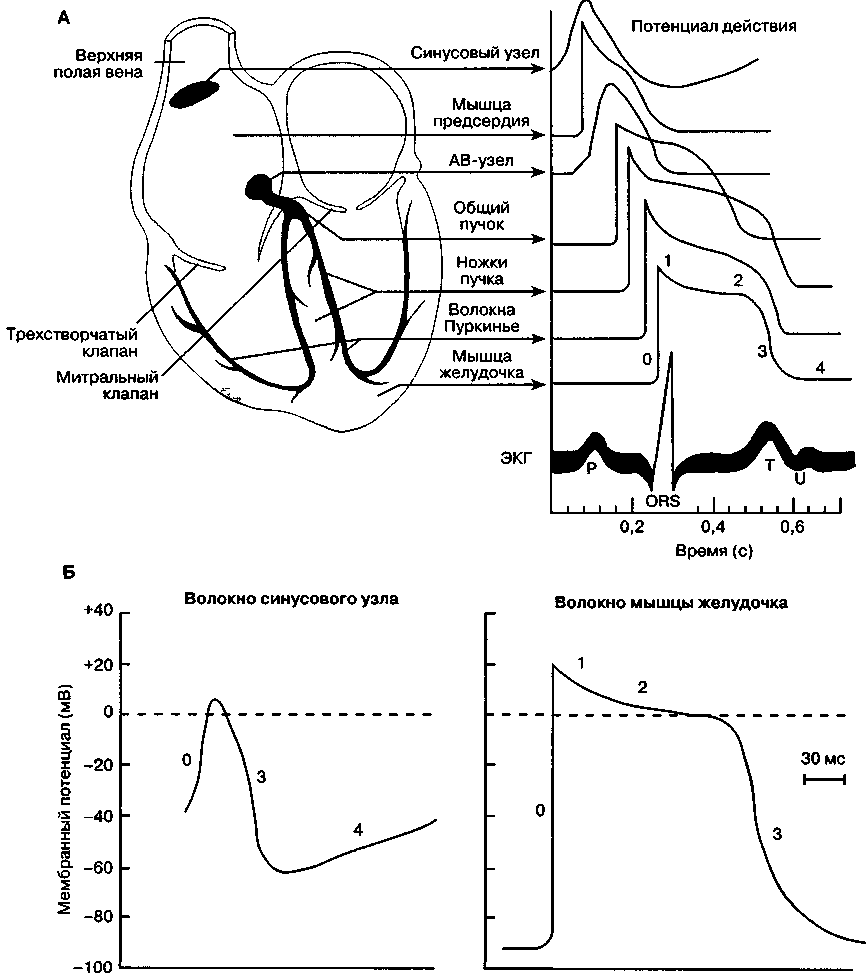
Рис. 19-1. Потенциалы действия сердца. А. Характеристика потенциалов действия различных отделов сердца. Б. Клетки пейсмекера синусового узла характеризуются отчетливой спонтанной диастолической деполяризацией, в них значительно слабее выражены четкие фазы потенциала действия, в отличие от клеток миокарда предсердия или желудочка. Смотрите табл 19-1 для объяснения различных фаз потенциала действия. (С изменениями. Из: Ganong W. F. Review of Medical Physiology, 16th ed Appleton & Lange, 1993.)
Импульс, возникший в синусовом узле, в нормальных условиях быстро распространяется по предсердиям и к АВ-узлу. Специализированные волокна проводят возбуждение как к левому предсердию, так и к АВ-узлу. АВ-узел расположен с правой стороны межпредсердной перегородки, впереди от отверстия венечного синуса и над перегородочной створкой трехстворчатого клапана. В АВ-узле выделяют три отдельные области: верхнюю, среднюю и нижнюю. Средняя область АВ-уз-ла не обладает внутренней спонтанной активностью (автоматизмом), в то время как верхняя и нижняя области способны вырабатывать импульсы. В физиологических условиях водителем ритма является синусовый узел, потому что частота его спонтанной диастолической деполяризации выше, чем в верхней и нижней областях АВ-узла, где она составляет 40-60 мин-1. Любой фактор, уменьшающий частоту деполяризации синусового узла или увеличивающий автоматизм верхней и нижней областей АВ-узла, способствует возникновению АВ-узлового ритма.
Импульсы из синусового узла в норме достигают АВ-узла через 0,04 с и покидают его через последующие 0,11 с. Эта задержка связана с низкой скоростью проведения возбуждения в тонких волокнах внутри АВ-узла, что в свою очередь определяется активацией медленных кальциевых каналов. Напротив, проведение импульса между примыкающими друг к другу клетками в предсердиях и желудочках определяется активацией и инактивацией быстрых натриевых каналов. Волокна, отходящие от нижней части АВ-узла, образуют пучок Гиса. Эта специализированная группа волокон проходит в межжелудочковую перегородку, а затем разделяется на левую и правую ножки, разветвляющиеся в сложную сеть волокон Пуркинье, которые деполяризуют оба желудочка. Волокна Гиса-Пуркинье разительно отличаются от ткани АВ-узла: они имеют наиболее высокую скорость проведения в сердце, что приводит к почти одновременной деполяризации эндокарда обоих желудочков (в норме это занимает 0,03 с). Распространение возбуждения от эндокарда к эпикарду через миокард требует еще 0,03 с. Таким образом, импульсу, возникающему в синусовом узле, в нормальных условиях необходимо менее 0,2 с для деполяризации всего сердца.
Галотан, энфлюран и изофлюран угнетают автоматизм синусового узла. С другой стороны, данные препараты оказывают лишь весьма умеренное непосредственное влияние на АВ-узел, увеличивая время проведения возбуждения и рефрактерность. Сочетание этих эффектов позволяет объяснить высокий риск возникновения АВ-узловой тахикардии в тех случаях, когда на фоне ингаляционной анестезии для лечения синусовой брадикардии применяют холиноблокаторы: скорость водителей ритма в АВ-узле возрастает в большей степени, чем таковая в синусовом узле. Электрофизиологические эффекты ингаляционных анестетиков на волокна Пуркинье и миокард желудочков имеют сложный характер из-за участия в процессе вегетативной нервной системы. Описаны как антиаритмические, так и аритмогенные свойства анестетиков. Первые могут быть обусловлены прямым подавлением потока Са2+ внутрь клетки, вторые — потенцированием действия катехоламинов (гл. 7). Для возникновения аритмогенного эффекта необходима активация как альфа1-, так и 3-адренорецепторов.
Токсическая концентрация местных анестетиков в крови сопряжена с риском развития электрофизиологических нарушений в сердце. Лидокаин способен оказывать антиаритмическое действие при низкой концентрации в крови (гл. 48). При высокой концентрации в крови местные анестети-ки подавляют проведение возбуждения в сердце, связываясь с быстрыми натриевыми каналами. Самые мощные местные анестетики — бупивакаин и, в меньшей степени, этидокаин и ропивакаин, по-видимому, оказывают наиболее сильное влияние на сердце, особенно на волокна Пуркинье и миокард желудочков. Бупивакаин связывается с инак-тивированными быстрыми натриевыми каналами (и затем медленно диссоциирует), что приводит к возникновению тяжелой синусовой брадикардии, остановки синусового узла, а также опасной для жизни желудочковой аритмии.
Антагонисты кальция представляют собой органические химические соединения, которые блокируют ток кальция внутрь клетки через медленные каналы. Антагонисты кальция из группы дигидропиридинов (нифедипин) перекрывают канал, а верапамил и, в меньшей степени, дилтиазем связываются с деполяризованным инактивированным каналом.
Механизм сокращения
Клетки миокарда сокращаются в результате взаимодействия двух сократительных белков — актина и миозина. Эти белки фиксированы внутри клетки как во время сокращения, так и при расслаблении. Сокращение клетки происходит, когда актин и миозин взаимодействуют и скользят друг относительно друга (рис. 19-2). Это взаимодействие в норме предотвращается двумя регулирующими белками: тропонином и тропомиозином. Молекулы тропонина присоединены к молекулам актина на одинаковом расстоянии друг от друга. Тропомиозин располагается в центре актиновых структур. Увеличение концентрации внутриклеточного кальция (приблизительно с 10~7 до 10~5 моль/л) приводит к сокращению, поскольку ионы кальция связывают тропонин. Кальций изменяет конформацию тропонина, что обеспечивает открытие активных участков у молекул актина, способных взаимодействовать с миозиновыми мостиками. Активные участки на миозине функционируют как Mg-зависимая АТФ-аза, чья активность возрастает при увеличении концентрации кальция внутри клетки. Мостик миозина последовательно соединяется и разъединяется с новым активным участком актина. При каждом соединении потребляется АТФ.
Сопряжение возбуждения с сокращением
Количество кальция, необходимое для запуска механизма сокращения, превышает таковое, попадающее в клетку через медленные каналы во время 2-й фазы потенциала действия. То небольшое количество кальция, которое входит в клетку (через медленные каналы и механизм двунаправленного ЫауСа2+-трансмембранного обмена), запускает процесс высвобождения гораздо большего количества кальция, хранящегося в клетке (кальцийзависимое высвобождение кальция). Запасы связанного кальция находятся внутри цистерн саркоплазматического ретикулума и, в меньшем количестве, в Т-трубочках. Сила сокращения прямо пропорциональна величине начального потока кальция внутрь клетки. Во время расслабления, когда медленные каналы ь закрыты, внутриклеточный кальций снова поглощается саркоплазматическим ретикулумом; это активный процесс, требующий участия АТФ-азы мембраны (фосфоламбан). Кроме того, кальций удаляется из клетки посредством трансмембранного обмена внутриклеточного кальция на внеклеточный натрий, а также с помощью активного транспорта АТФ-азой мембраны. Таким образом, процесс расслабления сердечной мышцы также требует АТФ.
Количество доступного внутриклеточного Са2+, скорость его доставки и удаления определяют, соответственно, максимальное развиваемое напряжение, скорость сокращения и скорость расслабления. Симпатическая стимуляция увеличивает силу сокращения: катехоламины, взаимодействуя с бета1-адренорецепторами, изменяют активность стимулирующего G-белка (глава 18), что вызывает увеличение внутриклеточной концентрации цАМФ (глава 12), а это, в свою очередь, повышает концентрацию внутриклеточного Са2+. Увеличение внутриклеточной концентрации цАМФ приводит к рекрутированию дополнительных открытых кальциевых каналов. Более того, адреномиметики ускоряют расслабление, потенцируя эффекты фосфоламбана. Ингибиторы фосфодиэстеразы (теофиллин и амринон), предотвращая метаболизм внутриклеточного цАМФ, действуют аналогично. Дигиталис повышает внутриклеточную концентрацию кальция, ингибируя мембраносвязанную Ыа+/К+-зависимую АТФ-азу; в результате происходит незначительное увеличение внутриклеточной концентрации Na+, что способствует прохождению через механизм транс-мембранного натрий-кальциевого обмена большего количества Са2+. Глюкагон, активируя специфические норадренергические рецепторы, увеличивает сократимость за счет повышения уровня внутриклеточного цАМФ.
Высвобождение ацетилхолина, сопряженное со стимуляцией блуждающего нерва, наоборот, снижает сократимость, увеличивая уровень цГМФ и ингибируя аденилатциклазу: эти эффекты опосредованы ингибирующим G-белком. При ацидозе блокируются медленные кальциевые каналы и, соответственно, подавляется сократимость сердца из-за неблагоприятного влияния на внутриклеточную кинетику кальция. Предполагают, что ингаляционные анестетики подавляют сократимость, уменьшая поступление Са2+ в клетки во время деполяризации, изменяя кинетику его высвобождения и поглощения саркоплазматическим ретикулумом, а также снижая чувствительность сократительных белков к кальцию. По силе воздействия на кинетику кальция ингаляционные анестетики располагаются в следующем порядке: галотан > энфлюран > изофлюран > закись азота. Механизм прямого угнетающего действия неингаляционных анестетиков на сократимость миокарда до конца не изучен, но предполагают, что он аналогичен описанному выше.
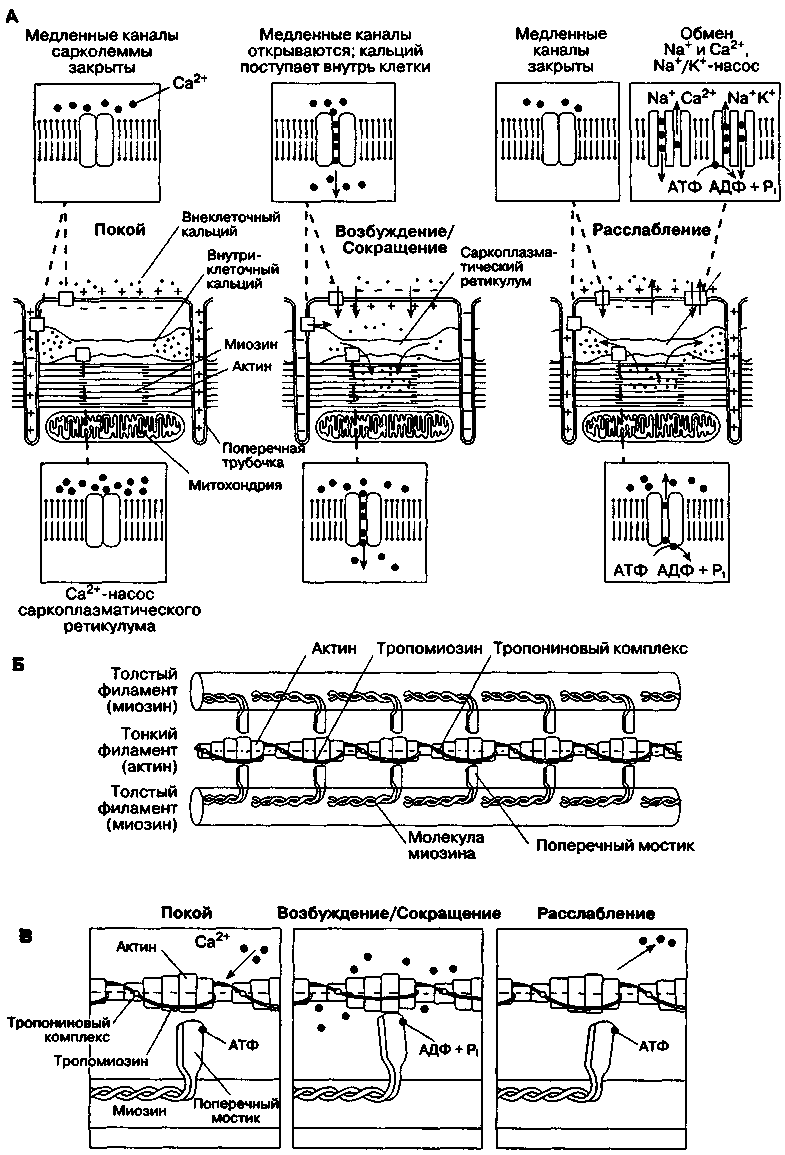
Рис. 19-2. Сопряжение возбуждения с сокращением и взаимодействие актина с миозином. А. Деполяризация мембраны клетки сердечной мышцы позволяет кальцию проходить в клетку и освобождает кальций, накопившийся в сарко-плазматическом ретикулуме. Б. Структура актомиозинового комплекса. В. Кальций связывает тропонин, давая возможность актину и миозину взаимодействовать друг с другом. (С изменениями. Из: Katz А. М, Smith V. Е. Hosp. pract, 1985; 19: 69. Braunwald E. The Myocardium: Failure and Infarction. HP Publishing, 1974.)
Иннервация сердца
Парасимпатические волокна иннервируют главным образом предсердия и проводящую систему. Ацетилхолин взаимодействует со специализированными м-холинорецепторами сердца (М2), что вызывает отрицательный хронотропныи, дромо-тропный и инотропный эффекты. Симпатические волокна распределены в сердце более широко. Преганглионарные симпатические волокна начинаются в грудных сегментах спинного мозга (Т,-Т,,), достигают шейных узлов симпатического ствола (в том числе звездчатого узла), где переключаются на постганглионарные волокна, формирующие сердечные нервы. Высвобождение норадреналина из окончаний симпатических сердечных нервов вызывает положительный хронотропныи, дромотропный и инотропный эффекты, главным образом путем активации бета1-адренорецепторов. Число бета2-адренорецепторов гораздо меньше, и они находятся в основном в предсердиях; их активация увеличивает ЧСС. Стимуляция Огадренорецепторов вызывает положительный инотропный эффект.
Вегетативная иннервация сердца имеет четко выраженное разделение на правую и левую часть: правые симпатические и правый блуждающий нервы влияют главным образом на синусовый узел, в то время как левые симпатические и левый блуждающий нервы преимущественно воздействуют на АВ'-узел. Влияния блуждающего нерва часто проявляются очень быстро и так же быстро разрешаются. Симпатическое влияние, напротив, обычно постепенно нарастает и так же исчезает. Синусовая аритмия — это циклическое изменение ЧСС, которое зависит от дыхания (ЧСС увеличивается при вдохе и уменьшается при выдохе); данный феномен обусловлен циклическими изменениями тонуса блуждающего нерва.
Сердечный цикл
Сердечный цикл — это череда электрических и механических явлений (рис. 19-3). Сокращение сердца называется систолой, расслабление — диастолой. Диастолическое наполнение желудочков происходит главным образом пассивно, еще до сокращения предсердий. Сокращение предсердий в физиологических условиях обеспечивает 20-30 % от конечно-диастолического объема желудочков. На кривой давления в предсердии выделяют три волны (рис. 19-3). Волна а обусловлена систолой предсердий. Волна с совпадает с систолой желудочка, считается, что ее вызывает выбухание атриовентрикулярного клапана в предсердие. Волна v, регистрируемая перед открытием атриовентрикулярного клапана, вызвана нарастанием давления в предсердии, обусловленным притоком крови из вен. Отрицательная волна х представляет собой снижение давления в промежутке между волнами с и о. Ее происхождение связывают с опусканием предсердия в сторону верхушки сердца при сокращении желудочков При недостаточности правого или левого атриовентрикулярного клапана волна х с этой стороны сердца исчезает, что приводит к появлению сливной волны cv. За волной v следует отрицательная волна у, обусловленная падением давления в предсердии при открытии атриовентрикулярного клапана. Зубец на кривой давления в аорте называется инцизурой и отражает кратковременный обратный поток крови в левый желудочек непосредственно перед закрытием аортального клапана.
Факторы, влияющие на функцию желудочков сердца
При обсуждении функции желудочков в качестве модели чаще рассматривают левый желудочек, но те же положения распространяются и на правый. Допущение о раздельном функционировании желудочков ошибочно, так как доказана их тесная взаимозависимость. Выделяют факторы, влияющие на систолическую (изгнание) и диастолическую (заполнение) функцию желудочков.
Систолическую функцию желудочков чаще всего отождествляют с сердечным выбросом, который может быть определен как объем крови, перекачиваемый сердцем за одну минуту. В физиологических условиях сердечный выброс левого и правого желудочков одинаков, потому что они соединены последовательно. Величина сердечного выброса (СВ) описывается следующим уравнением:
СВ = УО х ЧСС,
где УО — ударный объем (объем крови, выбрасываемый сердцем за одно сокращение); ЧСС — частота сердечных сокращений. Для сравнения сердечного выброса у людей с неодинаковым ростом и массой тела, используют сердечный индекс (СИ):
СИ = СВ/(площадь поверхности тела).
Площадь поверхности тела определяют по номограмме, учитывающей рост и массу тела человека. В норме СИ колеблется от 2,5 до 4,2 л/мин/м2. В силу широкого диапазона нормы СИ не является достаточно чувствительным показателем функции желудочка. СИ снижается лишь при тяжелой дисфункции желудочка. Изменение сердечного выброса при физической нагрузке позволяет оценить функцию желудочка точнее. Если при физической нагрузке сердечный выброс не увеличивается для обеспечения возросшего потребления кислорода, то SvO2 снижается (гл. 22). Уменьшение SvO2 при возрастании потребности в кислороде обычно отражает неадекватную перфузию тканей. Таким образом, в отсутствие гипоксии или тяжелой анемии, SvO2 (или PvO2) является наиболее точным показателем адекватности сердечного выброса (т.е. систолической функции левого желудочка).
