
- •1Врач-анестезиолог, отделение общей анестезиологии, Кливлендский клинический фонд, Кливленд, Огайо, сша.
- •Классификация нервных волокон
- •Электромиография и исследование нервно-мышечной проводимости
- •1Вместо лидокаина можно использовать хлоропрокаин.
- •1В состав гидрокодонсодержащих препаратов входит также и ацетаминофен (викодин, др.).
- •1В состав оксикодонсодержащих препаратов может входить ацетаминофен (перкоцет) или аспирин (перкодан).
- •1В состав некоторых пропоксифенсодержащих препаратов входит ацетаминофен (дарвоцет).
- •1В большинстве случаев авторы не рекомендуют проведение постоянной поддерживающей инфузии.
- •Раздел IV
- •1. Частота сердечных сокращений
- •2. Ударный объем
- •1. Функциональные кривые желудочка
- •2. Оценка систолической функции
- •Фракция выброса
- •3. Оценка диастол ической функции
- •Эндотелиальные факторы
- •Анатомия и физиология коронарного кровообращения
- •1. Анатомия
- •2. Факторы, определяющие величину коронарного кровотока
- •3. Кислородный баланс в миокарде
- •Потребность миокарда в кислороде
- •I. Наджелудочковые аритмии
- •II. Желудочковые аритмии
- •2. Выбор анестетиков и вспомогательных средств:
- •1. Общие принципы
- •2. Премедикация
- •1. Митральный стеноз
- •2. Митральная недостаточность
- •3. Пролапс митрального клапана
- •4. Аортальный стеноз
- •5. Гипертрофическая кардиомиопатия
- •6. Аортальная недостаточность
- •7. Трикуспидальная недостаточность
- •Гипоплазия левых отделов сердца
- •1. Обструктивные поражения
- •2. Простые шунты
- •3. Сложные шунты
- •Внесердечные заболевания
- •Гипогликемия
- •1Частота импульсов автоматически изменяется в зависимости от потребности в сердечном выбросе.— Примеч. Пер.
- •1. Преиндукционный период
- •2. Индукция анестезии
- •3. Предперфузионный период
- •4. Перфузионный период
- •5. Завершение ик
- •6. Постперфузионный период
- •7. Послеоперационный период
- •Анестезия при трансплантации сердца
- •1. Тампонада сердца
- •2. Констриктивныи перикардит
- •Расслаивание аорты
- •1. Аэробный метаболизм
- •2. Анаэробный метаболизм
- •3. Влияние анестезии на клеточный метаболизм
- •1. Грудная клетка и дыхательная мускулатура
- •2. Трахеобронхиальное дерево
- •3. Кровообращение и лимфоток в легких
- •4. Иннервация
- •1.Эластическое сопротивление
- •2. Легочные объемы
- •3. Неэластическое сопротивление
- •4. Работа дыхания
- •5. Влияние анестезии на механику дыхания
- •1. Вентиляция
- •2. Легочный кровоток
- •3. Шунты
- •4. Влияние анестезии на газообмен
- •Напряжение газов в альвеолах, артериальной и венозной крови
- •1.Кислород
- •Высокий альвеолярно-артериальный градиент по кислороду
- •2. Углекислый газ
- •1.Кислород
- •2. Углекислый газ
- •1. Дыхательные центры
- •2. Центральные рецепторы
- •3. Периферические рецепторы
- •4. Влияние анестезии на регуляцию дыхания
- •Состояния, при которых необходима раздельная вентиляция легких
- •Тяжелая гипоксемия при заболевании одного легкого
- •1. Опухоли
- •2. Легочные инфекции
- •3. Бронхоэктазы
- •1. Предоперационный период
- •2. Интраоперационный период
- •3. Послеоперационный период
- •Анестезия при торакоскопических операциях
- •Легочный лимфангиоматоз
- •1. Предоперационный период
- •2. Интраоперационный период
- •3. Послеоперационный период
- •1. Церебральное перфузионное давление
- •2. Ауторегуляция мозгового кровообращения
- •3. Внешние факторы
- •Внутричерепное давление
- •Влияние анестетиков и вспомогательных средств на цнс
- •1. Испаряемые анестетики
- •Мк и внутричерепной объем крови
- •2. Закись азота
- •1.Для индукции анестезии
- •2. Вспомогательные средства
- •3. Вазопрессоры
- •4. Вазодилататоры
- •5. Миорелаксанты
- •Патологическое пристрастие к алкоголю и наркотическим препаратам
- •Как проводят эст?
- •Неосмотическая секреция адг
- •Гиперосмоляльность и гипернатриемия
- •Гипернатриемия при низком содержании натрия в организме
- •Гипоосмоляльность и гипонатриемия
- •Гипонатриемия с повышенной осмоляльностью плазмы
- •Застойная сердечная недостаточность
- •Внепочечные потери
- •Тяжелая физическая нагрузка
- •Изолированное снижение секреции калия в дистальном отделе нефрона
- •Повышенное поступление калия
- •Гиперкальциемия
- •Клинические проявления гиперкальциемии
- •1.Гемолитические реакции
- •2. Негемолитические иммунные реакции
- •Нитропруссид
- •Кислоты и основания
- •Сопряженные пары и буферы
- •Клинические нарушения
- •Компенсаторные механизмы
- •Нервно-мышечные нарушения
- •Травмы и заболевания грудной клетки
- •Болезни плевры
- •Обструкция дыхательных путей
- •Наследственные нарушения обмена веществ
- •Центральная стимуляция дыхания
- •Хлоридчувствительный метаболический алкалоз
- •1. Антагонисты альдостерона
- •2. Неконкурентные калийсберегающие диуретики
- •Сердечно-сосудистая система
- •Предоперационное обследование
- •Миорелаксанты
- •Предоперационный период
1.Кислород
Кислород переносится кровью в растворенном виде и в связанной (обратимо) с гемоглобином форме.
Физически растворенный кислород
Количество кислорода, растворенного в крови, определяется законом Генри, согласно которому концентрация любого газа в растворе пропорциональна его парциальному давлению. Математическое выражение этого закона следующее:
Концентрация газа = а х Парциальное давление,
где а — коэффициент растворимости газа в данном растворе и при данной температуре.
Коэффициент растворимости кислорода в крови при нормальной температуре тела равен 0,003 мл/100 мл/мм рт. ст. Даже при РAO2, равном 100 мм рт. ст., максимальное количество кислорода, которое может раствориться в крови, очень мало (0,3 мл в 100 мл крови) по сравнению с фракцией кислорода, связанного с гемоглобином.
Гемоглобин
Гемоглобин — это крупная сложная молекула, состоящая из четырех железосодержащих порфириновых соединений (гемов) и четырех белковых субъединиц. Железо, которое содержится в теме, играет главную роль в образовании связи с кислородом; с кислородом может связываться только двухвалентная форма железа. В норме у взрослых имеется так называемый гемоглобин А1, состоящий из двух альфа- и двух бета-цепей (субъединиц); эти четыре цепи удерживаются вместе за счет слабых связей между аминокислотными остатками. Теоретически каждый грамм гемоглобина способен переносить до 1,39 мл кислорода.
Кривая диссоциации оксигемоглобина
Молекула гемоглобина присоединяет четыре молекулы кислорода. В результате сложного взаимодействия между субъединицами связывание гемоглобина с кислородом носит нелинейный характер (соответствующая кривая зависимости имеет S-образную форму; рис. 22-22). Насыщением (сатурацией) гемоглобина называют количество связанного с гемоглобином кислорода, отнесенное к общей кислородной емкости гемоглобина и выраженное в процентах. Присоединение каждой из четырех молекул кислорода обеспечивается отдельной химической реакцией. Изменение молекулярной конформации гемоглобина, возникающее в результате присоединения первых трех молекул кислорода, резко ускоряет образование четвертой связи с кислородом. Последняя реакция отвечает за ускоренное присоединение кислорода в диапазоне насыщения от 25 до 100 %. В диапазоне от 90 до 100 % кривая диссоциации (насыщения) постепенно уплощается по мере уменьшения количества доступных мест связывания кислорода.
Факторы, влияющие на кривую диссоциации оксигемоглобина
На процесс присоединения кислорода к гемоглобину влияют следующие факторы: концентрация ионов водорода, напряжение углекислого газа, температура, концентрация 2,3-дифосфоглицерата (2,3-ДФГ). Их суммарный эффект на взаимодействие гемоглобина с кислородом отражает величина Pw — значение напряжения кислорода, при котором гемоглобин насыщен на 50% (рис. 22-23). Изменение каждого из факторов способно смещать кривую диссоциации вправо (увеличение Pw) или влево (уменьшение рзо). Сдвиг вправо вызывает снижение сродства гемоглобина к кислороду, вытесняет кислород из связи с гемоглобином и увеличивает количество кислорода, доступного тканям; сдвиг влево дает обратный эффект В норме Р,0 составляет 26,6 мм рт ст (3,4 кПа)
Увеличение концентрации ионов водорода в крови снижает связывание гемоглобина с кислородом (эффект Бора) Форма кривой диссоциации оксигемоглобина такова, что этот эффект более выражен в венозной крови, чем в артериальной (рис 22-23); данный феномен облегчает освобождение кислорода в тканях, практически не сказываясь на потреблении кислорода (в отсутствие тяжелой гипоксии).
Влияние напряжения СО2 на сродство гемоглобина к кислороду имеет важное физиологическое значение; вместе с тем оно вторично по отношению к увеличению концентрации ионов водорода, которая возрастает с увеличением РСО2. Высокое содержание СО2 в венозном сегменте капилляров, снижая сродство гемоглобина к кислороду, облегчает освобождение кислорода в тканях; наоборот, низкое содержание СО2 в легочных капиллярах вновь увеличивает сродство гемоглобина к кислороду, облегчая поглощение кислорода из альвеол.
2,3-ДФГ, побочный продукт гликотшза (шунт Rapoport-Luebering), накапливается при анаэробном метаболизме Хотя эффект 2,3-ДФГ на гемоглобин теоретически благоприятен для организма (уменьшается сродство гемоглобина к кислороду и облегчается освобождение О2 в тканях.— Примеч. ред.), его физиологическое значение невелико 2,3-ДФГ, тем не менее, играет важную компенсаторную роль при хронической анемии и существенно влияет на транспортную функцию гемоглобина донорской крови при гемотрансфузиях (гл. 29).
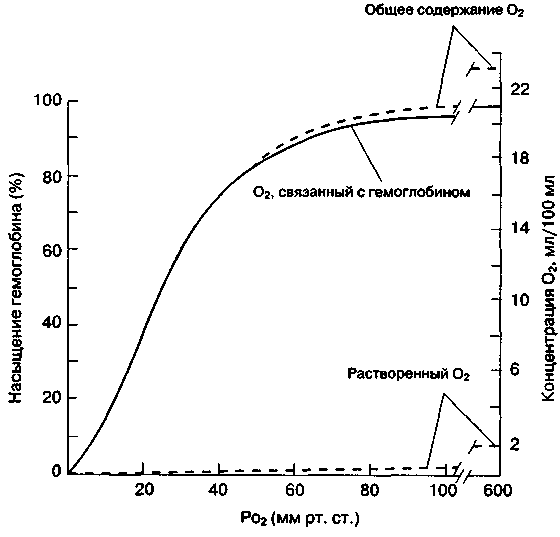
Рис. 22-22. Кривая диссоциации оксигемоглобина у здорового взрослого человека. (С разрешения. Из West J В Respvatory Physiology The Essentials, 3rd ed Williams & Wilkms, 1985 )
Аномальные лиганды и аномальные формы гемоглобина
Окись углерода (СО), цианиды, азотная кислота и аммиак могут связываться с гемоглобином в местах соединения с кислородом. Они вытесняют кислород и смещают кривую диссоциации влево. Угарный газ отличается особенной активностью: его сродство к гемоглобину в 200-300 раз выше, чем у кислорода. СО связывается с гемоглобином, образуя карбоксигемоглобин, что снижает кислородную емкость гемоглобина и нарушает освобождение кислорода в тканях.
При окислении железа тема до трехвалентной формы образуется метгемоглобин. В редких случаях нитраты, нитриты, сульфаниламиды и другие лекарственные средства могут вызывать сильную метгемоглобинемию. Метгемоглобин неспособен связывать кислород, до тех пор пока он не будет восстановлен с помощью фермента метгемоглобинредуктазы; кроме того, метгемоглобин смещает кривую диссоциации оксигемоглобина влево. Метгемоглобинемия, как и отравление угарным газом, снижает кислородную емкость крови и нарушает высвобождение кислорода в тканях. Метиленовый синий и аскорбиновая кислота способствуют восстановлению метгемоглобина в гемоглобин.
Аномальные формы гемоглобина возникают в результате изменений в составе белковых субъединиц. Каждый вариант имеет собственные характеристики связывания с кислородом. Наиболее распространенные аномальные формы гемоглобина включают фетальный гемоглобин, гемоглобин А2, гемоглобин при серповидно-клеточной анемии (гл. 29).
Содержание кислорода в крови
Общее содержание кислорода в крови равно сумме физически растворенного и связанного с гемоглобином кислорода. Связывание кислорода с гемоглобином никогда не достигает теоретического максимума, поэтому считают, что 1 г гемоглобина может связать приблизительно 1,31 мл кислорода. Содержание кислорода в крови (С, от англ, content — содержание) выражается следующим уравнением:
Содержание кислорода (в 100 мл крови) =
[(0,003 мл О2/100 мл крови/мм рт. ст.) х РО2] +
+ (SO2xHb x 1,31 мл/100 мл крови),
где Hb — концентрация гемоглобина (г/100 мл крови), a SO2 — насыщение гемоглобина кислородом (S, от англ, saturation — насыщенеие) при данном РО2.
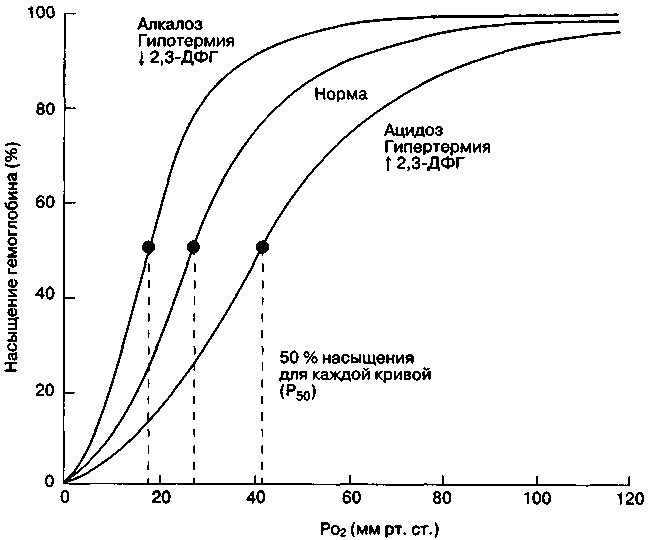
Рис. 22-23. Сдвиги кривой диссоциации оксигемоглобина при изменениях рН, температуры тела и концентрации 2,3-дифосфоглицерата (2,3-ДФГ) в эритроцитах.
Используя эту формулу и величину Hb, равную 15 г/100 мл, можно рассчитать содержание О2 в артериальной и смешанной венозной крови, а также артериовенозную разницу по кислороду (при SaO2 = 97,5 % и SvO2 = 75 %):
СаО2 = (0,003 х 100) + (0,975 Х 15 Х 1,31)= 19,5 мл О2/100 мл крови;
CvO2=(0,003 x 40) + (0,75x 15 X 1,31) = 14,8 мл O2/100 мл крови;
(СаО2 - СVО2) = 4,7 мл О2/100 мл крови.
Транспорт кислорода
Транспорт кислорода зависит как от дыхания, так и от кровообращения (гл. 19). Общая доставка кислорода (DO2; от англ, delivery — доставка) к тканям равна произведению содержания кислорода в артериальной крови и сердечного выброса:
DO2 = СаО2 х Qt.
Заметим, что содержание кислорода в артериальной крови зависит как от РAО2, так и от концентрации гемоглобина. Следовательно, недостаточная доставка кислорода может быть результатом низкого РAО2 низкой концентрации гемоглобина или низкого сердечного выброса. В норме расчет доставки кислорода выглядит так:
DO2 = 20 мл О2/100 мл крови х 5000 мл/мин = 1000 мл О2/мин.
Уравнение Фика выражает связь между потреблением О2, артериовенозной разницей по кислороду и сердечным выбросом:
Потребление О2 = VO2 = Q, х (СаО2 - CvO2).
После преобразования получаем:
СаО2 - CvO2 = VO2/Qt
Следовательно, артериовенозную разницу можно рассматривать как меру адекватности доставки кислорода.
При нормальном потреблении кислорода около 250 мл/мин и сердечном выбросе 5000 мл/мин нормальная артериовенозная разница, согласно этому уравнению, составит 5 мл О2/100 мл крови. Заметим, что при этом нормальный коэффициент экстракции О2 [(СаО2 - CvO2)/CaO2] составит 25 %, т. е. 5 мл/20 мл. Таким образом, в норме организм потребляет только 25 % кислорода, переносимого гемоглобином. Когда потребность в О2 превосходит возможность его доставки, то коэффициент экстракции становится выше 25 %. Наоборот, если доставка О2 превышает потребность, то коэффициент экстракции падает ниже 25 %.
Если доставка кислорода снижена умеренно, потребление кислорода не изменяется благодаря увеличению экстракции О2 (насыщение гемоглобина кислородом в смешанной венозной крови снижается); в этом случае VO2 не зависит от доставки. По мере дальнейшего снижения DO2 достигается критическая точка, в которой VO2 становится прямо пропорционально DO2. Состояние, при котором потребление кислорода зависит от доставки, характеризуется прогрессирующим лактат-ацидозом (гл. 30), обусловленным клеточной гипоксией.
Кислородный резерв
Понятие кислородного резерва имеет большое значение в анестезиологии. Когда в результате апноэ прекращается поступление в организм кислорода, то в ходе клеточного метаболизма потребляется имеющийся кислородный резерв; после того как резерв исчерпан, развивается гипоксия и наступает смерть клеток. Теоретически нормальный кислородный резерв у взрослого человека составляет около 1500 мл. Он включает остатки кислорода в легких; кислород, находящийся в связи с гемоглобином и миоглобином; кислород, растворенный в жидкостях организма. К сожалению, высокое сродство гемоглобина к кислороду (сродство миоглобина к кислороду еще выше), а также незначительное количество кислорода, физически растворенного в тканях, представляют собой очень малый резерв. Следовательно, основным источником кислорода является дыхательная смесь, находящаяся в легких в объеме, соответствующем ФОЕ (исходный объем при апноэ). Необходимо отметить, что только около 80 % этого объема может быть использовано.
При наступлении апноэ у больного, дышавшего перед этим атмосферным воздухом, в легких имеется примерно 480 мл кислорода (если FiO2 = 0,21 и ФОЕ = 2300 мл, то объем кислорода составит FiO2 х ФОЕ; 0,21 х 2300 мл = 480 мл). Метаболически активные ткани быстро используют этот резерв (предположительно со скоростью потребления кислорода); в течение 90 с развивается тяжелая гипоксемия. Возникновение гипоксемии можно отсрочить путем увеличения FiO2 перед апноэ. После дыхания чистым кислородом легкие содержат 2300 мл кислорода, что задерживат развитие гипоксемии после апноэ на 4-5 мин. Данная концепция лежит в основе проведения преоксигена-ции перед индукцией анестезии (гл. 5).
