
- •Міністерство освіти та науки, молоді та спорту України Харківський національний університет
- •Зміст програми Вступ
- •Хімічна рівновага
- •Органічні реагенти в аналітичній хімії
- •Основні метрологічні характеристики методів визначення
- •Методи визначення
- •Методи визначення
- •Титриметрія
- •Кислотно-основне титрування
- •Комплексонометричне титрування
- •Окисно-відновлювальне титрування
- •Птичні методи аналізу Молекулярна абсорбційна спектрометрія (спектрофотометрія)
- •Атомно-емісійний аналіз і фотометрія полум’я
- •Атомно-абсорбційна спектрометрія
- •Електрохімічні методи аналізу
- •Хроматографічні методи аналізу
- •Біологічні методи аналізу
- •Біохімічні методи аналізу
- •Закінчення
- •Навчальна література
- •1. Аналітична хімія. Загальні поняття і визначення
- •Класифікація методів аналізу, що грунтується на кількості речовини аналіту
- •2. Якісний аналіз. Загальні відомості
- •3. Тeхнікa роботи у лабораторії
- •4. Органічні реагенти у неорганічНому аналізі
- •Характерні групи атомів у органічних реагентах
- •Використання органічних реагентів у аналізі
- •5. Закон дії мас. Алгебра хімічних реакцій
- •Позначення констант рівноваг
- •2. Константи кислотно-основних рівноваг (продовження)
- •Реакції кислотної дисоціації – зворотні до наведених:
- •6. Концентраційно-логарифмічні діаграм (клд)
- •7. Розрахунки рівноважного складу розчинів
- •Метод матеріального балансу при розрахунках рівноважного складу розчинів
- •Приклади обчислень рівноважних концентрацій розчинів за схемою Комаря м. П.
- •8. Буферні розчини
- •9. Лабораторні роботи з якісного аналізу Аналіз катіонів за кислотно-основною схемою
- •Взаємодія катіонів із деякими реагентами
- •Лабораторна робота № 1. Реакції катіонів 1-ї групи. Оформлення записів у лабораторних журналах
- •Зразок запису результатів дослідження властивостей об’єктів у лабораторному журналі
- •Pеaкцiї катіонів l-ї аналiтичної групи
- •Лабораторна робота № 2.
- •2.3.3. Мікрокристалоскопічна реакція на кальцій
- •Peaкції катіонів 2-ї aнaлiтичної групи
- •Лабораторна робота № 3. Аналіз катіонів 1-2-ї груп.
- •3‑Я групa катіонів
- •Приклад звітної картки для катіонів 1-ї та 2-ї груп
- •Лабораторна робота № 4. Реакції катіонів 3-ї групи.
- •4.1. Алюміній
- •4.2. Цинк (іі)
- •4.3. Хром
- •4.4. Станум (іі) та станум (іv)
- •Реакції катіонів 3-ї аналітичної групи
- •Лабораторна робота № 5. Аналіз катіонів 3-ї групи.
- •4‑A групa катіонів
- •Лабораторна робота № 6. Реакції катіонів 4-ї групи.
- •6.1. Ферум (іі) та ферум (ііі)
- •6.2. Бісмут (ііі)
- •6.3. Манган
- •Реакції катіонів 4-ї аналітичної групи
- •6.4. Стибій (ііі) та стибій (V)
- •Лабораторна робота № 7. Реакції катіонів 5-ї групи.
- •7.1. Купрум (іі)
- •7.2. Кадмій (іі)
- •7.4. Кобальт (іі)
- •7.5. Магній (іі)
- •Реакції катіонів 5-ї аналітичної групи
- •Лабораторна робота № 8. Аналіз катіонів 4-5 груп.
- •9.1. Натрій
- •9.3. Амоній
- •Реакції катіонів 6-ї аналітичної групи
- •Лабораторна робота № 10. Аналіз катіонів 6-ї групи.
- •Окисно-відновні властивості аніонів
- •Класифікація аніонів за реакціями осадження
- •Лабораторна робота № 11. Реакції аніонів.
- •11.1. Попередні випробування
- •11.1.3. Проби на присутність аніонів‑відновників.
- •Лабораторна робота № 12. Аналіз аніонів.
- •Коментарі до звітної картки (табл. 16)
- •Хід аналізу аніонів (р0 – вихідна суха речовина,
- •Питання до колоквіуму за темою «якісний аналіз катіонів та аніонів»
- •Кислотно-основна схема систематичного аналізу катіонів
- •Інші схеми систематичного аналізу катіонів
- •Систематичний якісний аналіз аніонів
- •Теорія похибок і статистична обробка результатів вимірювань
- •Теоретичні значення q – критерію. При різних довірчих імовірностях р
- •Значення критерію грубої похибки β
- •Значення t-критерію Стьюдента
- •Значення критерію фішера,
- •1. Гравіметричний аналіз
- •1.1. Терези і принцип зважування
- •Конструкція аналітичних терезів
- •1.2. Порядок зважування на терезах типу влр-200.
- •Лабораторна робота № 1.1. Гравіметричне визначення води в твердих тілах. (для самостійного ознайомлення)
- •2. Підготовка до роботи
- •3. Обладнання
- •4. Хід роботи
- •5. Обробка результатів
- •Умови висушування деяких кристалогідратів
- •Література
- •2.Титриметрія
- •2.1. Загальні відомості
- •2.2. Мірний посуд та робота з ним
- •Час витікання рідини (за стандартом дсту)
- •2.2.1. Перевірка місткості посуду
- •Поправки для об’ємів (в см3), що виміряні мірним посудом (каліброваним для температури 20 °с), якщо ним користуються при різних температурах
- •Лабораторна робота № 2.1. Перевірка місткості посуду. (для самостійного ознайомлення)
- •1. Реактиви й обладнання
- •2. Хід роботи
- •3. Приклад розрахунків
- •2.3. Кислотно-основне титрування
- •Лабораторна робота № 2.2. Стандартизація розчину хлороводневої кислоти.
- •1. Реактиви й обладнання
- •2. Хід роботи
- •3. Обробка результатів
- •Лабораторна робота № 2.3. Титрування сумішей NaOh, Na2co3, NaHco3.
- •1. Попередні зауваження
- •2. Реактиви й обладнання
- •3. Хід роботи
- •4. Обробка результатів
- •Залежно від постановки задачі, ці маси перераховуємо, зважаючи на те:
- •Лабораторна робота № 2.4. Титриметричне визначення аміаку в амонійних солях.
- •1. Загальні відомості
- •2. Реактиви й обладнання
- •3. Хід роботи
- •Відкривають кран (4) і через лійку вводять у колбу для дистиляції 25 мл розчину гідроксиду натрію. Кран закривають, не допускаючи втрати через нього газоподібного аміаку.
- •4. Обробка результатів
- •2.4. Комплексонометричне титрування
- •Лабораторна робота № 2.5. Стандартизація розчину едта.
- •1.Загальні відомості
- •2. Реактиви й обладнання
- •3. Хід роботи
- •4. Обробка результатів
- •Лабораторна робота № 2.6. Визначення цинку й алюмінію в алюмінієвому стопі.
- •1. Загальні відомості
- •2. Реактиви та обладнання
- •3. Хід роботи
- •4. Обробка результатів
- •1. Загальні відомості
- •2. Реактиви й обладнання
- •3. Хід роботи
- •4. Обробка результатів
- •2.5. Окислювально-відновлювальне титрування
- •Лабораторна робота № 2.8. Стандартизація розчину тіосульфату.
- •1. Загальні відомості
- •А. Стандартизація за наважками кристалічного іоду
- •2А. Реактиви й обладнання:
- •3А. Хід роботи
- •4А. Обробка результатів
- •Б. Стандартизація за наважками дихромату калію
- •2Б. Реактиви й обладнання:
- •3Б. Хід роботи
- •4Б. Обробка результатів
- •Лабораторна робота № 2.9. Іодометричне визначення міді.
- •1. Загальні відомості
- •2. Реактиви й обладнання:
- •3. Хід роботи
- •4. Обробка результатів
- •Лабораторна робота № 2.10. Визначення аскорбінової кислоти у фруктових соках.
- •1. Загальні відомості
- •2. Реактиви й обладнання:
- •3. Хід роботи
- •4. Обробка результатів
- •Кислотно-основне титрування
- •Комплексонометричне титрування
- •3. Електрохімічні методи аналізу
- •3.1. Потенціометричний метод аналізу
- •3.1.1. Теоретичні основи потенціометрії
- •3.1.2. Вимірювання потенціалу
- •Класифікація іоноселективних електродів
- •Лабораторна робота № 3.1. Вимірювання рН водяних розчинів методом іонометрії.
- •3.2. Порядок вимірювань Схему приладу наведено на рис. 3.2. Вимірюють у режимі ерс («mV») і вузькому піддіапазоні («-1-4»).
- •4. Хід роботи
- •Лабораторна робота № 3.2. Визначення фторидів у зубній пасті методом іонометрії.
- •1. Загальні відомості
- •3. Алгоритм вимірювань
- •Лабораторна робота № 3.3. Біхроматометричне визначення заліза в окалині, продуктах корозії та інших матеріалах.
- •1. Загальні відомості
- •2. Реактиви й обладнання
- •Шпателі, скляні палички.
- •3. Хід роботи
- •4. Обробка результатів
- •Література
- •Оптичні методи аналізу
- •4.1. Атомна спектроскопія
- •4.2. Атомно-емісійний метод аналізу Лабораторна робота № 4.1. Визначення калію та натрію в мінеральних водах методом полум'яно-емісійної спектрометрії.
- •1. Загальні відомості
- •2. Стандартні розчини
- •3. Підготовка полум’яного фотометра до роботи градуювання
- •4. Аналіз зразка води
- •4.3. Атомно-абсорбційна спектрометрія
- •Лабораторна робота № 4.2. Атомно-абсорбційне визначення міді, цинку та марганцю в соках і водах.
- •1. Загальні відомості
- •2. Апаратура, реактиви, розчини
- •4.4. Спектрофотометрія
- •Лабораторна робота № 4.3. Спектрофотометричне визначення загальної концентрації іонів феруму в мінеральній воді з о-фенантроліном.
- •1. Загальні відомості
- •2. Прилади, матеріали, реактиви
- •3. Визначення градуювальної залежності
- •4. Аналіз зразка води
- •5. Обробка результатів
- •Лабораторна робота № 4.4. Спектрофотометричне визначення летких фенолів. Визначення загальної кількості летких фенолів у стічній воді у перерахунку на c6h5oh.
- •2. Прилади, матеріали, реактиви
- •Фенол, стандартний розчин 0,94 г/л; 9,4 мг/л (розчин фенолу з масовою концентрацією 9,4 мг/л, готують перед застосуванням, розводячи розчин з масовою концентрацією 9,4 г/л).
- •3. Визначення градуювальної залежності
- •4. Попередня підготовка проби
- •5. Вимірювання вмісту фенолів
- •6. Обробка результатів
- •5. Вибрані кінетичні методи аналізу
- •Лабораторна робота № 5.1. Визначення вмісту формальдегіду в розчинах кінетичним методом.
- •1. Сутнiсть методики
- •2. Алгоритм методики
- •2.1. Прилади й реагенти
- •2.2. Побудова градуювального графiка
- •2.3. Вимiрювання невiдомої концентрацiї
- •Лабораторна робота № 5.2. Визначення вмісту хрому (VI) в розчинах кінетичним методом.
- •1. Сутнiсть методики
- •2. Алгоритм методики
- •2.1. Прилади та реагенти
- •2.2. Побудова градуювального графiка
- •2.3. Визначення концентрацiї хрому в дослiджуваному розчинi
- •Література
- •6. Хроматографічні методи аналізу
- •Лабораторна робота № 6.1. Розділення нейтральних хелатів (комплексів металівіз органічним лігандом) методом тшх.
- •1. Реактиви й обладнання
- •2. Одержання екстрактів комплексів
- •3. Хроматографування
- •Лабораторна робота № 6.2. Розділення амінокислот методом тшх.
- •1. Реактиви й обладнання
- •2. Хроматографування
- •7. Біологічні та біохімічні методи аналізу
- •Приклади використання біологічних методів для визначення різних сполук
- •Приклади використання ферментів для визначення їх субстратів (I) і інгібіторів (II)
- •Вибрані логарифми констант рівноваг Неорганічні ліганди
- •I‑, іодид‑іон
- •I‑, іодид‑іон (продовження)
- •Io3‑, іодат‑іон
- •Io3‑, іодат‑іон (продовження)
- •Органічні ліганди: аміни
- •Органічні ліганди: карбонові кислоти
- •Органічні ліганди: амінокислоти
- •Інші органічні ліганди: оксими, тіоли тощо
- •Відновні напівреакції
- •Індикатори
- •61022, Харків, пл. Свободи, 4
Позначення констант рівноваг
|
Реакції (загальний вигляд та приклади) |
Позначення |
Примітки |
|
1. Константи стійкості комплексів | ||
|
m M + n L MmLn |
nm |
Загальні константи стійкості |
|
2 Ag+ + 6 I‑ Ag2I64‑ |
62 | |
|
M + n L MLn |
n |
Для одноядерних комплексів m = 1 опускають |
|
Ag+ + NH3 AgNH3+ |
1 | |
|
Ag+ + 2 NH3 Ag(NH3)2+ |
2 | |
|
MLn‑1 + L MLn |
Kn |
K – ступінчаті константи стійкості, Kn = n / n‑1 |
|
Ag+ + NH3 AgNH3+ |
K1 | |
|
AgNH3+ + NH3 Ag(NH3)2+ |
K2 | |
|
2O H+ + OH‑ |
Kw |
Іонний добуток води |
|
m H+ + L HmL |
Hm |
Якщо L – ліганд, H+ комплексоутворювач, то Hm – це 1m |
|
H+ + PO43‑ HPO42‑ |
H1 | |
|
2 H+ + PO43‑ H2PO4‑ |
H2 | |
|
3 H+ + PO43‑ H3PO4 |
H3 | |
|
H+ + Hm‑1L HmL |
KHm |
KHm – ступінчаті константи стійкості KHm = Hm / H(m‑1) |
|
H+ + PO43‑ HPO42‑ |
KH1 | |
|
H+ + HPO42‑ H2PO4‑ |
KH2 | |
|
H+ + H2PO4‑ H3PO4 |
KH3 | |
|
Hm+1L HmL + H+ |
Ka(N‑m) |
Ступінчата константа іонізації кислоти HNL, Ka(N‑m) = 1 / KH(m+1) |
|
H3PO4 H+ + H2PO4‑ |
Ka1 | |
|
H2PO4‑ H+ + HPO42‑ |
Ka2 | |
|
HPO42‑ H+ + PO43‑ |
Ka3 | |
|
m M + n OH‑ Mm(OH)n |
nm |
Константи стійкості гідроксокомплексів (окремого випадку комплексів) |
|
2 Fe3+ + 2 OH‑ Fe2(OH)24+ |
22 | |
|
Hg2+ + OH‑ HgOH+ |
1 | |
|
Hg2+ + 2 OH‑ Hg(OH)2 |
2 | |
|
Hg2+ + 3 OH‑ Hg(OH)3‑ |
3 |
2. Константи кислотно-основних рівноваг (продовження)
|
m M + n H2O Mm(OH)n + n H+ |
*nm |
Константа взаємодії іона металу з H2O *nm = nm Kwn, m = 1 опускають |
|
2 Fe3+ + 2 H2O Fe2(OH)24+ + 2 H+ |
*22 | |
|
M + n H2O M(OH)n + n H+ |
*n | |
|
Hg2+ + H2O HgOH+ + H+ |
*1 | |
|
Hg2+ + 2 H2O Hg(OH)2 + 2 H+ |
*2 | |
|
Hg2+ + 3 H2O Hg(OH)3‑ + 3 H+ |
*3 | |
|
3. Константи гетерогенних реакцій | ||
|
L L(орг),
або L |
KD |
Константа розподілу (в дужках – розчинник) |
|
Br2 Br2(CCl4),
або Br2 | ||
|
Al3+ + 3 HOxin (орг) AlOxin3 (орг)+ 3 H+ |
Kex |
Загальна константа екстракції |
|
L(g) L |
Kp |
Закон Генрі, p в атмосферах |
|
CO2(g) CO2 | ||
|
L(s) L, L(l) L, |
Ks |
Розчинність (s – тверда, l – рідка речовина) |
|
I2(s) I2, Br2(l) Br2, | ||
|
MmLn(s) mMLq + (n – m q) L |
Ksq |
Добуток розчинності (q = 0 можна опускати), Ksq = Ks0 q. Нижче – складний випадок, де слідом за Ks у дужках наведено продукти у розчині. |
|
HgI2(s) Hg2+ + 2 I‑ |
Ks0 | |
|
HgI2(s) HgI+ + I‑ |
Ks1 | |
|
HgI2(s) HgI2 |
Ks2 | |
|
HgI2(s) + I‑ HgI3‑ |
Ks3 | |
|
HgI2(s) + 2 I‑ HgI42‑ |
Ks4 | |
Концентраційні константи. Константу рівноваги, виражену через рівноважні концентрації (3) називають концентраційною. Підставляючи вираз (6) у ЗДМ (3), приходимо до його аналога із рівноважними концентраціями замість активностей,
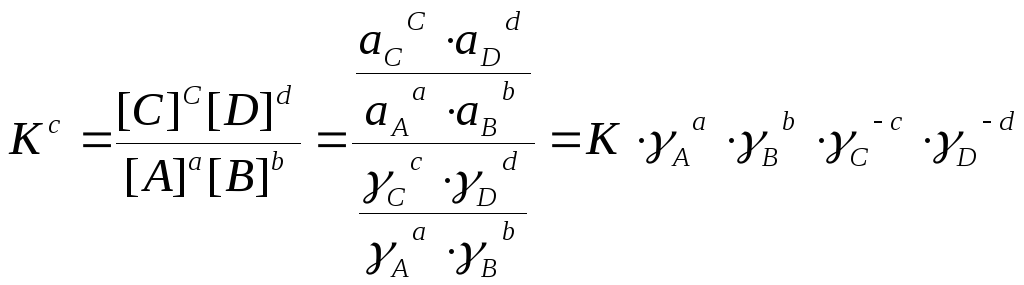
Або дотримуючись алгебраїчного підходу в записі реакцій і рівнянь, маємо:
![]() = Kc = K ·
(
= Kc = K ·
(![]() )-1,
)-1,
lg Kc = lg K -![]() lg (
lg (![]() ) =
lgK
–
) =
lgK
– ![]() j lg j. (15)
j lg j. (15)
Концентраційна константа рівноваги Kc залежить від складу розчину через j. Часто користуючись Kc, не вказуватимемо індекс «c». У довідниках наводять як термодинамічні (при І = 0), так і концентраційні константи.
Приблизно оцінюючи іонну силу, обмежуємось внеском від переважаючих компонентів, зокрема іонів сильних електролітів (тих, що дисоційовані повністю). Досліджуючи константи, з сильних електролітів утворюють так званий «сольовий фон», що стабілізує коефіцієнти активності. У водяних розчинах сильними є кислоти HCl, HClO4, HBr, HI, H2SO4 (за першим ступенем дисоціації), HNO3; основи та солі з катіонами Na+, K+, Rb+, Cs+ , не схильними до комплексоутворення, і солі з аніоном ClO4‑.
Рівноважні концентрації розраховують за концентраційними константами, вдаючись до ітерацій (послідовних наближень). Розрахувавши [Aj] за lg Kc, що відповідають наближеній іонній силі, уточнюють І та lg Kc, й знову [Aj]. Процес закінчують, якщо значення lg Kc відрізняються від попередніх у межах похибок. Ітерації сходяться, бо lg Kc повільно змінюються з [Aj].
Наприклад, для реакції
Ca5(OH)(PO4)3(s) 5 Ca2+ + OH- + 3 PO43-, lg Ks = ‑55,91 [I=0],
lg Ksc у середовищі c(NaClO4) = 0,1 моль/л обчислюємо так. Електроліт NaClO4 – сильний,
[Na+] = [ClO4‑] = c(NaClO4) = 0,1 моль/л.
Без внеску від продуктів реакції іонна сила
I = {[Na+] + [ClO4‑]} / 2 = 0,1.
За формулою Девіса,
lg = ‑ 0,5 ![]() / (1 +
/ (1 +![]() ) + 0,15I = -0,105.
) + 0,15I = -0,105.
Підставляючи її у вираз (6), маємо
lg Ksс = lg Ks ‑ {![]() j zj2} lg = ‑55,91 ‑ {5·22 +
j zj2} lg = ‑55,91 ‑ {5·22 +
+ 1·(‑1)2 + 3·(‑3)2}·(-0,105) = ‑55,91 + 30·0,105 = -52,76.
Лінійні комбінації реакцій
Ми вже мали змогу звернути увагу, що рівняння приєднання кількох протонів до багатозарядного аніону (або кількох лігандів до іону-комплексоутворювача) характеризуються загальною константою, яка дорівнює добутку ступінчастих констант: βn = K·K·…·Kn.
Аналогічним чином можна обчислитити константу більш складної рівноваги, використовючи константи простих рівноваг.
Приклад 1. Розглянемо рівновагу розчинення малорозчинної солі слабої кислоти в розчині сильної кислоти.
CaCO3↓ + 2H+ Ca2+ + H2O + CO2; K-?
Розв’язання. Реакція складається з двох простих рівноваг:
CaCO3↓ Ca2+ +CO32- ; Ks=10‑8,52
CO32- +2H+H2O+CO2; βH2=KH1·KH2=1010,33· 106,35=1016,68
Значить константа рівноваги вихідної реакції: K= Ks βH2=10‑8,52 ·1016,68=108,16;
Відповідь: K=1,45·108.
Приклад 2. Рівновага розчинення малорозчинного гідроксиду в розчині аміаку:
Cu(OH)2↓ +4NH3 Cu(NH3)42++2OH- K=?
Розв’язання. Вихідною речовиною є осад гидроксиду, значить першою рівновагою слід розглянути рівновагу розчинення:
Cu(OH)2↓ Cu2++2OH Ks = 10-19,32.
Утворені іони Cu2+ взаємодіють із молекулами аміаку:
Cu2+ + 4NH3 Cu(NH3)42+ β4 =1011,75.
константа рівнваги вихідної реакції: K = Ks·β4=10-19,32·1011,75 = 10-7,57.
Відповідь: K = 2,69·10-8.
Приклад 3. Рівновага утворення осаду при руйнуванні комплексної сполуки
BiI4-+PO43- BiPO4↓ + 4I-.
Розв’язання. Вихідними є комплексні аніони, значить першою рівновагою слід розглянути рівновагу дисоціації:
BiI4- Bі3+ + 4I- β4-1 = 10-15.
Утворені іони Bі3+ взаємодіють із аніонами фосфату
Bі3+ + PO43- BiPO4↓ Ks-1 = 1022.
константа рівноваги вихідної реакції: K= β4-1· Ks-1 =10-15·1022,9 = 107,9;
Відповідь: K = 7,94·107.
Теоретично вивчаючи рівноважні системи, враховуємо ЗДМ для різних реакцій. Замість того, щоб перетворювати алгебраїчні рівняння ЗДМ, наочніше перетворити реакції, для яких є довідкові дані, переходячи до лінійних комбінацій реакцій.
Розглянемо вихідні реакції
ij Aj 16
де i – номер реакції, ij – стехіометричний коефіцієнт у i-й реакції при реагенті Aj . Множачи реакції на множники ki й додаючи добутки, утворюємо лінійну комбінацію
ki ij) Aj 17
із стехіометричними коефіцієнтами – лінійними комбінаціями коефіцієнтів вихідних реакцій.
Логарифмуючи рівняння ЗДМ для реакції (7), маємо
ij lg aj = lg Ki,
де Kі – константа ЗДМ для і-ї реакції; aj – активність реагенту Aj. Створюючи лінійну комбінацію цих рівнянь, маємо
ki ij) lg aj = lg Ki = lg K, (18)
де K – константа ЗДМ лінійної комбінації (тобто реакції 8). Не ускладнюючи рівнянь ЗДМ, ki вибираємо так, щоб коефіцієнти ki ij) при деяких реагентах обертались на 0 (реагенти «скорочувались»), і відповідна активність у ЗДМ не входила. Комбінуючи n реакцій, «скорочуємо» принаймні (n - 1) реагентів. Лінійна комбінація задовольняє вимозі, що число атомів кожного елемента у реакції зберігається, бо їй задовольняють вихідні реакції.
Лінійно незалежні реакції – такі, що жодна з них не є лінійною комбінацією інших. Математичні терміни «лінійна комбінація» та «лінійна незалежність» відповідають структурі множини реагентів та реакцій. ЗДМ для незалежних реакцій є незалежними алгебраїчними рівняннями. Залежним реакціям відповідають залежні рівняння ЗДМ.
Розглянемо найчастіше вживані лінійні комбінації. Найпростіша з них – зворотна реакція, комбінація з однієї реакції, із множником (‑1). Наприклад, для щавлевої (оксалатної) кислоти маємо
H+ + C2O42‑ HC2O4‑, lg KH1 = 4,266,
H+ + HC2O4‑ H2C2O4, lg KH2 = 1,252.
