
- •Міністерство освіти та науки, молоді та спорту України Харківський національний університет
- •Зміст програми Вступ
- •Хімічна рівновага
- •Органічні реагенти в аналітичній хімії
- •Основні метрологічні характеристики методів визначення
- •Методи визначення
- •Методи визначення
- •Титриметрія
- •Кислотно-основне титрування
- •Комплексонометричне титрування
- •Окисно-відновлювальне титрування
- •Птичні методи аналізу Молекулярна абсорбційна спектрометрія (спектрофотометрія)
- •Атомно-емісійний аналіз і фотометрія полум’я
- •Атомно-абсорбційна спектрометрія
- •Електрохімічні методи аналізу
- •Хроматографічні методи аналізу
- •Біологічні методи аналізу
- •Біохімічні методи аналізу
- •Закінчення
- •Навчальна література
- •1. Аналітична хімія. Загальні поняття і визначення
- •Класифікація методів аналізу, що грунтується на кількості речовини аналіту
- •2. Якісний аналіз. Загальні відомості
- •3. Тeхнікa роботи у лабораторії
- •4. Органічні реагенти у неорганічНому аналізі
- •Характерні групи атомів у органічних реагентах
- •Використання органічних реагентів у аналізі
- •5. Закон дії мас. Алгебра хімічних реакцій
- •Позначення констант рівноваг
- •2. Константи кислотно-основних рівноваг (продовження)
- •Реакції кислотної дисоціації – зворотні до наведених:
- •6. Концентраційно-логарифмічні діаграм (клд)
- •7. Розрахунки рівноважного складу розчинів
- •Метод матеріального балансу при розрахунках рівноважного складу розчинів
- •Приклади обчислень рівноважних концентрацій розчинів за схемою Комаря м. П.
- •8. Буферні розчини
- •9. Лабораторні роботи з якісного аналізу Аналіз катіонів за кислотно-основною схемою
- •Взаємодія катіонів із деякими реагентами
- •Лабораторна робота № 1. Реакції катіонів 1-ї групи. Оформлення записів у лабораторних журналах
- •Зразок запису результатів дослідження властивостей об’єктів у лабораторному журналі
- •Pеaкцiї катіонів l-ї аналiтичної групи
- •Лабораторна робота № 2.
- •2.3.3. Мікрокристалоскопічна реакція на кальцій
- •Peaкції катіонів 2-ї aнaлiтичної групи
- •Лабораторна робота № 3. Аналіз катіонів 1-2-ї груп.
- •3‑Я групa катіонів
- •Приклад звітної картки для катіонів 1-ї та 2-ї груп
- •Лабораторна робота № 4. Реакції катіонів 3-ї групи.
- •4.1. Алюміній
- •4.2. Цинк (іі)
- •4.3. Хром
- •4.4. Станум (іі) та станум (іv)
- •Реакції катіонів 3-ї аналітичної групи
- •Лабораторна робота № 5. Аналіз катіонів 3-ї групи.
- •4‑A групa катіонів
- •Лабораторна робота № 6. Реакції катіонів 4-ї групи.
- •6.1. Ферум (іі) та ферум (ііі)
- •6.2. Бісмут (ііі)
- •6.3. Манган
- •Реакції катіонів 4-ї аналітичної групи
- •6.4. Стибій (ііі) та стибій (V)
- •Лабораторна робота № 7. Реакції катіонів 5-ї групи.
- •7.1. Купрум (іі)
- •7.2. Кадмій (іі)
- •7.4. Кобальт (іі)
- •7.5. Магній (іі)
- •Реакції катіонів 5-ї аналітичної групи
- •Лабораторна робота № 8. Аналіз катіонів 4-5 груп.
- •9.1. Натрій
- •9.3. Амоній
- •Реакції катіонів 6-ї аналітичної групи
- •Лабораторна робота № 10. Аналіз катіонів 6-ї групи.
- •Окисно-відновні властивості аніонів
- •Класифікація аніонів за реакціями осадження
- •Лабораторна робота № 11. Реакції аніонів.
- •11.1. Попередні випробування
- •11.1.3. Проби на присутність аніонів‑відновників.
- •Лабораторна робота № 12. Аналіз аніонів.
- •Коментарі до звітної картки (табл. 16)
- •Хід аналізу аніонів (р0 – вихідна суха речовина,
- •Питання до колоквіуму за темою «якісний аналіз катіонів та аніонів»
- •Кислотно-основна схема систематичного аналізу катіонів
- •Інші схеми систематичного аналізу катіонів
- •Систематичний якісний аналіз аніонів
- •Теорія похибок і статистична обробка результатів вимірювань
- •Теоретичні значення q – критерію. При різних довірчих імовірностях р
- •Значення критерію грубої похибки β
- •Значення t-критерію Стьюдента
- •Значення критерію фішера,
- •1. Гравіметричний аналіз
- •1.1. Терези і принцип зважування
- •Конструкція аналітичних терезів
- •1.2. Порядок зважування на терезах типу влр-200.
- •Лабораторна робота № 1.1. Гравіметричне визначення води в твердих тілах. (для самостійного ознайомлення)
- •2. Підготовка до роботи
- •3. Обладнання
- •4. Хід роботи
- •5. Обробка результатів
- •Умови висушування деяких кристалогідратів
- •Література
- •2.Титриметрія
- •2.1. Загальні відомості
- •2.2. Мірний посуд та робота з ним
- •Час витікання рідини (за стандартом дсту)
- •2.2.1. Перевірка місткості посуду
- •Поправки для об’ємів (в см3), що виміряні мірним посудом (каліброваним для температури 20 °с), якщо ним користуються при різних температурах
- •Лабораторна робота № 2.1. Перевірка місткості посуду. (для самостійного ознайомлення)
- •1. Реактиви й обладнання
- •2. Хід роботи
- •3. Приклад розрахунків
- •2.3. Кислотно-основне титрування
- •Лабораторна робота № 2.2. Стандартизація розчину хлороводневої кислоти.
- •1. Реактиви й обладнання
- •2. Хід роботи
- •3. Обробка результатів
- •Лабораторна робота № 2.3. Титрування сумішей NaOh, Na2co3, NaHco3.
- •1. Попередні зауваження
- •2. Реактиви й обладнання
- •3. Хід роботи
- •4. Обробка результатів
- •Залежно від постановки задачі, ці маси перераховуємо, зважаючи на те:
- •Лабораторна робота № 2.4. Титриметричне визначення аміаку в амонійних солях.
- •1. Загальні відомості
- •2. Реактиви й обладнання
- •3. Хід роботи
- •Відкривають кран (4) і через лійку вводять у колбу для дистиляції 25 мл розчину гідроксиду натрію. Кран закривають, не допускаючи втрати через нього газоподібного аміаку.
- •4. Обробка результатів
- •2.4. Комплексонометричне титрування
- •Лабораторна робота № 2.5. Стандартизація розчину едта.
- •1.Загальні відомості
- •2. Реактиви й обладнання
- •3. Хід роботи
- •4. Обробка результатів
- •Лабораторна робота № 2.6. Визначення цинку й алюмінію в алюмінієвому стопі.
- •1. Загальні відомості
- •2. Реактиви та обладнання
- •3. Хід роботи
- •4. Обробка результатів
- •1. Загальні відомості
- •2. Реактиви й обладнання
- •3. Хід роботи
- •4. Обробка результатів
- •2.5. Окислювально-відновлювальне титрування
- •Лабораторна робота № 2.8. Стандартизація розчину тіосульфату.
- •1. Загальні відомості
- •А. Стандартизація за наважками кристалічного іоду
- •2А. Реактиви й обладнання:
- •3А. Хід роботи
- •4А. Обробка результатів
- •Б. Стандартизація за наважками дихромату калію
- •2Б. Реактиви й обладнання:
- •3Б. Хід роботи
- •4Б. Обробка результатів
- •Лабораторна робота № 2.9. Іодометричне визначення міді.
- •1. Загальні відомості
- •2. Реактиви й обладнання:
- •3. Хід роботи
- •4. Обробка результатів
- •Лабораторна робота № 2.10. Визначення аскорбінової кислоти у фруктових соках.
- •1. Загальні відомості
- •2. Реактиви й обладнання:
- •3. Хід роботи
- •4. Обробка результатів
- •Кислотно-основне титрування
- •Комплексонометричне титрування
- •3. Електрохімічні методи аналізу
- •3.1. Потенціометричний метод аналізу
- •3.1.1. Теоретичні основи потенціометрії
- •3.1.2. Вимірювання потенціалу
- •Класифікація іоноселективних електродів
- •Лабораторна робота № 3.1. Вимірювання рН водяних розчинів методом іонометрії.
- •3.2. Порядок вимірювань Схему приладу наведено на рис. 3.2. Вимірюють у режимі ерс («mV») і вузькому піддіапазоні («-1-4»).
- •4. Хід роботи
- •Лабораторна робота № 3.2. Визначення фторидів у зубній пасті методом іонометрії.
- •1. Загальні відомості
- •3. Алгоритм вимірювань
- •Лабораторна робота № 3.3. Біхроматометричне визначення заліза в окалині, продуктах корозії та інших матеріалах.
- •1. Загальні відомості
- •2. Реактиви й обладнання
- •Шпателі, скляні палички.
- •3. Хід роботи
- •4. Обробка результатів
- •Література
- •Оптичні методи аналізу
- •4.1. Атомна спектроскопія
- •4.2. Атомно-емісійний метод аналізу Лабораторна робота № 4.1. Визначення калію та натрію в мінеральних водах методом полум'яно-емісійної спектрометрії.
- •1. Загальні відомості
- •2. Стандартні розчини
- •3. Підготовка полум’яного фотометра до роботи градуювання
- •4. Аналіз зразка води
- •4.3. Атомно-абсорбційна спектрометрія
- •Лабораторна робота № 4.2. Атомно-абсорбційне визначення міді, цинку та марганцю в соках і водах.
- •1. Загальні відомості
- •2. Апаратура, реактиви, розчини
- •4.4. Спектрофотометрія
- •Лабораторна робота № 4.3. Спектрофотометричне визначення загальної концентрації іонів феруму в мінеральній воді з о-фенантроліном.
- •1. Загальні відомості
- •2. Прилади, матеріали, реактиви
- •3. Визначення градуювальної залежності
- •4. Аналіз зразка води
- •5. Обробка результатів
- •Лабораторна робота № 4.4. Спектрофотометричне визначення летких фенолів. Визначення загальної кількості летких фенолів у стічній воді у перерахунку на c6h5oh.
- •2. Прилади, матеріали, реактиви
- •Фенол, стандартний розчин 0,94 г/л; 9,4 мг/л (розчин фенолу з масовою концентрацією 9,4 мг/л, готують перед застосуванням, розводячи розчин з масовою концентрацією 9,4 г/л).
- •3. Визначення градуювальної залежності
- •4. Попередня підготовка проби
- •5. Вимірювання вмісту фенолів
- •6. Обробка результатів
- •5. Вибрані кінетичні методи аналізу
- •Лабораторна робота № 5.1. Визначення вмісту формальдегіду в розчинах кінетичним методом.
- •1. Сутнiсть методики
- •2. Алгоритм методики
- •2.1. Прилади й реагенти
- •2.2. Побудова градуювального графiка
- •2.3. Вимiрювання невiдомої концентрацiї
- •Лабораторна робота № 5.2. Визначення вмісту хрому (VI) в розчинах кінетичним методом.
- •1. Сутнiсть методики
- •2. Алгоритм методики
- •2.1. Прилади та реагенти
- •2.2. Побудова градуювального графiка
- •2.3. Визначення концентрацiї хрому в дослiджуваному розчинi
- •Література
- •6. Хроматографічні методи аналізу
- •Лабораторна робота № 6.1. Розділення нейтральних хелатів (комплексів металівіз органічним лігандом) методом тшх.
- •1. Реактиви й обладнання
- •2. Одержання екстрактів комплексів
- •3. Хроматографування
- •Лабораторна робота № 6.2. Розділення амінокислот методом тшх.
- •1. Реактиви й обладнання
- •2. Хроматографування
- •7. Біологічні та біохімічні методи аналізу
- •Приклади використання біологічних методів для визначення різних сполук
- •Приклади використання ферментів для визначення їх субстратів (I) і інгібіторів (II)
- •Вибрані логарифми констант рівноваг Неорганічні ліганди
- •I‑, іодид‑іон
- •I‑, іодид‑іон (продовження)
- •Io3‑, іодат‑іон
- •Io3‑, іодат‑іон (продовження)
- •Органічні ліганди: аміни
- •Органічні ліганди: карбонові кислоти
- •Органічні ліганди: амінокислоти
- •Інші органічні ліганди: оксими, тіоли тощо
- •Відновні напівреакції
- •Індикатори
- •61022, Харків, пл. Свободи, 4
8. Буферні розчини
Якщо для розчину характерна властивість зберігати значення будь-якої рівноважної концентрації (активності) при його розведенні або додаванні до нього інших реактивів, то такий розчин називають буферним відносно цього компонента або показника, який розраховують через рівноважну концентрацію (активність) компонента. Відомі буферні розчини рН (pH = -lg[H+]), pM (pM = -lg[Mμ+]), pe- (pe = -lg[e-] = f([Ox]/[Red]). Останні з названих підтримують значення окислювально-відновного потенціалу який є мірою рівноважної концентрації (активності) незв’язаних електронів.
Біологічні системи проявляють буферні властивості відносно рН і ре-.
властивість протидіяти змінам зовні називають буферністю. Буферність вимірюють буферною ємністю. Наприклад, для буферних розчинів рН буферну ємність розраховують за рівнянням:
= C(H+)/pH = (при (С0)) = dC(H+)/dpH. Класичне визначення – це концентрація сильної кислоти (або лугу), додавання яких змінює рН на ±1,0. Буферний розчин рН містить два компоненти, що перетворюються один в одного, приєднуючи або втрачаючи протон. Для розчину слабкої кислоти й її солі (наприклад, оцтової) справджується константа дисоціації:
CH3COOH
CH3COO-
+ H+
Ka
=![]() .
.
Після
логарифмування маємо: pH
= pKa
+lg
![]() .
.
Значення водневого показника такого розчину визначається значенням константи дисоціації та співвідношенням рівноважних концентрацій кислоти та її аніону. При введенні в розчин слабкої кислоти та солі цієї ж кислоти рівноважні концентрації кислоти й аніона відрізняються від введених на незначну величину. Якщо змінювати співвідношення концентрацій від 1:100 до 100:1 можна змінювати рН розчину від рКа – 2 до рКа + 2. Саме в цьому діапазоні (рКа ± 2) на практиці готують буферні розчини рН.
Наприклад: нижченаведені значення рКа слабких кислот:
рКа(CH3COOH CH3COO- + H+) = 4,76;
рКа(NH4+ NH3+ H+ ) = 9,24;
рКа1(H3PO4 H2PO4- + H+) = 2,15;
рКа2(H2PO4- HPO42- + H+) = 7,20;
рКа2(HPO42- PO43- + H+) = 12,35.
Обчислимо діапазони рН, в яких можна приготувати відповідні буферні розчини. Оцтово-ацетатні буферні розчини можна приготувати в діапазоні рН = 4,76 ± 2 = 2,76 – 6,76. Амонійно-аміакові буферні розчини готують у діапазоні рН = 9,24 ± 2 = 7,24 – – 11,246. А фосфатні буферні розчини можна приготувати в діапазонах рН = pKa1 ± 2 = 0,15 – 4,15; рН = pKa2 ± 2 = 5,2 – 9,2; рН = pKa3 ± 2 = 10,35 – 14.
Слід звернути увагу на те, що в сильнокислому (рН ≤ 2) та сильнолужному (рН ≥ 12) середовищах на практиці розчини слабких кислот не використовують. При необхідності такі середовища створюють розчинами сильних кислот та сильних основ (лугів).
розрахунки рН буферних розчинів.
Розглянемо кілька прикладів.
Приклад 1. Визначити рН буферного розчину, який приготували змішуванням розчинів: 55 мл оцтової килоти (с0(HAc) = 0,15 моль/л) та 120 мл розчину ацетату натрію (c0(NaAc) = 0,22 моль/л).
Розв’язання. Обчислимо загальні концентрації в розчині.
с(HAc) = c0(HAc)·V(HAc) / ( V(HAc) + V(naAc)) = = 0,15·0,055/(0,055 + 0,120) = 0,0471 моль/л.
с(СН3COONa) = c0(NaAc)·V(NaAc) / ( V(HAc) + V(naAc)) = = 0,22·0,120/(0,055 + 0,120) = 0,1509 моль/л.
Скористаємося схемою М. П. Комаря.
CH3COOH CH3COO- + H+ lgKа = 4,76
с 0,0471 0,1509
Δс -х х х
[ ] 0,0471 − x 0,1509 + x x
Зробимо підстановку в рівняння константи ЗДМ
-lgх
= pH
= pKa
+lg
![]() =
4,76 + lg
=
4,76 + lg![]() .
.
Приймаючи умови 0,0471 >>x, 0,1509>>x маємо: рН = 5,27.
Умови справджуються 0,0471 >>10-5,27 0,1509>>10-5,27 . Значить розвязання вірне.
Відповідь: рН = 5,27.
Приклад 2. Визначити рН буферного розчину, який приготували змішуванням розчинів: 75 мл гідрокарбонату натрію (с0(NaHCO3) = 0,12 моль/л) та 60 мл розчину карбонату натрію (c0(Na2CO3) = 0,03 моль/л).
Розв’язання. У розчині співіснують іони HCO3- та СO32-. Ці два іони співіснують в другій ступінчастій рівновазі дисоціації вугільної кислоти:
HCO3- СO32- + H+ рKа2 = 10,33;
с 0,12·0,075 0,03·0,06
0,075+0,06 0,075+0,06
Δс -х х х
[ ] 0,12·0,075 - x 0,03·0,06 + x x
0,075+0,06 0,075+0,06
Приймаючи умови x << 0,12·0,075 та x<<0,03·0,06, виражаємо значення –lg x з константи рівноваги
- lgх
= pH
= pKa2
+ lg
lgх
= pH
= pKa2
+ lg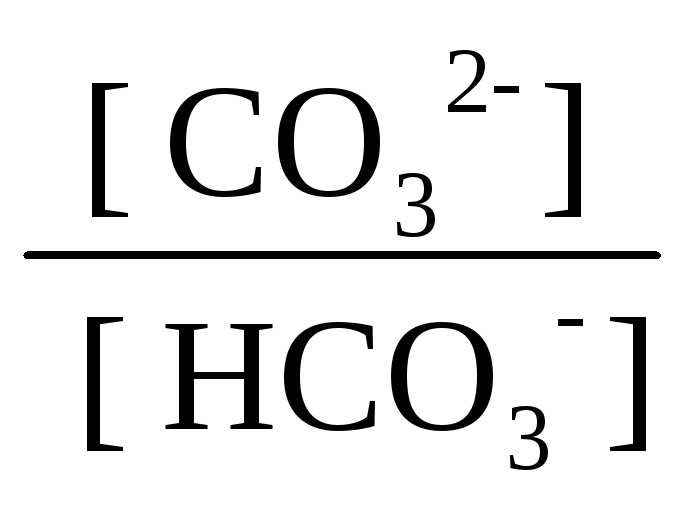 = 10,33 + lg
= 10,33 + lg =
9,63.
=
9,63.
Відповідь: рН = 9,63.
Звертаємо увагу, що добуток концентрації на об’єм розчину можна замінити на кількість речовини (n). При цьому рН буферного розчину залежить від співвідношення кількостей речовини іонів, що утворюють буферну систему (nHA / nA-) і не залежить від об’єму розчину, в якому вони знаходяться. Саме тому розведення буферного розчину водою не змінює (значимо) його рН.
приготування буферних розчинів із заданим рН
Буферний розчин із заданим рН з відомою парою буферуючих компонентів можна приготувати трьома способами:
змішуючи в необхідному співвідношенні кількості речовини; розчини слабкої кислоти і розчинної солі цієї кислоти («кислотою» може виступати кисла сіль багатоосновної кислоти);
змішуючи в необхідному співвідношенні кількості речовини; розчин слабкої кислоти і розчин лугу;
змішуючи в необхідному співвідношенні кількості речовини; розчин солі слабкої кислоти і розчинн сильної кислоти.
Приклад 3. У якому співвідношенні треба змішати розчини, щоб отримати буфер з рН = 5,0?
0,20 моль/л NaAc і 0,15 моль/л НAc;
0,20 моль/л NaAc і 0,15 моль/л НCl;
0,20 моль/л NaOH і 0,15 моль/л НAc.
Розв’язання. 1) За схемою М. П. Комаря.
Hac Ac- + H+ lgKа = 4,76,
c 0, 15·VHac 0,20·VNaac
VHac+VNaac VHac+VNaac
Δс -х х х
[ ] cHac -x cNaac + x x
Знехтувавши змінами введених концентрацій кислоти і солі, враховуючи, що x = 10-рН = 10-5 , зробимо підстановку в вираз константи ЗДМ і прологарифмуємо з негативним знаком.
pH
–
pKa
= lg
![]() ;
;
5,0
–
4,76 = lg![]() ;
;
100,24![]() =
=
![]() ;
;
![]() =
1,30.
=
1,30.
Відповідь: Для приготування буферного розчину з рН = 5,0 треба змішати 0,15 моль/л НAc і 0,20 моль/л NaAc у співвідношенні 1:1,3 (або до 100 мл 0,15 моль/л Нac додати 130 мл 0,20 моль/л NaAc).
2) Розглянемо рівняння реакції протонування ацетат-іона.
Ac- + H+ HAc KH = 104,76
n 0,20·VNaAc 0,15·VHCl -
Після змішувння розчинів
cАс = (0,20·VNaAc − 0,15·VHCl)/ (VNaAc + VHCl);
сHAc = 0,15·VHCl / (VNaAc + VHCl);
c cАс - сHAc
Δc x x -x
[ ] cАс+ x x сHAc−x
x = 10-5; cАс+ x= cАс; сHAc−x= сHAc. Підставляємо в ЗДМ:
![]() ;
;
100,24 = 1,333 VNaAc /VHCl –1,0;
![]()
![]() .
.
Відповідь: Для приготування буферного розчину з рН = 5,0 треба змішати 0,15 моль/л НCl і 0,20 моль/л NaAc у співвідношенні 1:2,05 або до 100 мл 0,20 моль/л NaAc додати 48,7 мл 0,15 моль/л НСl.
Розглянемо рівняння реакції нейтралізації HAc розчином NaOH.
НAc + OH- Ac- + H2O KaKw-1 = 109,24
n 0,15·VHAc 0,20·VNaOH -
Після змішувння розчинів
cАс = 0,20·VNaOH / (VNaOH + VHAc);
сHAc = (0,15·VHAc − 0,20·VNaOH)/ (VNaAc + VHCl);
c cHАс - сAc-
Δc x x -x
[ ] cHАс+ x x сAc−x
x = Kw/[H+]=10-14/10-5= 10-9; cHАс+ x= cHАс; сAc−x= сAc. Підставляємо в ЗДМ
![]() ;
;
109.24-9,0
= 100,24
=
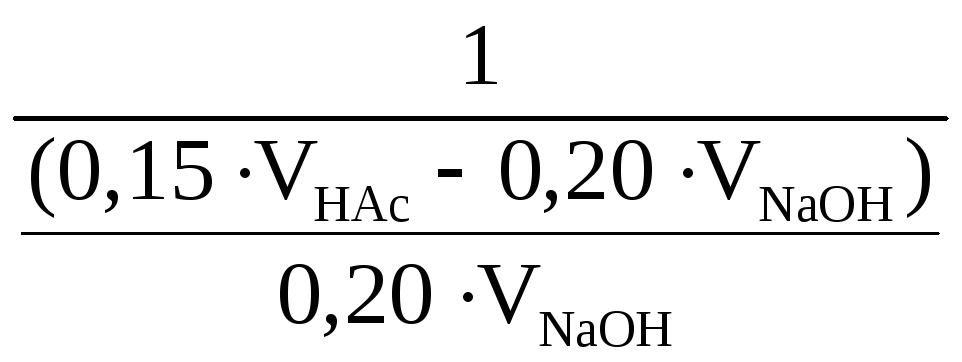 ;
;
![]() ;
;
![]() .
.
Відповідь: Для приготування буферного розчину з рН = 5,0 треба змішати 0,15 моль/л НAc і 0,20 моль/л NaOH у співвідношенні 2,10:1 або до 100 мл 0,15 моль/л HAc додати 47,6 мл 0,20 моль/л NaOH.
