
- •Міністерство освіти та науки, молоді та спорту України Харківський національний університет
- •Зміст програми Вступ
- •Хімічна рівновага
- •Органічні реагенти в аналітичній хімії
- •Основні метрологічні характеристики методів визначення
- •Методи визначення
- •Методи визначення
- •Титриметрія
- •Кислотно-основне титрування
- •Комплексонометричне титрування
- •Окисно-відновлювальне титрування
- •Птичні методи аналізу Молекулярна абсорбційна спектрометрія (спектрофотометрія)
- •Атомно-емісійний аналіз і фотометрія полум’я
- •Атомно-абсорбційна спектрометрія
- •Електрохімічні методи аналізу
- •Хроматографічні методи аналізу
- •Біологічні методи аналізу
- •Біохімічні методи аналізу
- •Закінчення
- •Навчальна література
- •1. Аналітична хімія. Загальні поняття і визначення
- •Класифікація методів аналізу, що грунтується на кількості речовини аналіту
- •2. Якісний аналіз. Загальні відомості
- •3. Тeхнікa роботи у лабораторії
- •4. Органічні реагенти у неорганічНому аналізі
- •Характерні групи атомів у органічних реагентах
- •Використання органічних реагентів у аналізі
- •5. Закон дії мас. Алгебра хімічних реакцій
- •Позначення констант рівноваг
- •2. Константи кислотно-основних рівноваг (продовження)
- •Реакції кислотної дисоціації – зворотні до наведених:
- •6. Концентраційно-логарифмічні діаграм (клд)
- •7. Розрахунки рівноважного складу розчинів
- •Метод матеріального балансу при розрахунках рівноважного складу розчинів
- •Приклади обчислень рівноважних концентрацій розчинів за схемою Комаря м. П.
- •8. Буферні розчини
- •9. Лабораторні роботи з якісного аналізу Аналіз катіонів за кислотно-основною схемою
- •Взаємодія катіонів із деякими реагентами
- •Лабораторна робота № 1. Реакції катіонів 1-ї групи. Оформлення записів у лабораторних журналах
- •Зразок запису результатів дослідження властивостей об’єктів у лабораторному журналі
- •Pеaкцiї катіонів l-ї аналiтичної групи
- •Лабораторна робота № 2.
- •2.3.3. Мікрокристалоскопічна реакція на кальцій
- •Peaкції катіонів 2-ї aнaлiтичної групи
- •Лабораторна робота № 3. Аналіз катіонів 1-2-ї груп.
- •3‑Я групa катіонів
- •Приклад звітної картки для катіонів 1-ї та 2-ї груп
- •Лабораторна робота № 4. Реакції катіонів 3-ї групи.
- •4.1. Алюміній
- •4.2. Цинк (іі)
- •4.3. Хром
- •4.4. Станум (іі) та станум (іv)
- •Реакції катіонів 3-ї аналітичної групи
- •Лабораторна робота № 5. Аналіз катіонів 3-ї групи.
- •4‑A групa катіонів
- •Лабораторна робота № 6. Реакції катіонів 4-ї групи.
- •6.1. Ферум (іі) та ферум (ііі)
- •6.2. Бісмут (ііі)
- •6.3. Манган
- •Реакції катіонів 4-ї аналітичної групи
- •6.4. Стибій (ііі) та стибій (V)
- •Лабораторна робота № 7. Реакції катіонів 5-ї групи.
- •7.1. Купрум (іі)
- •7.2. Кадмій (іі)
- •7.4. Кобальт (іі)
- •7.5. Магній (іі)
- •Реакції катіонів 5-ї аналітичної групи
- •Лабораторна робота № 8. Аналіз катіонів 4-5 груп.
- •9.1. Натрій
- •9.3. Амоній
- •Реакції катіонів 6-ї аналітичної групи
- •Лабораторна робота № 10. Аналіз катіонів 6-ї групи.
- •Окисно-відновні властивості аніонів
- •Класифікація аніонів за реакціями осадження
- •Лабораторна робота № 11. Реакції аніонів.
- •11.1. Попередні випробування
- •11.1.3. Проби на присутність аніонів‑відновників.
- •Лабораторна робота № 12. Аналіз аніонів.
- •Коментарі до звітної картки (табл. 16)
- •Хід аналізу аніонів (р0 – вихідна суха речовина,
- •Питання до колоквіуму за темою «якісний аналіз катіонів та аніонів»
- •Кислотно-основна схема систематичного аналізу катіонів
- •Інші схеми систематичного аналізу катіонів
- •Систематичний якісний аналіз аніонів
- •Теорія похибок і статистична обробка результатів вимірювань
- •Теоретичні значення q – критерію. При різних довірчих імовірностях р
- •Значення критерію грубої похибки β
- •Значення t-критерію Стьюдента
- •Значення критерію фішера,
- •1. Гравіметричний аналіз
- •1.1. Терези і принцип зважування
- •Конструкція аналітичних терезів
- •1.2. Порядок зважування на терезах типу влр-200.
- •Лабораторна робота № 1.1. Гравіметричне визначення води в твердих тілах. (для самостійного ознайомлення)
- •2. Підготовка до роботи
- •3. Обладнання
- •4. Хід роботи
- •5. Обробка результатів
- •Умови висушування деяких кристалогідратів
- •Література
- •2.Титриметрія
- •2.1. Загальні відомості
- •2.2. Мірний посуд та робота з ним
- •Час витікання рідини (за стандартом дсту)
- •2.2.1. Перевірка місткості посуду
- •Поправки для об’ємів (в см3), що виміряні мірним посудом (каліброваним для температури 20 °с), якщо ним користуються при різних температурах
- •Лабораторна робота № 2.1. Перевірка місткості посуду. (для самостійного ознайомлення)
- •1. Реактиви й обладнання
- •2. Хід роботи
- •3. Приклад розрахунків
- •2.3. Кислотно-основне титрування
- •Лабораторна робота № 2.2. Стандартизація розчину хлороводневої кислоти.
- •1. Реактиви й обладнання
- •2. Хід роботи
- •3. Обробка результатів
- •Лабораторна робота № 2.3. Титрування сумішей NaOh, Na2co3, NaHco3.
- •1. Попередні зауваження
- •2. Реактиви й обладнання
- •3. Хід роботи
- •4. Обробка результатів
- •Залежно від постановки задачі, ці маси перераховуємо, зважаючи на те:
- •Лабораторна робота № 2.4. Титриметричне визначення аміаку в амонійних солях.
- •1. Загальні відомості
- •2. Реактиви й обладнання
- •3. Хід роботи
- •Відкривають кран (4) і через лійку вводять у колбу для дистиляції 25 мл розчину гідроксиду натрію. Кран закривають, не допускаючи втрати через нього газоподібного аміаку.
- •4. Обробка результатів
- •2.4. Комплексонометричне титрування
- •Лабораторна робота № 2.5. Стандартизація розчину едта.
- •1.Загальні відомості
- •2. Реактиви й обладнання
- •3. Хід роботи
- •4. Обробка результатів
- •Лабораторна робота № 2.6. Визначення цинку й алюмінію в алюмінієвому стопі.
- •1. Загальні відомості
- •2. Реактиви та обладнання
- •3. Хід роботи
- •4. Обробка результатів
- •1. Загальні відомості
- •2. Реактиви й обладнання
- •3. Хід роботи
- •4. Обробка результатів
- •2.5. Окислювально-відновлювальне титрування
- •Лабораторна робота № 2.8. Стандартизація розчину тіосульфату.
- •1. Загальні відомості
- •А. Стандартизація за наважками кристалічного іоду
- •2А. Реактиви й обладнання:
- •3А. Хід роботи
- •4А. Обробка результатів
- •Б. Стандартизація за наважками дихромату калію
- •2Б. Реактиви й обладнання:
- •3Б. Хід роботи
- •4Б. Обробка результатів
- •Лабораторна робота № 2.9. Іодометричне визначення міді.
- •1. Загальні відомості
- •2. Реактиви й обладнання:
- •3. Хід роботи
- •4. Обробка результатів
- •Лабораторна робота № 2.10. Визначення аскорбінової кислоти у фруктових соках.
- •1. Загальні відомості
- •2. Реактиви й обладнання:
- •3. Хід роботи
- •4. Обробка результатів
- •Кислотно-основне титрування
- •Комплексонометричне титрування
- •3. Електрохімічні методи аналізу
- •3.1. Потенціометричний метод аналізу
- •3.1.1. Теоретичні основи потенціометрії
- •3.1.2. Вимірювання потенціалу
- •Класифікація іоноселективних електродів
- •Лабораторна робота № 3.1. Вимірювання рН водяних розчинів методом іонометрії.
- •3.2. Порядок вимірювань Схему приладу наведено на рис. 3.2. Вимірюють у режимі ерс («mV») і вузькому піддіапазоні («-1-4»).
- •4. Хід роботи
- •Лабораторна робота № 3.2. Визначення фторидів у зубній пасті методом іонометрії.
- •1. Загальні відомості
- •3. Алгоритм вимірювань
- •Лабораторна робота № 3.3. Біхроматометричне визначення заліза в окалині, продуктах корозії та інших матеріалах.
- •1. Загальні відомості
- •2. Реактиви й обладнання
- •Шпателі, скляні палички.
- •3. Хід роботи
- •4. Обробка результатів
- •Література
- •Оптичні методи аналізу
- •4.1. Атомна спектроскопія
- •4.2. Атомно-емісійний метод аналізу Лабораторна робота № 4.1. Визначення калію та натрію в мінеральних водах методом полум'яно-емісійної спектрометрії.
- •1. Загальні відомості
- •2. Стандартні розчини
- •3. Підготовка полум’яного фотометра до роботи градуювання
- •4. Аналіз зразка води
- •4.3. Атомно-абсорбційна спектрометрія
- •Лабораторна робота № 4.2. Атомно-абсорбційне визначення міді, цинку та марганцю в соках і водах.
- •1. Загальні відомості
- •2. Апаратура, реактиви, розчини
- •4.4. Спектрофотометрія
- •Лабораторна робота № 4.3. Спектрофотометричне визначення загальної концентрації іонів феруму в мінеральній воді з о-фенантроліном.
- •1. Загальні відомості
- •2. Прилади, матеріали, реактиви
- •3. Визначення градуювальної залежності
- •4. Аналіз зразка води
- •5. Обробка результатів
- •Лабораторна робота № 4.4. Спектрофотометричне визначення летких фенолів. Визначення загальної кількості летких фенолів у стічній воді у перерахунку на c6h5oh.
- •2. Прилади, матеріали, реактиви
- •Фенол, стандартний розчин 0,94 г/л; 9,4 мг/л (розчин фенолу з масовою концентрацією 9,4 мг/л, готують перед застосуванням, розводячи розчин з масовою концентрацією 9,4 г/л).
- •3. Визначення градуювальної залежності
- •4. Попередня підготовка проби
- •5. Вимірювання вмісту фенолів
- •6. Обробка результатів
- •5. Вибрані кінетичні методи аналізу
- •Лабораторна робота № 5.1. Визначення вмісту формальдегіду в розчинах кінетичним методом.
- •1. Сутнiсть методики
- •2. Алгоритм методики
- •2.1. Прилади й реагенти
- •2.2. Побудова градуювального графiка
- •2.3. Вимiрювання невiдомої концентрацiї
- •Лабораторна робота № 5.2. Визначення вмісту хрому (VI) в розчинах кінетичним методом.
- •1. Сутнiсть методики
- •2. Алгоритм методики
- •2.1. Прилади та реагенти
- •2.2. Побудова градуювального графiка
- •2.3. Визначення концентрацiї хрому в дослiджуваному розчинi
- •Література
- •6. Хроматографічні методи аналізу
- •Лабораторна робота № 6.1. Розділення нейтральних хелатів (комплексів металівіз органічним лігандом) методом тшх.
- •1. Реактиви й обладнання
- •2. Одержання екстрактів комплексів
- •3. Хроматографування
- •Лабораторна робота № 6.2. Розділення амінокислот методом тшх.
- •1. Реактиви й обладнання
- •2. Хроматографування
- •7. Біологічні та біохімічні методи аналізу
- •Приклади використання біологічних методів для визначення різних сполук
- •Приклади використання ферментів для визначення їх субстратів (I) і інгібіторів (II)
- •Вибрані логарифми констант рівноваг Неорганічні ліганди
- •I‑, іодид‑іон
- •I‑, іодид‑іон (продовження)
- •Io3‑, іодат‑іон
- •Io3‑, іодат‑іон (продовження)
- •Органічні ліганди: аміни
- •Органічні ліганди: карбонові кислоти
- •Органічні ліганди: амінокислоти
- •Інші органічні ліганди: оксими, тіоли тощо
- •Відновні напівреакції
- •Індикатори
- •61022, Харків, пл. Свободи, 4
Шпателі, скляні палички.
3. Хід роботи
Наважку зразка (mo), що містить близько 0,1 г заліза, розчиняють при нагріванні у 20 мл концентрованої хлорводневої кислоти. Якщо розчинення неповне, додають по краплях пероксид водню. Додають 20 мл дистильованої води, кип’ятять протягом 3‑5 хв, охолоджують і додають дистильовану воду до об’єму близько 50 мл.
Розчин пропускають через редуктор зі швидкістю 2 мл/хв, редуктор промивають 10-15 мл розчину НCl (с= 1 моль/л). Розчини об’єднують, переводять в електрохімічну комірку і титрують розчином біхромату калію, реєструючи об’єм титранту і е.р.с. Першу пробу зразка титрують грубо, порціями титранту по 1 мл. Перед другою, повторною пробою розраховують орієнтовне значення об’єму титранту, щоб потім, титруючи, в межах стрибка потенціалу додавати титрант порціями по 2-3 краплі. Після стрибка продовжують титрувати до надлишку титранту в 15-20 %. Схему приладу та конструкцію редуктора наведено на рис. 3.3.
4. Обробка результатів
Використовуючи експериментальні дані залежності ЕРС від об’єму титранту, будують криву титрування, загальний вид якої наведено на рис. 3.4. Іон діхромату – у рівновазі з іоном гідрохромату,
Cr2O72‑ + H2O 2 HCrO4‑, lg K = 1,53 [I = 0], 1,97 [1,0], 2,17[3,0].
До точки стехіометрії концентрація [Cr2O72‑] мізерна прівняно з [HCrO4‑]. Враховуючи, що окислювачем є переважно мономір HCrO4‑, у напівреакції відновлення якого бере участь (лише) 3 електрони, розраховують потенціал в стехіометричній точці (ЕS) і відповідний об’єм титранту (vS), ЕS = (3 Е1+ Е2) / (3 + 1).
Масову частку заліза в зразку розраховують за рівнянням:
= vSс(K2Cr2O7)M(Fe)/mo,
де M(Fe) = 55,847 г/моль – молярна маса заліза.
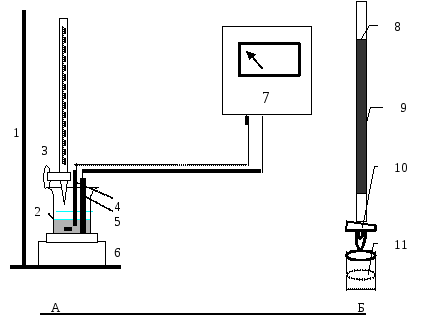
Р
1 – штатив, 2 – комірка (ячейка) для титрування, 3 – бюретка, 4 – платиновий електрод, 5 – електрод порівняння, 6 – магнітна мішалка, 7 – іономір, 8 – скляна трубка, частково заповнена гранулами металічного кадмію, 9 – гранули металічного кадмію, 10 – пристрій, що регулює швидкість витікання розчину, 11 – розчин відновленого компонента.
Література
1. Кольтгоф И. М. Количественный анализ / И. М. Кольтгоф, Е. Б. Сендел – М.: Л., Госхимиздат, 1948. – 824 с.
2.Лайтинен Г. А. Химический анализ. /Г. А. Лайтинен; пер. с англ. – М. : Химия, 1966. – 656 с.
3. Шарло Г.. Методы аналитичесой химии. / Г. Шарло – М.: Л.:, Химия, 1965 – 976 с.
4. Умланд Ф., Комплексные соединения в аналитическойхимии / Ф. Умланд, А. Янсен, Д. Тириг, Г. Вюнш – М.: Мир, 1975. – 532 с.
5. Шварценбах Г. Комплексонометрическое титрование / Г. Шварценбах, Г. Флашка – М.: Химия, 1970. – 360 с.
Оптичні методи аналізу
4.1. Атомна спектроскопія
Атомна спектроскопія – фізичний метод, що грунтується на залежності між складом речовини та випромінюванням чи поглинанням світла у певних умовах. Емісійний спектральний аналіз грунтується на дослідженні емісійних спектрів, що випромінюються збудженими атомами, іонами чи іншими частинками. Як джерела збудження використовують полум’я газу, дугові й іскрові розряди між електродами. Частинка не може довго знаходитись у збудженому стані. Вертаючись у стаціонарний стан, вони випромінюють кванти світла, енергія яких пов’язана з певною довжиною хвилі та частотою. Потік випромінюваного світла, оптичною призмою розкладають на компоненти з різною довжиною хвилею (спектральні лінії), що відповідають певним переходам між енергетичними рівнями відповідно з більшою та меншою енергією. Сукупність таких ліній утворює спектр. Найінтенсивніші зі спектральних ліній, що останніми спостерігаються при зменшенні концентрації хімічного елемента, називають аналітичними лініями. Ідентифікація елемента грунтується на тому, що атомові або його іонові відповідає певна система енергетичних рівней, отже і характерний лише для нього емісійний спектр із певним набором ліній. Використовуючи найпростіші прилади – стилоскопи, спектроскопи, стилометри – емісійний спектр реєструють візуально, коли він виникає, а довжину хвилі окремих ліній визначають приблизно за шкалою відповідного приладу. У спектрографах спектр реєструють на фотопластинці. У полум’яних фотометрах та квантометрах спектр реєструють фотоелементом.
Спектр досліджують одним із двох способів:
1. Визначивши довжину хвилі спектральної лінії, за довідковими даними знаходять відповідний їй хімічний елемент.
2. Знаючи (за довідковими даними) довжину хвиль найінтенсивніших спектральних ліній елемента, що визначають, шукають їх у спектрограмі.
У випадках, коли пріоритетними вимогами до аналізу є швидкість та низька межа виявлення, емісійний спектральний аналіз виявляється дуже ефективним. Проте цим методом неможливо виявити такі елементи, як нітроген (азот), оксиген (кисень), сульфур (сірку), галогени. До того ж цей метод аналізу є деструктивним – руйнує відповідний зразок. Якщо число потрібних аналізів є малим, метод стає занадто дорогим через велику вартість необхідного обладнання.
Кількісний аналіз базується на вимірюванні ітенсивності випромінювання або погинання світла.
