- •Міністерство освіти та науки, молоді та спорту України Харківський національний університет
- •Зміст програми Вступ
- •Хімічна рівновага
- •Органічні реагенти в аналітичній хімії
- •Основні метрологічні характеристики методів визначення
- •Методи визначення
- •Методи визначення
- •Титриметрія
- •Кислотно-основне титрування
- •Комплексонометричне титрування
- •Окисно-відновлювальне титрування
- •Птичні методи аналізу Молекулярна абсорбційна спектрометрія (спектрофотометрія)
- •Атомно-емісійний аналіз і фотометрія полум’я
- •Атомно-абсорбційна спектрометрія
- •Електрохімічні методи аналізу
- •Хроматографічні методи аналізу
- •Біологічні методи аналізу
- •Біохімічні методи аналізу
- •Закінчення
- •Навчальна література
- •1. Аналітична хімія. Загальні поняття і визначення
- •Класифікація методів аналізу, що грунтується на кількості речовини аналіту
- •2. Якісний аналіз. Загальні відомості
- •3. Тeхнікa роботи у лабораторії
- •4. Органічні реагенти у неорганічНому аналізі
- •Характерні групи атомів у органічних реагентах
- •Використання органічних реагентів у аналізі
- •5. Закон дії мас. Алгебра хімічних реакцій
- •Позначення констант рівноваг
- •2. Константи кислотно-основних рівноваг (продовження)
- •Реакції кислотної дисоціації – зворотні до наведених:
- •6. Концентраційно-логарифмічні діаграм (клд)
- •7. Розрахунки рівноважного складу розчинів
- •Метод матеріального балансу при розрахунках рівноважного складу розчинів
- •Приклади обчислень рівноважних концентрацій розчинів за схемою Комаря м. П.
- •8. Буферні розчини
- •9. Лабораторні роботи з якісного аналізу Аналіз катіонів за кислотно-основною схемою
- •Взаємодія катіонів із деякими реагентами
- •Лабораторна робота № 1. Реакції катіонів 1-ї групи. Оформлення записів у лабораторних журналах
- •Зразок запису результатів дослідження властивостей об’єктів у лабораторному журналі
- •Pеaкцiї катіонів l-ї аналiтичної групи
- •Лабораторна робота № 2.
- •2.3.3. Мікрокристалоскопічна реакція на кальцій
- •Peaкції катіонів 2-ї aнaлiтичної групи
- •Лабораторна робота № 3. Аналіз катіонів 1-2-ї груп.
- •3‑Я групa катіонів
- •Приклад звітної картки для катіонів 1-ї та 2-ї груп
- •Лабораторна робота № 4. Реакції катіонів 3-ї групи.
- •4.1. Алюміній
- •4.2. Цинк (іі)
- •4.3. Хром
- •4.4. Станум (іі) та станум (іv)
- •Реакції катіонів 3-ї аналітичної групи
- •Лабораторна робота № 5. Аналіз катіонів 3-ї групи.
- •4‑A групa катіонів
- •Лабораторна робота № 6. Реакції катіонів 4-ї групи.
- •6.1. Ферум (іі) та ферум (ііі)
- •6.2. Бісмут (ііі)
- •6.3. Манган
- •Реакції катіонів 4-ї аналітичної групи
- •6.4. Стибій (ііі) та стибій (V)
- •Лабораторна робота № 7. Реакції катіонів 5-ї групи.
- •7.1. Купрум (іі)
- •7.2. Кадмій (іі)
- •7.4. Кобальт (іі)
- •7.5. Магній (іі)
- •Реакції катіонів 5-ї аналітичної групи
- •Лабораторна робота № 8. Аналіз катіонів 4-5 груп.
- •9.1. Натрій
- •9.3. Амоній
- •Реакції катіонів 6-ї аналітичної групи
- •Лабораторна робота № 10. Аналіз катіонів 6-ї групи.
- •Окисно-відновні властивості аніонів
- •Класифікація аніонів за реакціями осадження
- •Лабораторна робота № 11. Реакції аніонів.
- •11.1. Попередні випробування
- •11.1.3. Проби на присутність аніонів‑відновників.
- •Лабораторна робота № 12. Аналіз аніонів.
- •Коментарі до звітної картки (табл. 16)
- •Хід аналізу аніонів (р0 – вихідна суха речовина,
- •Питання до колоквіуму за темою «якісний аналіз катіонів та аніонів»
- •Кислотно-основна схема систематичного аналізу катіонів
- •Інші схеми систематичного аналізу катіонів
- •Систематичний якісний аналіз аніонів
- •Теорія похибок і статистична обробка результатів вимірювань
- •Теоретичні значення q – критерію. При різних довірчих імовірностях р
- •Значення критерію грубої похибки β
- •Значення t-критерію Стьюдента
- •Значення критерію фішера,
- •1. Гравіметричний аналіз
- •1.1. Терези і принцип зважування
- •Конструкція аналітичних терезів
- •1.2. Порядок зважування на терезах типу влр-200.
- •Лабораторна робота № 1.1. Гравіметричне визначення води в твердих тілах. (для самостійного ознайомлення)
- •2. Підготовка до роботи
- •3. Обладнання
- •4. Хід роботи
- •5. Обробка результатів
- •Умови висушування деяких кристалогідратів
- •Література
- •2.Титриметрія
- •2.1. Загальні відомості
- •2.2. Мірний посуд та робота з ним
- •Час витікання рідини (за стандартом дсту)
- •2.2.1. Перевірка місткості посуду
- •Поправки для об’ємів (в см3), що виміряні мірним посудом (каліброваним для температури 20 °с), якщо ним користуються при різних температурах
- •Лабораторна робота № 2.1. Перевірка місткості посуду. (для самостійного ознайомлення)
- •1. Реактиви й обладнання
- •2. Хід роботи
- •3. Приклад розрахунків
- •2.3. Кислотно-основне титрування
- •Лабораторна робота № 2.2. Стандартизація розчину хлороводневої кислоти.
- •1. Реактиви й обладнання
- •2. Хід роботи
- •3. Обробка результатів
- •Лабораторна робота № 2.3. Титрування сумішей NaOh, Na2co3, NaHco3.
- •1. Попередні зауваження
- •2. Реактиви й обладнання
- •3. Хід роботи
- •4. Обробка результатів
- •Залежно від постановки задачі, ці маси перераховуємо, зважаючи на те:
- •Лабораторна робота № 2.4. Титриметричне визначення аміаку в амонійних солях.
- •1. Загальні відомості
- •2. Реактиви й обладнання
- •3. Хід роботи
- •Відкривають кран (4) і через лійку вводять у колбу для дистиляції 25 мл розчину гідроксиду натрію. Кран закривають, не допускаючи втрати через нього газоподібного аміаку.
- •4. Обробка результатів
- •2.4. Комплексонометричне титрування
- •Лабораторна робота № 2.5. Стандартизація розчину едта.
- •1.Загальні відомості
- •2. Реактиви й обладнання
- •3. Хід роботи
- •4. Обробка результатів
- •Лабораторна робота № 2.6. Визначення цинку й алюмінію в алюмінієвому стопі.
- •1. Загальні відомості
- •2. Реактиви та обладнання
- •3. Хід роботи
- •4. Обробка результатів
- •1. Загальні відомості
- •2. Реактиви й обладнання
- •3. Хід роботи
- •4. Обробка результатів
- •2.5. Окислювально-відновлювальне титрування
- •Лабораторна робота № 2.8. Стандартизація розчину тіосульфату.
- •1. Загальні відомості
- •А. Стандартизація за наважками кристалічного іоду
- •2А. Реактиви й обладнання:
- •3А. Хід роботи
- •4А. Обробка результатів
- •Б. Стандартизація за наважками дихромату калію
- •2Б. Реактиви й обладнання:
- •3Б. Хід роботи
- •4Б. Обробка результатів
- •Лабораторна робота № 2.9. Іодометричне визначення міді.
- •1. Загальні відомості
- •2. Реактиви й обладнання:
- •3. Хід роботи
- •4. Обробка результатів
- •Лабораторна робота № 2.10. Визначення аскорбінової кислоти у фруктових соках.
- •1. Загальні відомості
- •2. Реактиви й обладнання:
- •3. Хід роботи
- •4. Обробка результатів
- •Кислотно-основне титрування
- •Комплексонометричне титрування
- •3. Електрохімічні методи аналізу
- •3.1. Потенціометричний метод аналізу
- •3.1.1. Теоретичні основи потенціометрії
- •3.1.2. Вимірювання потенціалу
- •Класифікація іоноселективних електродів
- •Лабораторна робота № 3.1. Вимірювання рН водяних розчинів методом іонометрії.
- •3.2. Порядок вимірювань Схему приладу наведено на рис. 3.2. Вимірюють у режимі ерс («mV») і вузькому піддіапазоні («-1-4»).
- •4. Хід роботи
- •Лабораторна робота № 3.2. Визначення фторидів у зубній пасті методом іонометрії.
- •1. Загальні відомості
- •3. Алгоритм вимірювань
- •Лабораторна робота № 3.3. Біхроматометричне визначення заліза в окалині, продуктах корозії та інших матеріалах.
- •1. Загальні відомості
- •2. Реактиви й обладнання
- •Шпателі, скляні палички.
- •3. Хід роботи
- •4. Обробка результатів
- •Література
- •Оптичні методи аналізу
- •4.1. Атомна спектроскопія
- •4.2. Атомно-емісійний метод аналізу Лабораторна робота № 4.1. Визначення калію та натрію в мінеральних водах методом полум'яно-емісійної спектрометрії.
- •1. Загальні відомості
- •2. Стандартні розчини
- •3. Підготовка полум’яного фотометра до роботи градуювання
- •4. Аналіз зразка води
- •4.3. Атомно-абсорбційна спектрометрія
- •Лабораторна робота № 4.2. Атомно-абсорбційне визначення міді, цинку та марганцю в соках і водах.
- •1. Загальні відомості
- •2. Апаратура, реактиви, розчини
- •4.4. Спектрофотометрія
- •Лабораторна робота № 4.3. Спектрофотометричне визначення загальної концентрації іонів феруму в мінеральній воді з о-фенантроліном.
- •1. Загальні відомості
- •2. Прилади, матеріали, реактиви
- •3. Визначення градуювальної залежності
- •4. Аналіз зразка води
- •5. Обробка результатів
- •Лабораторна робота № 4.4. Спектрофотометричне визначення летких фенолів. Визначення загальної кількості летких фенолів у стічній воді у перерахунку на c6h5oh.
- •2. Прилади, матеріали, реактиви
- •Фенол, стандартний розчин 0,94 г/л; 9,4 мг/л (розчин фенолу з масовою концентрацією 9,4 мг/л, готують перед застосуванням, розводячи розчин з масовою концентрацією 9,4 г/л).
- •3. Визначення градуювальної залежності
- •4. Попередня підготовка проби
- •5. Вимірювання вмісту фенолів
- •6. Обробка результатів
- •5. Вибрані кінетичні методи аналізу
- •Лабораторна робота № 5.1. Визначення вмісту формальдегіду в розчинах кінетичним методом.
- •1. Сутнiсть методики
- •2. Алгоритм методики
- •2.1. Прилади й реагенти
- •2.2. Побудова градуювального графiка
- •2.3. Вимiрювання невiдомої концентрацiї
- •Лабораторна робота № 5.2. Визначення вмісту хрому (VI) в розчинах кінетичним методом.
- •1. Сутнiсть методики
- •2. Алгоритм методики
- •2.1. Прилади та реагенти
- •2.2. Побудова градуювального графiка
- •2.3. Визначення концентрацiї хрому в дослiджуваному розчинi
- •Література
- •6. Хроматографічні методи аналізу
- •Лабораторна робота № 6.1. Розділення нейтральних хелатів (комплексів металівіз органічним лігандом) методом тшх.
- •1. Реактиви й обладнання
- •2. Одержання екстрактів комплексів
- •3. Хроматографування
- •Лабораторна робота № 6.2. Розділення амінокислот методом тшх.
- •1. Реактиви й обладнання
- •2. Хроматографування
- •7. Біологічні та біохімічні методи аналізу
- •Приклади використання біологічних методів для визначення різних сполук
- •Приклади використання ферментів для визначення їх субстратів (I) і інгібіторів (II)
- •Вибрані логарифми констант рівноваг Неорганічні ліганди
- •I‑, іодид‑іон
- •I‑, іодид‑іон (продовження)
- •Io3‑, іодат‑іон
- •Io3‑, іодат‑іон (продовження)
- •Органічні ліганди: аміни
- •Органічні ліганди: карбонові кислоти
- •Органічні ліганди: амінокислоти
- •Інші органічні ліганди: оксими, тіоли тощо
- •Відновні напівреакції
- •Індикатори
- •61022, Харків, пл. Свободи, 4
Класифікація іоноселективних електродів
Залежно від того, який матеріал використовують для виготовлення, розрізняють тверді, скляні та рідкі мембрани.
|
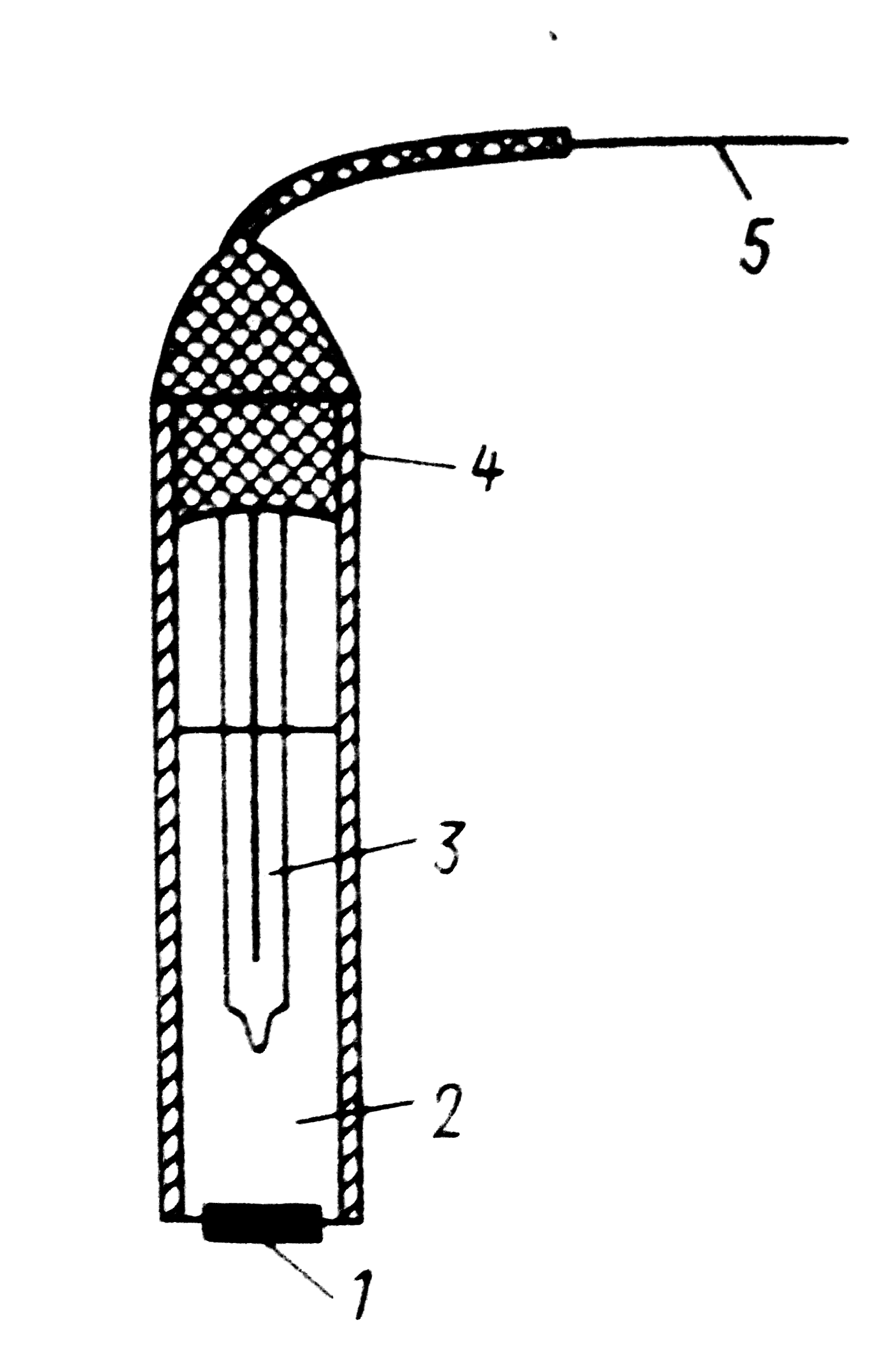
Рис. 3.5. Фторид – селективний електрод: 1 – пластина з LaF3; 2–стандартний внутрішній розчин NaF+NaCl; 3 – внутрішній електрод порівняння; 4 – ізоляція; 5 – струмовідвід |
Тверда мембрана — це маленький диск або пігулка з монокристалічного (наприклад, LaF3) або порошкового (наприклад, Ag2S або суміш Ag2S і AgBr) матеріалу з іонною провідністю. Електроди з мембранами на основі таких матеріалів мають низьку межу визначення (вона визначається найнижчою розчинністю матеріалу мембрани) і високою селективністю. Кращі представники цього класу електродів фторид-селективний із мембраною з монокристала LaF3 та електрод з мембраною з Ag2S. Фторид-селективний електрод (рис. 3.5) виконує функцію Нернста в інтервалі pF від 0 до 6. Визначенню фторида не заважають навіть 1000-кратна кількість більшості сторонніх іонів. Дуже заважають тільки ОН- - іони (вважають, що це через реакції |
LaF3 + 30H- ↔ La(OH)3 + 3F-), тому електрод не можна використовувати в лужному середовищі. У дуже кислих розчинах електродна функція порушується внаслідок реакції утворення малодисоційованої HF.
Фторид-селективний електрод. Багато років його випускає промисловість і застосовують для визначення фтора в різноманітних об’єктах (грунт, попіл рослин, мінерали, води, повітря, харчові продукти, біологічні рідини, зубна емаль). На основі цього електрода створено автоматичний датчик для контролю процесу фторування питної води.
Добрим
матеріалом для виготовлення твердих
мембран є Ag2S,
оскільки він характеризується малою
розчинністю (Ks ~10-51),
доволі низьким електричним опором та
високою стійкістю до дії окисників та
відновників. Функція Нернста електрода
в розчинах аргентум нітрату виконується
в межах pAg від 0 до 7. Цей електрод можна
використовувати для визначення й
сульфід-іонів, його потенціал визначається
рівнянням Е
= const
–
![]() у сильно лужному середовищі ця залежність
має нахил 29,6 мВ/р аS
у
межах pSвід
2 до 6. Завдяки низькому електричному
опору Ag2S
часто використовують як інертну матрицю
для створення електродів на основі
сумішей; наприклад, AgBr і Ag2S
для визначення бромід-іонів або CuS і
Ag2S
для визначення іонів купруму (II).
Іноді
такі електроди виготовляють без
внутрішнього розчину (рис. 3.6), що зручно
на практиці. Такі електроди називають
твердотілими.
у сильно лужному середовищі ця залежність
має нахил 29,6 мВ/р аS
у
межах pSвід
2 до 6. Завдяки низькому електричному
опору Ag2S
часто використовують як інертну матрицю
для створення електродів на основі
сумішей; наприклад, AgBr і Ag2S
для визначення бромід-іонів або CuS і
Ag2S
для визначення іонів купруму (II).
Іноді
такі електроди виготовляють без
внутрішнього розчину (рис. 3.6), що зручно
на практиці. Такі електроди називають
твердотілими.
![]()
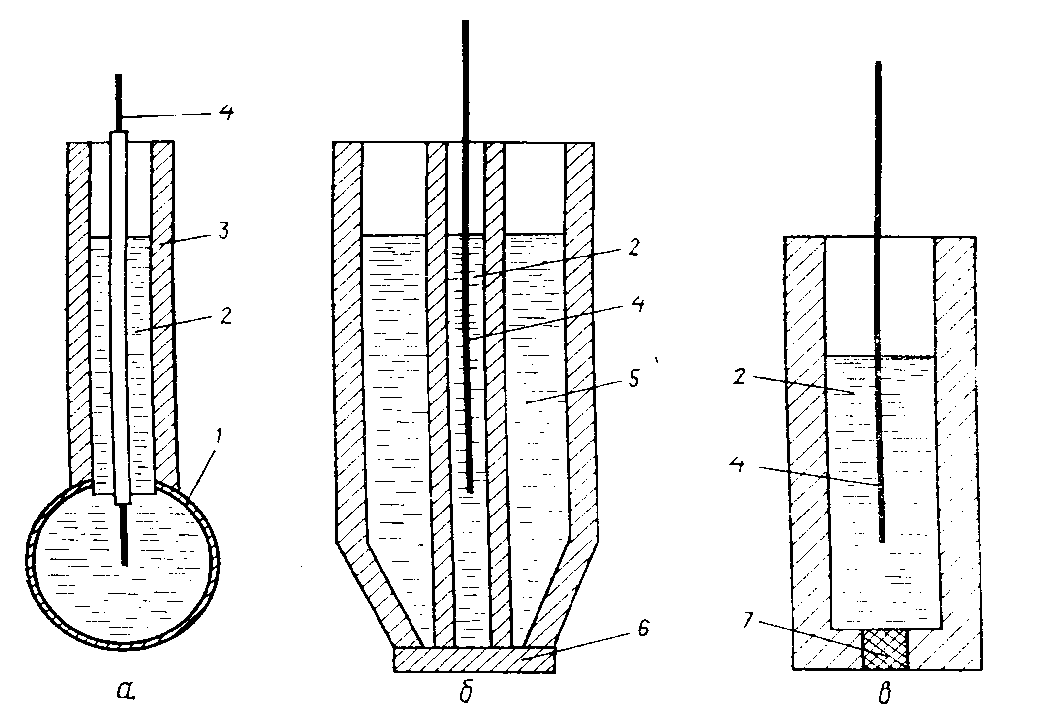
Рис. 3.6. Схеми скляного електрода (а), та іонселективних електродів з рідкою (б) та твердою мембраною (в).
1−скляна мембрана, 2−внутрішній розчин, 3−скляна трубка, 4−внутрішній електрод, 5−рідкий іонообмінник, 6−мембрана, насичена рідким іонообмінником, 7−гомогенна або гетерогенна тверда мембрана.
Скляні
мембрани виготовляють
зі спеціального скла. Їх склад підбирають
таким чином, щоб мембрана виявляла
підвищену селективність до іона, який
визначають. Першим електродом зі скляною
мембраною був електрод, селективний
відносно![]() Н+-іонів,
який витіснив усі інші електроди, які
використовували для вимірювання рН.
Потім були створені скляні електроди
для визначення інших іонів (К+,
Na+,
Ag+).
Скляний електрод для вимірювання рН
зображено на рис. 3.6. Головна його частина
− тонка скляна мембрана у вигляді
кульки, яка припаяна до скляної трубки.
Для виготовлення мембрани найчастіше
використовують скло, що містить 22 %
Na2О,
6 % СаО, 72 % SiО2.
Всередину кульки наливають 0,1 М розчин
хлоридної кислоти, насичений аргентум
хлоридом, і вставляють срібний дріт,
який є внутрішнім електродом порівняння.
Н+-іонів,
який витіснив усі інші електроди, які
використовували для вимірювання рН.
Потім були створені скляні електроди
для визначення інших іонів (К+,
Na+,
Ag+).
Скляний електрод для вимірювання рН
зображено на рис. 3.6. Головна його частина
− тонка скляна мембрана у вигляді
кульки, яка припаяна до скляної трубки.
Для виготовлення мембрани найчастіше
використовують скло, що містить 22 %
Na2О,
6 % СаО, 72 % SiО2.
Всередину кульки наливають 0,1 М розчин
хлоридної кислоти, насичений аргентум
хлоридом, і вставляють срібний дріт,
який є внутрішнім електродом порівняння.
Структуру скла складає решітка з атомів Оксигену, які пов’язані один з одним через атоми Силіцію. Силіцій пов’язаний з чотирма атомами Оксигену, а Оксиген бере участь у двох групах SiО4, тому утворюється тривимірна решітка. Порожнини в ній зайняті катіонами, які утримуються за рахунок електростатичних взаємодій із киснем. Чим вище заряд катіона, тим міцніше він утримується, тому в реакції обміну з протонами, яка відбувається при гідратації скла, здатні брати участь практично тільки однозарядні катіони.
Якщо скляний електрод довгий час витримати в воді, то на обох поверхнях мембрани утворюється тонкий шар (~ 10 -4 мм) гідратованого геля. Усі порожнини займають іони Н+, які витіснили іони натрію, що там знаходились. Потенціал добре вимоченого скляного електрода описують рівнянням
E = 0,0591lgaH+ .
Це означає, що електрод має водневу функцію і його можна використовувати для вимірювання рН. Однак треба пам’ятати, що і в дуже кислому і в дуже лужному середовищі електрод дає неправильні результати, так як спостерігається велика похибка (∆рН) вимірювань. У сильно лужному середовищі занижені результати пояснюють впливом іонів лужних металів унаслідок реакції обміну на поверхні гідратованого геля:
H+Gel- + M+ ↔ M+Gel- + H+.
скло розчин скло розчин
Константа
рівноваги цієї реакції Кн-м
залежить від сорту скла, тому мембрани
з різних видів скла будуть характеризуватися
різними коефіцієнтами селективності
![]() Похибка
вимірювання рН лужних розчинів також
буде залежати від сорту скла.
Похибка
вимірювання рН лужних розчинів також
буде залежати від сорту скла.
Рідкі мембрани готують так: розчиняють органічну іонну сполуку (наприклад, кальцієву сіль естеруортофосфатної кислоти) або нейтральну (наприклад, валіноміцин) сполуку в органічному розчиннику. Цей розчин наносять на пористий полімерний носій. За конструкцією електрод із рідкою мембраною схожий на скляний. Найважливіші представники електродів із рідкою мембраною - Са-селективний електрод на основі кальцієвої солі естеруортофосфатної кислоти [(RO)2POO]2Ca (R містить від 8 до 16 атомів С) і К-селективний електрод на основі валіноміцина.
Існують ще ферментні електроди. Відповідно до рекомендацій ІЮПАК ферментний електрод − іоноселективний електрод, що покритий шаром ферменту, який викликає реакцію органічної або неорганічної речовини (субстрату) з утворенням частинок (іонів, молекул), що зумовлюють відгук електрода.
В основі роботи ферментного електрода є ферментативна реакція:
Фермент
Р ечовина, що визначається(субстрат)
ечовина, що визначається(субстрат)
 Продукти(молекули,
іони)
Продукти(молекули,
іони)
У результаті утворюється частинка, за зміною концентрації якої можна прослідкувати за допомогою іоноселективного електрода. Кожний фермент каталізує тільки один тип реакції, тому ферментні електроди мають високу селективність.
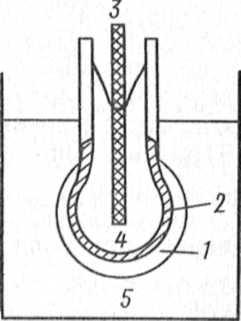
Для прикладу розглянемо електрод на основі ферменту уреази для визначення карбаміду CO(NH2)2 (рис. 3.7). У шарі геля, що містить уреазу, відбувається реакція:
Уреаза
C O(NH2)2
+ 2H2О
+ H
+
2NH+4
+ HCO-3
O(NH2)2
+ 2H2О
+ H
+
2NH+4
+ HCO-3
Буфер Н+
Концентрацію NH+4 – іонів, що утворюються, вимірюють за допомогою NH+4-селективного електрода. При постійній активності ферменту потенціал цього електрода є функцією логарифма концентрації CO(NH2)2.
|
|
Рис. 3.7. Ферментний електрод для визначення карбаміду: 1−гель, який містить фермент уреазу; 2−скляна мембрана, селективна до NH4+-іонів; 3−внутрішній електрод порівняння; 4− внутрішній стандартний розчин NH4+; 5− cубстрат |
Серед іон-селективних електродів виділимо як найважливіші: скляні (H+, Na+, NH4+, Ag+, Tl+, Li+, Cs+), твердомембранні (F‑, Cl‑, Br‑, I‑, CN‑, SCN‑, S2‑, Ag+, Pb2+, Cd2+, Cu2+), рідкомембранні (Са2+, NO3‑, CO32‑, поверхнево-активні речовин), газочутливі (NH3, CO2, SO2, H2S), біоспецифічні (ферментні, імуноферментні, бактеріальні, мікробні).
Титруючи потенціометрично, реєструють зміну потенціалу залежно від кількості титранту. Оскільки в околі точки стехіометрії буферність мала, то е.р.с. комірки різко змінюється зі зміною кількості титранту. На кривій титрування в координатах об’єм розчину титранту − е.р.с. спостерігаємо «стрибок», з найкрутішою частиною якого ототожнюємо кінцеву точку титрування. Переваги потенціометричного титрування порівняно з титруванням з індикатором полягають у можливості точніше зафіксувати стехіометричну точку, можливості титрувати мутні і забарвлені розчини. Використовуючи математичні методи, можна визначати координату точки стехіометрії за інформацією з широкого відтінку значень змінної – витрати титранту. У методах кислотно-основного титрування застосовують як індикаторний електрод, оборотний відносно іонів Н+, найбільш поширено – скляний. В окислювально-відновному титруванні зазвичай використовують платиновий електрод. У комплексонометричному й осаджувальному титруванні індикаторний електрод має бути селективним відносно одного з іонів, що беруть участь у реакції.