- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Введение
- •Преформация и эпигенез
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Французские тератологи
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Цитоплазматическая спецификация у зародышей оболочников
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •10________________ Глава 7______________________________________________________________________________
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •12________________ Глава 7______________________________________________________________________________
- •Природа морфогенетических детерминантов у оболочников
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •14________________ Глава 7______________________________________________________________________________
- •Цитоплазматическая локализация у зародышей моллюсков
- •Дополнительные сведения и гипотезы: Внутриклеточная локализация и движения морфогенетических детерминантов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •16________________ Глава 7______________________________________________________________________________
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Полярная лопасть
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Детерминация у нематодыCaenorhabditis elegans
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Цитоплазматическая локализация детерминантов половых клеток
- •Детерминация половых клеток у нематод
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Детерминация половых клеток у насекомых
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Детерминация половых клеток у амфибий
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Генетика цитоплазматических детерминантов у дрозофилы
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Август Вейсман: теория зародышевой плазмы
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Вильгельм Ру: мозаичное развитие
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Ганс Дриш: регуляционное развитие
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Свен Гёрстадиус: потенции и градиенты в ооците
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Ганс Шпеман: прогрессивная детерминация эмбриональных клеток
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Ганс Шпеман и Гильда Мангольд: первичная эмбриональная индукция
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Региональная специфичность индукции
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Механизмы первичной эмбриональной индукции
- •Индукция мезодермальной специфичности энтодермой
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Влияние индукции на активность генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Поиски индукторов мезодермы
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Нейральный индуктор как молекула, способная к диффузии
- •Компетенция и вторичная индукция
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •62________________ Глава 8______________________________________________________________________________
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Тождество геномов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •66________________ Глава 9______________________________________________________________________________
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Трансдетерминация
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •70________________ Глава 9______________________________________________________________________________
- •Метаплазия
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Клонирование у амфибий: ограничение потенций клеток
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Клонирование у амфибий: исключения из ограничения потенций
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Методы молекулярной биологии Гибридизация нуклеиновых кислот
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Клонирование генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Когда ген клонирован...
- •Секвенирование
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Перенос генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Сайт-специфичный мутагенез и трансляция разрыва
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дифференциальная экспрессия генов
- •Идентичность геномов
- •Стабильность генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Нарушение стабильности геномов: изменения в генах лимфоцитов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Изменения генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дифференциальный синтез рнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с. Глава 11. Регуляция экспрессии генов на уровне транскрипции: изменение транскрипции в ходе развития
- •Введение
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гетерохроматин
- •Отцовский гетерохроматин у мучнистого червеца
- •Инактивация X хромосомы у млекопитающих
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Определение времени инактивации х-хромосомы
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Амплифицированные гены Амплификация генов рибосомной рнк
- •Механизм амплификации рибосомных генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Визуализация транскрипции на амплифицированных генах
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Молекулярная основа быстрой транскрипции рибосомных генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Селективная транскрипция генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Хромосомные пуфы и хромосомы типа ламповых щеток
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Синтез овальбумина
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Транскрипция глобиновых генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Белок-регулятор транскрипции: контроль генов5s-рРнк Центральный промоторный элемент
- •Регуляция транскрипции факторомTfiiia
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Связывание и функцияTfiiia
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Контроль детерминации на уровне транскрипции: гены переключения путей дифференцировки дочерних клеток
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Детерминация клеток вульвы у Caenorhabditis elegans
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Эукариотические гены, кодирующие белки Экзоны и интроны
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Структура и функция промотора
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Связывание транс-регуляторных белков с промоторами
- •Структура и функция энхансеров
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Энхансеры, активность которых регулируется во времени
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Тканеспецифические энхансеры
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Энхансеры, реагирующие на гормоны
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Транскрипция генов легких цепей иммуноглобулинов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Модульные гены
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Метилирование днк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Определение сайтов метилирования
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Хроматин эукариот Нуклеосомы
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Активация репрессированного хроматина Доступность для транс-регупяторных факторов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Сайты, гиперчувствительные к днКазе
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гиперчувствительность к днКазе и характер метилирования
- •Регуляция активности генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Связь активной днк с ядерным матриксом Присоединение активного хроматина к ядерному матриксу
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Топоизомеразы и транскрипция генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Гетерогенная ядерная рнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Сложность ядерной и цитоплазматической рнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Контроль развития на уровне процессинга яРнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Механизмы специфического процессинга ядерных рнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Присутствие в ядре предшественников мРнк, не прошедших процессинг
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Образование альтернативных белков на одном гене: дифференциальный процессинг рнк в иммунной системе
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дифференциальный процессинг рнк: генерация новых белков в разных клетках в разное время
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Альтернативный процессинг рнк и детерминация пола
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Биохимия процессинга рнк
- •Сайты сплайсинга
- •Сайты разветвления
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Роль малых ядерных рибонуклеопротеидных частиц
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Транспорт из ядра
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Трансляционная регуляция развития
- •Механизм трансляции у эукариот
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Контроль на уровне трансляции при координированном синтезе белка: продукция гемоглобина
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Селективная деградация мРнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Трансляционный контроль ооцитных мРнк Данные, свидетельствующие о материнской регуляции раннего развития
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Запасенные мРнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Характеристика материнских мРнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Механизм трансляционного контроля ооцитных мРнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Материнские мРнк и дробление
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Активация генома зародыша
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гормональная стабилизация специфических мРнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Широкая распространенность контроля на уровне трансляции
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Посттрансляционная регуляция экспрессии генов
- •Посттрансляционная активация белков
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Инактивация белков при посттрансляционных модификациях
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Субклеточная компартментализация белков с помощью посттрансляционных модификаций: адресование белков в мембраны и лизосомы
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Адресование белков в ядра и митохондрии
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Надмолекулярная сборка
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Коллаген: конспект посттрансляционной регуляции
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Глава 8. Прогрессивная детерминация.
- •Глава 9. Тождество геномов и дифференциальная экспрессия генов: эмбриологические исследования. Перевод г. М. Игнатьевой.................................................... 65
- •Глава 10. Тождество геномов и дифференциальная экспрессия генов: молекулярные исследования. Перевод b.C.
- •Глава 11. Регуляция экспрессии генов на уровне транскрипции: изменение транскрипции в ходе развития. Перевод
- •Глава 12. Регуляция экспрессии генов на уровне транскрипции: механизмы дифференциальной транскрипции генов. Перевод b.C. Михайлова.............................. 137
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Глава 13. Контроль развития на уровне процессинга рнк. Перевод b.C. Михайлова i77
- •Глава 14. Трансляционная и посттрансляционная регуляция процессов развития. Перевод b.C. Михайлова .... 199
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Cкотт ф. Гилберт биология развития
- •129820. Гсп. Москва. 1-й Рижский пер., 2.
- •Глава 8. Прогрессивная детерминация 39
- •Глава 9. Тождество геномов и дифференциальная экспрессия генов: эмбриологические исследования 65
- •Глава 10. Тождество геномов и дифференциальная экспрессия генов: молекулярные исследования 80
- •Глава 11. Регуляция экспрессии генов на уровне транскрипции: изменение транскрипции в ходе развития 109
- •Глава 12. Регуляция экспрессии генов на уровне транскрипции: механизмы дифференциальной транскрипции генов 137
- •Глава 13. Контроль развития на уровне процессинга рнк 177
- •Глава 14. Трансляционная и посттрансляционная регуляция процессов развития 199
Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
|
|
|
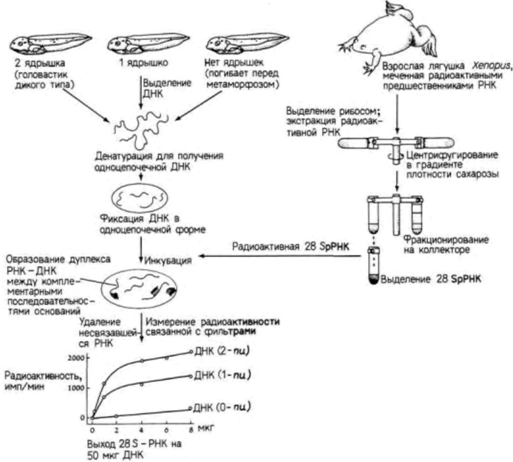
Рис. 10.1. Опыт по гибридизации нуклеиновых кислот, из которого становится ясно, что ядрышко кодирует рибосомную 28S-PHK. Из содержащих 2, 1 и 0 ядрышек клеток головастиков экстрагировали по отдельности ДНК. Полученную ДНК денатурировали (делали одноцепочечной) и определенное количество одноцепочечной ДНК запекали на нитроцеллюлозных фильтрах. Одновременно из клеток взрослых лягушек получали радиоактивную 28S-pPHK путем выделения рибосом и последующего разделения трех основных видов РНК. Радиоактивную 28S-pPHK инкубировали на ДНК-содержащих фильтрах в условиях, когда она могла присоединяться к комплементарным участкам ДНК. Затем измеряли радиоактивность фильтров в сцинтилляционном счетчике. |
|
|
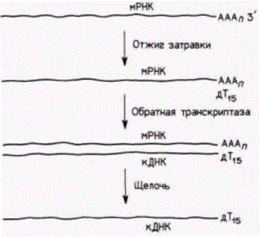
Рис. 10.2. Метод получения комплементарной ДНК (кДНК). Большая часть информационных РНК (мРНК) содержит протяженную последовательность из остатков аденозина (АААn) на 3’-концс молекул (см. гл. 11): поэтому, экспериментаторы гибридизуют «затравку», состоящую из 15 остатков дезокситимидина (дТ15), с 3'-концом мРНК. Затем с помощью обратной транскриптазы синтезируют комплементарную цепь ДНК, начиная от затравки дТ15., кДНК можно выделить с помощью повышения pH раствора, что вызывает денатурацию двухцепочечного гибрида и деградацию РНК. |
Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
________ ТОЖДЕСТВО ГЕНОМОВ И ДИФФЕРЕНЦИАЛЬНАЯ ЭКСПРЕССИЯ ГЕНОВ 83
|
Таблица 10.1. Широко используемые рестриктазы | ||
|
Фермент |
Источник |
Сайт узнавания и расщепления1 |
|
| ||
1 Все сайты узнавания рестриктаз имеют центральную симметрию. Двухцепочечная последовательность, прочитанная в одном направлении, идентична последовательности, прочитанной в обратном направлении.
На рис. 10.3 показана плазмида pBR322, которая часто используется молекулярными биологами в качестве клонирующего вектора. Она несет два гена устойчивости к антибиотикам – tcR, который обеспечивает устойчивость к тетрациклину, и АрR, который делает бактерии устойчивыми к ампициллину. Эти гены устойчивости к антибиотикам, столь нежелательные для медиков, становятся незаменимыми для генных инженеров, поскольку один из BamH1 сайтов в этой плазмиде расположен в середине гена tcR. Предполагаемые рекомбинантные плазмиды. полученные описанным ранее способом, затем инкубируют с клетками Ε. coli дикого типа, чувствительными к обоим антибиотикам, в условиях, позволяющих бактериям захватить эти плазмиды. При этом не каждая бактерия включает плазмиду и не каждая плазмида включает чужеродный ген. т.к. липкие концы плазмиды в сайте рестрикции могут ренатурировать друг с другом. Для отбора тех бактерий, которые включили плазмиды, обработанные клетки Ε. coli выращивают на агаре в присутствии ампициллина. При этом выживают только те бактерии, которые включили плазмиды. Затем часть каждой жизнеспособной колонии переносится на агар, содержащий тетрациклин. Если бактерии продолжают рост, то, следовательно, ген tcR плазмиды остался интактным и эта плазмида восстановилась в результате простого соединения собственных концов друг с другом. Если бактерии, выросшие на среде с ампициллином, не выживают на среде с тетрациклином, то ген устойчивости к тетрациклину в плазмиде уже не функционирует. Это означает, что ген tcR разорван фрагментом фермента рестрикции из чужого генома. Со среды, содержащей ампициллин, отбираются те колонии, которые не росли на среде, содержащей тетрациклин. Эти колонии следует проверить на присутствие определенного гена.
Клетки из каждой колонии E. coli, содержащей рекомбинантные плазмиды, помещают на нитроцеллюлозный фильтр. После лизиса клеток клеточная ДНК присоединяется к фильтру. Затем цепи ДНК разделяют с помощью нагревания и инкубируют фильтр в растворе, содержащем радиоактивную РНК (или ее кДНК-копию) для гена, выбранного для клонирования. Если плазмида содержит этот ген, то ДНК этого гена должна присутствовать на бумаге и только эта ДНК обладает способностью присоединять радиоактивную РНК или кДНК. Именно поэтому соответствующие места фильтра окажутся радиоактивными. Радиоактивность этих участков регистрируется с помощью радиоавтографии. Для этого чувствительная рентгеновская пленка помещается поверх обработанной бумаги. Электроны с высокой энергией, излучаемые радиоактивной РНК, сенсибилизируют зерна серебра в пленке, вызывая их потемнение при последующем проявлении. В результате над каждой колонией, содержащей рекомбинантную плазмиду с определенным геном, образуется темное пятно (рис. 10.3). Эти колонии изолируют и выращивают вновь. В итоге можно получить многие триллионы клеток, каждая из которых содержит сотни рекомбинантных плазмид.
Рекомбинантные плазмиды можно отделить от хромосомы Ε. coli с помощью центрифугирования. Фрагмент ДНК человека, содержащий интересующий нас ген, высвобождается при инкубации плазмид с BamH1. Этот фрагмент затем отделяют от плазмидной ДНК. Таким образом, экспериментатор получает микрограммы очищенной ДНК, содержащей определенный ген. [Хотя описанная процедура выглядит вполне логичной и простой, число колоний, которые следует скринировать, достигает часто астрономических чисел. Число случайных фрагментов, которые должны быть клонированы, для того чтобы получить интересующий вас ген, возрастает с увеличением сложности генома организма1. Чтобы клонировать с 99%-ной надежностью желаемый ген из Е. coli, необходимо проанализировать примерно 1500 колоний. Для млекопитающих это число возрастет до 800 000: вместо
![]()
1 Сложность в данном случае определяется числом генов различного типа, содержащихся в клеточном ядре.