- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Введение
- •Преформация и эпигенез
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Французские тератологи
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Цитоплазматическая спецификация у зародышей оболочников
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •10________________ Глава 7______________________________________________________________________________
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •12________________ Глава 7______________________________________________________________________________
- •Природа морфогенетических детерминантов у оболочников
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •14________________ Глава 7______________________________________________________________________________
- •Цитоплазматическая локализация у зародышей моллюсков
- •Дополнительные сведения и гипотезы: Внутриклеточная локализация и движения морфогенетических детерминантов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •16________________ Глава 7______________________________________________________________________________
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Полярная лопасть
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Детерминация у нематодыCaenorhabditis elegans
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Цитоплазматическая локализация детерминантов половых клеток
- •Детерминация половых клеток у нематод
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Детерминация половых клеток у насекомых
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Детерминация половых клеток у амфибий
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Генетика цитоплазматических детерминантов у дрозофилы
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Август Вейсман: теория зародышевой плазмы
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Вильгельм Ру: мозаичное развитие
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Ганс Дриш: регуляционное развитие
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Свен Гёрстадиус: потенции и градиенты в ооците
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Ганс Шпеман: прогрессивная детерминация эмбриональных клеток
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Ганс Шпеман и Гильда Мангольд: первичная эмбриональная индукция
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Региональная специфичность индукции
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Механизмы первичной эмбриональной индукции
- •Индукция мезодермальной специфичности энтодермой
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Влияние индукции на активность генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Поиски индукторов мезодермы
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Нейральный индуктор как молекула, способная к диффузии
- •Компетенция и вторичная индукция
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •62________________ Глава 8______________________________________________________________________________
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Тождество геномов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •66________________ Глава 9______________________________________________________________________________
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Трансдетерминация
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •70________________ Глава 9______________________________________________________________________________
- •Метаплазия
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Клонирование у амфибий: ограничение потенций клеток
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Клонирование у амфибий: исключения из ограничения потенций
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Методы молекулярной биологии Гибридизация нуклеиновых кислот
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Клонирование генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Когда ген клонирован...
- •Секвенирование
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Перенос генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Сайт-специфичный мутагенез и трансляция разрыва
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дифференциальная экспрессия генов
- •Идентичность геномов
- •Стабильность генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Нарушение стабильности геномов: изменения в генах лимфоцитов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Изменения генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дифференциальный синтез рнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с. Глава 11. Регуляция экспрессии генов на уровне транскрипции: изменение транскрипции в ходе развития
- •Введение
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гетерохроматин
- •Отцовский гетерохроматин у мучнистого червеца
- •Инактивация X хромосомы у млекопитающих
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Определение времени инактивации х-хромосомы
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Амплифицированные гены Амплификация генов рибосомной рнк
- •Механизм амплификации рибосомных генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Визуализация транскрипции на амплифицированных генах
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Молекулярная основа быстрой транскрипции рибосомных генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Селективная транскрипция генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Хромосомные пуфы и хромосомы типа ламповых щеток
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Синтез овальбумина
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Транскрипция глобиновых генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Белок-регулятор транскрипции: контроль генов5s-рРнк Центральный промоторный элемент
- •Регуляция транскрипции факторомTfiiia
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Связывание и функцияTfiiia
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Контроль детерминации на уровне транскрипции: гены переключения путей дифференцировки дочерних клеток
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Детерминация клеток вульвы у Caenorhabditis elegans
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Эукариотические гены, кодирующие белки Экзоны и интроны
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Структура и функция промотора
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Связывание транс-регуляторных белков с промоторами
- •Структура и функция энхансеров
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Энхансеры, активность которых регулируется во времени
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Тканеспецифические энхансеры
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Энхансеры, реагирующие на гормоны
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Транскрипция генов легких цепей иммуноглобулинов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Модульные гены
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Метилирование днк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Определение сайтов метилирования
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Хроматин эукариот Нуклеосомы
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Активация репрессированного хроматина Доступность для транс-регупяторных факторов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Сайты, гиперчувствительные к днКазе
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гиперчувствительность к днКазе и характер метилирования
- •Регуляция активности генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Связь активной днк с ядерным матриксом Присоединение активного хроматина к ядерному матриксу
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Топоизомеразы и транскрипция генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Гетерогенная ядерная рнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Сложность ядерной и цитоплазматической рнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Контроль развития на уровне процессинга яРнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Механизмы специфического процессинга ядерных рнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Присутствие в ядре предшественников мРнк, не прошедших процессинг
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Образование альтернативных белков на одном гене: дифференциальный процессинг рнк в иммунной системе
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дифференциальный процессинг рнк: генерация новых белков в разных клетках в разное время
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Альтернативный процессинг рнк и детерминация пола
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Биохимия процессинга рнк
- •Сайты сплайсинга
- •Сайты разветвления
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Роль малых ядерных рибонуклеопротеидных частиц
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Транспорт из ядра
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Трансляционная регуляция развития
- •Механизм трансляции у эукариот
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Контроль на уровне трансляции при координированном синтезе белка: продукция гемоглобина
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Селективная деградация мРнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Трансляционный контроль ооцитных мРнк Данные, свидетельствующие о материнской регуляции раннего развития
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Запасенные мРнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Характеристика материнских мРнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Механизм трансляционного контроля ооцитных мРнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Материнские мРнк и дробление
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Активация генома зародыша
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гормональная стабилизация специфических мРнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Широкая распространенность контроля на уровне трансляции
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Посттрансляционная регуляция экспрессии генов
- •Посттрансляционная активация белков
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Инактивация белков при посттрансляционных модификациях
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Субклеточная компартментализация белков с помощью посттрансляционных модификаций: адресование белков в мембраны и лизосомы
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Адресование белков в ядра и митохондрии
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Надмолекулярная сборка
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Коллаген: конспект посттрансляционной регуляции
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Глава 8. Прогрессивная детерминация.
- •Глава 9. Тождество геномов и дифференциальная экспрессия генов: эмбриологические исследования. Перевод г. М. Игнатьевой.................................................... 65
- •Глава 10. Тождество геномов и дифференциальная экспрессия генов: молекулярные исследования. Перевод b.C.
- •Глава 11. Регуляция экспрессии генов на уровне транскрипции: изменение транскрипции в ходе развития. Перевод
- •Глава 12. Регуляция экспрессии генов на уровне транскрипции: механизмы дифференциальной транскрипции генов. Перевод b.C. Михайлова.............................. 137
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Глава 13. Контроль развития на уровне процессинга рнк. Перевод b.C. Михайлова i77
- •Глава 14. Трансляционная и посттрансляционная регуляция процессов развития. Перевод b.C. Михайлова .... 199
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Cкотт ф. Гилберт биология развития
- •129820. Гсп. Москва. 1-й Рижский пер., 2.
- •Глава 8. Прогрессивная детерминация 39
- •Глава 9. Тождество геномов и дифференциальная экспрессия генов: эмбриологические исследования 65
- •Глава 10. Тождество геномов и дифференциальная экспрессия генов: молекулярные исследования 80
- •Глава 11. Регуляция экспрессии генов на уровне транскрипции: изменение транскрипции в ходе развития 109
- •Глава 12. Регуляция экспрессии генов на уровне транскрипции: механизмы дифференциальной транскрипции генов 137
- •Глава 13. Контроль развития на уровне процессинга рнк 177
- •Глава 14. Трансляционная и посттрансляционная регуляция процессов развития 199
Активация репрессированного хроматина Доступность для транс-регупяторных факторов
Эксперименты по гибридизации в растворах свидетельствуют, что в геноме большинства позвоночных имеется по меньшей мере 10 000 тканеспецифических генов: и в клетках любого конкретного типа активность почти всех этих генов репрессирована. Обычно считают, что «молчащее» состояние хроматина является репрессированным и что тканеспецифические гены активируются локальным удалением ингибирующих факторов (Weintraub, 1985). Как отмечено выше, главным механизмом общей репрессии генов является, вероятно, компактизация ДНК в кластеры нуклеосом. Если ДНК оказывается закрученной в эти плотные структуры, транс-регуляторные факторы инициации транскрипции не в состоянии найти последовательности ДНК. с которыми они могли бы связаться (Schlissel, Brown, 1984). Когда ДНК, содержащая промотор, входит в состав нуклеосом, соответствующие гены не могут транскрибироваться (Workman, Roeder, 1987). Однако, если к этим генам перед сборкой нуклеосом или во время сборки добавлен белок, связывающийся с ТАТА-боксом (TFIID), то реконструированный хроматин оказывается транскрипционно активным.
Специфическая для клеточного типа активация генов может проходить поэтому в два этапа. Во-первых, участок хроматина должен развернуться так, чтобы ген и его промотор стали доступными для транскрипционных факторов и РНК-полимеразы. Во-вторых, чтобы связаться с экспонированной ДНК, эти транскрипционные факторы должны присутствовать в ядрах.
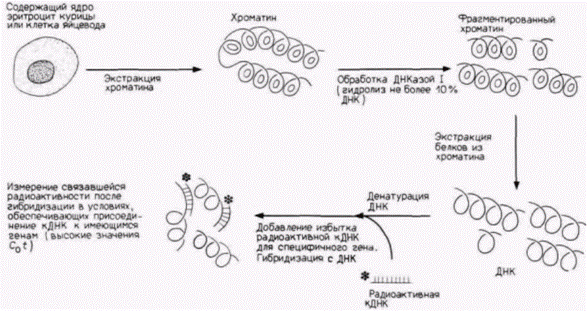
Имеются данные, что в любой конкретной клетке транскрибируемые гены более доступны для РНК-полимеразы и транс-регуляторных факторов, чем нетранскрибируемые. (Иными словами, репрессирующая система отменена локально в этих участках.) Основные данные в пользу этого положения получены в работах по определению чувствительности специфических генов различных клеток к ДНКазе. Доступность гена к ядерным белкам может быть оценена при обработке хроматина ткани небольшими количествами ДНКазы I (ДНКаза, отличающаяся по специфичности от микрококковой ДНКазы). Из обработанного хроматина экстрагируют ДНК и смешивают с радиоактивной кДНК для конкретного гена (рис. 12.25). Если кДНК находит последовательности для связывания, значит, соответствующий ген был защищен белками хроматина от переваривания ДНКазой (он был для нее недоступен), и этот ген будет, вероятно, недоступен также для РНК-полимеразы. Однако если зонд кДНК не находит последовательности для связывания, значит, этот ген был экспонирован для ДНКазы и будет, вероятно, доступен для РНК-полимеразы и транс-регуляторных факторов.
Было обнаружено, что чувствительность определенного гена к ДНКазе I зависит от типа клеток, в которых он находится (табл. 12.2) (Weintraub, Groudine, 1976). Когда хроматин из развивающихся эритроцитов курицы был обработан ДНКазой I,
Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
_________ МЕХАНИЗМЫ ДИФФЕРЕНЦИАЛЬНОЙ ТРАНСКРИПЦИИ ГЕНОВ__________________________________ 163
|
|
|
Рис. 12.25. Протокол опыта по определению специфичности гидролиза хроматина ДНКазой I. Результаты опыта см. в табл. 12.2. |
затем из него была экстрагирована ДНК и смешана с радиоактивной глобиновой кДНК, глобиновой кДНК практически не было с чем связываться. Глобиновые гены в хроматине оказались гидролизованными небольшими количествами ДНКазы I. Однако обработка теми же количествами ДНКазы I хроматина из клеток мозга не приводила к деградации глобиновых генов. Поэтому глобиновые гены доступны для экзогенных ферментов в хроматине развивающихся эритроцитов, но не в хроматине клеток мозга.
Сходным образом ген овальбумина доступен для переваривания ДНКазой I в хроматине яйцевода и недоступен в хроматине эритроцитов. Когда хроматин обрабатывают ДНКазой I и экстрагируют ДНК, овальбуминовая кДНК способна найти комплементарные последовательности в препаратах из эритроцитов, но не в ДНК из хроматина яйцевода. Таким образом, здесь мы имеем четкую корреляцию между дифференциальной регуляцией генов и структурой хроматина.