- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Введение
- •Преформация и эпигенез
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Французские тератологи
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Цитоплазматическая спецификация у зародышей оболочников
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •10________________ Глава 7______________________________________________________________________________
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •12________________ Глава 7______________________________________________________________________________
- •Природа морфогенетических детерминантов у оболочников
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •14________________ Глава 7______________________________________________________________________________
- •Цитоплазматическая локализация у зародышей моллюсков
- •Дополнительные сведения и гипотезы: Внутриклеточная локализация и движения морфогенетических детерминантов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •16________________ Глава 7______________________________________________________________________________
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Полярная лопасть
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Детерминация у нематодыCaenorhabditis elegans
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Цитоплазматическая локализация детерминантов половых клеток
- •Детерминация половых клеток у нематод
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Детерминация половых клеток у насекомых
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Детерминация половых клеток у амфибий
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Генетика цитоплазматических детерминантов у дрозофилы
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Август Вейсман: теория зародышевой плазмы
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Вильгельм Ру: мозаичное развитие
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Ганс Дриш: регуляционное развитие
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Свен Гёрстадиус: потенции и градиенты в ооците
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Ганс Шпеман: прогрессивная детерминация эмбриональных клеток
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Ганс Шпеман и Гильда Мангольд: первичная эмбриональная индукция
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Региональная специфичность индукции
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Механизмы первичной эмбриональной индукции
- •Индукция мезодермальной специфичности энтодермой
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Влияние индукции на активность генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Поиски индукторов мезодермы
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Нейральный индуктор как молекула, способная к диффузии
- •Компетенция и вторичная индукция
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •62________________ Глава 8______________________________________________________________________________
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Тождество геномов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •66________________ Глава 9______________________________________________________________________________
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Трансдетерминация
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •70________________ Глава 9______________________________________________________________________________
- •Метаплазия
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Клонирование у амфибий: ограничение потенций клеток
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Клонирование у амфибий: исключения из ограничения потенций
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Методы молекулярной биологии Гибридизация нуклеиновых кислот
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Клонирование генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Когда ген клонирован...
- •Секвенирование
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Перенос генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Сайт-специфичный мутагенез и трансляция разрыва
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дифференциальная экспрессия генов
- •Идентичность геномов
- •Стабильность генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Нарушение стабильности геномов: изменения в генах лимфоцитов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Изменения генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дифференциальный синтез рнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с. Глава 11. Регуляция экспрессии генов на уровне транскрипции: изменение транскрипции в ходе развития
- •Введение
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гетерохроматин
- •Отцовский гетерохроматин у мучнистого червеца
- •Инактивация X хромосомы у млекопитающих
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Определение времени инактивации х-хромосомы
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Амплифицированные гены Амплификация генов рибосомной рнк
- •Механизм амплификации рибосомных генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Визуализация транскрипции на амплифицированных генах
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Молекулярная основа быстрой транскрипции рибосомных генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Селективная транскрипция генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Хромосомные пуфы и хромосомы типа ламповых щеток
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Синтез овальбумина
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Транскрипция глобиновых генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Белок-регулятор транскрипции: контроль генов5s-рРнк Центральный промоторный элемент
- •Регуляция транскрипции факторомTfiiia
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Связывание и функцияTfiiia
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Контроль детерминации на уровне транскрипции: гены переключения путей дифференцировки дочерних клеток
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Детерминация клеток вульвы у Caenorhabditis elegans
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Эукариотические гены, кодирующие белки Экзоны и интроны
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Структура и функция промотора
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Связывание транс-регуляторных белков с промоторами
- •Структура и функция энхансеров
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Энхансеры, активность которых регулируется во времени
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Тканеспецифические энхансеры
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Энхансеры, реагирующие на гормоны
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Транскрипция генов легких цепей иммуноглобулинов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Модульные гены
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Метилирование днк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Определение сайтов метилирования
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Хроматин эукариот Нуклеосомы
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Активация репрессированного хроматина Доступность для транс-регупяторных факторов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Сайты, гиперчувствительные к днКазе
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гиперчувствительность к днКазе и характер метилирования
- •Регуляция активности генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Связь активной днк с ядерным матриксом Присоединение активного хроматина к ядерному матриксу
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Топоизомеразы и транскрипция генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Гетерогенная ядерная рнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Сложность ядерной и цитоплазматической рнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Контроль развития на уровне процессинга яРнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Механизмы специфического процессинга ядерных рнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Присутствие в ядре предшественников мРнк, не прошедших процессинг
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Образование альтернативных белков на одном гене: дифференциальный процессинг рнк в иммунной системе
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дифференциальный процессинг рнк: генерация новых белков в разных клетках в разное время
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Альтернативный процессинг рнк и детерминация пола
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Биохимия процессинга рнк
- •Сайты сплайсинга
- •Сайты разветвления
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Роль малых ядерных рибонуклеопротеидных частиц
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Транспорт из ядра
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Трансляционная регуляция развития
- •Механизм трансляции у эукариот
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Контроль на уровне трансляции при координированном синтезе белка: продукция гемоглобина
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Селективная деградация мРнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Трансляционный контроль ооцитных мРнк Данные, свидетельствующие о материнской регуляции раннего развития
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Запасенные мРнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Характеристика материнских мРнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Механизм трансляционного контроля ооцитных мРнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Материнские мРнк и дробление
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Активация генома зародыша
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гормональная стабилизация специфических мРнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Широкая распространенность контроля на уровне трансляции
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Посттрансляционная регуляция экспрессии генов
- •Посттрансляционная активация белков
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Инактивация белков при посттрансляционных модификациях
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Субклеточная компартментализация белков с помощью посттрансляционных модификаций: адресование белков в мембраны и лизосомы
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Адресование белков в ядра и митохондрии
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Надмолекулярная сборка
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Коллаген: конспект посттрансляционной регуляции
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Глава 8. Прогрессивная детерминация.
- •Глава 9. Тождество геномов и дифференциальная экспрессия генов: эмбриологические исследования. Перевод г. М. Игнатьевой.................................................... 65
- •Глава 10. Тождество геномов и дифференциальная экспрессия генов: молекулярные исследования. Перевод b.C.
- •Глава 11. Регуляция экспрессии генов на уровне транскрипции: изменение транскрипции в ходе развития. Перевод
- •Глава 12. Регуляция экспрессии генов на уровне транскрипции: механизмы дифференциальной транскрипции генов. Перевод b.C. Михайлова.............................. 137
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Глава 13. Контроль развития на уровне процессинга рнк. Перевод b.C. Михайлова i77
- •Глава 14. Трансляционная и посттрансляционная регуляция процессов развития. Перевод b.C. Михайлова .... 199
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Cкотт ф. Гилберт биология развития
- •129820. Гсп. Москва. 1-й Рижский пер., 2.
- •Глава 8. Прогрессивная детерминация 39
- •Глава 9. Тождество геномов и дифференциальная экспрессия генов: эмбриологические исследования 65
- •Глава 10. Тождество геномов и дифференциальная экспрессия генов: молекулярные исследования 80
- •Глава 11. Регуляция экспрессии генов на уровне транскрипции: изменение транскрипции в ходе развития 109
- •Глава 12. Регуляция экспрессии генов на уровне транскрипции: механизмы дифференциальной транскрипции генов 137
- •Глава 13. Контроль развития на уровне процессинга рнк 177
- •Глава 14. Трансляционная и посттрансляционная регуляция процессов развития 199
Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
156_______________ ГЛАВА 12_______________________________________________________________________
|
|
|
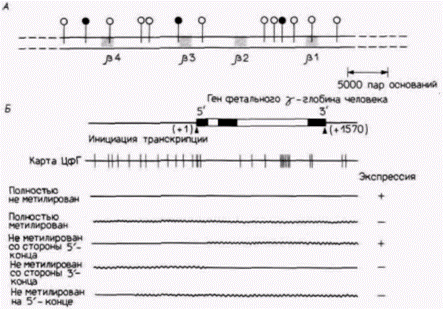
Рис. 12.19. Схема метилирования глобиновых генов. А. Метилирование ß-цепей глобина кролика (ß1, ß2, ß3, ß4). Каждый ген этого кластера представлен серым квадратом. Последовательности ЦЦГГ обозначены кружками, причем черными кружками обозначены те из них, которые полностью метилированы только в клетках, не транскрибирующих глобины. Б. Метилирование контролирует транскрипцию клонированного гена фетального γ-глобина человека. На верхней диаграмме показаны клонированный глобиновый ген и его 5'- и 3'-фланкирующие области. Экзоны обозначены черным цветом, интроны – белым, фланкирующие области – тонкими линиями. Под диаграммой представлена карта возможных сайтов метилирования ДНК, которые представляют собой участки, где присутствует динуклеотид ЦфГ. Под этой картой приведены схемы метилирования пяти клонов, которые были изучены в данной работе. Прямыми линиями изображены неметилированные сегменты, волнистыми – метилированные. Знаки + и – с правой стороны рисунка указывают на то, экспрессировались или не экспрессировались данные сегменты. (А – по Shen, Maniatis, 1980; Б – по Busslinger et al., 1983.) |
ние на 5’-конце гена играет, по-видимому, главную роль в регуляции экспрессии генов.
Третья группа данных получена в экспериментах, в которых изначально неактивные гены активировались при их деметилировании непосредственно внутри ядер. Была получена корреляция между активацией молчащих генов и утратой метильных групп из их цитозинов. Из гл. 10 мы узнали, что неактивные гены, специфичные для печени, могут быть активированы в фибробластах мыши после слияния этих фибробластов с клетками печени. Эта активация сопровождается деметилированием генов, специфических для печени особенно в их 5'-областях (Sellem et al., 1985). Когда 5'-области этих генов деметилированы, они похожи на активные гены, специфические для печени, и активно транскрибируют РНК.
Другой метод деметилирования генов заключается в обработке клеток препаратом 5-азацитидином. Полагают, что это соединение ингибирует метилтрансферазу, что приводит к деметилированию той ДНК, которая обычно является метилированной (Razin et al., 1984). Когда 5-азацитидин добавляли к колониям мышиных фибробластов С3Н10Τ1/2, эти клетки с высокой частотой превращались в миоциты, адипоциты или хондроциты (Taylor, Jones, 1982; Konieczny, Emerson, 1984). Полученные фенотипы были стабильны, на основании чего можно предположить, что характер метилирования передается через многие циклы клеточных делений. Было показано, что ДНК из миобластов, полученных из обработанных 5-азацитидином клеток C3H10T1/2, способна превращать другие клетки C3H10T1/2 в миобласты, тогда как ДНК из необработанных клеток С3Н10Т1/2 не обладает этой способностью (Lassar et al., 1986).
Четвертая группа данных, свидетельствующих о регуляции транскрипции с помощью метилирования ДНК, получена в исследованиях инактивации Х-хромосомы у млекопитающих. В этом случае метилирование ДНК играет главную роль в поддержании неактивного состояния одной из двух Х-хромосом в каждой клетке. Предположение о существовании определенных различий в ДНК хромосом впервые возникло на основе данных, полученных в опытах по трансфекции гена гипоксантинфосфорибозилтрансферазы (ГФРТ), связанного с Х-хромосомой, в мышиные клетки фенотипа ГФРТ– (Liskay, Evans, 1980). Когда использовали клон клеток, в которых ген находился на неактивной Х-хромосоме, получен-