- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Введение
- •Преформация и эпигенез
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Французские тератологи
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Цитоплазматическая спецификация у зародышей оболочников
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •10________________ Глава 7______________________________________________________________________________
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •12________________ Глава 7______________________________________________________________________________
- •Природа морфогенетических детерминантов у оболочников
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •14________________ Глава 7______________________________________________________________________________
- •Цитоплазматическая локализация у зародышей моллюсков
- •Дополнительные сведения и гипотезы: Внутриклеточная локализация и движения морфогенетических детерминантов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •16________________ Глава 7______________________________________________________________________________
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Полярная лопасть
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Детерминация у нематодыCaenorhabditis elegans
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Цитоплазматическая локализация детерминантов половых клеток
- •Детерминация половых клеток у нематод
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Детерминация половых клеток у насекомых
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Детерминация половых клеток у амфибий
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Генетика цитоплазматических детерминантов у дрозофилы
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Август Вейсман: теория зародышевой плазмы
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Вильгельм Ру: мозаичное развитие
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Ганс Дриш: регуляционное развитие
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Свен Гёрстадиус: потенции и градиенты в ооците
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Ганс Шпеман: прогрессивная детерминация эмбриональных клеток
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Ганс Шпеман и Гильда Мангольд: первичная эмбриональная индукция
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Региональная специфичность индукции
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Механизмы первичной эмбриональной индукции
- •Индукция мезодермальной специфичности энтодермой
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Влияние индукции на активность генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Поиски индукторов мезодермы
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Нейральный индуктор как молекула, способная к диффузии
- •Компетенция и вторичная индукция
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •62________________ Глава 8______________________________________________________________________________
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Тождество геномов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •66________________ Глава 9______________________________________________________________________________
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Трансдетерминация
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •70________________ Глава 9______________________________________________________________________________
- •Метаплазия
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Клонирование у амфибий: ограничение потенций клеток
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Клонирование у амфибий: исключения из ограничения потенций
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Методы молекулярной биологии Гибридизация нуклеиновых кислот
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Клонирование генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Когда ген клонирован...
- •Секвенирование
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Перенос генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Сайт-специфичный мутагенез и трансляция разрыва
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дифференциальная экспрессия генов
- •Идентичность геномов
- •Стабильность генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Нарушение стабильности геномов: изменения в генах лимфоцитов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Изменения генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дифференциальный синтез рнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с. Глава 11. Регуляция экспрессии генов на уровне транскрипции: изменение транскрипции в ходе развития
- •Введение
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гетерохроматин
- •Отцовский гетерохроматин у мучнистого червеца
- •Инактивация X хромосомы у млекопитающих
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Определение времени инактивации х-хромосомы
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Амплифицированные гены Амплификация генов рибосомной рнк
- •Механизм амплификации рибосомных генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Визуализация транскрипции на амплифицированных генах
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Молекулярная основа быстрой транскрипции рибосомных генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Селективная транскрипция генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Хромосомные пуфы и хромосомы типа ламповых щеток
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Синтез овальбумина
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Транскрипция глобиновых генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Белок-регулятор транскрипции: контроль генов5s-рРнк Центральный промоторный элемент
- •Регуляция транскрипции факторомTfiiia
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Связывание и функцияTfiiia
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Контроль детерминации на уровне транскрипции: гены переключения путей дифференцировки дочерних клеток
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Детерминация клеток вульвы у Caenorhabditis elegans
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Эукариотические гены, кодирующие белки Экзоны и интроны
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Структура и функция промотора
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Связывание транс-регуляторных белков с промоторами
- •Структура и функция энхансеров
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Энхансеры, активность которых регулируется во времени
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Тканеспецифические энхансеры
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Энхансеры, реагирующие на гормоны
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Транскрипция генов легких цепей иммуноглобулинов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Модульные гены
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Метилирование днк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Определение сайтов метилирования
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Хроматин эукариот Нуклеосомы
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Активация репрессированного хроматина Доступность для транс-регупяторных факторов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Сайты, гиперчувствительные к днКазе
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гиперчувствительность к днКазе и характер метилирования
- •Регуляция активности генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Связь активной днк с ядерным матриксом Присоединение активного хроматина к ядерному матриксу
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Топоизомеразы и транскрипция генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Гетерогенная ядерная рнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Сложность ядерной и цитоплазматической рнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Контроль развития на уровне процессинга яРнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Механизмы специфического процессинга ядерных рнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Присутствие в ядре предшественников мРнк, не прошедших процессинг
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Образование альтернативных белков на одном гене: дифференциальный процессинг рнк в иммунной системе
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дифференциальный процессинг рнк: генерация новых белков в разных клетках в разное время
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Альтернативный процессинг рнк и детерминация пола
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Биохимия процессинга рнк
- •Сайты сплайсинга
- •Сайты разветвления
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Роль малых ядерных рибонуклеопротеидных частиц
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Транспорт из ядра
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Трансляционная регуляция развития
- •Механизм трансляции у эукариот
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Контроль на уровне трансляции при координированном синтезе белка: продукция гемоглобина
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Селективная деградация мРнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Трансляционный контроль ооцитных мРнк Данные, свидетельствующие о материнской регуляции раннего развития
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Запасенные мРнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Характеристика материнских мРнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Механизм трансляционного контроля ооцитных мРнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Материнские мРнк и дробление
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Активация генома зародыша
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гормональная стабилизация специфических мРнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Широкая распространенность контроля на уровне трансляции
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Посттрансляционная регуляция экспрессии генов
- •Посттрансляционная активация белков
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Инактивация белков при посттрансляционных модификациях
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Субклеточная компартментализация белков с помощью посттрансляционных модификаций: адресование белков в мембраны и лизосомы
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Адресование белков в ядра и митохондрии
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Надмолекулярная сборка
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Коллаген: конспект посттрансляционной регуляции
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Глава 8. Прогрессивная детерминация.
- •Глава 9. Тождество геномов и дифференциальная экспрессия генов: эмбриологические исследования. Перевод г. М. Игнатьевой.................................................... 65
- •Глава 10. Тождество геномов и дифференциальная экспрессия генов: молекулярные исследования. Перевод b.C.
- •Глава 11. Регуляция экспрессии генов на уровне транскрипции: изменение транскрипции в ходе развития. Перевод
- •Глава 12. Регуляция экспрессии генов на уровне транскрипции: механизмы дифференциальной транскрипции генов. Перевод b.C. Михайлова.............................. 137
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Глава 13. Контроль развития на уровне процессинга рнк. Перевод b.C. Михайлова i77
- •Глава 14. Трансляционная и посттрансляционная регуляция процессов развития. Перевод b.C. Михайлова .... 199
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Cкотт ф. Гилберт биология развития
- •129820. Гсп. Москва. 1-й Рижский пер., 2.
- •Глава 8. Прогрессивная детерминация 39
- •Глава 9. Тождество геномов и дифференциальная экспрессия генов: эмбриологические исследования 65
- •Глава 10. Тождество геномов и дифференциальная экспрессия генов: молекулярные исследования 80
- •Глава 11. Регуляция экспрессии генов на уровне транскрипции: изменение транскрипции в ходе развития 109
- •Глава 12. Регуляция экспрессии генов на уровне транскрипции: механизмы дифференциальной транскрипции генов 137
- •Глава 13. Контроль развития на уровне процессинга рнк 177
- •Глава 14. Трансляционная и посттрансляционная регуляция процессов развития 199
Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
228_______________ ГЛАВА 14______________________________________________________________________________
|
|
|
Рис. 14.33. Образование волокон гемоглобина при серповидноклеточной анемии. А. Электронная микрофотография волокон дезоксигенированного аномального гемоглобина, выходящих из эритроцита, разрушенного осмотическим шоком. Б. Модель формирования волокон, согласно которой мутантный ß-глобин способен присоединяться к ß-глобиновому пептиду другого гемоглобинового тетрамера. (А- из Wellems, Josephs, 1979; фотография с любезного разрешения авторов. Б. – по Dickerson, Geis, 1983.) |
относительно небольшому набору клеточных белков. Приобретение этой способности другими белками благодаря мутации может приводить к гибельным последствиям. Такое явление наблюдается при серповидноклеточной анемии. Замена одной аминокислоты (глутамина на валин в шестом положении ß-цепи глобина) вызывает образование гидрофобного кармана, который позволяет взаимодействовать гемоглобиновым тетрамерам в восстановленной форме. Такие волокна растягивают клетку, придавая ей характерную форму серпа, и уменьшают ее гибкость (рис. 14.33).
Некоторые белки образуют комплексы с нуклеиновыми кислотами. Например, гистоны нужны только для того, чтобы вместе с ДНК формировать нуклеосомные частицы. Эукариотическая 80S-рибосома состоит приблизительно из 70 белков и 4 различных рибосомных РНК. Эти белки и нуклеиновые кислоты для своего функционирования должны собираться вместе, и что примечательно, эта сборка происходит быстро и эффективно внутри всех клеток. После этого не должен вызывать удивление тот факт, что полноценные инфекционные вирусы могут быть получены при совместной инкубации структурных белков и нуклеиновых кислот. Белки, которые «маскируют» мРНК в ооцитах, также являются примерами белков, которые могут формировать специфические комплексы с нуклеиновыми кислотами. Белок TFIIIA, который комплексируется с 5S-pPHK в гене 5S-pPHK Xenopus, связывается также с 5S-pPHK в ооците и образует стабильную 7S-частицу (Pelham, Brown, 1980). Таким образом, спонтанная самосборка является еще одной важной формой посттрансляционного контроля.
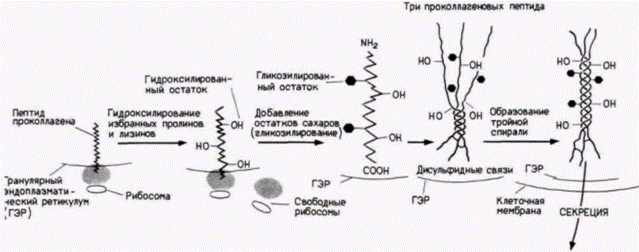
Коллаген: конспект посттрансляционной регуляции
При рассмотрении синтеза коллагена, одного из главнейших структурных белков тела, мы можем показать важность и разнообразие механизмов посттрансляционного контроля (см. обзоры Prockop et al., 1979; Davidson, Berg, 1981).
Во-первых, последовательность мРНК коллагена транслируется в пептид проколлагена. Аминоконец проколлагена содержит сигнальную последовательность, которая позволяет ему войти в полость гранулярного эндоплазматического ретикулума. Этот сигнальный пептид отщепляется от остальной части молекулы коллагена. Внутри эндоплазмати-
Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
ТРАНСЛЯЦИОННАЯ И ПОСТТРАНСЛЯЦИОННАЯ РЕГУЛЯЦИЯ РАЗВИТИЯ___________ 229
|
| |
|
Рис. 14.34. Модель посттрансляционных модификаций молекулы коллагена внутри гранулярного эндоплазматического ретикулума, а также после секреции. (По Alberts et al., 1983.) |
|
ческого ретикулума молекулы коллагена встречаются также с тремя ферментами, которые его гидроксилируют. Два из этих ферментов гидроксилируют остатки пролина в 3-гидроксипролин и 4-гидроксипролин; третий превращает лизины в оксилизиловые остатки. Эти ферменты узнают остатки пролина и лизина только в определенных положениях (рис. 14.34).
Когда цепи коллагена становятся гидроксилированными, к оксилизинам могут быть добавлены остатки сахаров. Первый фермент – галактозил-трансфераза – добавляет к оксилизину галактозу; второй фермент – глюкозилтрансфераза – добавляет к оксилизилгалактозе глюкозу. Участок около карбоксильного конца модифицируется глюкозамином и маннозой.
Следующий этап включает образование внутрицепочечных дисульфидных связей и организацию трех коллагеновых полипептидов в тройную спираль. Дисульфидные связи образуются на карбоксильных концах между прилежащими молекулами коллагена, создавая тем самым условия для формирования тройной спирали. Если пролины были гидроксилированы правильно, то три цепи скручиваются одна вокруг другой, образуя протяженный участок тройной спирали, ограниченный с обеих сторон глобулярными областями.
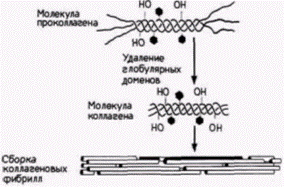
В таком виде молекула коллагена выделяется во внеклеточное пространство. Процессинг продолжается даже там. Сначала протеолитические ферменты удаляют глобулярные домены на аминоконце и карбоксильном конце. В результате этого отрезания образуется фрагмент совершенной тройной спирали. На следующем этапе эти фрагменты самопроизвольно собираются в фибриллы. Однако эти фибриллы не обладают достаточной механической прочностью, чтобы функционировать в качестве структурных белков до тех пор, пока различные тройные спирали не будут ковалентно связаны друг с другом с помощью дополнительных поперечных сшивок. Это связывание осуществляется путем ферментативной модификации лизилов в оксилизиловых остатках и присоединения их друг к другу· Таким образом, существует значительное число необходимых этапов модификации белка после трансляции (как мы увидим в следующих двух главах, коллаген не только исключительно важный структурный белок, но, как полагают, он ответствен