- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Введение
- •Преформация и эпигенез
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Французские тератологи
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Цитоплазматическая спецификация у зародышей оболочников
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •10________________ Глава 7______________________________________________________________________________
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •12________________ Глава 7______________________________________________________________________________
- •Природа морфогенетических детерминантов у оболочников
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •14________________ Глава 7______________________________________________________________________________
- •Цитоплазматическая локализация у зародышей моллюсков
- •Дополнительные сведения и гипотезы: Внутриклеточная локализация и движения морфогенетических детерминантов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •16________________ Глава 7______________________________________________________________________________
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Полярная лопасть
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Детерминация у нематодыCaenorhabditis elegans
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Цитоплазматическая локализация детерминантов половых клеток
- •Детерминация половых клеток у нематод
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Детерминация половых клеток у насекомых
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Детерминация половых клеток у амфибий
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Генетика цитоплазматических детерминантов у дрозофилы
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Август Вейсман: теория зародышевой плазмы
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Вильгельм Ру: мозаичное развитие
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Ганс Дриш: регуляционное развитие
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Свен Гёрстадиус: потенции и градиенты в ооците
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Ганс Шпеман: прогрессивная детерминация эмбриональных клеток
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Ганс Шпеман и Гильда Мангольд: первичная эмбриональная индукция
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Региональная специфичность индукции
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Механизмы первичной эмбриональной индукции
- •Индукция мезодермальной специфичности энтодермой
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Влияние индукции на активность генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Поиски индукторов мезодермы
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Нейральный индуктор как молекула, способная к диффузии
- •Компетенция и вторичная индукция
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •62________________ Глава 8______________________________________________________________________________
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Тождество геномов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •66________________ Глава 9______________________________________________________________________________
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Трансдетерминация
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •70________________ Глава 9______________________________________________________________________________
- •Метаплазия
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Клонирование у амфибий: ограничение потенций клеток
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Клонирование у амфибий: исключения из ограничения потенций
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Методы молекулярной биологии Гибридизация нуклеиновых кислот
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Клонирование генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Когда ген клонирован...
- •Секвенирование
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Перенос генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Сайт-специфичный мутагенез и трансляция разрыва
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дифференциальная экспрессия генов
- •Идентичность геномов
- •Стабильность генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Нарушение стабильности геномов: изменения в генах лимфоцитов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Изменения генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дифференциальный синтез рнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с. Глава 11. Регуляция экспрессии генов на уровне транскрипции: изменение транскрипции в ходе развития
- •Введение
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гетерохроматин
- •Отцовский гетерохроматин у мучнистого червеца
- •Инактивация X хромосомы у млекопитающих
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Определение времени инактивации х-хромосомы
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Амплифицированные гены Амплификация генов рибосомной рнк
- •Механизм амплификации рибосомных генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Визуализация транскрипции на амплифицированных генах
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Молекулярная основа быстрой транскрипции рибосомных генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Селективная транскрипция генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Хромосомные пуфы и хромосомы типа ламповых щеток
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Синтез овальбумина
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Транскрипция глобиновых генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Белок-регулятор транскрипции: контроль генов5s-рРнк Центральный промоторный элемент
- •Регуляция транскрипции факторомTfiiia
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Связывание и функцияTfiiia
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Контроль детерминации на уровне транскрипции: гены переключения путей дифференцировки дочерних клеток
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Детерминация клеток вульвы у Caenorhabditis elegans
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Эукариотические гены, кодирующие белки Экзоны и интроны
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Структура и функция промотора
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Связывание транс-регуляторных белков с промоторами
- •Структура и функция энхансеров
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Энхансеры, активность которых регулируется во времени
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Тканеспецифические энхансеры
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Энхансеры, реагирующие на гормоны
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Транскрипция генов легких цепей иммуноглобулинов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Модульные гены
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Метилирование днк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Определение сайтов метилирования
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Хроматин эукариот Нуклеосомы
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Активация репрессированного хроматина Доступность для транс-регупяторных факторов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Сайты, гиперчувствительные к днКазе
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гиперчувствительность к днКазе и характер метилирования
- •Регуляция активности генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Связь активной днк с ядерным матриксом Присоединение активного хроматина к ядерному матриксу
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Топоизомеразы и транскрипция генов
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Гетерогенная ядерная рнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Сложность ядерной и цитоплазматической рнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Контроль развития на уровне процессинга яРнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Механизмы специфического процессинга ядерных рнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Присутствие в ядре предшественников мРнк, не прошедших процессинг
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Образование альтернативных белков на одном гене: дифференциальный процессинг рнк в иммунной системе
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дифференциальный процессинг рнк: генерация новых белков в разных клетках в разное время
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Альтернативный процессинг рнк и детерминация пола
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Биохимия процессинга рнк
- •Сайты сплайсинга
- •Сайты разветвления
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Роль малых ядерных рибонуклеопротеидных частиц
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Транспорт из ядра
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Трансляционная регуляция развития
- •Механизм трансляции у эукариот
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Контроль на уровне трансляции при координированном синтезе белка: продукция гемоглобина
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Селективная деградация мРнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Трансляционный контроль ооцитных мРнк Данные, свидетельствующие о материнской регуляции раннего развития
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Запасенные мРнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Характеристика материнских мРнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Механизм трансляционного контроля ооцитных мРнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Материнские мРнк и дробление
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Дополнительные сведения и гипотезы: Активация генома зародыша
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гормональная стабилизация специфических мРнк
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Широкая распространенность контроля на уровне трансляции
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Посттрансляционная регуляция экспрессии генов
- •Посттрансляционная активация белков
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Инактивация белков при посттрансляционных модификациях
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Субклеточная компартментализация белков с помощью посттрансляционных модификаций: адресование белков в мембраны и лизосомы
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Адресование белков в ядра и митохондрии
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Надмолекулярная сборка
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Коллаген: конспект посттрансляционной регуляции
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Литература
- •Глава 8. Прогрессивная детерминация.
- •Глава 9. Тождество геномов и дифференциальная экспрессия генов: эмбриологические исследования. Перевод г. М. Игнатьевой.................................................... 65
- •Глава 10. Тождество геномов и дифференциальная экспрессия генов: молекулярные исследования. Перевод b.C.
- •Глава 11. Регуляция экспрессии генов на уровне транскрипции: изменение транскрипции в ходе развития. Перевод
- •Глава 12. Регуляция экспрессии генов на уровне транскрипции: механизмы дифференциальной транскрипции генов. Перевод b.C. Михайлова.............................. 137
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Глава 13. Контроль развития на уровне процессинга рнк. Перевод b.C. Михайлова i77
- •Глава 14. Трансляционная и посттрансляционная регуляция процессов развития. Перевод b.C. Михайлова .... 199
- •Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
- •Cкотт ф. Гилберт биология развития
- •129820. Гсп. Москва. 1-й Рижский пер., 2.
- •Глава 8. Прогрессивная детерминация 39
- •Глава 9. Тождество геномов и дифференциальная экспрессия генов: эмбриологические исследования 65
- •Глава 10. Тождество геномов и дифференциальная экспрессия генов: молекулярные исследования 80
- •Глава 11. Регуляция экспрессии генов на уровне транскрипции: изменение транскрипции в ходе развития 109
- •Глава 12. Регуляция экспрессии генов на уровне транскрипции: механизмы дифференциальной транскрипции генов 137
- •Глава 13. Контроль развития на уровне процессинга рнк 177
- •Глава 14. Трансляционная и посттрансляционная регуляция процессов развития 199
Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
226_____________ ГЛАВА 14___________________________________________________________________________
|
|
|
|
|
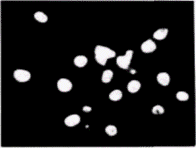
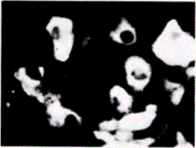
Рис. 14.30. Идентификация аминокислотной последовательности, которая направляет белок в ядро. 25 аминокислотных остатков, фланкирующих лизин-128 в Т-антигене вируса SV40(А), адресуют в ядро пируваткиназу. Выделенный на рисунке участок показывает ближайшие аминокислотные остатки. Б–И. Вариации в выделенной последовательности позволяют идентифицировать остатки, необходимые для накопления белка в ядрах. Фотографии показывают внутриклеточную локализацию для случаев З и И. (Из Kalderon et al., 1984.) |
последовательность, состоящая из периодически расположенных основных аминокислот (конкретные длины и состав аминокислотных последовательностей у митохондриальных белков варьируют). Если эта последовательность находится в белке, то он не только направляется в митохондрии, но будет транслоцирован через обе мембраны в митохондриальный матрикс. Если между зрелым белком и адресующей в матрикс последовательностью лежит гидрофобный участок, то предполагается, что он блокирует перенос белка в матрикс. Это приведет к тому, что данный белок станет частью внутренней мембраны. Если зрелый белок легко отщепляется от этого гидрофобного участка, то он будет обнаруживаться в межмембранном пространстве (van Loon, Schatz, 1987).
Надмолекулярная сборка
Последняя форма посттрансляционной регуляции, которую мы рассмотрим, связана со сборкой новосинтезированных белков в функциональный комплекс. Мы уже рассмотрели ряд белков, которые могут спонтанно собираться в функциональные комплексы. Например, гемоглобин и лактатдегидрогеназа состоят из четырех полипептидных цепей, которые образуют с помощью нековалентных связей функциональный белок. Пример на несколько более высоком уровне – два сократительных белка, тубулин и актин, существуют в полимерных и неполимерных формах. Мы видели, что полимеризация актина из глобулярных мономеров в микрофила-
Гилберт с. Биология развития: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1994. – 235 с.
____________ ТРАНСЛЯЦИОННАЯ И ПОСТТРАНСЛЯЦИОННАЯ РЕГУЛЯЦИЯ РАЗВИТИЯ______________ 227
|
|
|
|
Рис. 14.31. Модель адресования белков в специфические области внутри митохондрии. Все митохондриальные белки, кодируемые ядерными генами, содержат сигнальную последовательность, направляющую в матрикс (изображена прямоугольником с положительными зарядами). Если транспорт белка следует прервать до достижения матрикса, то второй (гидрофобный) сигнал (изображен в виде черного квадрата) позволяет белку задержаться в мембране. Останется ли он в мембране или войдет в межмембранное пространство, зависит от того, будет ли белок отщеплен от этой сигнальной последовательности. Предполагается, что вход предшественников происходит в участках, где две мембраны сближаются друг с другом (Schleyer, Neupert, 1985). Модель составлена по работам Hurt, van Loon (1986), van Loon, Schatz (1987). |
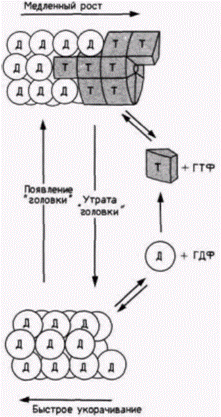
Рис. 14.32. Модель роста и деполимеризации микротрубочек. К растущим микротрубочкам добавляются ГТФ-содержащие субъединицы тубулина (обозначены буквой Т), которые плотно ассоциируют с другими субъединицами тубулина. По мере старения субъединиц связанный с тубулином ГТФ гидролизуется до ГДФ. Тубулин, содержащий ГДФ (обозначен буквой Д), относительно быстро отделяется от микротрубочек. Если гидролиз превосходит сборку, то «головка» из ГТФ-тубулина исчезает и микротрубочка быстро укорачивается. (По Kirschner, Mitchison, 1986.) |
менты необходима для развития акросомного процесса при оплодотворении. Сходным образом тубулин собирается в микротрубочки митотического аппарата и распадается на мономеры при завершении митоза. Затем эти тубулиновые единицы могут быть реорганизованы в новые микротрубочки, которые важны для детерминации формы клеток.
Рост микротрубочки регулируется гидролизом молекул ГТФ, которые ковалентно связаны с тубулином. Новополимеризованный тубулин присоединяется к ГТФ и образует стабильные комплексы с другими молекулами тубулина. При старении тубулинов (или при реорганизации клетки) ГТФ гидролизуется с образованием ГДФ. Тубулин, связанный с ГДФ, не образует комплекс с соседними молекулами тубулина. Полагают, что эта пониженная стабильность вызывает деполимеризацию микротрубочки (рис. 14.32). Как мы увидим в следующей главе, дифференциальный рост микротрубочек может оказывать определяющее влияние на клеточный и эмбриональный морфогенез.
Способность формировать волокна свойственна