
- •Глава 32. Патология внешнего дыхания
- •32.1. Распространенность, этиология, классификация заболеваний органов дыхания
- •32.2. Этиология заболеваний системы внешнего дыхания
- •Классификация заболеваний системы внешенего дыхания
- •32.3. Нарушения вентиляции легких
- •32.3.1. Обструктивные нарушения вентиляции легких
- •Наиболее характерные изменения функциональных показателей легких при обструктивных и рестриктивных процессах
- •32.4. Расстройства регуляции вентиляции легких
- •32.5. Нарушения перфузионной способности легких (патология легочного кровотока)
- •32.6. Нарушения вентиляционно-перфузионных отношений
- •32.7. Нарушения диффузии газов через альвеолярно-капиллярные мембраны
- •32.8. Дыхательная недостаточность. Понятие. Классификация. Характеристика
- •32.9. Нарушения негазообменных функций легких
- •32.10. Принципы профилактики заболеваний системы внешнего дыхания
- •32.11. Принципы лечения заболеваний системы внешнего дыхания
- •Глава 33. Патология системы пищеварения
- •33.1. Особенности патологии системы пищеварения
- •33.2. Этиология
- •33.5.Типовые нарушения функций системы пищеварения. Их характеристика
- •Характеристика хронических гастритов (п.Я. Григорьев, а.В. Яковенко, 2003)
- •Защитные факторы
- •Агрессивные факторы
- •Глава 34. Патология печени
- •34.2. Особенности патологии печени
- •34.4. Классификация основных видов патологии печени
- •34.5. Краткая характеристика основных клинико-
- •34.6. Печеночная недостаточность
- •34.6.1. Характеристика основных проявлений печёночной недостаточности
- •34.7. Основные синдромы при патологии печени
- •34.7.1. Печеночная кома
- •34.7.2. Портальная гипертензия
- •34.7.3. Гепатолиенальный синдром
- •34.7.4. Желтухи
- •1 Звенья патогенеза.
- •34.8. Основные заболевания печени
- •34.9. Принципы профилактики и терапии
- •Глава 35. Патология почек
- •35.1. Особенности патологии почек
- •35.2. Роль нефропатий в патологии организма
- •35.3. Этиология нефропатий
- •35.4. Основные механизмы нарушений экскреторной
- •35.5. Почечные синдромы
- •35.5.2. Изменения ритма мочеиспускания
- •35.5.3. Изменения качественного состава мочи
- •35.5.4. Изменения удельной плотности мочи
- •35.6. Внепочечные синдромы
- •35.7. Классификация основных болезней почек
- •35.8.Типовые формы патологии почек
- •35.8.1. Гломерулонефриты
- •35. 8. 2. Пиелонефрит
- •Острый пиелонефрит
- •35.8.3 Нефроз. Нефротический синдром
- •35.8.4. Почечная недостаточность
- •35.9. Краткая характеристика других синдромов и заболеваний почек и мочевыделительных путей
- •35.10. Принципы профилактики болезней почек
- •35.11. Принципы лечения болезней почек
- •Часть II. Частная патология
- •Раздел 4. Патология регуляторных систем
- •Глава 36. Патология иммунной системы
- •36.1. Введение. Краткие сведения об иммунитете
- •36.2. Иммунопатология
- •36.2.1.2. Характеристика основных видов первичных иммунодефицитных состояний
- •Тяжелый комбинированный т- и в-иммуннодефицит
- •Стволовая клетка
- •Стволовая клетка Общий лимфоидный предшественник
- •36.2.1.3. Принципы профилактики первичных иммуннодефицитов
- •36.2.1.4. Принципы терапии первичных иммуннодефицитов
- •36.2.1.2. Вторичные (приобретенные) иммунодефициты
- •Синдром приобретенного иммунодефицита
- •Этиология спиДа
- •Патогенез спиДа
- •Принципы лечения вич-инфекции (спиДа)
- •36.2.2. Аллергия
- •Псевдоаллергические реакции
- •Проявления аллергических реакций и заболеваний
- •36.2.2.1. Этиология аллергических реакций и заболеваний
- •Этиологические факторы, приводящие к развитию аллергии
- •Роль аллергии в патологии человека
- •36.2.2.2. Классификация аллергических реакций
- •Классификация иммунопатологических реакций в зависимости от типа иммунного повреждения тканей и органов
- •36.2.2.3. Общий патогенез аллергических реакций
- •Аллергические реакции I типа (реагиновый, афилактический тип аллергии)
- •IgE-связывающие факторы
- •Первичные клетки-мишени (тучная клетка, базофил)
- •Медиаторы аллергических реакций I типа
- •Аллергические реакции II типа (цитотоксический тип аллергии)
- •Медиаторы аллергических реакций II типа
- •Аллергические реакции III типа (реакции иммунных комплексов)
- •Аллергические реакции IV типа (опосредованные т-лимфоцитами)
- •Медиаторы аллергических реакций, опосредованных т-клетками
- •36.2.2.6. Аутоиммунные заболевания
- •Классификация аутоиммунных заболеваний
- •Патологическая иммунная толерантность
- •36.2.3. Болезни, связанные с нарушением пролиферации иммунокомпетентных клеток
- •Болезни, обусловленные нарушением пролиферации
- •Болезни, обусловленные нарушением пролиферации плазматических клеток
- •Глава 37. Патология эндокринной системы
- •37.1. Введение
- •37.2. Классификация эндокринопатий
- •37.3. Этиология эндокринопатий
- •37.4. Патогенез эндокринопатий
- •37.4.1. Расстройства центрального отдела эндокринноЙ системы
- •Нарушения парагипофизарного пути регуляции эндокринных желез
- •37. 4. 2. Расстройства железистого отдела эндокринной системы
- •37. 4. 3. РасстроЙства внежелезистого отдела эндокринной системы
- •37.4.4. Основные клинические проявления эндокринных болезней
- •37.4.5. Роль эндокринных расстройств в патологии
- •37.4.6. Патология гипоталамо-гипофизарной системы
- •Гипофункция гипоталамо-аденогипофизарной системы
- •Тотальная гипофункция гипоталамо-гипофизарной системы
- •Гиперфункция гипоталамо-аденогипофизарной системы
- •Гиперфункция гипоталамо - нейрогипофизарной системы
- •Гиперфункция системы гипоталамус-средняя доля гипофиза
- •37.4.7. Патология надпочечников
- •Патология коркового вещества надпочечников Гиперфункция клубочковой зоны коры надпочечников
- •Гиперфункция пучковой зоны коры надпочечников
- •Гиперфункция сетчатой зоны коры надпочечников
- •Гиперфункция розничных зон коры надпочечников
- •Гипофункция коры надпочечников
- •Острая надпочечниковая недостаточность
- •Хроническая надпочечниковая недостаточность
- •Патология мозгового вещества надпочечников
- •Патогенез надпочечниковой недостаточности
- •37.4.8. Патология щитовидной железы
- •Гипофункция щитовидной железы
- •Нарушения секреции тиреокальцитонина
- •Тиреоидиты
- •37.4.10. Патология половых желез
- •37.5. Принципы терапии эндокринных расстройств
- •Глава 38. Патология нервной системы
- •38.2. Этиология
- •38.4. Стадийность патологического процесса
- •38.5. Следовые реакции в патологии нервной системы
- •Исходы патологических процессов в нервной Системе
- •38.6. Типовые патологические процессы в нервной системе
- •38.10. Принципы терапии нервных расстройств
- •Глава 39. Основные нарушения естественного сна
- •39.1. Введение
- •39.2. Инсомнии
- •Характеристика основных типов диссомний
- •Характеристика основных видов диссомний
- •39.3. Гиперсомнии
- •39.4. Парасомнии
- •39.5. Расстройства сна, связанные
- •39.6. Расстройства сна, вызванные приемом психоактивных веществ
- •39.7. Расстройства сна, вызванные соматическими заболеваниями
- •39.8. Основные принципы лечения нарушений сна
- •Глава 40. Основы боли и обезболивания
- •40.1. Введение
- •40. 2. Биологическое значение боли
- •40.3. Защитно-приспособительные реакции организма
- •40.4. Этиология боли
- •40.5. Классификация боли
- •40.6. Краткая характеристика основных видов боли
- •40.7. Болевые синдромы. Виды. Патогенез
- •40.7.1. Краткая характеристика основных болевых синдромов
- •40.8. Основные теории возникновения боли
- •40.9. Структурно-функциональная организация
- •Рецепторный аппарат ноцицептивной системы
- •Проводниковый аппарат ноцицептивной системы
- •40.10. Структурно-функциональная организация
- •40.11. Основные пути, методы и средства обезболивания
- •Глава 41. Стресс и его роль в адаптации и дезадаптации организма
- •41.1. Введение
- •41.2. Классификация адаптаций
- •41.3. Стрессоры и стресс. Понятия. Виды
- •Характеристика проявлений и стадий стресса
- •Развитие специфической адаптации
- •41.4. Структурно-функциональная организация
- •41.4.1. Механизмы формирования стресс-реакции
- •41.5. Структурно – функциональная организация
- •41.6. Принципы профилактики и лечения дистресса
32.3.1. Обструктивные нарушения вентиляции легких
Как известно, обструктивные легочные расстройства очень распространены. В настоящее время известно около 100 заболеваний, сопровождающихся бронхообструктивным синдромом. Последний является основным выражением бронхиальной астмы, обструктивной эмфиземы легких, хронического бронхита, бронхоэктатической болезни, экспираторного стеноза, стенотического ларинготрахеита, муковисцедоза и др. заболеваний.
Причинами обструктивных нарушений вентиляции являются:
Обтурация дыхательных путей либо рвотными массами и инородными телами, либо сдавлением трахеи, главного, крупных, средних и мелких бронхов увеличенными лимфатическими узлами, загрудинным зобом, опухолью средостения, либо утолщением, либо спазмом стенок возхдухоносных структур.
Инфекции (туберкулез легких, сифилис, грибковые поражения, хронический бронхит, пневмония).
Аллергические поражения дыхательных путей (анафилактический шок, анафилаксия, бронхиальная астма).
Отравления медикаментами (передозировка холинотропными препаратами, вагостимуляторами, бета- адреноблокаторами и др.).
Обструктивные нарушения вентиляции легких – уменьшение просвета (проходимости) либо верхних дыхательных путей (носовых ходов, носоглотки, входа в гортань, голосовой щели, трахеи, крупных и средних бронхов), либо нижних дыхательных путей (мелкие бронхи, воздухоносные бронхиолы (воспаление, отек, обтурация, спазм).
Обструктивные нарушения вентиляции легких - это такая форма патологии системы внешнего дыхания, при которой увеличено сопротивление току воздуха в дыхательных путях при их закупорке, сужении, спазме или сдавлении извне. Обструктивные нарушения воздухоносных путей могут быть эндо- и экзобронхиального генеза.
Биофизической основой обструктивных расстройств является увеличение неэластического дыхательного сопротивления. Это обусловлено:
аэродинамическим (вязкостным) сопротивлением, возникающим из-за перемещения молекул газа и трения о стенки дыхательных путей;
фрикционным (деформационным) сопротивлением, появлящимся в связи с действием сил трения во время дыхания (при патологических изменениях дыхательных путей и легочной паренхимы фрикционное сопротивление возрастает в несколько раз);
• инерционным сопротивлением, зависящим от массы тела и особенностей строения грудной клетки (существует как в покое, при дыхательной паузе, так и при дыхании, при вдохе и выдохе).
Общее неэластическое сопротивление зависит от ДО. У здоровых лиц оно составляет 1,3-3,5 см вод. ст./л/мин. При спокойном вдохе сила дыхательных мышц необходима для преодоления сопротивления эластической тяги легких. При форсированном дыхании резко возрастают силы, направленные на преодоление неэластического сопротивления и расходуемые на преодоление сопротивления току воздуха в трахее и бронхах. Величину неэластического сопротивления определяет состояние воздухоносных путей и скорость потока воздуха. При обструктивных нарушениях сопротивление току воздуха при вдохе и выдохе возрастает. Возможно пролабированние мембранной части трахеи, крупных и средних бронхов и частичная или полная обтурация их просвета. Утрата легкими эластических свойств приводит к спадению мелких бронхов и, особенно, бронхиол и, соответственно, увеличению бронхиального сопротивления на выдохе.
При тахипноэ (частом поверхностном дыхании) скорость воздушного потока при выдохе увеличивается, происходит его завихрение, увеличивается турбулентный компонент сопротивления, для преодоления которого требуется дополнительное усилие дыхательных мышц. Адекватной альвеолярной вентиляции при этом не происходит, а объемно-временные параметры изменяются.
При повышении сопротивления дыхательных путей увеличивается работа дыхательных мышц, повышаются энергетические затраты и кислородная задолженность дыхательной мускулатуры. Следовательно, компенсаторно-приспособительные возможности аппарата внешнего дыхания ограничиваются. Это ограничение связано и с феноменом так называемой динамической компрессии воздухоносных путей (экспираторного коллапса) и, таким образом, обусловлено не столько неспособностью дыхательных мышц увеличивать усилие, сколько механическими свойствами системы легкие - воздухоносные пути.
Механизм экспираторного коллапса воздухоносных путей состоит в следующем. Бронхиолы, имеющие просвет 1-5 мм, как известно, лишены хрящевых колец и потому могут полностью спадаться, что ведет к окклюзии их просвета. Такое спадение (коллапс) происходит в том случае, если давление снаружи бронхиол (внутригрудное) оказывается больше, нежели изнутри. Это, чаще, может происходить при активном, форсированном выдохе. С одной стороны, сокращение экспираторных мышц ведет к резкому повышению внутригрудного давления, а с другой - рост скорости экспираторного потока воздуха в бронхиолах (здесь усилие, создаваемое экспираторными мышцами суммируется с эластической тягой легких) по закону Бернулли сопровождается падением бокового давления, оказываемого потоком на внутреннюю поверхность бронхиальной стенки. Место, где обе силы (наружное и внутреннее давление на стенку бронхиолы) уравновешиваются, называют точкой равного давления. В этом месте просвет бронхиолы еще сохраняется открытым ввиду жестких и упругих свойств ее стенки, которые обусловливают сопротивление деформации последней. Однако несколько «ниже по течению» экспираторного потока, где преобладание внутригрудного давления над внутрибронхиолярным оказывается достаточным, наступает спадение бронхиолы (рис. 32-2).
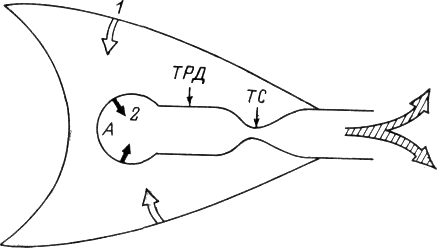
Рис. 32-2. Схема динамической компрессии нижних воздухоносных путей при форсированном выдохе.
Обозначения: А — альвеола; ТРД — точка равного давления; ТС- точка спадения бронхиолы. 1 — давление, создаваемое экспираторными мышцами; 2- эластическая тяга легких
Большое значение в патогенезе обструктивных нарушений имеет гиперреактивность бронхов - выраженная бронхоконстрикция, возникающая в ответ на раздражение. Вещества, обладающие раздражающим действием, проникают в интерстиций, активируют нервные рецепторы, в первую очередь n. vagus, и вызывают бронхоспазм, который устраняется фармакологической блокадой активности м-холинорецепторов. Основой бронхоконстрикции является как специфическая (аллергическая), так и неспецифическая (неаллергическая) гиперреактивность бронхиального дерева.
В стенках воздухоносных путей и тканях легких образуются бронхо- и вазоактивные вещества. Эпителий бронхиального дерева секретирует фактор, обладающий свойствами бронхорелаксации. При бронхоспазме этот фактор в большей степени влияет на тонус гладкой мускулатуры крупных бронхов. Секреция его снижена при повреждении эпителиальных клеток, например, при бронхиальной астме, что способствует стойкой обструкции бронхов.
В эндотелии легочных сосудов и эпителии бронхов синтезируется пептид эндотелин-I, проявляющий выраженное не только бронхо-, но и вазоконстрикторное действие. Продукция эндотелина-I увеличивается при гипоксии, сердечной недостаточности, бактериемии, хирургических вмешательствах.
Эйкозаноиды, образующиеся при распаде арахидоновой кислоты, оказывают как релаксирующее (простагландины Е), так и констрикторное (лейкотриены, РGF2α, тромбоксан A2) действие на гладкую мускулатуру. Однако суммарный их эффект проявляется в бронхоконстрикции. Кроме того, одни эйкозаноиды (тромбоксан А2) стимулируют агрегацию тромбоцитов, другие (РGI2) не только угнетают агрегацию тромбоцитов, но и повышают проницаемость сосудистой стенки, вызывают ее дилатацию, усиливают секрецию слизистой, активируют хемотаксис, регулируют высвобождение медиаторов тучной клеткой и т.д.
Под влиянием метаболитов арахидоновой кислоты возникает дисбаланс адренорецепторов с преобладанием активности α -адренорецепции над -адренорецепцией. В гладкомышечных клетках бронхов снижается содержание цАМФ, замедляется удаление ионов Са2+ из клеточной цитоплазмы. Ионы Са2+ активируют фосфолипазу А2, определяющую метаболизм арахидоновой кислоты. Формируется "порочный круг", поддерживающий бронхоконстрикцию.
Патофизиологические последствия обструкции
воздухоносных путей
Обструкция воздухоносных путей, как правило, приводит к:
Увеличению сопротивления воздушному потоку, особенно на выдохе, вызывает задержку воздуха в легких и рост функциональной остаточной емкости, перерастяжение и вздутие легких. Перерастяжение грудной клетки сопровождается увеличением работы дыхания.
Снижению эффективности дыхательных мышц. Требуется большая степень изменения внутригрудного давления, чтобы изменить объем легких. Дыхание обеспечивается с использованием даже менее эффективных дыхательных мышц.
Увеличению потребления кислорода и продукции углекислоты. Это ведет к гипоксемии, снижению рН, развитию дыхательного и метаболического ацидоза.
Развитию рассогласования между вентиляцией и перфузией. Это приводит к падению артериальной оксигенации. Плохо перфузируемые зоны дополнительно усиливают нарушение выведения СО2.
Развитию дыхательной недостаточности.
Преимущественно по обструктивному типу развиваются:
бронхиальная астма,
хроническая обструктивная болезнь легких (ХОБЛ), основу которой составляет хронический бронхит или эмфизема, либо их сочетание,
бронхоэктатическая болезнь.
Бронхиальная астма (БА) – хроническое тяжелое заболевание легких человека. Представляет наиболее распространенное аллергическое заболевание. Им болеет от 0,3 до 1 % населения.
Причинами БА могут быть: а) внутренние (генетически детерминированные дефекты в виде гиперчувствительности слизистой бронхов); б) внешние (курение, пыль, токсические газы, пыльца растений и др.).
Бронхиальной астме (БА) предшествует состояние предастмы, характеризующееся наличием следующих признаков:
Острые или хронические заболевания легких с обструкцией бронхов. (астматический и обструктивный бронхит, острая пневмония с обструкцией, острые респиратоные заболевания с обструкцией).
Внелегочные проявления измененной реактивности.
Эозинофилия крови и /или мокроты.
Наследственная предрасположенность.
Если эти признаки выявляются, то в течение трех лет возникает клинически выраженная БА у 70 % пациентов. Чем меньше этих признаков, тем меньше вероятность развития данного заболевания.
На БА приходится 67-72 % бронхообструктивных состояний. БА характеризуется резко выраженным изменением внешнего дыхания, (обусловленного бронхиальной обструкцией и нарушением газообмена между внешней средой и организмом).
Обязательным признаком БА является приступ удушья в течение нескольких часов.
Расстройство дыхания при БА чаще имеет экспираторный характер и сопровождается ощущением сжатия грудной клетки. Грудная клетка находится в положении максимального вдоха (расширяется).
В дыхании принимают участие не только мышцы грудной клетки, но и мышцы шеи, плечевого пояса, спины, брюшной стенки.
БА вызывается различными этиологическими факторами, центральное положение среди которых занимают аллергены, главным образом, инфекционного и пыльцевого происхождения, а также холодный воздух, пыль, физическая нагрузка, эмоции, либераторы (гистамин и др.) и т.д.
Патогенез приступа БА определяется следующими изменениями.
1. В последнее время большое значение в формировании обструктивного синдрома придается роли гиперреактивности бронхов (рис. 32-3).
2. Другим важным патогенетическим фактором БА являются изменения в иммунокомпетентной системе, что нашло отражение в современной классификации БА (инфекционно-аллергическая и неинфекционно-аллергическая или атопическая).
При иммунозависимой форме БА попавшие в сенсибилизированный организм аллергены взаимодействуют с реагинами (IgE), фиксированными на тучных клетках, эндотелиоцитах, гладко-мышечных клетках и др. Реагины реализуют свое действие через активацию: G- протеинов (снижающих чувствительность -адренорецепторов к адреналину и норадреналину), тучных клеток, эозинофилов, моноцитов, лимфоцитов и гистиофагов, продуцирующих различные ФАВ.
У 2 % всех астматиков развивается аутоиммунный вариант БА, являющейся самым тяжелым вариантом развития данного заболевания. В развитии БА важное значение имеют различные виды иммунодефицитов.
-

 Сенсибилизация
СенсибилизацияВрожденные дефекты мембран и рецепторного аппарата клеток-мишеней
Длительные инфекции дыхательных путей




Повышение раздражительности (реактивности) бронхов
Воздействие аллергена
Обострение инфекции дыхательных путей
Действие физико-химических раздражителей
Психо-эмоциональное возбуждение
Приступ бронхиальной астмы
Рис.32-3.Патогенез приступа бронхиальной астмы.
3. Сильное сокращающее или расслабляющее действие на тонус гладких мышц бронхов оказывает неадренергическая и нехолинергическая система с участием субстанции Р, вазоактивного интестинального пептида –ВИП). Так, бронхоспазм может быть обусловлен усилением бронхосуживающих стимулов (повышением холинергической, -адренергической активности или субстанции Р) или понижением -адренергической активности или ВИП-высвобождения.
4. В основе БА может лежать лекарственный механизм, в частности аспириновый. Аспириновая астма характеризуется: непереносимостью аспирина, бронхоспазмом и поллинозом. В механизме бронхоконстрикторного действия ацетилсалициловой кислоты лежит его способность изменять метаболизм арахидоновой кислоты. При активизации липооксигеназного пути ее метаболизма повышается выработка лейкотриенов (в том числе медленно реагирующей субстанции), обладающих бронхоспастическим действием.
5. Дисгормональные нарушения, приводящие к развитию БА.
5.1. БА, обусловленная глюкокортикоидной недостаточностью. Формируется чаще при абсолютной глюкокортикоидной недостаточности (если кортизола в крови на 25-30 % меньше нормы), в этом случае необходима заместительная терапия глюкокортикоидами. Относительная глюкокортикоидная недостаточность проявляется симптомами гипокортицизма, при этом уровень кортизола обычно соответствует нормальным значениям . В этом случае необходимо проверить тканевую чувствительность к глюкокортикоидам. При наличии тканевой глюкокортикоидной резистентности тканей развивается очень упорный в клиническом течении вариант БА, при котором приходится давать гипердозы глюкокортикоидных препаратов.
5.2. Дизовариальная БА характеризуется обострением, возникающим за 2 - 3 дня до начала менструации. Это обусловлено дефектом выработки бронходилатирующего прогестерона и избытком эстрогенов. Проявляется повышением ректальной температуры более, чем на 10 С.
5.3. БА с выраженным адренергическим дисбалансом характеризуется повышением активности α-адренорецепторов. При этом даже нормальный уровень адреналина может вызвать патологическую бронхоспастическую реакцию. Часто такая реакция возникает при передозировке адреномиметиками (когда в течение дня проводится более 5 их ингаляций по 2 вдоха).
5.4 Холинергический вариант БА связан с конституциональными особенностями или заболеваниями внутренних органов, при которых наблюдается выраженная ваготония. Данный вариант наблюдается у 1 % больных БА, у которых выделяется много мокроты (1/2 - 1 стакан в сутки). В анамнезе обычно отмечается язвенная болезнь, брадикардия, гипотония, мокрые (потные) ладони. Купировать приступ БА можно при помощи атропина.
6. Нервные механизмы возникновения БА.
6.1 Условно-рефлекторный механизм может быть ведущим у ряда больных (классический пример - искусственная бумажная роза своим видом провоцирует приступ БА). Может быть и условно-рефлекторное прекращение приступа БА. Отмечено, что непереносимость запахов у больных БА на 70 % носит не аллергический, а условно- рефлекторный характер. Таких больных удается лечить внушением.
6.2. Доминантный механизм сводится к тому, что мелкие раздражения могут приводить к суммации возбуждения и возникновению приступов БА. Возникновение другой, более сильной доминанты может на некоторое время подавлять доминанту БА. Отмечено также, что при повышении температуры тела свыше 380С, приступы БА не возникают.
6.3. Вагусный механизм проявляется, как правило, тем, что приступы БА возникают во второй половине ночи. Это связано с дефецитом медиаторов неадренергической системы, в частности ВИП (обладающего мощным бронходилатирующим действием).
6.4. Механизм, обусловленный неадекватной адаптацией организма к микросоциальной среде, также может лежат в основе развития БА. По такому механизму БА возникает у 10-20 % пациентов (чаще у детей, реже – у взрослых).
7. Обструктивные изменения бронхов при БА можно объяснить также влиянием провоспалительных медиаторов (тканевых гормонов), которые усиленно освобождаются из тучных клеток в стенках дыхательных путей. Особое место среди них занимает гистамин, обусловливающий спазм гладкой мускулатуры, развитие артериальной гиперемии, повышение проницаемости стенок капилляров, увеличение секреции слизи. В последние годы в патогенезе БА большое значение придается повышению продукции простагландина PGF2α и понижению продукции PGE2.
В значительной мере обструкции воздухоносных путей способствуют отек их слизистой оболочки и ее инфильтрация.
Основными клиническими проявлениями БА являются: -инспираторная и, особенно, экспираторная одышка; - приступы удушья, кашля, стеснений за грудиной, свистящих хрипов, особенно, при выдохе; -цианоз, тахикардия, лейкоцитоз, эозинофилия и др. Эти признаки усиливаются при физических нагрузках, охлаждении, инфицировании слизистой различных отделов дыхательных путей.
Принципы лечения БА базируются на выявлении и учете этиологических и патогенетических факторов, провоцирующих рецидив заболевания, а также на проведении мероприятий и использовании средств, предупреждающих или ослабляющих их патогенные воздействия на верхние и нижние дыхательные пути.
Основными патогенетическими подходами, снижающими реактивность слизистых дыхательных путей, являются:
предупреждение взаимодействия аллергенов с IgE,
снижение или блокирование высвобождения медиаторов аллергии,
дилатация мышц бронхов и, особенно,бронхиол и др.
Для этого необходимо осуществлять мероприятия, направленные на:
элиминацию или нейтрализацию аллергенов,
проведение специфической иммунотерапии (гипосенсибилизации),
предупреждение или снижение опосредованного иммунными механизмами бронхоспазма, вызываемого медиаторами тучных клеток,
использование различных противовоспалительных средств и бронходилататоров (симпато- и адреномиметиков: эфедрина, адреналина и др., увеличивающих образование цАМФ; антихолинергические средства: атропин и др.; кортикостероиды: преднизолон, дексаметозон и др.; неспецифические противовоспалительные средства: аспирин, бутадион, ибупрофен, индометацин, пироксикам, бронхолитин и др.; ингибиторы фосфодиэстеразы: метилксантины - эуфиллин, теофиллин и др.).
32.3.2. РЕСТРИКТИВНЫЕ НАРУШЕНИЯ ДЫХАНИЯ
Основу рестриктивных расстройств (от лат. restrictio – ограничение) дыхания составляет изменение вязкоэластических свойств легочной ткани.
К рестриктивным нарушениям дыхания относят гиповентиляционные расстройства, возникающие вследствие ограничения расправления легких из-за повреждения белков их интерстиция под действием ферментов (эластаза, коллагеназа и др.). В состав интерстиция входят коллаген (60-70 %), эластин (25-30 %), гликозаминогликаны (1 %), фибронектин (0,5 %). Фибриллярные белки обеспечивают стабильность каркаса легких, его эластичность и растяжимость, создают оптимальные условия для выполнения основной газообменной функции. Структурные изменения белков интерстиция проявляются снижением растяжимости легочной паренхимы и повышением эластического сопротивления легочной ткани. Так, при развитии эмфиземы нарушается равновесие между синтезом и распадом эластина, так как имеющийся избыток протеаз не уравновешивается ингибиторами протеолитических ферментов. При этом наибольшее значение имеет дефицит -1-антитрипсина.
Сопротивление, которое приходится преодолевать дыхательным мышцам во время вдоха, может быть эластическим и неэластическим.
Эластическая тяга легких направлена на сокращение объема легких. То есть, это величина, обратная растяжимости. Примерно 2/3 эластической тяги легких зависит от поверхностного натяжения стенок альвеол. Эластическая тяга легких численно равна транспульмональному давлению. На вдохе увеличивается транспульмональное давление и объем легких. В зависимости от фазы дыхания имеются колебания внутриплеврального давления: в конце спокойного выдоха оно составляет 2-5 см вод. ст., в конце спокойного вдоха - 4-8 см вод. ст., на высоте максимального вдоха - 20 см вод. ст.
Растяжимость легких (податливость легких, легочный комплеанс) - величина, характеризующая изменения объема легких на единицу транспульмонального давления. Растяжимость - величина, обратно пропорциональная эластичности. Основным фактором, определяющим предел максимального вдоха, является растяжимость. По мере углубления вдоха растяжимость легких прогрессивно уменьшается, а эластическое сопротивление становится наибольшим. Поэтому главным фактором, определяющим предел максимального выдоха, является эластическое сопротивление легких.
Увеличение транспульмонального давления на 1 см вод. ст. проявляется повышением объема легких на 150-350 мл. Работа по преодолению эластического сопротивления пропорциональна дыхательному объему, то есть растяжимость легких на вдохе тем больше, чем большая работа при этом совершается. Затруднения расправления легочной ткани определяют степень гиповентиляционных нарушений.
Выделяют две группы факторов, приводящих к ограничительным нарушениям вентиляции легких: 1) внелегочные и 2) внутрилегочные.
Рестриктивные расстройства дыхания внелегочного происхождения могут быть следствием сдавления туловища, вызванного воздействиями механического характера (сдавление одеждой или предметами производственного оснащения, тяжелыми предметами, землей, песком и т.п., особенно, при различных катастрофах), либо возникают вследствие ограничения экскурсий грудной клетки при пневмо-, гидро- и гемотораксе и других патологических процессах, ведущих к компрессии легочной ткани и нарушению расправления альвеол при вдохе.
Пневмоторакс возникает из-за попадания воздуха в плевральную полость и бывает первичным или спонтанным, (например, при кистах бронхов, сообщающихся с плевральной полостью) и вторичным (опухоли, туберкулез и др.), травматического и искусственного происхождения, а по механизму - открытым, закрытым и клапанным.
Гидроторакс возникает при попадании в плевральную полость либо экссудата (развивается экссудативный плеврит), либо транссудата (развивается транссудативный плеврит).
Гемоторакс проявляется наличием в плевральной полости крови и возникает при ранениях грудной клетки и плевры, опухолях плевры с повреждением сосудов.
К рестриктивным нарушениям дыхания относятся также поверхностные, учащенные дыхательные движения, возникающие в связи с чрезмерным окостенением реберных хрящей и малой подвижностью связочно-суставного аппарата грудной клетки.
Особое значение в развитии внелегочных форм рестриктивных нарушений внешнего дыхания имеет плевральная полость.
У человека в ноpмальныx уcловияx плевpальная жидкоcть обpазуетcя в апикальной чаcти паpиетальной плевpы; дpениpование жидкоcти пpоиcxодит поcpедcтвом лимфатичеcкиx cтоматов (поp). Меcтом иx наибольшей концентpации являютcя медиаcтинальная и диафpагмальная чаcти плевpальной полоcти. Таким обpазом, фильтpация и pеабcоpбция плевpальной жидкоcти являетcя функцией паpиетальной плевpы (pиc.32-4).
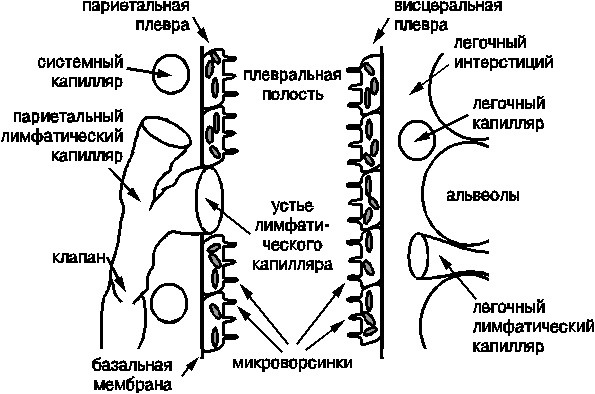
Рис. 32-4. Механизм образования плевральной жидкости
Знание меxанизмов обpазования плевpальной жидкоcти объясняет целый pяд клинических cиндpомов. Так, у больныx c легочной гипеpтензией и пpизнаками пpавожелудочковой недоcтаточноcти также как и у больных c xpоничеcким легочным cеpдцем в cтадии пpавожелудочковой недоcтаточноcти, cкопления жидкоcти в плевpальной полоcти не пpоиcxодит. Cкопление тpанccудата в плевpальной полоcти возникает при диcфункции левого желудочка с pазвитием клиничеcкиx пpизнаков заcтойной cеpдечной недоcтаточноcти. Возникновение этого клиничеcкого феномена cвязывают c повышением давления в легочныx капилляpаx, что и пpиводит к пpопитыванию тpанccудата чеpез повеpxноcть виcцеpальной плевpы в ее полоcть. Удаление тpанccудата поcpедcтвом тоpакоцентеза cнижает объем циpкулиpующей кpови и давление в легочныx капилляpаx, поэтому в cовpеменные теpапевтичеcкие pекомендации эта пpоцедуpа включена как обязательная пpи ведении больныx c заcтойной cеpдечной недоcтаточноcтью.
Патофизиологичеcкие закономеpноcти возникновения тpанccудата пpи заcтойной cеpдечной недоcтаточноcти обуcловлены большим объемом кpови в cиcтеме малого кpуга кpовообpащения. При этом возникает эффект объем-давление-тpанccудат.
В оcнове этих закономеpноcтей pазвития экccудативного плевpита лежит возpаcтающий поток белков ферментов, фоpменныx элементов и электролитов кpови в плевральную полость.
Поверхность плевральных листков микроворсинок концентpиpует большое количеcтво гликопpотеинов и гиалуpоновой киcлоты и окpужена фоcфолипидами, т.е. по cвоей моpфологичеcкой xаpактеpиcтике напоминает альвеоляpный cуpфактант. Эти особенности объяcняют легкоcть cкольжения повеpxноcтей пеpиетального и виcцеpального лиcтков плевpы. Мезотелиальные клетки активно участвуют в воспалительном процессе. Мигpация нейтpофилов в плевpальную полоcть оcущеcтвляетcя под дейcтвием некотоpыx цитокинов, к котоpым, в чаcтноcти, отноcитcя интеpлейкин-8. Выcокая концентpация данного цитокина наблюдаетcя у больныx c эмпиемой плевpы. Меcтом cинтеза этого цитокина являютcя вовлеченные в воcпалительный пpоцеcc мезотелиальные клетки и иx воpcинки. Интеpлейкин-8 оказалcя чувcтвительным теcтом в пpоведении xимиотеpапии и оценке ее эффективноcти у больныx c мезотелиомой. Его рассматривают как биомаpкеp в диффеpенциальной диагноcтике воcпалительныx и канцеpогенныx плевpитов. В экcпеpиментальныx уcловияx были иcпользованы антитела пpотив интеpлейкина-8, что пpивело к ингибиpующему эффекту на пpоцеcc мигpации нейтpофилов в плевpальную полоcть. В физиологичеcкиx уcловияx ингибиpующим эффектом на дейcтвие xемоаттpактанта обладает интеpлейкин-10.
Рестриктивные расстройства дыхания легочного происхождения возникают в результате : 1) изменения вязкоэластических свойств, в том числе потери эластических волокон, легочной ткани; 2) повреждения сурфактанта или снижения его активности.
Нарушения вязкоэластических свойств легочной ткани отмечается при: - различных видах повреждений паренхимы легких; - диффузном фиброзировании легких различного происхождения (первичная эмфизема легких, пневмосклероз, пневмофиброз, альвеолиты); - очаговых изменениях в легких (опухоли, ателектазы); - отеке легких различного генеза (воспалительный, застойный). Растяжимость легких резко (более 50 %) уменьшается при увеличении кровенаполнения легких, интерстициальном отеке, в том числе воспалительного характера. Так, в далеко зашедших случаях эмфиземы легких (из-за снижения растяжимости их даже при максимальном вдохе) не удается достичь предела функциональной растяжимости легких. В силу снижения эластической тяги легких происходит формирование бочкообразной грудной клетки.
Уменьшение растяжимости легочной ткани является типичным проявлением фиброза легких.
Потеря эластических свойств легочной ткани происходит при разрушении эластических волокон под влиянием длительного действия многих патогенных факторов (токсины микробов, ксенобиотики, табачный дым, нарушения питания, пожилой и старческий возраст), активирующих протеолитические ферменты.
Растяжимость и эластичность легких зависят также от тонуса альвеол и терминальных бронхиол.
Снижение количества и активности сурфактанта способтвует спадению альвеол. Последнему препятствует покрытие их стенок сурфактантом (фосфолипид-протеин-полисахарид) и наличие межальвеолярных перегородок. Сурфактантная система является составной частью аэрогематического барьера. Как известно, сурфактант вырабатывается пневмоцитами 2-го порядка, состоит из липидов (90 %, из них 85 % приходится на долю фосфолипидов), белков (5-10 %), мукополисахаридов (2 %) и имеет период полураспада менее двух суток. Сурфактантный слой обеспечивает снижение поверхностного натяжения альвеол. При уменьшении легочных объемов сурфактант предупреждает коллабирование альвеол. На высоте выдоха объем легких минимальный, поверхностное натяжение благодаря выстилке ослаблено. Поэтому для раскрытия альвеол требуется меньшее транспульмональное давление, чем в отсутствие сурфактанта.
Преимущественно по рестриктивному типу развиваются:
острая диффузная пневмония (крупозная пневмония),
пневмоторакс,
гидроторакс,
гемоторакс,
ателектаз.
Крупозная пневмония – острое, как правило, инфекционное экссудативное воспаление значительного объема паренхимы (респираторных структур) легкого, а также других его анатомических образований. Таким образом, пневмония (греч. pneumon - легкое; син.: воспаление легких) – это воспаление респираторных отделов легкого, возникающее в виде самостоятельного заболевания или осложнения какого-либо заболевания.
Заболеваемость пневмониейвысока, ею заболевают около 1 % населения Земли, с большими колебаниями в разных странах. С возрастом, особенно старше 60 лет, заболеваемость пневмонией и смертность от нее увеличиваются, достигая соответственно более 30 % и 3 %.
Этиология пневмоний. Среди этиологических факторов в развитии пневмонии важное значение имеют различные вирусы (аденовирусы, вирусы гриппа, парагриппа и др.), микоплазмы, риккетсии, бактерии (пневмококки, стрептококки, стафилококки, палочка Фридлендера (Клебсиела), гемофильная палочка Пфейфера и др.), простейшие. Неблагоприятными условиями, ускоряющими развитие, усиливающими тяжесть течения и ухудшающими исход заболевания, являются охлаждение ног, всего тела, недоедание, недосыпание, интоксикации, дистресс и другие факторы, снижающие иммунитет организма.
Патогенез пневмоний. Установлено, что при пневмонии основным путем проникновения флогогенного фактора в легкие является бронхогенный с распространением их по ходу дыхательных путей в респираторные отделы легких. Гематогенный путь проникновения инфекционных возбудителей в легкие - исключение. Он имеет место при септических (метастатических) и внутриутробных пневмониях.
Патогенные микроорганизмы вызывают пневмонию, как правило, только тогда, когда они попадают в бронхи из верхних дыхательных путей, особенно со слизью, которая предохраняет микробы от бактериостатического и бактерицидного действия бронхиального секрета и благоприятствует их размножению. Вирусная инфекция, способствуя избыточной секреции слизи в носоглотке, обладающей к тому же пониженными бактерицидными свойствами, облегчает проникновение инфекции в нижние отделы дыхательных путей. Кроме того, вирусная инфекция нарушает работу мукоцилиарного эскалатора и макрофагов легких, тем самым, препятствуя очищению легких от микробов. Установлено, что у 50 % взрослых ежедневно во сне происходит микроаспирация слизи в дыхательные пути. Микробы адгезируются к эпителиальным клеткам (факторы адгезии - фибронектин и сиаловые кислоты, содержащиеся в щеточной кайме эпителиальных клеток) и проникают в их цитоплазму, в итоге развивается микробная колонизация эпителия. Однако, в этот момент фагоцитирующие свойства первой линии защиты нижних дыхательных путей (резидентных макрофагов) против микроорганизменной, особенно бактериальной, флоры нарушены предшествующими вирусной и микоплазменной инфекциями. После разрушения эпителиальных клеток слизистой дыхательных путей в очаг воспаления привлекаются полиморфноядерные лейкоциты, моноциты, активируется каскад комплемента, что, в свою очередь, усиливает миграцию нейтрофилов в очаг воспаления.
Начальные воспалительные изменения в легких при пневмониях обнаруживают преимущественно в респираторных бронхиолах. Это объясняется тем, что именно в этом месте происходит задержка попавших в легкие микробов вследствие наличия здесь ампулообразного расширения бронхиол, отсутствия реснитчатого цилиндрического эпителия и менее развитой гладкой мышечной ткани. Инфекционный агент, распространяясь за пределы респираторных бронхиол, вызывает воспалительные изменения в паренхиме легких, т. е. пневмонию. При кашле и чихании инфицированный выпот из очага воспаления попадает в различные по размеру бронхи, а затем распространяется в другие респираторные бронхиолы, что обусловливает возникновение новых очагов воспаления. Таким образом, распространение инфекции в легких может происходить бронхогенно. При ограничении распространения инфекции вследствие развития воспалительной реакции в непосредственной близости от респираторных бронхиол (как правило вокруг них) развивается очаговая пневмония. В случае распространения бактерий и отечной жидкости через поры альвеол в пределах одного сегмента и закупорки инфицированного слизью сегментарного бронха возникает сегментарная пневмония (как правило, на фоне ателектаза), а при более бурном распространении инфицированной отечной жидкости в пределах доли легкого - долевая (крупозная) пневмония.
Характерной чертой пневмоний является раннее вовлечение в патологический процесс регионарных лимфатических узлов (бронхопульмональных, бифуркационных, паратрахеальных). В связи с этим, одним из наиболее ранних симптомов пневмонии, который можно обнаружить при объективном обследовании (пальпаторная перкуссия, рентгеноскопия, рентгенография и др.), является расширение корней легких.
В патогенезе пневмоний определенная роль отводится также дефициту сурфактанта. Это приводит к ослаблению его бактерицидного действия, нарушению эластичности легочной ткани и рационального соотношения вентиляции и кровотока в легких. Гипоксия, аспирация, табакокурение, грамотрицательные бактерии, способствующие снижению уровня сурфактанта в легких, одновременно приводят к возникновению вторичных гиалиновых мембран, которые патологоанатомы нередко обнаруживают на вскрытии у больных пневмонией. Ограниченные вторичные гиалиновые мембраны обычно не вызывают выраженного нарушения дыхания, являясь спутниками воспалительного процесса в легких.
Кислородная недостаточность, закономерно развивающаяся при пневмонии, прежде всего, отражается на деятельности ЦНС. Часто в разгар пневмонии возникает дисфункция автономной нервной системы с преобладанием симпатического ее отдела. В период выхода организма из токсикоза начинают доминировать холинергические реакции.
Различают первичное, самостоятельное (чаще инфекционное, реже неинфекционное: застойное, аспирационное, травматическое, токсическое либо асептическое), а также вторичное (возникающее при других, не легочных, первичных инфекционных заболеваниях) воспаление легких.
Клиническая картина пневмоний, вызываемых различными инфекционными и неинфекционными патогенными факторами, естественно, отличается друг от друга. Например, при наиболее часто встречаемой пневмококковой пневмонии заболевание начинается остро с нарастающего озноба, одышки, кашля, к которым присоединяется боль в груди (при кашле и даже дыхании), гнойная мокрота с кровью и т.д. По лабораторным данным отмечается лейкоцитоз с ядерным сдвигом влево, токсическая зернистость нейрофилов, увеличение СОЭ, анемия. Рентгенологически определяются очаговые и сливные затемнения и явления деструкции легких. На фоне ослабленного и/или жесткого дыхания выслушиваются участки звучных влажных хрипов.
Принципы лечения пневмоний включают преимущественно этиотропное, патогенетическое и саногенетическое лечение. Лечение пневмонии должно начинаться как можно раньше, быть комплексным и эффективным. Ведущее значение имеет правильный выбор антимикробного средства, его дозы и схемы лечения. Назначаемый препарат должен оказывать выраженное бактерицидное действие. Лечение пневмоний должно проводиться:
под тщательным клинико-бактериологическим контролем;
на фоне улучшения (нормализации) проходимости воздухоносных путей (для этого назначаются теофедрин, эуфилин и его аналоги);
путем назначения средств: - разжижающих мокроту (мукалтин, термопсис, препараты йода); - ослабляющих или ликвидирующих ацидоз воздухоносных и газообменных тканей легких (щелочные паровые ингаляции 2-3 % раствором соды при температуре 50-600С по 5-10 минут перед сном и др.); - обладающих десенсибилизирующим и противовоспалительным действие; - улучшающих кровообращение и трофику легких (фитоадаптогены, лечебная физкультура, различные физиотерапевтические процедуры: наначальных этапах - банки и горчичники, однако, если есть опасность легочного кровотечения или накопления жидкости в легких их следует исключить;на этапе рассасывания– массаж, тепловые процедуры: индуктотермия, УВЧ, диадинамия) и т.д.
32.3.3. Изменения основных функциональных
показателей дыхания при обструктивных
и рестриктивных расстройствах
Для оценки вентиляционной способности легких, а также для решения вопроса по какому типу (обструктивному или рестриктивному) развивается дыхательная недостаточность в клинической практике исследуются различные функциональные показатели. Определение последних ведется либо с помощью спирометрии (статические показатели), либо пневмотахометрии (динамические показатели).
Основными показателями спирометрии являются: 1) дыхательный объем (ДО), представляющий собой инспираторный объем во время спокойного дыхания; 2) резервный объем вдоха – максимальный объем воздуха, который способен вдохнуть испытуемый после спокойного вдоха (РО вд.); 3) жизненная емкость легких (ЖЕЛ), представляющая собой максимальный объем воздуха, который можно вдохнуть или выдохнуть; 4) остаточный объем (ОО) - количество воздуха, которое остается в легких даже после максимального выдоха; 5) общая емкость легких (ОЕЛ), представляющая сумму ЖЕЛ и ОО; 6) функциональная остаточная емкость (ФОЕ) - объем воздуха в легких в состоянии покоя по окончании обычного выдоха.
К динамическим показателям системы дыхания относятся: 1) частота дыхания (ЧД); 2) дыхательный ритм (ДР); 3) минутный объем дыхания (МОД), представляющий собой произведение ДО и ЧД; 4) максимальная вентиляция легких (МВЛ), составляющая произведение ЖЕЛ и форсированной частоты дыхания; 5) объем форсированного выдоха за 1 секунду (ОФВ1), выражаемого в процентах к форсированной жизненной емкости легких (ФЖЕЛ); 6) форсированный экспираторный поток воздуха между 25 % и 75 % форсированной жизненной емкости легких (ФЭП 25 %-75 %), позволяющий оценивать среднюю объемную скорость воздушного потока.
У больных с обструктивными и рестриктивными заболеваниями выявляются характерные изменения (табл.32-1).
Таблица 32-1
