
Общая нозология
Предмет и задачи патологии, ее связь с другими медицинскими науками.
Патфиз – наука, изучающая общие закономерности возникновения, развития и исхода болезни. Наука о жизнедеятельности больного организма. Изучает общее в болезни, т.е. наиболее общие закономерности возникновения и развития болезни, в то время как другие науки изучают частное, особенное, специальное. Задачи: установление сущности болезни (что такое болезнь); изучение причин и условий возникновения болезни; раскрытие механизмов развития болезни и отдельных ее проявлений, установление закономерностей течения болезни и механизмов выздоровления; определение общих принципов профилактики и лечения болезни.
Связь с другими науками: науки изучающие свойства факторов окружающей среды, способных вызывать болезни (физика, химия, биология, микробиология, социология) – дают сведения необходимые для изучения этиологии; науки изучающие свойства организма и его жизнедеятельность (цитология, эмбриология, гистология, нормальная физиология, биохимия, иммунология, генетика) – создают основу для изучения патогенеза; общетеоретические науки изучающие болезнь (патологическая анатомия, фармакология) – вместе с патологической физиологией создают целостную картину болезни; клинические науки – патологическая физиология определяет основные этиологические и патогенетические принципы профилактики, диагностика и лечения.
Методы патологии. Значение экспериментального метода изучения болезни.
Для изучения болезни используют клинический, эпидемиологический, анатомический, экспериментальный методы. Клинический– предполагает изучение болезни непосредственно у постели больного.Эпидемиологический– использует в качестве объекта наблюдения популяцию людей. Он имеет огромное значение для установления причин возникновения и закономерностей развития инфекционных заболеваний.Анатомический– основной метод патологической анатомии, которая вместе патфиз изучает сущность болезни, используя при этом в качестве объекта труп человека.Экспериментальный– предполагает изучение болезни на лабораторных животных, которые являются объектом моделирования болезней человека.Основной метод патфиз – эксперимент– активное влияние человека на природу и искусственное воспроизведение разных ее явлений с целью познания объективных закономерностей.Особенность патфиз экспериментасостоит в воспроизведении на лабораторных животных экспериментальных моделей болезней с целью установления механизмов их возникновения, развития и исхода у человека. Эксперимент дает возможность наблюдать и изучать болезнь от самого начала до ее завершения, что не возможно в клинике. В нем можно контролировать условия окружающей среды, влияющие на течение болезни, а также исходное состояние животных, которые являются объектом опыта. Это единственная возможность изучения таких влияний на организм, использование которых в клинике недопустимо (травма, трансплантация опухолей, облучение). Экспериментальные исследования дают объективный материал для построения научных теорий.
Исторические этапы развития патологии. Вклад отечественных ученых в формировании науки.
До второй половины 19 века патфиз в России не существовала как самостоятельная наука и дисциплина для преподавания.
А.М. Шумлянский– первый преподаватель элементов общей патологии в госпитальных и медицинских школах, занимал кафедру терапии, акушерства и патологической анатомии в Московской госпитальной школе.М.М. Тереховский– преподаватель фармакологии, патологии и практической медицины в Кронштадском морском госпитале.С.Г. Забелин, М.И. Барсук-Моисеев– общая патология Московский университет.И.А. Смеловский, К.Ф. Уден, Д.М. велланский, А.П. Загорский– терапевты, Питер.
Первая половина XIXвека – И.Е. Дядьковский – терапевт и патолог, его ученик К.В. Лебелев – курс общей патологии и терапии Московский университет (учебник Общая антропатология – первое руководство по общей патологии на русском языке).
И.Е. Дьяковский – учитель первого русского физиолога И.Т. Глебова, у которого учился отец русской физиологии И.М. Сеченов. Ученик Сеченова – В.В. Паштин.
Профессор Московского университета А.М. Филомафитский, руководитель кафедры физиологии и общей патологии, впервые в России произвел ряд патфиз экспериментов – удаление почек у животных, перевязку мочеточников. Широко разработал вопросы переливания крови, совместно с Пироговым исследовал действия на животный организм наркотических средств (эфир, хлороформ).
Общая патология выделилась как самостоятельная дисциплина в 1869 г но преподавали ее в основном терапевты. В Москве в 1869 г курс общей патологии читал ученик терапевта И.В. Варвинского А.И. Полунин – пропагандировал экспериментальные методы патологии. Но только после 1889 г при его ученике А.Б. Фохте эта кафедра становится экспериментально-патофизиологической.
В.В. Пашутин – основоположник отечественной патофизиологии – первая в России кафедра экспериментальной патологии. Первое оригинальное руководство по патфиз. Научные интересы сосредоточены на: нарушениях обмена веществ и энергии (полное и частичное голодание).
Для патологии в Росси во второй половине XIXвека характерен переход от морфологического направления к экспериментальному изучению функций, т.е. к патологической физиологии.
Пашутин создал самую большую школу отечественных патофизиологов. Его ученики: Альбицкий – кафедра в Томске, затем в Петербурге, Репрев – Томск, Харьков, Тимофеевский – создал томскую школу патофизиологов.
В истории отечественной общей патологии два основных периода – «допашутинский» (с 1726-1766 – основание русский университетов до 1874 - организация кафедры общей патологии в Казани ) и «послепашутинский» (продолжается до наших дней). Во втором периоде развития патфиз яркую страницу внесли работы Павлова, который обосновал принципиально новые подходы к изучению жизненных явлений на животных, развил идеи нервизма в патологии вписал новые главы в учение о кровообращении, пищеварении и ВНД.
Школы и направления исследований отечественных патофизиологов.
Московская школа: Фохт – работы по патологии кровообращения; широко применял физиологические методы экспериментального изучения пат процессов. Впервые в мире воспроизвел в эксперименте многие пороки сердца, тампонаду сердца и большое число нарушений кровообращения. Сахаров его ученик. Ученик Сахарова – Неговский – создал большую школу и оригинальное направление исследований по реанимации проблеме смерти и пограничных состояний.
Петербургская школа: Веселкин с сотрудниками – обширные исследования по различным вопросам патологии углеводно-фосфорного обмена, по патогенезу панкреатического диабета, а также исследования обмена веществ при хроническом неполном голодании. Аничков – руководитель кафедры общей и экспериментальной патологии – инфильтративная теория патогенеза атеросклероза, «Учение о ретикуло-эндотелиальной системе». 1939-1963 руководитель кафедры патофизиологии ВГИА Петров создал свою школу патофизиологов (Зорькин, Кулагн, Кочетыгов) – изучение патогенеза различных видов шока и разработка патогенетически обоснованных способов его профилактики и лечения. Петров – патогенез кислородного голодания, терапия и профилактика различных форм гипоксических состояний.
Казанская школа: Хорват – изучал состояние организма при зимней спячке и анабиозе. Савченко - этиология злокачественных опухолей, вопросы иммунитета и аллергии при инфекциях, теории фагоцитоза. Гордиенко - исследования по сравнительной и экспериментальной аллергии, по влиянию вегетотропных ядов на иммунитет, по патогенезу травматического шока. Сиротинин – патогенез анафилаксии.
4. Основные понятия общей нозологии: норма, здоровье, предболезнь, болезнь. Понятие о патологической реакции, патологическом процессе патологическом состоянии.
Норма– состояние оптимальной жизнедеятельности организма в конкретных условиях его существования.
Здоровье– состояние полного физического, духовного и социального благополучия, а не только отсутствие болезней или физических дефектов.
Предболезнь– обозначает начальную, бессимптомную стадию развития патологических изменений, резко повышающих чувствительность организма к определённым патогенным влияниям. Самой общей характеристикой понятия "предболезнь" является то, что само по себе это состояние, хотя и патологическое, ещё не нарушает здоровья; оно только несёт в себе объективные предпосылки для его нарушения.
Болезнь– нарушение нормальной жизнедеятельности организма, возникающее вследствие наследуемого генетического дефекта и/или действия на организм повреждающего фактора, характеризующееся развитием закономерного динамического комплекса взаимосвязанных патогенных и адаптивных изменений, а также ограничением диапазона биологических и социальных возможностей индивида.
Патологическая реакция – качественно и/или количественно неадекватный и биологически нецелесообразный (неадаптивный) ответ организма или его части (ткани, органа, системы) на действие обычных или патогенных агентов.
Патологический процесс– закономерная динамическая совокупность патогенных и адаптивных изменений в тканях, органах и их системах, возникающих под действием повреждающего фактора, характеризующаяся нарушением жизнедеятельности организма.
Патологическое состояние– длительное отклонение от нормы, структуры, биохимических и/или функциональных свойств тканей, органов, их систем, возникающее под действием патогенного агента, характеризующееся, как правило, нарушением жизнедеятельности организма.
5. Принципы классификации болезней. Стадии развития болезней.
1) Этиологический, согласно ему выделяют наследственные и приобретенные, инфекционные и неинфекционные болезни.2) Анатомо-топографический– сердечнососудистые болезни, болезни органов дыхания, болезни почек и др. 3) По возрасту и полу– детские болезни, женские болезни, болезни старческого возраста.4) Экологический– тропические болезни, болезни Крайнего Севера и др.5) В зависимости от уровня поражений– молекулярные болезни, хромосомные болезни.6) Социальный– профессиональные болезни, болезни военного времени, болезни цивилизации.7) Патогенетический принцип– аллергические, воспалительные, опухолевые, обменные и др.8) В зависимости от соотношения структурных и функциональных нарушений– органические и функциональные болезни.9) По клиническому течению– острые, подострые, хронические.10) В зависимости от методов, которые преимущественно используются для лечения болезней, - терапевтические и хирургические.
Стадии болезни: латентная, продромальная, выраженной болезни, исходов болезни.
Латентная– период от момента воздействия патогенного агента на организм до первых признаков болезни. Симптомов нет.Продромальная– от момента первых проявлений болезни до развития типичной клинической картины. Выявляются первые неспецифические признаки болезни: недомогание, быстрая утомляемость, раздражительность, болезненность в мышцах и суставах, снижение аппетита, головная боль, тошнота, ощущение дискомфорта.Выраженной болезни- появляются типичные для конкретной болезни местные и общие симптомы. При неблагоприятном течение болезни могут развиться осложнения (гипертонический криз при ГБ, коллапс при гипертермии, кома при сахарном диабете).Стадия исходов болезни– возможно несколько вариантов исхода болезни: выздоровление (полное и неполное), рецидив, ремиссия, осложнение, переход в хроническую форму, смерть.
Полное выздоровление– в основе лежит формирование эффективных адаптивных процессов и реакций, которые ликвидируют причину болезни и ее патогенные последствия, полностью восстанавливают гомеостаз организма.Неполное выздоровление– при сохранении в организме остаточных явлений болезни, отдельных структурных и функциональных отклонений после ее завершения как таковой.Рецидив– повторное появление или повторное усиление симптомов болезни после их устранения или ослабления.Ремиссия– временное ослабление (неполная) или устранение (полная ремиссия) болезни.Осложнения– патологический процесс, состояние или реакция, развивающееся на фоне основной болезни, но не обязательные для нее.Смерть– процесс прекращения жизнедеятельности организма. Этому предшествует более или менее длительный период умирания организма. Он включает: преагонию, терминальную паузу, агонию, клиническую смерть, биологическую смерть. Клиническая смерть – принципиально обратимый этап терминального состояния. Характеризуется прекращением дыхания, сердцебиения, кровообращения. Длится 3-6 минут при нормотермии, 15-25 минут при гипотермии. Основным фактором, определяющим длительность периода клинической смерти, является степень гипоксии нейронов коры головного мозга.
Биологическая смерть – необратимое прекращение жизнедеятельности организма и физиологических процессов в клетках. При этом оживление организма как целостной системы (включая и восстановление мышления) уже невозможно, хотя еще и есть возможность восстановить функцию отдельных органов (сердца, почек, печени).
6. Этиология, определение понятия. Роль, причины и условия возникновения болезни. Этиотропные принципы профилактики и терапии болезней.
Этиология– учение о причинах и условиях возникновения болезни. Причина болезни – фактор, вызывающий данную болезнь и придающий ей специфические черты.
Фактор может быть причиной, если обладает тремя свойствами: 1) является материальным, т.е. существует объективно, не зависимо от сознания; 2) взаимодействует с организмом; 3) придает болезни специфичность.
Условия болезни– совокупность различных факторов, среди которых ни один не является абсолютно необходимым для ее развития.По характеру влияния на возникновение болезни все условия делят на:1)Условия, которые усиливают действие причины и таким образом способствуют развитию болезни. Например, причиной острых респираторных заболеваний являются вирусы, а способствующими условиями - охлаждение, утомление, отсутствие иммунитета. Иногда условия могут иметь решающее значение. Без определенных условий, не смотря на наличие причины, болезнь не возникает (например, аллергия на пищевые продукты).2)Условия, которые ослабляют действие причины и таким образом препятствуют развитию болезни. К ним относятся рациональное питание, правильная организация режима дня, физическая культура, хороший уход за больными. Иногда условия могут полностью нейтрализовать действие причины (например, наличие естественного или приобретенного иммунитета к тем или иным возбудителям инфекционных болезней).
Этиотропная профилактика и терапия болезней преследуют две главные цели: 1) выявление причин болезни или патологического процесса и проведение мероприятий, направленных на предотвращение ее воздействия на организм (профилактика); 2) выявление факторов, способствующих и препятствующих реализации патогенного действия причинного агента, и проведение мероприятий по устранению или подавлению эффектов первых и потенцированию вторых. Если причинный агент уже воздействует на организм, то принимаются меры по прекращению, либо уменьшению интенсивности и/или длительности его действия (лечебные мероприятия).
Пример профилактики: меры, направленные на предупреждение действия на организм патогенных химических агентов, болезнетворных м/о, проникающей радиации и других физических факторов. Медикаментозно – гормоны, ферменты, дез средства или не медикаментозно – защитная одежда, УФ-излучение. Пример лечебных мероприятий – противомикробные и антипаразитарные средства при инфицировании организма или остановка кровотечения и переливание препаратов крови и кровезаменителей при нарушении при нарушении целостности сосудистой стенки.
7. Сущность учения о монокаузолизме, кондиционализме, конституционализме.
Монокаузолизм– течение в патологии, которое признает абсолютное верховенство причины в возникновении болезни. У болезни всегда есть одна причина. Разные условия практически никогда не имеют никакого значения. Это течение возникло во второй половине Х1Х века и связано с успехами в микробиологии. Является материалистическим, метафизическим.
Кондиционализм– течение, которое не признает определяющей роли причины в возникновении болезни. Его представители считают, что болезнь возникает как следствие сочетания многих равнозначимых факторов, т.е. условий. Выделить из такой совокупности один, самый существенный фактор не представляется возможным (принцип полиэтиологичности). Появилась в начале ХХ века и является отражением субъективно идеалистических воззрений на болезнь.
Конституционализм. Сторонники этого течения считают, что решающее значение в возникновении болезни принадлежит не патогенным факторам окружающей среды, а самому организму, в частности его наследственности и конституции.
8. Патогенез, определение понятия. Повреждение как начальное звено патогенеза. Проявления повреждений на разных уровнях организма (молекулярном, клеточном, органно-тканевом, организменном).
Патогенез– комплекс взаимосвязанных процессов повреждения и адаптации организма, лежащих в основе возникновения, развития и исходов конкретных болезней и патологических процессов. Пусковым механизмом (звеном) любого патологического процесса, заболевания является повреждение, возникающее под влиянием вредоносного фактора.Повреждения могут быть:первичными; они обусловлены непосредственным действием патогенного фактора на организм – это повреждения на молекулярном уровне, вторичными; они являются следствием влияния первичных повреждений на ткани и органы, сопровождаются выделением биологически активных веществ (БАВ), протеолизом, ацидозом, гипоксией, нарушением микроциркуляции, микротромбозом и т.д. Характер повреждения зависит от природы раздражителя (патогенного фактора), видовых и индивидуальных свойств живого организма. Одновременно с повреждением включаются защитно-компенсаторные процессы на тех же самых уровнях – молекулярном, клеточном, тканевом, органном и организменном.
Молекулярный уровень– повреждения локальные, проявляются разрывом молекул, внутримолекулярными перестройками – отсюда появление новых радикалов, молекул, новых веществ, оказывающих патогенное действие на организм. Межмолекулярные перестройки способствуют появлению веществ с новыми антигенными свойствами. Одновременно с повреждением включаются защитно-компенсаторные процессы на молекулярном уровне. Например, наследственное заболевание: первичное повреждение – в генетическом аппарате на молекулярном уровне. Генная мутация вызывает нарушение синтеза белков, ферментов – влияет на обменные процессы в организме - нарушение структуры и функций органов и систем.
Клеточные уровень– структурные и метаболические нарушения, сопровождаются синтезом и секрецией БАВ: гистамина, серотонина, гепарина …многие из них оказывают патогенное действие, повышая проницаемость сосудов микроциркуляторного русла – сгущение крови, склонность к микротромбозу, т.е. нарушение микроциркуляции. При повреждении клетки, особенно в условиях гипоксии, образуется большое количество недоокисленных продуктов обмена, обусловливающих внутриклеточный ацидоз и нарушающих гомеостаз в целом. Структурные изменения клетки характеризуются нарушением внутриклеточных органелл. Следствием структурно–метаболических изменений может наступить перерождение клетки вплоть до ее гибели.
Тканевый уровень- нарушение основных функциональных свойств, развитие патологического парабиоза, перерождение ткани. Нарушение основных функциональных свойств сопровождается снижением функциональной подвижности, уменьшением функциональной лабильности. Защитно-компенсаторные процессы на тканевом уровне проявляются включением ранее не функционировавших капилляров, образованием новых микрососудов, что улучшает трофику поврежденных тканей.
Органный уровень– снижение, извращение или потеря специфических функций органа, уменьшение доли участия поврежденного органа в общих реакциях организма. Например, инфаркт миокарда – нарушается функция сердца и доля его участия в адекватном гемодинамическом обеспечении функционирующих органов и систем.
При первичном повреждении на системном или организменном уровне возникает генерализованное выпадение или ограничение той или иной функции, что особенно отчетливо наблюдается при заболеваниях ЦНС, эндокринных поражениях. При этом происходит сложная перестройка регуляторных процессов, обмена веществ, что в ряде случаев позволяет организму сохранить жизнь
9. Причинно-следственные связи и «порочные круги» в патогенезе болезни.
Каждый патологический процесс, заболевание рассматривается как длинная цепь причинно-следственных отношений, которая распространяется по типу цепной реакции. Первичным звеномв этой длинной цепи является повреждение, возникающее под влиянием патогенного фактора, и которое становится причиной вторичного повреждения, вызывающего третичное и т.д. (воздействие механического фактора – травма – кровопотеря – централизация кровообращения – гипоксия – ацидоз - токсемия, септицемия и т.д.). в этой цепи выделяют основное звено (явление, которое определяет развитие процесса с характерными для него специфическими особенностями). Пример: артериальная гиперемия – в основе расширение артериол (главное звено), что обусловливает ускорение кровотока, покраснение, повышение температуры гиперемированного участка, увеличение его в объеме и повышение обмена веществ. При устранении главного звена наступает выздоровление.
Несвоевременное устранение главного звена - нарушение гомеостаза и формирование порочных кругов патогенеза. Они возникают тогда, когда появившееся отклонение уровня функционирования органа или системы начинает поддерживать и усиливать себя в результате образования положительной обратной связи. Пример: при ГБ ускоряется развитие атеросклероза, что приводит к нарушению функции барорецепторов и понижению их чувствительности к изменению АД и в результате этого АД стабильно держится на высоких цифрах. Сужение сосудов почек вызывает гипоксию и включение системы ренин-ангиотензин – спазм сосудов еще сильнее и повышается АД. Гиперсекреция альдостерона при гипоксии почек вызывает задержку натрия и гипернатриемию - раздражение осморецепторов – секреция АДГ – усиление реабсорбции воды в почечных канальцах – увеличение объема циркулирующей крови и дальнейшее нарастание АД. В цепи причинно-следственных отношений выделяют местные и общие изменения. В пат процесс, болезнь вовлекается весь организм.
Различают 4 варианта взаимосвязи местных и общих процессов в патогенезе:
Процесс начинается с местного повреждения органа или ткани в результате действия внешних или внутренних факторов, затем включаются адаптивные реакции, направленные на отграничение очага повреждения (например, воспаление– грануляционный вал, пиогенная капсула, барьерная функция лимфоузлов).
Участие общих реакций организма мобилизует локальные тканевые адаптивные механизмы, вследствие чего основные параметры гомеостаза (температура тела, количество лейкоцитов и лейкоцитарная формула, СОЭ, обмен веществ) существенно не меняются.
Местный процесс через рецепторы и поступление в кровь и лимфу БАВ вызывает развитие генерализованной реакции организма и определенные сдвиги параметров гомеостаза. Включаются приспособительные реакции, направленные на предупреждение развития общих патологических изменений в организме.
Генерализацияместного процесса при его тяжелом течении отличается максимальной напряженностью адаптивных и защитных реакций и процессов, а также выраженностью патологических явлений на уровне организма. Возникает общая интоксикация организма, сепсис. Параметры гомеостаза могут выйти за рамки совместимых с жизнью изменений.
Локальные патологические изменения органов и систем могут развиться вторично на основе первичногенерализованного процесса(ионизирующее излучение – больше поражаются ткани, характеризующиеся интенсивной пролиферацией клеток; при отравлении сулемой преимущественно поражаются почки).
При развитии любой болезни, как правило, обнаруживаются неспецифические и специфические механизмы. Неспецифические механизмы определяются включением в патогенез типовых патологических процессов, которые характеризуются закономерным, стереотипным и генетически детерминированным развертыванием во времени различных процессов: воспаления, лихорадки, изменения микроциркуляции, тромбоза и др., а также повышением проницаемости биомембран, генерацией активных форм кислорода и т.п.
Затем активируется система клеточного и гуморального иммунитета, обеспечивающая специфическую защиту и борьбу с чужеродным объектом, попавшим в организм. Однако, четкого разграничения специфических и неспецифических механизмов не существует.
Патогенное действие этиологических факторов реализуется благодаря трем механизмам патогенеза:прямого, гуморального и нейрогенного (нервно–рефлекторного). Прямое повреждающее действие оказывают физические и механические факторы, обладающие большим запасом кинетической энергии, тепловой (ожоги), химической (ожоги).
Гуморальные механизмы патогенеза опосредуются жидкими средами организма: кровью, лимфой, межклеточной жидкостью. Особая роль этому механизму принадлежит в генерализации патологии (метастазирование, сепсис и т.д.).
Нейрогенный механизм патогенеза опосредуется через нервную систему вследствие нарушения регуляторных процессов.
Единство функциональных и структурных изменений в патогенезе заболевания.
В основе любого заболевания лежит повреждение каких-либо структур живого организма, приводящее к нарушению его нормального функционирования. В роли повреждающих (альтерирующих) агентов могут выступать разнообразные экзо– и эндогенные факторы. В ряде случаев клеточно-тканевые изменения, возникающие при альтерации, достаточно очевидны (воспаление, некроз, дистрофия), однако иногда изменения, возникающие в биосистеме, минимальны и затрагивают организацию макромолекул (изменение третичной или четвертичной структуры белка, конформационные изменения в биомембранах и т. п.), что значительно затрудняет обнаружение первичного дефекта. Для врача в данном случае важна принципиальная методологическая посылка: если в организме выявляется какое-либо нарушение функции, то, несомненно, должна быть изменена и структура, ответственная за реализацию данной функции, т. е. являющаяся ее материальным (морфологическим) субстратом (единство структуры и функции).
С другой стороны, при наличии измененной структуры глубокий анализ позволяет выявить и наличие функциональных сдвигов. Это положение легко может быть проиллюстрировано на достаточно простых (модельных) системах – структура фермента и его каталитическая активность, структура рецептора и его сродство к агонисту и т. п.
Значительно сложнее проиллюстрировать это положение при переходе на уровень целого организма, поскольку здесь включается масса дублирующих, резервных, компенсаторных механизмов, позволяющих полноценно осуществлять сложную функцию (например, сохранение кровяного давления, поддержание постоянства рН и др.) при повреждении какого-либо регуляторного звена. И тем не менее, обнаружение измененной функции (симптома заболевания) является для врача ориентиром и сигналом для поиска структурной основы этой аномалии.
Термином «патогенез» обозначается механизм развития заболевания, т. е. динамичный комплекс изменений, происходящих в живой системе при воздействии на нее патогенного фактора.
Патогенез заболевания – диалектически противоречивый процесс, включающий в себя две противоположные тенденции: с одной стороны, это механизмы полома, повреждения, отклонения от нормы, а с другой – механизмы защиты, адаптации, компенсации и репарации. Борьба этих двух тенденций составляет основу и определяет направление развития болезни. Если преобладают механизмы повреждения, то имеет место прогрессирование патологического процесса, если верх берут саногенетические механизмы – начинается процесс выздоровления.
Изучение патогенеза заболеваний является главной задачей патологической физиологии.
Единство повреждения и защитно-компенсаторных реакций в патогенезе болезни. Понятие о патогенетической терапии.
При изучении патогенеза заболевания особое внимание уделяется оценке защитных механизмов, выработавшихся в процессе эволюции: барьерным образованиям, приспособительным и компенсаторным реакциям.
Барьеры –это морфологические и морфо–функциональные образования, предохраняющие организм от патогенных факторов. К ним относятся кожа, слизистые оболочки, костный покров черепа, передняя брюшная стенка, кишечник, ретикуло-эндотелиальная система – это все морфологические образования. К морфо–функциональным барьерам относятся гистогематический и гематоэнцефалический барьеры. Они представляют собой совокупность соединительнотканных элементов и капилляров, находящихся между кровью и тканями, а также между кровью, спинномозговой жидкостью и мозгом. Гистогематический барьер обеспечивает постоянство состава и физико-химических свойств тканевой жидкости, а также задерживает переход в нее из крови чужеродных веществ.
Гематоэнцефалический барьер защищает центральную нервную систему от проникновения в ликвор чужеродных веществ, введенных в кровь, или продуктов нарушенного обмена веществ. Барьерную функцию выполняют печень и буферные системы крови и тканевой жидкости. Барьеры предупреждают возникновение и развитие болезни, а при их возникновении ограничивают распространение патогенного фактора, локализуют очаг повреждения.
Защитно-компенсаторные процессы включаются при действии вредоносных факторов и представлены безусловными и условными рефлекторными реакциями. Безусловные реакции направлены на освобождение органа или ткани от контакта с патогенным фактором (кашель, чихание, моргание, спазм сосудов и др.).
При повторном контакте с вредоносным фактором развивается условно–рефлекторная реакция (учащение сердечных сокращений, подъем АД, слюнотечение, слезотечение). Действие условно–рефлекторных реакций более продолжительное.
Компенсаторные процессы возникают при длительном действии патогенного фактора и характеризуются развитием гипертрофии органа, включением резервных клеток, репаративной регенерацией (ускоренное образование эритроцитов, лейкоцитов; новообразование миофибрилл и митохондрий в кардиомиоцитах), усилением функции парного органа (почки, легкого) или органа и системы, смежных по функции (печени и мочевыделительной системы).
Механизмы выздоровления.Выздоровление – это процесс восстановления нормальной жизнедеятельности организма после болезни, восстановление нарушенных функций больного организма и приспособление его к окружающей среде. Выделяют:
а) срочные неустойчивые (аварийные) механизмы. Они представлены защитными рефлексами – например, выделением глюкокортикоидов и катехоламинов при стрессе;
б) относительно устойчивые механизмы, действующие в течение всего периода заболевания: увеличение резервных клеток – лейкоцитоз, эритроцитоз; включение регуляторных систем –устанавливается пониженная теплопродукция при повышении температуры окружающей среды;
в)продолжительно устойчивые механизмы – компенсатор–ная гипертрофия, репаративная регенерация, выработка антител, изменение пластических свойств ЦНС, охранительное торможение, выработка условных рефлексов и усиление безусловных рефлексов.
Знание механизмов патогенеза обеспечивает надежное лечение больного и профилактику заболевания. Патогенетические принципы терапии включают симптоматическую терапию, дезинтоксикационную и иммунодепрессивную терапию; лечение, направленное на повышение резистентности организма; десенсибилизацию и терапию типовых патологических процессов.
Реактивность организма, определение, виды. Формы ответной реакции организма на раздражитель (нормергия, патергия).
Реактивность – свойство целостного организма, обладающего нервной системой, дифференцированно (т.е. качественно и количественно определенным образом) реагировать изменением жизнедеятельности на воздействия факторов внешней и внутренней среды.
Реактивность бывает:а) видовая – присуща всем особям данного вида, групповая – определенной группе особей, индивидуальная – конкретному индивидуум; б) неспецифическая (первичная, простая) – проявляется при действии разнообразных факторов на организм. В ее основе генетически запрограммированные стандартные варианты ответа (например, защитно-компенсаторные реакции при действии высокой и низкой температур, при кислородном голодании; фагоцитоз и др.), специфическая – иммунологическая реактивность – способность организма отвечать на действие антигенов образованием антител комплексом клеточных реакций, специфических по отношению к данному антигену. в) физиологическая – охватывает реакции здорового организма, патологическая – качественно измененная реактивность при действии патогенных факторов на организм (например, аллергия – иммунная реакция организма, которая сопровождается повреждением собственных тканей). г) повышенная (гиперергия), пониженная (гипоергия), извращенная (дизергия).
Следует различать нормальную реактивность организма (когда реакция адекватна раздражителю) и патологически измененную реактивность (например, формирование повышенной чувствительности к аллергену при сенсибилизации).
Номергическаяреактивность выражается количественно и качественно адекватной реакцией на воздействие какого либо агента.
Патергия- болезненное повышение чувствительности организма, при котором подпороговые для нормального организма раздражения могут вызывать реакции в патергичном организме; понятие более широкое, чем понятие аллергии.
Роль реактивности организма в патологии. Резистентность организма, определение, виды.
Реактивность – свойство организма и его структур отвечать изменениями жизнедеятельности на действие факторов внешней среды. Реактивность обеспечивает взаимодействие организма с окружающим миром. Она существенно влияет на развитие и течение болезни.
Реактивность является интегральной характеристикой целого организма, определяющей возможность и характер развития заболевания и претерпевающей изменения в процессе болезни.
Выделяют несколько форм реактивности: 1) возрастную (отражает особенности реакции в различные возрастные периоды); 2) половую (отражает различия в реакции на воздействие на мужчин и женщин); 3) иммунологическую (отражает особенности реакции иммунной системы на антигенное воздействие); 4) групповую (например, предрасположенность к заболеваниям лиц с определенными группами крови); 5) индивидуальную и др.
Можно говорить о местной (локальной) реактивности (например, особенности метаболизма канцерогена в определенной ткани) и общей реактивности, определяющей целостную реакцию организма на воздействие.
Следует различать нормальную реактивность организма (когда реакция адекватна раздражителю) и патологически измененную реактивность (например, формирование повышенной чувствительности к аллергену при сенсибилизации).
Резистентность– устойчивость организма к воздействию патогенных факторов. Р. Бывает пассивной и активной, неспецифической и специфической (иммунитет). В основе специфической резистентности лежит иммунологическая реактивность (способность организма отвечать на действие антигенов образованием антител комплексом клеточных реакций, специфических по отношению к данному антигену).Пассивная резистентность– нечувствительность к действию патогенного фактора, невосприимчивость к нему. Возникает в том случае, когда взаимодействие организма с патогенным фактором невозможно или затруднено. Она является энергозависимой и может быть обусловлена следующими механизмами: 1) существование преград для взаимодействия патогенного фактора со структурами организма (биологические барьеры); 2) отсутствие или разрушение структур организма, способных взаимодействовать с патогенным фактором, например отсутствие рецепторов к патогенным вирусам; 3) уничтожение патогенного фактора механизмами, не связанными с реакцией организма на действие этого фактора (уничтожение холерного вибриона желудочным соком); 4) замедление реализации патогенетических механизмов, запускаемых взаимодействием организма с патогенным фактором (увеличение пассивной резистентности при гипотермии).
Активная резистентность (сопротивляемость) – устойчивость, которая обеспечивается комплексом защитно-компенсаторых реакций, направленных на уничтожение патогенного фактора и последствий его действия. Энергозависима, ее основу составляют механизмы реактивности (фагоцитоз, синтез антител, реакции клеточного иммунитета).
Неспецифическая резистентностьобеспечивается барьерными системами, защитными белками (интерфероны, пропердин, комплемент, лизоцим, Р-лизины), фагоцитирующими клетками, интегральными сосудисто-тканевыми реакциями (воспаление), системными нейрогуморальными механизмами (общий адаптационный синдром). Системной неспецифической защитной реакцией является лихорадка. Иммунитет как способ специфической защиты внутренней среды организма от веществ и агентов, несущих признаки чужеродной генетической информации, реализуется за счет гуморальных механизмов (выработки защитных антител) и при участии специализированных клеток (Т-лимфоцитов).
Роль возраста в патологии. Старение организма, патология старческого возраста.
Каждому возрасту свойственны свои болезни. Дети раннего возраста – чаще заболевания дыхательного аппарата, болезни пищеварительной системы и расстройства питания. У детей грудного возраста ребра расположены в горизонтальном направлении, грудная клетка не уплощена спереди назад =» тип дыхания диафрагмальный. Слизистая кишечника тонкая мускулатура слабо развита. Нервная регуляция деятельности указанных систем в раннем возрасте еще на совершенна. У детей первого года жизни часто отмечаются болезни пищеварительных и дыхательных органов, непосредственной или косвенной причиной смерти являются поражения дыхательной системы. Многие инфекции: корь, коклюш, дифтерия, скарлатина свойственны преимущественно детскому возрасту. Туберкулез редко встречается у детей, чаще у подростков и в юношеском возрасте. Многие болезни могут возникать в любом возрасте, но в старости наибольшее распространение имеют три недуга: атеросклероз, злокачественные новообразования и СД. В течение жизни организм подвергается необратимому старческому изменению.
Старение – биологический разрушительный процесс, который неминуемо развивается с возрастом и ведет к ограничению адаптационных способностей организма, развитию возрастной патологии и увеличению вероятности смерти.
Признаки старения проявляются на всех уровнях организации живого организма: на молекулярном, на уровне клеток и тканей, органов и систем и на уровне целостного организма. Изменения, возникающие на уровне целостного организма, выражаются в изменениях формы, величины тела и отдельных его частей.
К старости болезни накапливаются, вновь возникают, приобретают качественные и количественные особенности течения и, вследствие снижения приспособительных возможностей организма, становятся причиной его гибели. Старение способствует развитию многих болезней, которые в конечном итоге приводят к смерти. К таким болезням, в частности, относятся атеросклероз, ишемическая болезнь сердца, гипертоническаяболезнь, сахарный диабет, злокачественные опухоли, паркинсонизм.
С другой стороны, старение, способствуя развитию одних болезней, затрудняет развитие других. Так, благодаря возрастным изменениям реактивности организма пожилые и старые люди реже болеют ревматизмом, язвенной болезнью, бронхиальной астмой, гипертиреозом. Некоторые ученые считают, что если до 70-летнего возраста нет бурного развития атеросклероза, то в дальнейшем этот процесс резко не прогрессирует.
Для старения характерно ограничение общих компенсаторных возможностей организма.
Конституция организма, определение. Классификация конституционных типов человека. Роль конституции в патологии.
Конституция – это комплекс морфологических, функциональных и психических особенностей организма, достаточно устойчивых, определяющих его реактивность и сложившихся на наследственной основе под влиянием факторов внешней среды.
Классификация
Гиппократа. В
зависимости от особенностей темперамента
человека и его поведения в обществе
выделяют сангвиников,
холериков, флегматиков и меланхоликов.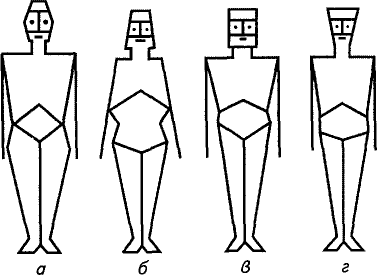
Классификация конституциональных типов по Сиго: а — дыхательный; 6 — пищеварительный; в — мышечный; г — мозговой
Классификация Сиго. В ее основе лежит принцип преимущественного развития той или иной физиологической системы. Различают следующие типы: дыхательный (респираторный), пищеварительный(дигестивный), мышечный и мозговой (церебральный).
Классификация Кречмера. Связывает морфологические особенности человека с особенностями его психики и с частотой определенных психических заболеваний. Выделяют атлетический, пикнический и астенический типы конституции.
Классификация М.В.Черноруцкого. С точки зрения основных функций и обмена веществ людей разделяют на нормостеников, гипо-стеников и гиперстеников.
Классификация А.А.Богомолъца. Основана на особенностях строения и функции соединительной ткани в организме. Различают фиброзный, липоматозный, пастозный и астенический типы конституции. Для фиброзного типа характерна плотная волокнистая соединительная ткань. Для липоматозного — обильное развитие жировой ткани, для пастозного — преобладание отечной, рыхлой соединительной ткани, а для астенического — нежной, тонкой мезенхимы.
Классификация И.П.Павлова. В зависимости от соотношения первой и второй сигнальных систем высшей нервной деятельности человека выделяют два типа: художественный (преобладает первая система) и мыслительный (преобладает вторая).
Роль конституции в патологии: Конституция определяет индивидуальную реактивность организма, его адаптационные особенности, своеобразие течения физиологических и патологических процессов, патологическое предрасположение.
Экстремальные состояния (коллапс, шок, кома), характеристика. Принципы патогенетической терапии.
Экстремальные состояния характеризуются, как правило, динамичным стадийным развитием. Пример: при коллапсе, шоке или коме наблюдается перераспределение кровотока. Большое количество крови скапливается в расширенных венозных и артериальных сосудах брюшной полости, лёгких, подкожной клетчатки. Это значительно уменьшает объем циркулирующей крови и, следовательно, приток крови к сердцу. Обусловленное этим снижение сердечного выброса крови приводит к еще большему уменьшению ОЦК и усугублению состояния пациента.
Коллапс– общее, остро развивающееся состояние, возникающие в результате значительного несоответствия ОЦК ёмкости сосудистого русла. Характеризуется недостаточностью кровообращения, первично циркуляторной гипоксией, расстройством функций тканей, органов и их систем.Этиология: непосредственная причина – быстро развивающееся значительное превышение ёмкости сосудистого русла по сравнению с ОЦК.Виды: кардиогенный, гиповолемический, вазодилационный, постгемаррогический, инфекционный, токсический, радиационный, панкреатический, ортостатический и др.Общий патогенез и проявления коллапса: нарушение функции ССС – инициальное и главное патогенетическое звено коллапса, характеризуется неадекватностью кровоснабжения тканей и органов; расстройство функций НС, имеет важную патогенетическую значимость, сопровождается – заторможенностью, апатией, тремором рук, иногда судорогами, обмороком; нарушение газообменной функции лёгких – частое поверхностное дыхание, гипоксемия; расстройство секреторной функции почек – олигурия, гиперстенурия; расстройства системы крови и гомеостаза – гиповолемия, повышение вязкости крови, образование тромбов. Многие перечисленные проявления обусловлены развитием гипоксии, при нарастании тяжести которой могут развиваться значительные расстройства жизнедеятельности организма, чревато смертью.Патогенетическая терапия: достигается путем устранения или снижения степени последствий несоответствия емкости сосудистого русла и ОЦК. С этой целью пациентам вливают препараты крови, крове – или плазмозаменители, буферные растворы; вводят ЛС, повышающие тонус стенок резистивных и емкостных сосудов, активирующие функцию сердца и дыхательного центра; проводят оксигенотерапию путем вдыхания газовых смесей с высоким парциальным содержанием кислорода; при наличии признаков надпочечниковой недостаточности используют кортикостероиды.
Шок– общее, крайне тяжелое состояние организма, возникающее под действием сверхсильных экстремальных факторов. Характеризуется стадийным прогрессирующим расстройством жизнедеятельности организма в результате нарастающего нарушения функций нервной, эндокринной, сердечнососудистой и других жизненно важных систем.Этиология: важная отличительная черта шока – вызывает экстремальный фактор большей силы, как правило, приводящий к различного масштаба нарушениям структурных элементов тканей и органов.Виды: критерий к дифференцировке – причина – травматический (раневой), ожоговый, посттрансфузионный, аллергический, электрический, кардиогенный, токсический, психогенный. В практической медицине шоковые состояния делят в зависимости от тяжести их течения: шок 1 степени (легкий), шок 11 степени (средней тяжести), 111 степени (тяжелый).Общий патогенез: сначала наблюдается активация специфических и неспецифических адаптивных реакций – адаптивная, компенсаторная, непрогрессирующая, ранняя стадия. Если процессы адаптации недостаточны, развивается вторая стадия шока – стадия дезадаптации или декомпенсации. На этой стадии выделяют 2 подстадии: прогрессирующая (заключается в истощении компенсаторных реакций и гиперфузии тканей) и необратимую (в ходе ее развиваются изменения, не совместимые с жизнью). Эффективность лечения шоковых состояний во многом определяется интервалом времени, через который оно начато после воздействия причинного агента: чем этот интервал короче, тем успешнее лечение и благополучнее прогноз.Патогенетическая терапия: 1) устранение кровотечения и кровоизлияний; 2) восстановление нарушенных дыхания и кровообращения; 3) снижение расстройств водно-электролитного обмена; 4) проведение иммобилизации костей и переломов; 5) щадящая транспортировка пострадавшего; 6) устранение боли; 7) снижение гиперактивности симпатической и парасимпатической активности путем назначения α-адреноюлокаторов, препаратов холинэстеразы; 8) ослабление гипоксии (дыхательной, кровяной, циркуляторной, тканевой) путем применения оксигенбаротерапии, антигипоксантов (лития окисбутират); 9) переливание крови, различных противошоковых солевых, пептидных плазмозаменяющих растворов.
Кома – тяжелое и опасное для жизни состояние организма, характеризующееся глубоким угнетением ЦНС, проявляющимся потерей сознания, отсутствием рефлекторных реакций на различные внешние раздражители, в том числе и болевые, расстройством жизненно важных функций (дыхания, кровообращения, выделения и др.) и обмена веществ.Этиология: может развиваться в результате либо прямого (первичного) поражения ЦНС (кровоизлияния в мозг или механического, электрического, токсического, инфекционного и опухолевого повреждения мозга), либо опосредованного (вторичного) токсико-инфекционного повреждения головного мозга как следствие первичного токсико-инфекционного процесса в других органах и тканях организма.Виды: при постепенном развитии комы выделяют прекому и 4 степени тяжести коматозного состояния: Прекома: расстройства сознания – спутанность, заторможенность, сонливость, реже психомоторное возбуждение; рефлексы сохранены, хотя координация движений и вегетативные функции изменены. Кома 1 степени: оглушенность сознания, торможение реакции на раздражители, контакт с больными затруднен, мышечный тонус повышен. Кома 2 степени: больной в глубоком сне, контакт с ним невозможен, реакции на раздражители резко ослаблены, проявляются патологические типы дыхания, возможны непроизвольные мочеиспускание и дефекация. Кома 3 степени: сознание отсутствует, большинство рефлексов угнетено, отмечаются патологические типы дыхания; мочеиспускание и дефекация непроизвольны, АД снижено, температура тела понижена. Кома 4 степени: полная арефлексия, атония мышц, гипотермия, глубокое нарушение функций продолговатого мозга с прекращением спонтанного дыхания, резким снижением АД.Патогенез: развитие комы связано с метаболическим и структурными нарушениями в ЦНС, соотношение которых при различных видах комы различно. Структурные изменения ЦНС возникают первично при травме и воспалениях ГМ, опухолях, нарушениях мозгового кровообращения и вторично при метаболических расстройствах (недостаточное энергетическое и пластическое обеспечение функций нервных клеток за счет дефицита или нарушений усвоения глюкозы и других веществ, развития гипоксии), вызванных отравлениями, эндокринными и внутренними заболеваниями. Важное значение имеют расстройство водно-электролитного гомеостаза нейронов и функции их мембран с нарушением медиаторных процессов в синапсах ЦНС.Патогенетическая терапия: Необходимо сочетание искусственного замещения функций жизненно важных органов и этиопатогенетической терапии. Основная задача лечения - поддержание оптимального транспорта кислорода, в связи с чем очень опасны даже кратковременные эпизоды гипоксии и артериальной гипотензии. Должны быть приняты все меры, обеспечивающие свободную проходимость дыхательных путей. При I и II стадии для этой цели можно использовать воздуховод, при III и IV - интубацию трахеи или трахеостомию. При гиповентиляции или гипервентиляционном синдроме, который чаще встречается у больных с черепно-мозговой травмой, показана искусственная вентиляция легких. Во время искусственной вентиляции очень важен контроль не только PaO2, но и PaCO2. Принимают меры для нормализации температуры тела, а при показаниях прибегают к гипотермии. Для лечения и динамического контроля биохимических параметров выполняют катетеризацию центральной вены. Необходимы тщательный уход за больным (опасность образования пролежней), антибактериальная терапия, парентеральное и энтеральное зондовое питание.
Периоды умирания организма (преагония, агония, клиническая смерть, биологическая смерть). Патофизиологические и деонтологические основы реанимации.
Преагония- первое терминальное состояние - характеризуется различной продолжительностью (часы, сутки), в этот период наблюдается одышка, снижение артериального давления (верхнее давление - 60 мм.рт.ст., тахикардия, наблюдается затемнение сознания). Преагональное состояние продолжается не более суток и при отсутствии адекватной помощи переходит в агонию.
Агония - постепенное выключение всех физиологических функций при крайнем напряжении защитных механизмов, которые утрачивают свою целесообразность - например, судороги (следствие безудержного распространения возбуждения), терминальное дыхание (как проявление повышенной возбудимости дыхательного центра). Продолжительность агонии-2-4 мин.
Клиническая смерть– состояние, когда работа основных систем жизнеобеспечения – кровообращения и внешнего дыхания прекращена, но сохраняется определенный (минимальный) уровень обмена веществ в тканях. Необходимо помнить. Что на этом этапе жизнь можно восстановить. Именно поэтому необходимо, чтобы каждый медицинский работник мог надежно диагностировать эту стадию.
Биологическая смерть– стадия необратимых изменений в организме.
Основы реанимации: мероприятия направлены на восстановление дыхания и кровообращения: массаж сердца, искусственное дыхание. Поскольку, в терминальном периоде нередко наблюдается фибрилляция сердца, когда вследствие беспорядочного асинхронного сокращения отдельных мышечных групп, полноценная систола невозможна. В таких случаях применяют дефибрилляцию: на грудную клетку подается напряжение до 6 Кв продолжительностью 10мс. Такой единичный разряд устраняет фибрилляцию и способствует восстановлению кровообращения.
Патогенное действие на организм низких температур (гипотермия, отморожение, простудные заболевания).
Действие низких температур может быть местным (отморожения) и общим (переохлаждение организма, гипотермия, простуда).
Гипотермия - охлаждение организма общее, переохлаждение организма) нарушение теплового баланса, сопровождающееся снижением температуры тела ниже нормальных значений. Скорость и степень развития зависит от состояния организма и внешних условий. При продолжительном действии холода общая гипотермия может развиться, когда температура окр воздушной среды на 10-150ниже температуры тела. Биологический «0» для человека развивается 23-250С. Это такая температура тела, при которой активность ферментов и обмен веществ соответствуют нулевому значению, но восстановление жизненных функций возможно. При понижении температуры тела до +20-+170С обычно развивается смерть. Физическая гипотермия развивается в 2 фазы: компенсации и декомпенсации.Компенсациятемпература тела не снижается, а поддерживается на нормальном уровне благодаря включению механизмов физической терморегуляции, направленных на ограничение теплоотдачи – спазм сосудов кожи, подкожной клетчатки, уменьшение потоотделения, формирование «гусиной кожи». При более интенсивном и продолжительном действии холода активизируются механизмы химической терморегуляции, направленные на увеличение теплопродукции – активизация дрожательного (мышечная дрожь) и недрожательноготермогенеза (усиление обмена веществ, распад гликогена в печени и мышцах с развитием гипергликемии). Данный механизм способствует быстрому согреванию организма. Но длительная адаптация к холоду таким путем невозможна. Адаптация организма к холоду может проходить и в результате активации нейрогуморальных механизмов, особенно симпатического отдела автономной НС, гипофизаро-адреналовой, а также соматической НС.Декомпенсацияпротекает в 3 периода: 1) динамический (температура тела 32-340С, сознание сохранено, речь вялая, отмечается сонливость, желание присесть, хотя человек еще может двигаться, а также нарушение критической оценки своего состояния); 2) ступорозная (температура тела снижается до 29-320С, сознание угнетено дыхание и пульс замедлены; двигаться, а значит помочь себе человек уже не может); 3) судорожный (температура тела 26-29, сознание отсутствует, кожа бледная, холодная, все мышцы сокращены, отмечается тризм, дыхание поверхностное, пульс еле прощупывается, АД снижено, зрачки сужены, реакция их на свет ослаблена; это состояние обратимо).В первую фазу физической гипотермии развивается гипоксия всех тканей, особенно ЦНС. Отмечаемые в организме многие расстройства еще обратимы. Во вторую фазу физической гипотермии в организме. Наряду с приспособительными, отмечаются патологические изменения (снижение теплопродукции и увеличение теплоотдачи, уменьшение основного обмена, энергообразования и расхода энергии, уменьшение работы сердца и кровотока через органы, развитие поверхностного дыхания, снижение и исчезновение сначала корковых, затем подкорковых, потом стволовых и, наконец спинномозговых рефлексов). Принципиальные лечебные мероприятия по выведению организма из холодового наркоза заключаются в немедленном согревании тела и восстановлении, прежде всего, СС и дыхательной систем.
Отморожениевозникает в результате действии низких температур на ограниченные участки тела. Клиническая картина отморожений возникает, как правило, не сразу, а после согревания. Отморожения могут наступать в сырую погоду даже при температуре +5 -+8, а тем более – при значительных морозах. «Траншейная стопа» - особый вид отморожения. Она появлялась у солдат в холодных сырых окопах при длительной неподвижности и отсутствии горячей пищи. Гибель ткани может наступать даже тогда, когда их температура составляет +10-+12, что связано с длительным и интенсивным спазмом сосудов, нарушением трофики тканей и доставки к ним кислорода. Граница отморожения, как правило, проходит по линиям суставов.
Простудные заболеваниявозникают в результате охлаждения всего тела или его частей (особенно ног и поясницы). Является одним из важных условий возникновения так называемых простудных заболеваний (особенно воспаления ВДП и легких). Пусковой механизм простуды - рефлекторные сосудодвигательные реакции. Вначале интенсивный спазм, затем – паралитическое расширение сосудов, повышение проницаемости сосудистых, в т.ч. гематэнцефалических барьеров для микробов как в месте действия холода, так и в различных других частях тела, снижения активности мерцательного эпителия и образования слизи в слизистых воздухоносных путей. Это сопровождается снижением резистентности тканей организма к различным м/о и повреждающим факторам. В механизме простудных заболеваний определенную роль играют и аллергические реакции, которые проявляются местно в виде отека, зуда, расстройства местного и общего кровообращения, системы дыхания, иммунитета. Под влиянием холода могут возникать аллергические, в том числе и аутоиммунные реакции в организме, особенно почек или сердца. Профилактика: закаливание, ношение рациональной одежды и обуви.
Патогенное действие на организм высоких температур (гипертермия, тепловой удар, ожоги).
Гипертермия сопровождается обычно временным увеличением температуры тела в пределах +38-+40 в результате действия на него повышенной температуры окружающей среды на фоне существенного ограничения физических и/или физиологических механизмов теплоотдачи (испарения, теплопроведения, конвекции, теплоизлучения, потоотделения, вентиляции, кровообращения в тканях «оболочки» тела) и усиления процессов теплопроизводства (обусловленных усилением потребления кислорода, активацией метаболических, особенно катаболических процессов, а также активацией ССС, мышечной и дыхательной систем). В развитии гипертермии 2 стадии: Компенсации – напряжение всех механизмов теплоотдачи приводит к сохранению нормальной температуры тела; Декомпенсации – не смотря на все усилия организма, теплопродукция превышает теплоотдачу, и температура тела продолжает повышаться.
Сначала гипертермия сопровождается резким возбуждением ЦНС, усилением дыхания, кровообращения, обмена веществ. Дальнейшее прогрессирующее повышение температуры тела приводит к торможению ЦНС, нарушению и угнетению дыхания, системного и местного кровообращения, деятельности печени, пищеварительного тракта, почек. Развивается гипоксия и ацидоз всех тканей, особенно ЦНС. Обильное потоотделение приводит к обезвоживанию организма, сгущению крови, потере хлоридов. Повышается гемолиз эритроцитов, повреждаются различные ткани, что усиливает явления интоксикации организма. Нарушается свертываемость крови. На фоне нарастающей интоксикации и кислородного голодания – судороги, при температуре +42-+42 наступает смерть от остановки либо дыхания, либо сердца.
Тепловой удар сопровождается развитием резко выраженных расстройств деятельности ЦНС (потеря сознания, судороги, парезы, параличи, центрогенные рвота, нарушение дыхания и др.). В развитии теплового удара выделяют триклинические формы: 1) асфиктическую, 2) паралитическую, 3) психопатическую.
Тепловой удар чаще развивается на фоне тяжелой физической нагрузки в условиях высокой температуры (+35° - 40°) и влажности окружающей среды, а также теплоизолирующей одежды. Тепловой удар развивается внезапно или после продромальных явлений (головная боль, слабость, жажда, сухая горячая кожа, снижение потоотделения).
В начальной стадии теплового удара отмечаются головная боль, слабость, головокружение, тошнота, рвота, покраснение лица, субфебрильная температура.
В тяжелых случаях при тепловом ударе развиваются мышечная, сердечнососудистая недостаточность, гипоксия, гипоксемия, сгущение крови, повышение ее вязкости и уменьшение ее текучести; дыхательная и метаболическая недостаточность, резкое возбуждение, потеря сознания, бред, галлюцинации,клонические и тонические судороги, коллапс. Без оказания срочной медицинской помощи возможна смерть. Выздоровление обычно медленное, часто развиваются осложнения и рецидивы.
В патогенезе теплового удара важное значение имеют нарушения функций ЦНС, сердечнососудистой и дыхательной систем, тяжелые расстройства обмена веществ, особенно блокада тканевых ферментов, выраженное кислородное голодание клеток, образование и действие токсических веществ.
Ожоги вызываются горячими жидкостями, паром, пламенем, твердыми телами, вызывающими прогревание тканей, до 45-50 и более градусов по Цельсию. Патогенез, клинические проявления и последствия ожогов определяются площадью и глубиной термического повреждения тканей, обусловленного видом, длительностью и локализацией действия термоагента, особенностями иннервации и кровоснабжения повреждаемых тканей, а также состоянием регуляторных и исполнительных систем. Различные по характеру и степени повреждения тканей на локальных участках (обычно до 5 %поверхности тела) могут сопровождаться не только развитием воспаления, но и коагуляцией различных тканевых структур, приводящих к развитию соответственно коагуляционного (сухого) и колликвационного (влажного) некроза тканей. При коагуляционном некрозе граница между погибшими и жизнеспособными тканями отчетливо выражена и макроскопически и, особенно, микроскопически. При влажной некрозе эта граница неотчетливая и неровная. Со временем зона влажного некроза обычно расширяется и углубляется. При повреждении кожи диаметром до 1 см, как правило, отмечается ее восстановление первичным натяжением с полным восстановлением ее структуры, метаболизма и функции. При более обширных ожогах восстановление дефекта осуществляется с образованием либо нежного, либо грубого соединительно-тканного рубца, либо отмечается длительно сохраняющаяся трофическая язва.
Патогенное действие на организм высокого барометрического давления. Токсическое действие газов. Декомпрессионная болезнь.
Естественная гипербария – возникает при нахождении человека в барокамере.
Искусственная гипербария– проявляется компрессией тела при погружении в воду (ныряние, водолазные, кессонные работы, на флоте, особенно подводном). При погружении в воду на каждые 10м на человека действует дополнительно 1 атм.
При этом на организм человека действуют следующие патогенные факторы: 1.Собственно повышение атмосферного давления (компрессия) вызывает вдавление барабанных перепонок, в результатечего может появляться боль в ушах. При резком и очень быстром повышении атмосферного давления возможен разрыв легочных альвеол.В условиях компрессии в крови и тканях организма растворяется дополнительное количество газов (сатурация). 2.Азот оказывает патогенное действие при дыхании сжатым воздухом. Это проявляется в нарушении деятельности ЦНС: сначала легкое возбуждение, напоминающее эйфорию ("глубинный восторг"), в дальнейшем — явления наркоза и интоксикации.Указанные нарушения объясняются тем, что в результате сатурации количество азота в организме возрастает в несколько раз, причем больше всего он накапливается в органах, богатых жировой тканью, в частности, в тканях головного мозга, содержащих большое количество липидов. Азот в высоких концентрациях оказывает наркотическое действие, напоминающее действие оксида азота (I) ("веселящего газа"). Во избежание неблагоприятного действия азота этот газ в дыхательной смеси заменяют гелием. Получают смесь гелиокс. 3.Кислород при повышении атмосферного давления обладает токсическим действием. Это связано в первую очередь с тем, что в условиях гипероксии активируются процессы свбоднорадикального окисления, вызывающие повреждение клеток.Кроме того, как считают, при гипероксии нарушается выведение из тканей углекислого газа, что вызывает своеобразное их "удушение".
Болезнь декомпрессии возникает при быстром возвращении человека в условия нормального атмосферного давления после водолазных работ, работ в кессонах (кессонная болезнь). При этом растворенные вкрови и тканях газы (азот, кислород) в большом количестве переходят в газообразное состояние, образуя множество пузырьков, — происходит десатурация. Пузырьки газов, задерживаясь в крови и тканях, могут закупоривать кровеносные сосуды, оказывая давление на клетки,раздражая рецепторы (газовая эмболия).
Клиническая картина такой болезни определяется локализацией газовых пузырьков. Наиболее часто отмечается боль в суставах, зуд кожи; в тяжелых случаях — нарушения зрения, паралич, потеря сознания. Во избежание подобных нарушений декомпрессию следует проводить медленно, чтобы скорость образования газов не превышала возможности легких по их выведению.
Патогенное действие на организм низкого барометрического давления (высотная гипоксия, высотная декомпрессия).
Влияние пониженного атмосферного давления человек испытывает по мере подъема на высоту: в самолете, в горах. На организм человека в этих условиях действуют следующие патогенные факторы.
Собственно уменьшение атмосферного давления. Этот фактор вызывает развитие синдрома декомпрессии, который проявляется болью в ушах и лобных пазухах в результате расширения воздуха, заполняющего их полости; метеоризмом; кровотечениями из носа вследствие разрыва мелких сосудов.
Уменьшение парциального давления кислорода во вдыхаемом воздухе является причиной развития кислородного голодания (гипоксии).
Комплекс явлений, связанных со снижением атмосферного давления, называется синдромом декомпрессии.
Высотная гипоксия- болезненное состояние, связанное с кислородным голоданием вследствие понижения парциального давления кислорода во вдыхаемом воздухе, которое возникает высоко в горах, а также при полетах на летательных аппаратах, не оснащённых герметичной кабиной (напр. парапланах, дельтапланах, воздушных шарах), начиная примерно с 2000 метров и выше.
От величины атмосферного давления, как известно, зависят некоторые физические свойства газов и жидкостей (объем и растворимость газов в жидкостях, точка кипения жидкостей). При снижении атмосферного давления газы, находящиеся внутри организма, расширяются, понижается их растворимость в жидкой среде, точка кипения крови и других жидкостей понижается до такой степени, что они могут закипеть при температуре тела. Выраженность этих явлений зависит от скорости декомпрессии и ее степени. У летчиков, совершающих полет в негерметической кабине, может возникнуть ряд симптомов, связанных с декомпрессией, — расширение воздуха в кишках (высотный метеоризм), боль в ушах и лобных пазухах в результате расширения воздуха, заполняющего эти полости, кровотечение из носа из-за разрыва мелких сосудов. На высоту 19 000 м нельзя подниматься без надежно герметизированной кабины, так как именно на этой высоте жидкость закипает при температуре тела.
При быстром перепаде атмосферного давления развивается синдром взрывной декомпрессии. В его развитии имеет значение баротравма легких, сердца и крупных сосудов вследствие резкого повышения внутрилегочного давления. Разрыв альвеол и сосудов легкого приводит к проникновению газовых пузырьков в кровеносную систему (газовая эмболия). В случае разгерметизации космического корабля или высотного самолета происходит мгновенная смерть вследствие закипания крови и других жидкостей организма, а также в результате молниеносной формы гипоксии.
Патогенное действие на организм ионизирующей радиации. Лучевая болезнь.
Действие ионизирующей радиации может быть местным (лучевые ожоги, некрозы, катаракты) и общим (лучевая болезнь).
Местное действие ионизирующей радиации(переоблучение тканей при лучевой терапии, попадании на кожу радиоактивных изотопов) чаще проявляется в виде лучевых ожогов. Мягкое рентгеновское и β-излучение, проникающее в ткани на незначительную глубину, вызывают ожоги кожи. высокоэнергетическое тормозное γ-изучение и нейтроны, обладающие большей проникающей способностью, могут поражать глубоко лежащие ткани. Течение лучевых ожогов характеризуется развитием последовательно сменяющихся периодов (ранняя лучевая реакция, скрытое, острое воспаление, восстановление), длительность и выраженность которых зависят от тяжести поражения (Iстепени – 8-12 Гр – легкие;IIстепени – 12-20 Гр – средней тяжести;IIIстепени – более 20 Гр - тяжелые). При облучении дозами более 20 Гр погибает не только кожа, но и подкожная клетчатка, фасции, мышцы и даже кости. У больных развиваются лихорадка, высокий лейкоцитоз, тяжелый болевой синдром.
Лучевая болезнь. При внешнем равномерном облучении организма в зависимости от дозы ионизирующей радиации возникают поражения от едва уловимых реакций со стороны отдельных систем до острых форм лучевой болезни. При облучении в дозах 1-10 Гр развивается типичная форма острой лучевой болезни при которой наиболее четко проявляются основные патогенетические закономерности клинического формирования ее отдельных периодов, имеет место преимущественно поражение костного мозга костно-мозговой синдром). В диапазоне доз 10-20Гр возникает кишечная, при дозах 20-80 Гр токсемическая (сосудистая) и при дозах выше 80 Гр – церебральная форма лучевой болезни.
Типичная форма лучевой болезниделится на 4 группы: легкой степени – 1-2Гр, средней степени – 2-4 Гр, тяжелой степени – 4-6 Гр, крайне тяжелой степени – свыше 6 Гр.В ее течение выделяют 4 фазы:1) Фаза первичной острой реакции– в зависимости от дозы в первые минуты или часы после облучения: некоторое возбуждение, головная боль, общая слабость, затем - диспепсические расстройства (рвота, тошнота, потеря аппетита), со стороны крови - кратковременный нейтрофильный лейкоцитоз со сдвигом влево, абсолютнаялимфопения. Продолжительность фазы первичной острой реакции 1-3 дня.2) Фаза мнимого клинического благополучия– включение в патологический процесс защитных механизмов организма. Самочувствие больных становится удовлетворительным, проходят клинически видимые признаки болезни. Длительной скрытой фазы зависит от дозы облучения и колеблется от 10-15 дней до 4-5 недель. В это время нарастает поражение системы крови: в периферической крови прогрессирует лимфопения на фоне лейкопени, снижается содержание ретикулоцитов и тромбоцитов. В костном мозге развивается опустошение (аплазия). Могут наблюдаться развитие изменений в тонком кишечнике, коже. Неврологическая симптоматика постепенно сглаживается.3) Фаза разгара болезни– самочувствие больных вновь резко ухудшается, нарастает слабость, повышается температура тела, появляются кровоточивость и кровоизлияния в кожу слизистые оболочки, ЖКТ, мозг, сердце и легкие. В результате диспепсии – резко снижается масса тела. Развивается глубокая лейкопения, тромбоцитопения анемия, увеличивается СОЭ. Угнетается иммунитет, в результате чего развиваются инфекционные осложнения, аутоинфекция и аутоинтоксикация. Продолжительность - от нескольких дней до 2-3 недель. Без лечения – смерть.4) Фаза восстановления– постепенная нормализация нарушенных функций. Улучшение общего состояния больных. Снижается до нормы температура тела, исчезают геморрагические и диспепсические проявления. Со 2-5-го мес нормализуется функция потовых и сальных желез, возобновляется рост волос. происходит постепенное восстановление показателей крови и обмена веществ. Длительность – 3-4 месяца, в случаях тяжелого лучевого поражения 1-3 года, при этом возможен переход в хроническую форму.
Кишечная форма острой лучевой болезниу человека проявляется при облучении в дозах 10-20Гр смерть чаще наступает на 7-10 сутки. Основные признаки: тошнота, рвота, кровавый понос, повышение температуры тела, может наблюдаться полная паралитическая непроходимость кишечника и вздутие живота. Развивается геморрагия и глубокая лейкопения с полным отсутствием лимфоцитов в периферической крови, а также картина сепсиса. Причина смерти: дегидратация организма, сопровождающаяся потерей электролитов и белка, развитие необратимого шока, связанного с действием токсических веществ микробного и тканевого происхождения.
Токсемическая формахарактеризуется выраженными гемодинамическими нарушениями главным образом в кишечнике и печени, парезом сосудов, тахикардией, кровоизлияниями, тяжелой интоксикацией и менингеальными симптомами (отек мозга). Наблюдается олигурия и гиперазотемия вследствие поражения почек. Смерть наступает на 4-7 сутки.
Церебральная форма острой лучевой болезни облучение выше 80 Гр. Смерть через 1-3 после облучения. Развивается судорожно-паралитический синдром, нарушение крово- и лимфообращения в ЦНС, сосудистого тонуса и терморегуляции. Позже – функциональное нарушение пищеварительной системы, мочевыделительной, прогрессирующее понижение кровяного давления. Причина смерти – тяжелые и необратимые поражения ЦНС, которые характеризуются гибелью клеток коры ГМ и нейронов ядер гипоталамуса. При облучении в дозах превышающих 100 Гр происходят расстройств регуляции высшей нервной деятельности, кровообращения, дыхания.
Хроническая лучевая болезнь. При длительном облучении организма в малых, но превышающих допустимые дозах. Выделяют два основных варианта болезни: обусловленной внешним общим или местным облучением, а также в результате поступления в организм равномерно и неравномерно распределяющихся радиоактивных нуклидов. Заболевание отличается постепенным развитием и длительным волнообразным течением. Начальный период заболевания характеризуется развитием нестойкой лейкопении, вегето-сосудистой неустойчивостью. Развёрнутому периоду заболевания свойственна недостаточность физиологической регенерации наиболее радиочувствительных тканей в сочетании с функциональными изменениями в деятельности НС и ССС. Период восстановления характеризуется сглаживанием деструктивных и отчетливым преобладанием репаративных процессов в наиболее радиопоражаемых тканях. По тяжести ХЛБ, обусловленную общим облучением, подразделяют на 3 группы: легкой – нерезко выраженные нервно-регуляторные нарушения в деятельности различных органов и систем, умеренная нестойкая лейкопения и тромбоцитопения, средней – присоединяются функциональные нарушения нервной, СС и пищеварительной систем, прогрессируют лейкопения и лимфопения, количество тромбоцитов уменьшается; в костном мозге – явление гипоплазии кроветворения и тяжелой степени – анемия, явления выраженной гипоплазии кроветворения, атрофические процессы в слизистой ЖКТ, присоединяются инфекционно-септические осложнения, геморрагически синдром и нарушения кровообращения. Клиническую картину ХЛБ, обусловленной внутренним облучением, формирует поражение одного или нескольких критических органов, в которых депонируются поступившие в организм радиоактивные нуклиды.
Отдаленные последствия действия радиации могут развиваться как после общего, так и после местного облучения организма спустя ряд лет и носят неопухолевый (сокращение продолжительности жизни, гипопластические состояния в кроветворной ткани слизистых органов пищеварения, дыхательных путей, в коже и других органах; склеротические процессы (цирроз печени, нефросклероз, атеросклероз, лучевые катаракты), а также дисгормональные состояния – ожирение, несахарное мочеизнурение) или опухолевый характер (радиационные лейкозы, опухолевые процессы в критических органах).
Патогенное действие на организм электрической энергии.
Человек подвергается действию природного(молния) илитехническогоэлектричества.
Разряды молниидействуют как кратковременное (доли секунды, секунды) прохождение через тело человека тока огромного напряжения (до миллионов вольт). Смерть наступает от паралича сердца и (или) дыхания. В результате теплового действия молнии на теле остаются ожоги, кровоизлияния в виде особых ветвистых фигур, почернение и некроз тканей; возможно и механическое действие – отрыв тканей и даже частей тела.
Повреждающее действие электрического токаопределяют следующие факторы: 1) Физические параметры электрического тока: переменный или постоянный (при напряжении выше 500В и более опасен постоянный ток), частота переменного тока (наиболее опасен ток городской сети – 50Гц), напряжение и сила электрического тока. Существует прямая зависимость между напряжением и силой тока, с одной стороны, и повреждающим его действием, с другой. 2) Путь прохождения электрического тока в организме. Самым опасным является прохождение электрического тока через сердце и головной мозг. В этих случаях может наступить смерть в результате фибрилляции сердца или центральной остановки дыхания. 3) Физиологическое состояние организма. Имеют значение: а) состояние кожных покровов (при увлажнении или повреждении кожи степень поражения током увеличивается); б) общее состояние (повреждающее действие тока возрастает при перегревании, охлаждении, кровопотере и др.); в) адаптация к электрическому току (люди, работающие с током, менее чувствительны к его действию).
Механизмы повреждающего действия электрического тока. Электротравма может вызвать местные (знаки тока, ожоги) и общие изменения в организме. 1)Местные реакции организма на электротравму. Знаки тока, ожоги появляются на местах входа тока в результате превращения электрической энергии в тепловую.Знаки токапоявляются на коже, если температура в точке прохождения тока не больше 1200С – небольшие образования серовато-белого цвета, твердой консистенции, окаймленные волнообразным возвышением. Иногда – по окружности поврежденной ткани выступает красный ветвистый рисунок - паралич кровеносных сосудов. Ожоги появляются при температуре в точке прохождения тока свыше 1200С. Контактные - от выделения тепла при прохождении тока через ткани, оказывающие сопротивление, термические - при воздействии пламени вольтовой дуги – наиболее опасны. 2)Общие реакции организма на электротравму. При прохождении через тело ток вызывает возбуждение нервных рецепторов и проводников, скелетной и гладкой мускулатуры, железистых тканей -» топические судороги скелетных и гладких мышц, что может сопровождаться отрыванием, переломом и вывихом конечностей спазмом голосовых связок, остановкой дыхания, повышением кровяного давления, непроизвольным мочеиспусканием и дефекацией. Возбуждение НС и органов внутренней секреции приводит к выбросу катехоламинов (адреналин, норадреналин), изменяются многие соматические и висцеральные функции организма.
Непосредственной причиной смерти при электротравме являются: 1) остановка дыхания, которая может быть обусловлена: поражением дыхательного центра; спазмом позвоночных артерий, снабжающих кровью дыхательный центр; спазмом дыхательной мускулатуры; нарушением проходимости дыхательных путей вследствие ларингоспазма; 2) остановка сердца, которая может возникнуть вследствие: фибрилляции желудочков; спазма коронарных сосудов; поражения сосудодвигательного центра; повышения тонуса блуждающего нерва.
Гипоксия, определение понятия. Классификация гипоксических состояний.
Гипоксия - типовой патологический процесс, развивающийся в результате недостаточности биологического окисления, приводящий к нарушению энергетического обеспечения функций и пластических процессов в организме.
Этиологическая классификация: а) гипоксическая (экзогенная), б) дыхательная (респираторная), в) сердечно-сосудистая (циркуляторная), г) кровяная (гемическая), д) тканевая (гистотоксическая) гипоксия.
В качестве основных признаков той или иной выраженности (тяжести) гипоксии используют следующие: степень нарушения нервно-психической деятельности; выраженность расстройств функций ССС и дыхательной систем; величину отклонений показателей газового состава и КЩР крови, а также некоторых других показателей.
По темпам развития и длительности: а) молниеносная - гипоксия развивается в течение нескольких секунд. Как правило, через несколько десятков секунд (в пределах первой минуты) после действия причины гипоксии выявляется тяжёлое состояние пациента, нередко служащее причиной его смерти [(например, при разгерметизации летательных аппаратов на большой (более 9000—И 000 м) высоте или в результате быстрой потери большого количества крови (например, при ранениях крупных артериальных сосудов или разрыве аневризмы их стенки)], б) острая - развивается через несколько минут (как правило, в пределах первого часа) после воздействия причины гипоксии (например, в результатеострой кровопотери или острой дыхательной недостаточности), в) подострая - формируется в течение нескольких часов (но в пределах первых суток). Примерами такой разновидности могут быть гипоксические состояния, развивающиеся в результате попадания в организм метгемоглобинообразователей (нитратов, окислов азота, бензола), венозной кровопотери, медленно нарастающей дыхательной или сердечной недостаточности, г) хроническая - развивается и/или длится более чем несколько суток (недели, месяцы, годы), например, при хронической анемии, сердечной илидыхательной недостаточности..
В зависимости от распространенности процесса: а) общая и б) местная.
Этиология и патогенез основных типов гипоксий. Терапия гипоксических состояний.
Гипоксия – типовой патологический процесс, возникающий в результате недостаточности биологического окисления и обусловленной ею энергетической необеспеченности жизненных процессов.
Гипоксическая гипоксия(снижается парциальное давление кислорода во вдыхаемом воздухе; напряжение и содержание кислорода в артериальной крови; возникает гипокапния - пониженное парциальное давление (и содержание) СО₂в артериальной крови, сменяющаяся гиперкапнией): 1)Гипобарическая г.возникает при понижении парциального давления кислорода во вдыхаемом воздухе, в условиях разреженной атмосферы. Имеет место при подъеме в горы (горная б-нь) или при полетах на летательных аппаратах (высотная б-нь, болезнь летчиков). Факторы, вызывающие пат сдвиги: понижение парциального давления кислорода во вдыхаемом воздухе (гипоксия); понижение атмосферного давления (декомпрессия). 2)Нормобарическая г.развивается в тех случаях, когда общее барометрическое давление нормально, но парциальное давление кислорода во вдыхаемом воздухе понижено. Встречается г.о. в производственных условиях (шахты, подводные лодки, при нахождении в помещениях малого объема при большой скученности людей).
Гипероксическая гипоксия(в результате увеличения парциального давления кислорода во вдыхаемом воздухе увеличивается его воздушно-венозный градиент, но снижается скорость транспорта кислорода артериальной кровью и скорость потребления кислорода тканями, накапливаются недоокисленные продукты, возникает ацидоз): 1)Гипербарическая г. возникает в условиях избытка кислорода. «Лишний» кислород не потребляется в энергетических и пластических целях; угнетает процессы биологического окисления; подавляет тканевое дыхание является источником свободных радикалов, стимулирующих перикисное окисление липидов, вызывает накопление токсических продуктов, а также вызывает повреждение легочного эпителия, спадение альвеол, снижение потребления кислорода, и в конечном счете нарушается обмен веществ, возникают судороги, коматозное состояние. 2)Нормобарическая г. Развивается как осложнение при кислородной терапии, когда длительно используются высокие концентрации кислорода, особенно у пожилых людей, у которых с возрастом падает активность антиоксидантной системы.
Дыхательная гипоксия развивается в результате недостаточности газообмена в легких в связи с альвеолярной гиповентиляцией, нарушением вентиляционно-перфузионных отношений, затруднением диффузии кислорода (болезни легких, трахеи, бронхов, нарушении функции дыхательного центра; пневмо-, гидро-, гематоракс, воспаление, энфизема, каркоидоз легких; механические препятствия для поступления воздуха; локальное запустевание сосудов легких, врожденные пороки сердца). В результате нарушения газообмена в легких снижается напряжение кислорода в артериальной крови, возникает артериальная гипоксемия, в большинстве случаев в связи с ухудшением альвеолярной вентиляции, сочетающейся с гиперкапнией.
Циркуляторная гипоксиявозникает при нарушениях кровообращения, приводящих к недостаточному кровоснабжению органов и тканей. Важнейший показатель и патогенетическая основа ее развития – уменьшение минутного объема крови. Причины: расстройства сердечной деятельности (инфарки, кардиосклероз, перегрузка сердца, нарушения электролитного баланса, нейрогуморальной регуляции функции сердца, тампонада сердца; гиповолемия (массовая кровопотеря, уменьшение притока венозной крови к сердцу). Снижается скорость транспорта кислорода артериальной, капиллярной кровью при нормальном и сниженном содержании в артериальной крови кислорода, снижение этих показателей в венозной крови, высокая артериовенозная разница по кислороду.
Кровяная гипоксияразвивается при уменьшении кислородной емкости крови. Причины: анемия, гидремия; нарушение способности гемоглобина связывать, транспортировать и отдавать тканям кислород при качественных изменениях гемоглобина (образование карбокисгемоглобина, метгемоглобинобразование, генетически обусловленные аномалии Нв). Снижается содержание кислорода в артериальной и венозной крови; уменьшается артериовенозная разница по кислороду.
Тканевая гипоксия (парциальное напряжение и содержание кислорода в артериальной крови могут до известного предела оставаться нормальными, а в венозной крови значительно повышаются; уменьшается артериально-венозная разница по кислороду)Делится на: 1)первичную– состояния, при которых имеет место первичное поражение аппарата клеточного дыхания. Основные патогенетические факторы: снижение активности дыхательных ферментов, дегидрогенез (действие больших доз алкоголя, эфира), снижение синтеза дыхательных ферментов (недостаток рибофлавина, никотиновой кислоты); активация перекисного окисления липидов, ведущая к дестабилизации, декомпозиции мембран митохондрий и лизосом (ионизирующее излучение, дефицит естественных антиоксидантов – рутина, аскорбинки); разобщение биологического окисления и фосфорилирования, при котором потребление кислорода тканями может возрастать, но значительная часть энергии рассеивается в виде тепла и, не смотря на высокую интенсивность функционирования дыхательной цепи, ресинтез макроэргических соединений не покрывает потребностей тканей, возникает относительная недостаточность биологического окисления. Ткани находятся в состоянии гипоксии. 2)вторичную – может развиваться при всех других видах гипоксий.
Субстратная гипоксияразвивается, когда при адекватной поставке кислорода к органам и тканям, нормальном состоянии мембран и ферментативных систем возникает первичный дефицит субстратов, приводящий к нарушению всех звеньев биологического окисления. В большинстве случаев такая гипоксия связана с дефицитом в клетках глюкозы, например, при расстройствах углеводного обмена (СД), а также при дефиците других субстратов (жирных кислот в миокарде), тяжелом голодании.
Перегрузочная гипоксия(образование «кислородного долга» при увеличении скорости доставки и потребления кислорода, а также скорости образования и выведения углекислоты, венозная гипоксия, гиперкапния) возникает при напряжении органа или ткани, когда функциональные резервы систем транспорта и утилизации кислорода при отсутствии в них патологических изменений оказываются недостаточными для обеспечения резко увеличенной потребности в кислороде (чрезмерная мышечная работа, перегрузка сердца).
Профилактика и лечение гипоксиизависят от вызвавшей ее причины и должны быть направлены на ееустранение или ослабление. В качестве общих мер применяют вспомогательное или искусственное дыхание, дыхание кислородом под нормальным или повышенным давлением, электроимпульсную терапию нарушений сердечной деятельности, переливание крови, фармакологические средства. В последнее время получают распространение т.н. антиоксиданты - средства, направленные на подавление свободнорадикального окисления мембранных липидов, играющего существенную роль в гипоксическом повреждении тканей, и антигипоксанты, оказывающие непосредственное благоприятное воздействие на процессы биологического окисления. Устойчивость к гипоксии может быть повышена специальными тренировками для работы в условиях высокогорья, в замкнутых помещениях и других специальных условиях.
Экстренные и долговременные механизмы адаптации при гипоксии.
Адаптивные реакции при гипоксии делятся на: экстренные и долговременные.
Экстренные механизмы адаптации. Предсуществуют в каждом организме, поэтому включаются тотчас же. Направлены на срочное усиление доставки кислорода и субстратов к тканям. Носят несовершенный и неустойчивый характер. К ним относятся: 1) увеличение частоты, глубины дыхания, числа функционирующих альвеол; механизм рефлекторный, связан с активацией хеморецепторов при изменении химического и газового состава крови; 2) увеличение ударного и минутного объема сердца, а значит, МОС и скорости кровотока; механизм связан с активацией симпатоадреналовой системы; 3) централизация кровообращения (перераспределение кровотока в пользу ЖВО);механизм - активация САС и выброс КХА, а также накопление в миокарде метаболитов с сосудорасширяющим эффектом (аденозин, ПГЕ, кинины и др.); 4) выброс крови из депо и костного мозга (выброс КХА, тиреоидных и кортикостеридных гормонов); повышение сродства гемоглобина к кислороду в легких; усиление диссоциации оксигемоглобина в тканях (из-за гипоксемии, ацидоза, повышения содержания ДФГ и АДФ в эритроцитах); 5) активация тканевого дыхания, активация гликолиза (из-за снижения содержания АТФ в клетке и ослабления его ингибирующего влияния на ферменты гликолиза, а также активации этих ферментов под влиянием продуктов деградации АТФ), повышение сопряженности окисления и фосфорилирования;
Механизмы долговременной адаптации к гипоксии формируются постепенно. Носят устойчивый и более совершенный характер. В основе - активация синтетических процессов, прежде всего - синтез нуклеиновых кислот и белков, особенно в органах и системах, обеспечивающих доставку кислорода и субстратов. Иными словами обеспечивается структурная основа адаптации. Благодаря этому повышается мощность, экономичность и надежность систем доставки и биологического окисления. К механизмам долговременной адаптации при гипоксии относятся: 1) снижение интенсивности и увеличение экономичности обменных процессов; преобладание анаболических процессов;2) увеличение числа митохондрий, их крист, ферментов, повышение сопряженности окисления и фосфорилирования; 3) гипертрофия легких с увеличением числа альвеол и капилляров в них; 4) гипертрофия дыхательной мускулатуры; 5) гипертрофия миокарда с увеличением капилляров и митохондрий;6) гипертрофия нейронов и увеличение числа нервных окончаний в тканях и органах; 7) увеличение количества капилляров во всех органах и тканях, усиление перфузии; 8) активация эритропоэза; повышение сродства гемоглобина к кислороду в легких и облегчение отдачи его в тканях; 9) повышение эффективности и надежности систем нейрогуморальной регуляции работы сердца, тонуса сосудов;
При несостоятельности компенсаторно-приспособительных реакций проявляется повреждающее действие гипоксии. Степень повреждающего действия гипоксии зависит от мощности компенсаторно-приспособительных реакций, от тяжести гипоксии, скорости ее развития, степенью чувствительности тканей к гипоксии. Проявляется повреждающее действие гипоксии в отношении обмена веществ, функций и структуры клеток, тканей, органов.
Гипероксия, ее роль в патологии. Гипероксия и свободно радикальные процессы. Гипербарическая оксигенация и ее использование в медицине.
Гипероксия - комплекс физиологических реакций и патологических изменений, развивающихся при повышенном давлении (напряжении) кислорода в тканях организма вследствие увеличения его содержания во вдыхаемой газовой смеси или в окружающей газовой среде.
Реакции организма при Г. зависят от уровня парциального давления кислорода (рО2) в легких и длительности его действия. Вначале они имеют приспособительное значение. Урежение частоты дыхания и сердечных сокращений, снижение объема легочной вентиляции, систолического и минутного объема сердца, замедление кровотока, сужение сосудов сетчатки глаза и головного мозга, депонирование крови в паренхиматозных органах, уменьшение объема циркулирующей крови — все это направлено на ограничение чрезмерного повышения рО2 в тканях, особенно в головном мозге.
С увеличением рО2 в легких и удлинением экспозиции развиваются патологические реакции, перерастающие в типичную картину отравления кислородом с поражением преимущественно легких (при гипо- и нормобарической Г. — легочная форма) и ц.н.с. (при гипербарической Г. — судорожная форма). Выделяют и третью, общетоксическую, форму, развивающуюся при рО2 в пределах 1—4 атм, которая характеризуется поражением многих органов. По времени перехода физиологических реакций в патологические отмечается выраженная вариабельность индивидуальной чувствительности здорового человека к кислородной интоксикации. Безопасная экспозиция нормобарической Г. составляет 8—12 ч. При рО2 3—4 атм симптомы отравления кислородом могут развиться через несколько минут. Такие факторы, как физическая нагрузка, низкая температура наружного воздуха, повышенное содержание углекислого газа, наркотические концентрации индифферентных газов в воздушной среде, способствуют развитию кислородного отравления.
Субъективными симптомами кислородной интоксикации при нормобарической Г. являются прогрессирующие ощущения сухости во рту, першение в носоглотке, сухой кашель, жжение и боль за грудиной, усиливающиеся при глубоком вдохе, онемение пальцев рук, кончика носа, щек.
Наиболее ранним объективным признаком поражения легких считается снижение их жизненной емкости, которое связано как с боязнью усиления болей и возникновения кашля при глубоком вдохе, так и с образованием множественных мелкоочаговых ателектазов. Спазмы и повышение проницаемости капилляров, по-видимому, обусловливают развитие отека легких. Вследствие повреждения кислородом легочной мембраны и регионарных нарушений вентиляционно-перфузионных отношений прогрессивно снижается диффузионная способность легких. Указанные изменения могут привести к развитию кислородного голодания и гибели организма даже в условиях избытка кислорода.
В развитии судорожной формы Г. наблюдаются две фазы. В первой (период предвестников) отмечаются подергивание мышц губ, век и шеи, онемение пальцев рук и ног. Затем появляются звон в ушах, тяжесть и боль в голове, суживаются поля зрения; увеличивается частота сердечных сокращений и дыхания. Иногда возникает ощущение тепла, появляются тошнота, рвота, отмечается потемнение в глазах, Во второй фазе (судорожной) внезапно развиваются судороги по типу эпилептических с потерей сознания и последующей амнезией. Первый приступ судорог обычно продолжается 1—2 мин, затем после короткой паузы он повторяется, но протекает уже более длительно. Чем выше уровень рО2, тем продолжительнее судороги и короче паузы между ними. После перехода на дыхание воздухом пострадавший погружается в глубокий сон.
При избытке кислорода изменяется и его метаболизм в тканях. Основной путь утилизации O2 в клетках различных тканей — четырехэлектронное восстановление его с образованием воды при участии клеточного фермента — цитохромоксидазы. В то же время небольшая часть молекул кислорода (1-2 %) претерпевает одно-, дву- и трехэлектронное восстановление, когда образуются промежуточные продукты и свободнорадикальные формы кислорода.
Свободнорадикальные метаболиты обладают высокой активностью, действуя в качестве окислителей, повреждающих биологические мембраны. Липиды — основной компонент биологических мембран — представляют собой чрезвычайно легко окисляющиеся соединения. Свободнорадикальное окисление липидов часто становится разветвленной цепной реакцией, склонной к самостоятельному поддержанию даже после нормализации содержания кислорода в организме. Многие продукты этой реакции сами являются высокотоксичными соединениями и способны повреждать биологические мембраны.
При избытке кислорода в тканях, его восстановление до воды возрастает с 1-2 % в норме, до высоких значений, пропорциональных степени этого избытка.
Из вышесказанного следует, что избыток кислорода в организме приводит к значительным нарушениям в транспорте газов и повреждению мембран клеток различных органов и тканей. Известно, что не существует скрытого периода при отравлении кислородом, так как биохимические нарушения начинаются сразу же с увеличением его парциального давления в дыхательной смеси. Кислородную интоксикацию усиливает тяжелая физическая работа, переохлаждение, перегревание, содержание вредных газообразных примесей в дыхательной смеси, накопление углекислоты в организме, повышенная индивидуальная чувствительность. Отравление кислородом может быть более выражено в присутствии нейтрального газа.
ГБО- метод насыщения организма кислородом под повышенным давлением с профилактической или лечебной целью. Сеансы Г. о. проводят в барокамерах.
В основе Г. о. лежит повышение парциального давления кислорода (рО2) в жидких средах организма (плазме, лимфе, тканевой жидкости). Это приводит к соответствующему возрастанию их кислородной емкости и сопровождается увеличением диффузии кислорода в гипоксические участки тканей, что дает возможность полного удовлетворения потребности тканей в кислороде. Действие Г. о, наиболее полно проявляется при отсутствии нарушений функции системы кровообращения. В целом терапевтический эффект Г. о. обусловлен возможностью компенсировать кислородную задолженность организма при недостаточности внешнего дыхания, кислородсвязывающей функции крови, дефиците регионарного или общего кровоснабжения и др.
К нормальным реакциям организма на действие Г. о. относятся урежение и углубление дыхания, замедление частоты пульса, снижение сердечного выброса и объема органного кровотока, увеличение периферического сосудистого сопротивления. Однако иногда (обычно в первые 1—3 сеанса) могут выявляться признаки кислородной интоксикации в виде раздражения ЦНС (судорожный синдром) или расстройства легочной функции (одышки, цианоза), что связано с повышенной индивидуальной чувствительностью больных к кислороду.
ГБО м.б. использована при лечении различных заболеваний: облетирующие поражения периферических артерий – увеличение объема О2, проходящего через ишеминизированные ткани; хирургические инфекции (сепсис, перитонит, абсцесс мягких тканей, внутренних органов) – воздействует на некоторые параметры гомеостаза и изменяет биологические свойства возбудителей инфекции, особенно анаэробов; кардиология – для лечения ИБС; диффузные заболевания печени, особенно острый вирусный гепатит с явлениями энцефалопатии; ГБО – эффективный компонент комплексного лечения декомпенсированного СД; акушерство и гинекология – предупреждение неблагоприятных исходов родов у рожениц с тяжелым гипоксическим синдромом, связанны, в основном, с СС патологией, асфиксия новорожденных; неврология и психиатрия, офтальмология, стоматология, при проведении лучевой терапии опухолей, а также при лечении больных с отравлением угарным газом, при газовой эмболии, явлениях септического шока
Роль наследственности в патологии. Понятие о мутагенах и мутациях. Классификация наследственных болезней.
Наследственность- это способность организмов повторять из поколения в поколение похожие признаки и особенности развития.
Наследственность обусловлена тем, что в процессе размножения от родителей к детям передаются материальные структуры клетки, хранящие в себе информацию и программу развития организма. Наследственность обеспечивается самовоспроизведением таких материальных единиц, как гены. Благодаря этому наследственность обеспечивает преемственность физической, морфологической и биохимической организации новых особей.
По мере того как улучшаются методы лечения и профилактики инфекционных болезней, структура заболеваемости населения меняется, и на первый план выступают болезни, в которых генетические факторы играют ведущую роль. Причинами наследственных болезней являются мутации.
Мутации - стойкое скачкообразное изменение в наследственном аппарате клетки, не связанное с обычной рекомбинацией генетического материала.
Классификация мутаций. 1) По причинам возникновения мутации бывают спонтанными и индуцированными. Спонтанные возникают при действии обычных факторов внешней среды, а индуцированные вызывают искусственно, действуя факторами, получившими названиемутагенов. 2)По локализации мутации могут быть соматическими (возникают в соматических клетках) и половыми (возникают в половых клетках). Соматические мутации проявляются только в организме, который является хозяином клеток, получивших мутацию. Половые мутации могут проявляться только в последующих поколениях. Именно они являются причиной наследственных болезней. 3) По значению для организма мутации бывают полезными и вредными. Последние подразделяют на летальные (несовместимые с жизнью) и нелетальные. 4) В зависимости от объема генетического материала, претерпевшего мутацию, выделяют: а) геномные (изменение количества хромосом); б) хромосомные (изменение структуры хромосом); в) генные (изменение структуры гена) мутации.
Мутагены- факторы, являющиеся причиной мутаций. В зависимости от происхождения мутагены подразделяют на три группы: 1)Физические(виды ионизирующего излучения, ультрафиолетовое излучение, повышенные температуры). 2)Химические(дезаминирующие агенты (азотистая кислота и другие нитросоединения); алкилирующие вещества — агенты, способные переносить на молекулу ДНК алкильные группы (метиловую, этиловую); соединения — аналоги азотистых оснований (5-бромурацил, 2-аминопурин и др.); соединения, встраивающиеся в молекулу ДНК и вызывающие ее деформацию (акридин и его производные). 3)Биологические— вирусы.
Наследственные болезни– болезни, обусловленные нарушениями наследственной информации (мутациями), полученными организмом с половыми клетками своих родителей.Классификация: в зависимости от объема нарушенной генетической информации делят на 3 типа: 1) моногенные (обусловлены нарушением деятельности и поражением одного определенного гена – генные мутации); 2) полигенные (болезни с наследственной предрасположенностью; обусловлены взаимодействием нескольких или многих генов с факторами окружающей среды, В отличает от наследования, определяемого одним геном, в данном случае наличие признака зависит от взаимодействия многих генов. Поэтому выраженность его может варьировать в очень широком диапазоне – СД, атеросклероз, онкология, псориаз); 3) хромосомные (болезни, которые возникают вследствие нарушения количества хромосом или их структуры. Они возникают в результате геномных и хромосомных мутаций. Геномные — это мутации, при которых изменяется количество хромосом. При хромосомных мутациях имеют место дефекты структуры хромосом).
Генные наследственные болезни, классификация, характеристика, методы терапии и профилактика.
Генные болезни - это те заболевания, которые вызываются генными мутациями. Последние передаются из поколения в поколение без изменений.
Возникшие под влиянием мутагенов в гене мутации обычно приводят как к количественным, так и качественным нарушениям в синтезируемом ферменте, белковом продукте. В патогенезе генных болезней особое место занимают, во-первых, наследственные ферментопатии (энзимопатии) - наследственные заболевания, обусловленные отсутствием какого-либо фермента или существенным изменением его активности, во-вторых, те или иные структурные нарушения клеток.
Наследственные болезни клинически могут обнаруживаться в различном возрасте, что зависит не только от степени, локализации и характера изменения наследственного аппарата, но и от условий жизни (питания, работы, отдыха, состояния окружающей среды, вида и характера повреждений и др.).
В зависимости от количества генных мутаций выделяют моногенные и полигенные болезни. Моногенные являются истинно наследственными заболеваниями (с полностью сформированным дефектом метаболизма, структуры и функции), передающимися в ряду поколений.Полигенные чаще относятся к болезням с наследственным предрасположением (с незначительным дефектом метаболизма, структуры и функции), причем эта предрасположенность обычно является многофакторной.Как аномалии, так и болезни могут наследоваться по аутосомно-доминантному типу (действие мутантного гена проявляется практически всегда), аутосомно-рецессивному типу (проявляется в гомозиготном состоянии), а также сцеплено с полом (т.е. передаваться с половой, главным образом, с Х-хромосомой).
Профилактика: 1) Ограничение браков между близкими и даже дальними родственниками. 2) Ликвидация популяционных, обычно расовых или религиозных, изолятов. 3) Получение детей от здоровых, молодых и любящих родителей. 4) Вести здоровый образ жизни. 5) Осуществлять оздоровление внешней среды. Жить в экологически чистой местности. 6) Пользоваться качественной водой и пищей. 7) Избегать влияния на организм разнообразных физических (особенно ультрафиолетовых, рентгеновских и др. ионизирующих излучений, солей тяжелых металлов), химических (как неорганических, так и органических веществ и соединений) и биологических (особенно РНК содержащих вирусов) мутагенов. 8) Осуществлять оздоровление собственного организма. 9) Улучшать условия работы и проводить мероприятия по социальной профилактике.
Лечение: наиболее часто используются методы патогенетической и симптоматической терапии, принципы которых заключаются в следующем: 1) Исключение из пищи веществ, которые превращаются в токсические вещества. В том числе исключение совместного потребления несовместимых пищевых продуктов (например, большого количества жира и мяса). 2) Добавление недостающих продуктов (компонентов) пищи в рацион (при недостатке синтеза продукта). 3) Исключение из употребления лекарственных средств, к которым имеется наследственно обусловленная непереносимость. 4) Возмещение недостающего продукта деятельности отсутствующего или нарушенного гена (фермента, антигемофильного глобулина при гемофилии, гормона щитовидной железы при нарушении его синтеза). 5) Лекарственная коррекция наследственных нарушений метаболизма и структуры, а значит и функции. 6) Хирургическое и ортопедическое лечение (для устранения грубых дефектов скелета и различных частей тела, удаление доброкачественных или злокачественных опухолей). 7) Изменение патологических генов с помощью генной инженерии.
Хромосомные наследственные болезни, виды, методы диагностики.
Хромосомные болезни- формы патологии, клинически выражающиеся множественными врожденными пороками развития, генетическая основа - изменение числа хромосом или нарушение строения хромосомы.
В отличие от генных хромосомные мутации в половой клетке обычно резко нарушают ее жизнеспособность и она гибнет. В случае, если жизнеспособность половой клетки сохранена и она участвует в оплодотворении, плод может погибнуть на разных этапах своего развития. Если, однако, хромосомный дисбаланс совместим с постнатальным существованием, то у такого ребенка обычно нарушено соматическое и психическое развитие, а способность воспроизводить потомство отсутствует. В тех редких случаях, когда репродуктивная функция все же сохраняется (3 — 5 %), потомство наследует ту же хромосомную аномалию. Описана семейная тенденция к нерасхождению хромосом. Чаще встречаются:Трисомии: 1) По 21-й хромосоме - болезнь Дауна: нарушение лицевого черепа и мозга, сердце, ЖКТ, легкие, мозг, аномалии кистей, ног. Частота: 1 ребенок на 500 (800) новорожденных. 2) По 13-й хромосоме - синдром Патау: нарушение мозгового и пищевого черепа, полидактилия, брахидактилия, незавершенный поворот кишечника, незаращение перегородки сердца. Частота: 1 ребенок на 5-7 тыс. новорожденных. 3) По 18-й хромосоме - синдром Эдвардс: дефекты сердца, кишечника, конечностей. Частота : 1 на 7 тыс. новорожденных. 4) YXX - набор половых хромосом. Синдром Кляйнфельтера. Обнаруживается половой хроматин.Частота: 1 на 800 (1000) новорожденных мальчиков. 5) YYX - повышена агрессивность. 6) Трисомия Х - женский организм, первичная аменорея, 2 половых хроматина.
Диагностика:1. Демографический (демографо-статистический, популяционный, популяционно-статистический) - сравнение частоты болезни в семье с частотой ее возникновения в популяции. В больших группах населения (расы, нации, этнические группы, изоляты). В изолятах чаще выявляются наследственные болезни, особенно, передающиеся по рецессивному типу. Популяционно-статистический метод позволяет изучать, во-первых, значение наследственных факторов в анатомогенезе; во-вторых, частоту наследственных болезней в разных географических зонах проживания и в разных популяциях; в-третьих, роль наследственности и среды обитания в развитии болезней с наследственным предрасположением.2. Генеалогический (родословный) - обнаружение в ряду поколений патологических признаков. Данные признаки выявляются по «вертикали» от пробанда (от лица, первым попавшим в поле зрения врача) без перерывов или с перерывами среди поколений, с менделевским распределением между больными и здоровыми родными братьями и сестрами (3:1, 1:1, 1:0), с большей частотой выявления болезней у родственников, чем у не родственников. Целью генеалогического анализа является установление наследственного характера признака и типа наследования.3. Близнецовый- оценка патологичного признака у однояйцевых и двуяйцевых близнецов. Однояйцевые близнецы рождаются в 3-4 раза реже, чем двуяйцевые. У однояйцевых (монозиготных, идентичных) близнецов, живущих даже в разных условиях выявляется высокая конкордантность (идентичность, встречаемость) патологического признака. У двуяйцевых (дизиготных, неидентичных) близнецов отмечается низкаяконкордантность по патологическому признаку у живущих даже при одинаковых условиях. Близнецовый метод позволяетсудить о соотносительной роли наследственности и внешней среды в изменчивости разных признаков организм.4. Цитологический (цитогенетический - микроскопическое изучение, во-первых, кариотипа, (числа и особенностей строения всего набора хромосом: соматических и половых в ядрах делящихся соматических клеток (особенно, костного мозга, а также лейкоцитов крови, эпителия слизистой щеки и др.), а также количество и активность половых клеток); во-вторых, полового хроматина (телец Барра) в интерфазных (неделящихся) соматических клетках. В норме в соматических клетках мужчин тельце Барра не определяется (либо определяется не более чем в 1% случаев); у женщин в 4-25% случаев выявляется 1 тельце. У больных людей может определяться два и более телец Барра, что указывает на наличие в их кариотипе трех и болееX- хромосом.5. Биохимическийв том числе скрининговый(с использованием экспресс-тестов) - исследование метаболических процессов, количества и активности энзимов, отражающих наличие той или иной наследственной болезни у новорожденных (так называемая пренаталъная диагностика) и различных групп населения (так называемая постнатальная диагностика). Особую ценность представляет диагностика наследственной патологии не после рождения ребенка, а в период внутриутробного развития организма (так называемая пренатальная диагностика).
Для этого используются следующие методики:1) амниоцентез - прокол оболочки плода на 12-16 недели жизни, забор околоплодной амниотической жидкости и исследование в ней количества и активности гормонов, ферментов, моно- и димеров углеводов, липидов, белков и их метаболитов, а также культуры клеток плода (с изучением их кариотипа, что позволяет максимально диагностировать хромосомные болезни);2) фетоскопия - исследование формы и размера плода в первом триместре беременности;3) забор крови из пуповины путем ее пунктирования с дальнейшим исследованием в пуповинной крови различных биохимических показателей (следует отметить, что данный метод является довольно травматичным);4) биопсия ворсинок хориона;5) ультразвуковое исследование (УЗИ) эмбриона и плода (следует указать, что этот метод является наименее информативным, но в тоже время и наименее безопасным) и др. 6. Иммунологический - исследование показателей состояния различных (центральных и периферических, клеточных и гуморальных) звеньев иммунной системы, нарушение которых может свидетельствовать о наследственной патологии (иммунодефицитные, аллергические заболевания).7. Дерматоглифический - постановка диагноза наследственной патологии по папиллярным линиям, гребешкам и узорам кожи ладони и пальцев лиц, находящихся под генетическим контролем. В этом плане особенно показательна болезнь Дауна, характеризующаяся наличием кожной складки поперек всей ладони. 8. Экспериментальный - моделирование той или иной наследственной патологии у экспериментальных животных. Для этого специально выводят определенные мутантные линии животных, имеющих различные наследственные дефекты и нарушения (гидроцефалия и дефекты губы у мышей, ахондроплазия у кроликов, гемофилия у собак и т.д.) и способных переносить в ряду поколений.
ТИПОВЫЕ ПАТОЛОГИЧЕСКИЕ
ПРОЦЕССЫ
Повреждение клетки, виды. Этиология, патогенез и последствия повреждения клетки.
Повреждение клетки — типический патологический процесс, основу которого составляют нарушения внутриклеточного гомеостаза, приводящие к нарушению структурной целостности клетки и ее функциональных способностей.
В зависимости: от скорости развития и выраженности основных проявлений повреждение клетки может быть острым и хроническим. Острое повреждение развивается быстро, как правило, в результате однократного, но интенсивного повреждающего воздействия, в то время как хроническое — протекает медленно и является следствием многократных, но менее интенсивных патогенных влияний.
2) от периода жизненного цикла, на который приходится действие повреждающего агента, повреждение клетки может быть митотическим и интерфазным.
3) от степени нарушения внутриклеточного гомеостаза повреждение бывает обратимым и необратимым.
Этиология. Нарушения внутриклеточного гомеостаза, составляющие сущность повреждения клетки, могут возникать как в результате непосредственного воздействия на клетку патогенного агента, так и опосредованно, вследствие нарушений постоянства внутренней среды самого организма.
Непосредственное (первичное) повреждение. В зависимости от происхождения все факторы, способные при взаимодействии с клеткой вызвать ее повреждение, можно разделить на 3 группы: 1) Факторы физической природы. К ним относятся механическое воздействие, высокая и низкая температура, ультрафиолетовые лучи, ионизирующая радиация и др. 2) Факторы химического происхождения. Повреждение клетки могут вызвать неорганические вещества (кислоты, щелочи, соли тяжелых металлов), низкомолекулярные органические соединения (фенолы, альдегиды, галогенопроизводные), высокомолекулярные соединения (гидролитические ферменты, основные катионные белки, иммуноглобулины, комплексы антиген—антитело, комплемент). В настоящее время описано более 20 000 химических соединений, оказывающих повреждающее действие. 3) Факторы биологической природы. К ним относятся микроорганизмы, способные взаимодействовать с клетками организма — вирусы, бактерии, простейшие.
Опосредованное (вторичное) повреждение. Возникает как следствие первичных нарушений постоянства внутренней среды организма. К повреждению клетки приводят гипоксия, гипо- и гипертермия, ацидоз и алкалоз, гипер- и гипоосмия, гипогликемия, гиповитаминозы, повышение содержания в организме конечных продуктов метаболизма, оказывающих токсическое действие (аммиак, билирубин и др.)
Патогенез. В патогенезе повреждения клеток особое место занимают механизмы повреждения клеточных и субклеточных мембран. Среди них ведущее значение имеют деструкции углеводных (полисахаридных), белковых и, особенно, липидных компонентов мембраны. К наиболее важным патогенетическим факторам повреждения липидных компонентов мембран относятся:
• активизация процессов перекисного окисления ненасыщенных жирных кислот и фосфолипидов (возникающая в результате угнетения супероксиддисмутазы, каталазы, пероксидазы, восстановленного глутатиона);
• активация мембранных фосфолипаз;
• осмотическое растяжение мембран набухших клеток;
• увеличение абсорбции полиэлектролитов на липидном бислое;
• повреждающее действие макромолекул (иммуноглобулинов и иммунных комплексов) через активацию системы комплемента (процессов протеолиза) и др.
Последствия повреждения клетки: 1. Дистрофии - нарушения обмена веществ в клетках и тканях, сопровождающиеся расстройствами их функций, пластических проявлений, а также структурными изменениями, ведущими к нарушению их жизнедеятельности. Основными механизмами дистрофий являются: - синтез аномальных веществ в клетке, например, белково-полисахаридного комплекса амилоида; избуточная трнасформация одних соединений в другие, нарпример, жиров и углеводов в белки, углеводов в жиры; - декомпозиция (фанероз), например, белково-липидных комплексов мембран; - инфильтрация клеток и межклеточного вещества, органическими и неорганическими соединениями, например, холестерином и его эфирами стенок артерий при атеросклерозе. К числу основных клеточных дистрофий относят белковые (диспротеинозы), жировые (липидозы), углеводные и минеральные. 2. Дисплазии - нарушение процесса развития клеток, проявляющееся стойким изменением их структуры и функции, что ведет к расстройству их жизнедеятельности. Причиной дисплазии является повреждение генома клетки. Именно это обусловливает стойкие и, как правило, наследуемые от клетки к клетке изменения, в отличие от дистрофий, которые нередко носят временный, обратимый характер и могут устраниться при прекращении: действия причинного фактора. Основным механизмом дисплазий является расстройство процесса дифференцировки, который заключается в формировании структурной и функциональной специализации клетки. Структурными признаками дисплазий являются изменения величины и формы клеток, их ядер и других органелл, числа и строения хромосом. Как правило, клетки увеличены в размерах, имеют неправильную, причудливую форму (“клетки-монстры”), соотношение различных органелл в них диспропорционально. Нередко в таких клетках обнаруживаются различные включения, признаки дистрофических процессов. В качестве примеров дисплазий клеток можно назвать образование мегалобластов в костном мозге при пернициозной анемии, серповидных эритроцитов при патологии гемоглобина, крупных нейронов – “монстров” при поражении коры головного мозга (туберозный склероз), многоядерных гигантских клеток с причудливым расположением хроматина при нейрофиброматозе Реклингхаузена. Клеточные дисплазии являются одним из проявлений атипизма опухолевых клеток. 3.Изменение структуры и функций клеточных органелл при повреждении клетки. Повреждение клетки характеризуется большим или меньшим нарушением структуры и функции всех ее компонентов. Однако при действии различных патогенных факторов могут преобладать признаками повреждения тех или иных органелл.
При действии патогенных факторов отмечается изменение общего числа митохондрий, а также структуры отдельных органелл. Уменьшение числа митохондрий по отношению к общей массе клетки. Стереотипными для действия большинства повреждающих факторов изменениями отдельных митохондрий является уменьшение или увеличение их размеров и формы. Многие патогенные воздействия на клетку (гипоксия, эндо- и экзогенные токсические агенты, в том числе лекарственные препараты при их передозировке, ионизирующая радиация, изменение осмотического давления)сопровождаются набуханием и вакуолизацией митохондрий, что может привести к разрыву их мембраны, фрагментации и гомогенизации крист. Нарушение структуры митохондрий приводит к существенному подавлению процесса дыхания в них и образования АТФ, а также к дисбалансу ионов внутри клетки. Ядро. Повреждение ядра сочетается с изменением его формы, конденсацией хроматина по периферии ядра (маргинация хроматина), нарушением двуконтурности или разрывами ядерной оболочки, слиянием ее с полоской маргинации хроматина. Лизосомы. При патогенных воздействиях высвобождения и активация ферментов лизосом может привести к “самоперевариванию” (аутолизу) клетки. Выход лизосомальных гидролаз в цитоплазму может быть обусловлен механическими разрывами их мембраны или значительным повышением проницаемости последних. Это является следствием накопления в клетках ионов водорода (внутриклеточный ацидоз), продуктов ПОЛ, токсинов и других агентов. Рибосомы. При действии повреждающих факторов наблюдается разрушение группировок субъединиц рибосом (полисом), состоящих обычно из нескольких рибосом – “мономеров”, уменьшение числа рибосом, отрыв органелл от внутриклеточных мембран. Эти изменения сопровождаются снижением интенсивности процесса синтеза белка в клетке. Эндоплазматическая сеть. При повреждении отмечается расширение канальцев сети, вплоть до образования крупных вакуолей и цистерн вследствие накопления в них жидкости, очаговая деструкция мембран канальцев сети, их фрагментации. Аппарат Гольджи. Повреждение аппарата Гольджи сопровождается структурными изменениями, сходными с таковыми в эндоплазматической сети. При этом нарушается выведение из клетки продуктов жизнедеятельности, обусловливающее расстройство ее функции в целом.
Цитоплазма представляет собой жидкую, слабовязкую среду, в которой находятся органеллы и включения клети. Действие на клетку повреждающих факторов может обусловливать уменьшение или увеличение содержания в цитоплазме жидкости, протеолиз или коакуляцию белка, образование “включений”, не встречающихся в норме. Изменение состояния цитоплазмы, в свою очередь, существенно влияет на процессы метаболизма, протекающие в ней, в связи с тем, что многие ферменты (например, гликолиза) находятся в клеточном матриксе, на функцию органелл, на процессы восприятия регулирующих и других влияний на клетку. 4.Некроз и аутолиз. Некроз – гибель клеток и тканей, сопровождающаяся необратимым прекращением их жизнедеятельности. Некроз нередко является завершающим этапом дистрофий, дисплазий, а также следствием прямого действия повреждающих факторов значительной силы. Изменения, предшествующие некрозу называют некробиозом или патобиозом. Примерами патобиоза могут служить процессы омертвления тканей при нейро-трофических расстройствах в результате денервации тканей, вследствие длительной венозной гипереми или ишемии. Некробиотические процессы протекают и в норме, являясь завершающим этапом жизненного цикла многих клеток. Большинствопогибших клеток подвергаются аутолизу, т.е. саморазрушению структур. Основным механизмом аутолиза является гидролиз компонентов клеток и межклеточного вещества под влиянием ферментов лизосом. Этому способствует развитие ацидоза в поврежденных клетках. В процессе лизиса поврежденных клеток могут принимать участие и другие клетки – факоциты, а также микроорганизмы. В отличие от аутолитического механизма последний называют гетеролитичесим. Таким образом, лизис некротированных клеток (некролиз) может обеспечивать ауто- и гетеролитическими процессами, в которых принимают участие ферменты и другие факторы как погибших, так и контактирующих с ними живых клеток.
Артериальная гиперемия, определение понятия. Виды. Причины и механизм развития, проявления, последствия. Способы вызывания артериальной гиперемии как метода терапевтического воздействия.
Артериальной гиперемией называется состояние повышенного кровенаполнения органа и ткани, возникающее в результате усиленного притока крови к ним по расширенным артериям.
Общее артериальное полнокровие развивается при значительном увеличении объема циркулирующей крови (например, при эритроцитозе).
При физиологической артериальной гиперемии усиливается кровоток адекватно возросшим потребностям органа или ткани в кислороде и энергетических субстратах.
Патологическая артериальная гиперемия возникает вне зависимости от метаболических потребностей органа.
Миопаралитический механизм связан со снижением миогенного тонуса сосудов под влиянием метаболитов (лактата, пуринов, пировиноградной кислоты и др.), медиаторов, внеклеточного увеличения концентрации калия, водорода и других ионов, уменьшения содержания кислорода.
Сущность нейрогенного механизма состоит в изменении нейрогенных констрикторных и дилататорных влияний на сосуды, приводящих к снижению нейрогенного компонента сосудистого тонуса. Данный механизм лежит в основе развития нейротонической, нейропаралитической гиперемии, а также воспалительного артериального полнокровия при реализации аксон-рефлекса.
Нейротоническая артериальная гиперемия возникает при повышении тонуса парасимпатических или симпатических холинергических сосудорасширяющих нервов или при раздражении их центров опухолью, рубцом.
Постишемическая артериальная гиперемия представляет собой увеличение кровотока в органе или ткани после временного прекращения кровообращения.
Вакатная (лат. vacutio – «пустой») гиперемия наблюдается при уменьшении барометрического давления над какой-либо частью тела.
Воспалительная артериальная гиперемия возникает под действием вазоактивных веществ (медиаторов воспаления), вызывающих резкое снижение базального тонуса сосудов, а также вследствие реализации в зоне альтерации нейротонического, нейропаралитического механизмов и аксон-рефлекса.
Коллатеральная артериальная гиперемия носит приспособительный характер и развивается вследствие рефлекторного расширения сосудов коллатерального русла при затруднении притока крови по магистральной артерии.
Гиперемия вследствие артериовенозного свища может развиться при повреждении артериальных и венозных сосудов в результате образования соустья между артерией и веной.
Для артериальной гиперемии характерны следующие изменения микроциркуляции:
1) расширение артериальных сосудов;
2) увеличение линейной и объемной скорости кровотока в микрососудах;
3) повышение внутрисосудистого гидростатического давления, увеличение количества функционирующих капилляров;
4) усиление лимфообразования и ускорение лимфообращения;
5) уменьшение артериовенозной разницы по кислороду.
3. Венозная гиперемия, определение понятия. Причины и механизмы развития, проявления. Последствия.
Венозная гиперемия - состояние повышенного кровенаполнения органа или ткани, обусловленное затрудненным оттоком крови по венам.
Венозное полнокровие может быть местным и распространенным.
Причины местного венозного полнокровия: закупорка вен тромбом или эмболом, сдавление опухолью, рубцом, увеличенной маткой. Тонкостенные вены могут сдавливаться также в участках резкого повышения тканевого и гидростатического давления (в очаге воспаления, в почках при гидронефрозе).
Условием, способствующим венозному застою, является длительное нефизиологическое положение той или иной части тела, неблагоприятное для местного оттока крови. При этом формируется гипостаз - гравитационная венозная гиперемия.
Причинами распространенного венозного полнокровия наиболее часто являются: недостаточность функции сердца при ревматических и врожденных пороках его клапанов, миокардитах, инфаркте миокарда; декомпенсация гипертрофированного сердца; уменьшение присасывающего действия грудной клетки при экссудативном плеврите, гемотораксе и т.д.
По темпу развития и длительности существования данная патология может носить острый и хронический характер. Длительная венозная гиперемия возможна только при недостаточности коллатерального венозного кровообращения.
Микроциркуляторные расстройства при венозной гиперемии характеризуются: 1) расширением капилляров и венул; 2) замедлением кровотока по сосудам микроциркуляторного русла вплоть до стаза; 3) утратой деления кровотока на осевой и плазматический; 4) повышением внутрисосудистого давления; 5) маятникообразным или толчкообразным движением крови в венулах; 6) уменьшением интенсивности кровотока в области гиперемии; 7) нарушением лимфообращения; 8) увеличением артериовенозной разницы по кислороду.
Внешние признаки венозной гиперемии: 1) увеличение, уплотнение органа или ткани; 2) развитие отека; 3) возникновение синюшности, т.е. цианотичной окраски.
Острое венозное полнокровие: наблюдается выход эритроцитов из мелких сосудов в окружающие ткани. При скоплении значительного их количества в слизистых и серозных оболочках, коже формируются мелкие, точечные кровоизлияния. В тканях накапливается отечная жидкость. В условиях гипоксии в клетках паренхиматозных органов развиваются зернистая и жировая дистрофия, мукоидное набухание межуточного вещества. Эти изменения носят, как правило, обратимый характер и при устранении причины острое венозное полнокровие завершается восстановлением структуры и функции тканей.
Хроническое венозное полнокровие: развитие дистрофических процессов в тканях, атрофия паренхиматозных элементов с одновременным заместительным разрастанием клеток стромы и накоплением в ней коллагеновых волокон. Необратимое склерозирование и уплотнение органа сопровождается нарушением его функций и называется цианотической индурацией.
Местные и общие нарушения при венозной гиперемии.
Местные изменения: связаны в основном с кислородным голоданием ткани. Гипоксия при этом первоначально обусловлена ограничением притока артериальной крови, а затем действием на тканевые ферментные системы продуктов нарушенного обмена, следствием чего является нарушение утилизации кислорода.
Кислородное голодание при венозной гиперемии обусловливает расстройства тканевого метаболизма, вызывает атрофические и дистрофические изменения, избыточное разрастание соединительной ткани (цирроз печени при венозном застое, вызванном недостаточностью функции сердца).
Если венозная гиперемия имеет генерализованной характер, то возможен ряд общих гемодинамических нарушений с тяжелыми последствиями. Чаще всего они возникают при закупорке крупных кровеносных сосудов – воротной, нижней полой вен. Скопление крови в указанных сосудистых резервуарах (до 90% всей крови) сопровождается резким снижением АД, нарушением питания жизненно важных органов (сердце, мозг), что может вести к смертельному исходу.
4.Ишемия, определение понятия, виды. Причины и механизмы развития ишемий. Исходы ишемических состояний. Понятие об инфаркте.
Ишемия – несоответствие между притоком к тканям и органом артериальной крови и потребностью в ней. При этом потребность в кровоснабжении всегда выше реального притока крови по артериям.
По причинам возникновения и механизмам развития различают несколько видов ишемии: 1) ангиоспастическую, возникающую в результате спазма артерий, обусловленного либо повышением тонуса вазоконстрикторов, либо воздействием на стенки сосудов сосудосуживающих веществ; 2) компрессионную, вызывающуюся сдавлением артерий рубцом, опухолью, наложенным жгутом, излившейся кровью; 3) обтурационную, развивающуюся при частичном или полном закрытии просвета артерии тромбом, эмболом, атеросклеротической бляшкой и т. д.; 4) перераспределительную, имеющую место при межрегиональном, межорганном перераспределении крови; 5) обструктивную, возникающую в результате механического разрушения сосудов при травме; 6) ишемию, обусловленную значительным увеличением вязкости крови в мелких сосудах в сочетании с вазоконстрикцией.
Ишемизированный участок отличается бледностью, уменьшением объема и тургора вследствие нарушения кровенаполнения. Происходит снижение температуры участка ишемии из-за нарушения притока теплой артериальной крови и уменьшения интенсивности обменных процессов. Снижается величина пульсации артерий в результате уменьшения их систолического наполнения.
Ишемия характеризуется следующими нарушениями микроциркуляторного кровотока: 1) сужением артериальных сосудов; 2) замедлением тока крови по микрососудам; 3) уменьшением количества функционирующих капилляров; 4) понижением внутрисосудистого гидростатического давления; 5) уменьшением образования тканевой жидкости; 6) понижением напряжения кислорода в ишемизированной ткани.
Вследствие нарушения доставки кислорода и субстратов обмена веществ в ишемизированной ткани развиваются обменные, структурные и функциональные нарушения, выраженность которых зависит от следующих факторов: 1) от скорости развития и продолжительности ишемии; 2) от чувствительности тканей к гипоксии; 3) от степени развития коллатерального кровотока; 4) от предшествующего функционального состояния органа или ткани.
Ишемические участки испытывают состояние кислородного голодания, снижается интенсивность обменных процессов, развивается дистрофия паренхиматозных клеток вплоть до их гибели, исчезает гликоген. При продолжительной запредельной ишемии может наступить омертвение ткани.
Причины:
По природе причины делят на: 1) физические факторы: сдавление артериальных сосудов (опухолью, рубцовой тканью, инородным телом, жгутом), сужение или закрытие просвета изнутри (тромб, эмбол, атеросклеротическая бляшка), действие очень низкой температуры; 2) химические факторы: многие хим вещества обладают способностью вызывать сокращение ГМК артериальных сосудов и сужение их просвета (никотин, ряд ЛС – мезатон, препараты адреналина, ангиотензины); 3) биологические факторы: БАВ с сосудосуживающим эффектом – катехоламины, ангиотензин II, БАВ микробного происхождения – их экзо- и эндотоксины, метаболиты с вазоконстрикторным действием.
По происхождению выделяют ишемии, причина которых имеет эндогенное или экзогенное происхождение (инфекционное и неинфекционное).
Стаз. Определение понятия, виды. Этиология и патогенез истинного капиллярного стаза. Феномен сладжа, причины, последствия.
Стаз — это прижизненная остановка тока крови в кровеносных и лимфатических сосудах микроциркуляторного русла.
Виды стаза. Различают ишемический, венозный и капиллярный (истинный) стаз. В основе ишемического стаза лежит резко уменьшенное или полное закрытие просвета артериального сосуда; застойного стаза -значительное нарушение (затруднение или прекращение) оттока крови по венам; истинного стаза - первичное нарушение кровотока в капиллярах.
Причиной истинного стаза могут быть физические (холод, тепло), химические (яды, концентрированный раствор натрия хлорида и других солей, скипидар, горчичное и кротоновое масло) и биологические (токсины микроорганизмов) факторы.
Механизм развития истинного стаза объясняется внутрикапиллярной агрегацией эритроцитов, т. е. их склеиванием и образованием конгломератов, затрудняющих кровоток. При этом повышается периферическое сопротивление.
Агрегация возникает в результате изменения физических свойств плазмолеммы эритроцитов под непосредственным действием факторов, проникающих внутрь капиллярного сосуда. При электронно-микроскопическом изучении феномена агрегации эритроцитов оказалось, что их поверхность, гладкая в нормальных условиях, становится при усиленной агрегации неровной, "пушистой". При этом изменяются сорбционные свойства эритроцитов по отношению к некоторым красителям, что свидетельствует о нарушении их физико-химического состояния.
В патогенезе истинного стаза важное значение имеет замедление кровотока в капиллярных сосудах вследствие сгущения крови. Ведущую роль при этом играет повышенная проницаемость стенки капиллярных сосудов, расположенных в зоне стаза. Этому способствуют этиологические факторы, вызывающие стаз, и метаболиты, образующиеся в тканях. Особое значение в механизме стаза отводится биологически активным веществам (серотонин, брадикинин, гистамин), а также ацидотическому сдвигу тканевой реакции среды и ее коллоидному состоянию. В результате отмечается повышение проницаемости сосудистой стенки и расширение сосудов, ведущие к сгущению крови, замедлению кровотока, агрегации эритроцитов и, как следствие, — стазу.
Особенно важным является выход в ткани плазменных альбуминов, способствующих понижению отрицательного заряда эритроцитов, что может сопровождаться выпадением их из взвешенного состояния.
Стаз может быть обратимым и необратимым. Обратимый стаз при устранении причины исчезает, кровоток восстанавливается. Необратимый стаз развивается в том случае, когда клетки крови, особенно эритроциты, соединяются в нераспадающиеся конгломераты - сладжи.
Исходы (последствия) стаза для клеточно-тканевых структур органа обычно неблагоприятные. К ним, в частности, относятся:
- внутрисосудистая агрегация эритроцитов (приводит к уменьшению текучести крови, повышению вязкости и уменьшению поступления О2 в ткани);
шунтирование крови через артериально-венозные анастомозы, (кровь не проходит через нутритивные капилляры и т.о. не участвует в обмене веществ);
уменьшение количества плазматических капилляров;
- увеличение образования конгломератов эритроцитов (приводит к уменьшению суммарной поверхности дыхательной функции эритроцитов, а также к снижению способности эритроцитов отдавать кислород);
- микротромбоз и микроэмболии агрегатами эритроцитов (приводят к недостаточной диффузии кислорода, питательных и регуляторных веществ в клеточно-тканевые структуры; развитию в них количественных и качественных нарушений метаболизма и функций; основу последних составляют дистрофия, паранекроз, некробиоз и некроз).
Сладж - феномен, характеризующийся сепарацией крови на конгломераты (состоящие, главным образом, из эритроцитов, а также лейкоцитов и тромбоцитов) и плазму в результате адгезии, агрегации и агглютанации форменных элементов. Сладж приводит к возникновению серьёзных расстройств микроциркуляции.
Причины сладжа:
• нарушения центральной и периферической гемодинамики (сердечная недостаточность, венозный застой, ишемия и др.);
• повышение вязкости и снижение текучести крови (гемоконцентрация, полицитемия);повреждение стенок микрососудов (воспаление, аллергические реакции, опухоли и др.).
Последствия сладжа могут быть самыми разными:
• нарушение скорости и характера тока крови внутри сосуда (замедление, вплоть до стаза; турбулентный ток крови; «включение» артериоло-венулярных шунтов) в результате образования большого количества агрегатов клеток крови, упакованных в конгломераты;
• расстройства транспорта жидкости, газов, субстратов, ФАВ, форменных элементов крови через стенку микрососудов;
• развитие гипоксии и ацидоза, дистрофий, расстройств пластических процессов и функций тканей и органов в результате нарушений в них обмена О2, СО2, субстратов, ФАВ, а также развития васкулопатий из-за расстройств ангиотрофической функции клеток крови, особенно тромбоцитов
Тромбоз, определение понятия, последствия. Виды тромбозов, условия и механизмы тромбообразования. Исходы тромбов.
Тромбоз - это процесс прижизненного образования на внутренней поверхности стенки сосудов или в их просвете сгустков, состоящих из элементов крови и препятствующих движению крови по сосудам.
Виды тромбов: пристеночные (частично уменьшающие просвет сосудов) и закупоривающие тромбы.
В зависимости от преобладания в структуре сгустков тех или иных элементов различают разные их виды: 1) Белый (агглютинационный) тромб. В его образовании ведущее значение имеет активизация процессов адгезии, агрегации и агглютинации форменных элементов (преимущественно тромбоцитов и лейкоцитов). 2) Красный (коагуляционный) тромб. В основе его образования главную роль отводят активации процессов свертывания (коагуляции) крови, элементы которой (тромбоциты, лейкоциты и, главным образом эритроциты, так как их больше всего в крови) запутываются в нитях фибрина. Следует отметить, что красный тромб образуется быстрее белого, обычно после значительного повреждения стенки сосуда. 3) Смешанный тромб. Он встречается наиболее часто. В его образовании важною роль играет активация процессов как свертывания, так адгезии, агрегации и склеивания форменных элементов крови (чередование белых и красных тромбов).
Последствия тромбоза могут быть различными. Учитывая его значение как кровоостанавливающего механизма при острой травме, сопровождающейся кровотечением, тромбоз следует рассматривать с общебиологических позиций как приспособительное явление.
В то же время тромбообразование при различных заболеваниях (атеросклероз, облитерирующий эндартериит, сахарный диабет и др.) может сопровождаться тяжелыми осложнениями, вызванными острым нарушением кровообращения в зоне тромбированного сосуда (ишемия при тромбозе артерий, застой крови при тромбозе вен).
Развитие некроза (инфаркта, гангрены) в бассейне тромбированного, лишенного коллатералей сосуда — конечный этап тромбоза. Особенно велика роль тромбоза венечных артерий в развитии инфаркта миокарда.
Причиной образования тромбов является нарушение (повреждение) целостности стенки сосудов, вызванное различными патогенными факторами внешней среды (физическими, химическими, биологическими), в том числе теми, которые вызывают воспаление (флогогенами), аллергию (аллергенами) или которые приводят к развитию различных заболеваний (атеросклероза, ишемическая и гипертоническая болезни и др.).
В механизмах развития тромбов принимают участие следующие патогенетические факторы (триада Вирхова): 1) Повреждение сосудистой стенки (нарушения ее физико-химических свойств, питания, метаболизма, приводящие к дистрофии и расстройствам структуры). В частности, поврежденная сосудистая стенка становится смачиваемой, теряет электрический заряд и выделяет в кровь активный тромбопластин. В результате этого элементы крови прилипают к ней. 2) Повышение активности свертывающей и или снижение активности противосвертывающей и фибринолитической систем крови (увеличение образования тромбопластина, протромбина, тромбина, фибриногена, фибрина, уменьшение образования гепарина); 3) Замедление тока крови и его нарушения в виде завихрений (в области тромба, агрегатов эритроцитов, атероматозных бляшек, аневризмы сосуда.
В процессе гемостаза выделяют две фазы: 1 фаза - сосудисто-тромбоцитарная (клеточная), 2 фаза - коагуляционная (плазменная).
Исходы (последствия) тромбоза могут быть следующими:рассасывание тромба (с восстановлением местного кровообращения);расплавление асептическое или гнойное (с образованием абсцесса);организация (прорастание соединительной тканью, в результате чего тромб плотно фиксируется к стенке сосуда);реканализация (прорастание сосудами), особенно рыхлого тромба;отрыв тромба с образованием эмбола.
Эмболия, определение понятия, виды. Основные направления переноса эмболов и последствия эмболий.
Эмболия— острая окклюзия (закупорка) сосуда, обусловленная переносом с током крови различных субстратов (эмболов), не встречающихся в норме. В качестве эмболов в 99% случаев всех эмболии выступают сгустки свернувшейся внутри сосудов крови, то есть тромбы. Эмболия, так же как и тромбоз, является важной причиной уменьшения площади поперечного сечения сосуда, а следовательно, объемной скорости кровотока и перфузии сосуда кровью. Как правило, эмболия возникает в артериях в результате переноса эмболов по ходу тока крови. Однако возможна и эмболия вен — в том случае, если крупный эмбол застревает в области клапана или, двигаясь против тока крови под действием силы тяжести, опускается в узкий участок вены (ретроградная эмболия).
Классификация: 1) По происхождению эмбола:экзогенная — воздушная (газовая), жирорастворимыми лекарственными веществами;эндогенная — тромбоэмболия (оторвавшейся частью тромба), жировая (при травме, переломах трубчатых костей), опухолевыми массами, околоплодными водами. 2) По локализации: малого круга кровообращения; большого круга кровообращения; воротной вены. 3) По механизму развития: прямая (при переносе эмболов по ходу кровотока); ретроградная (при переносе эмболов против кровотока в венах под действием силы тяжести).
Основные направления переноса эмболов: 1) из венозной системы большого круга кровообращения и правых отделов сердца — в сосуды малого круга кровообращения; 2) из легочных вен, левой половины сердца и аорты — в артерии большого кругакровообращения (сердца, мозга, почек, селезенки, кишечника, конечностей); 3) из ветвей портальной системы — в воротную систему.
Последствия эмболии. В зависимости от места локализации эмболия может приводить к ишемии (несоответствие между притоком к тканям и органом артериальной крови и потребностью в ней) — в артериальных сосудах или к венозной гиперемии (переполнение кровью сосудов кровеносной системы какого-либо органа или области тела) — при венозной эмболии.
Воспаление, определение понятия. Этиология воспаления. Компоненты воспалительной реакции. Биологическое значение воспаления.
Воспаление - это типический патологический процесс, который возникает в результате повреждения ткани и проявляется комплексом структурных, функциональных и метаболических нарушений, я также расстройствами микроциркуляции.
Этиология. Воспаление вызывается самыми различными повреждающими агентами: 1) механическими; 2) физическими: термическими, лучевыми (ультрафиолетовые лучи, тепловые лучи, ионизирующая радиация) и др.; 3) химическими (действие кислот, щелочей, чужеродных белков, различных солевых растворов и других химических раздражителей); 4) биологическими (гноеродные кокки, патогенные грибки, простейшие и др.); 5) психическими и пр.
Компоненты воспалительной реакции: 1) альтерация – изменение, раздражение, разрушение; 2) нарушения микроциркуляции с явлениями экссудации – выпотевание воспалительной жидкости и эмиграции – выделение (выход клеток крови из просвета сосудов в очаге повреждения); 3) пролиферация – размножение клеток, главным образом, соединительной и эпителиальной ткани. Указанные процессы не являются строго последовательными.
Биологическое значение воспаления: воспаление – пат процесс, в котором имеются элементы, как повреждения, так и защиты. Защитной реакцией при воспалении является фагоцитоз, а также активация иммунной системы, в частности плазматических клеток, которые являются продуцентами антител. Блокирование кровеносных и лимфатических путей также имеет защитное значение, т.к. из очага воспаления ограничивается всасывание токсинов и продуктов распада тканей. Важное значение придается возникновению демаркации на границе с омертвевшими тканями. Это приводит либо к изоляции омертвевшего очага с помощью грануляционной ткани, либо к отторжению его от живой части органа. Защитное значение имеют некоторые биохимические сдвиги, как в самом воспалительном очаге, так и в целостном организме. Однако, воспаление включает и элементы повреждения, приносящие ущерб организму. Экссудация с одной стороны приводит к ускорению завершения воспалительного процесса, т.к. с экссудатом к очагу повреждения подходят лейкоциты, ферменты, но с другой стороны этот экссудат может распространиться и на другие ткани и вызвать там развитие воспалительного процесса. При гиперергии (чрезмерная реакция тканей на болезнетворный фактор) может развиться некроз значительной территории органа, что приведет к состоянию, несовместимому с деятельностью этого органа, системы и организма в целом.
Альтерация при воспалении, виды. Нарушения обмена веществ и физико-химические изменения в очаге воспаления.
Альтерация - раздражение и повреждение рецепторов, мембран, внутриклеточных органелл (особенно ядер, лизосом, митохондрий), целых клеток, межклеточного вещества, периферических, особенно терминальных, кровеносных и лимфатических сосудов.Альтерация является первым и непосредственнным следствием действия флогогенного и патогенетических факторов. Она включает комплекс обменных, физико-химических, структурных и функциональных изменений в поврежденных тканях и тканях, окружающих последние. Морфологически она проявляется различными формами и степенями дистрофии, паранекроза, некробиоза, некроза. Альтерация, как правило, является пусковым (инициальным) звеном патогенеза развития различных патологических процессов, состояний и болезней.
Различают два вида альтерации: первичную и вторичную.
Первичная альтерациявозникает в ответ на прямое действие воспалительного (флогогенного) фактора и пролонгирует его патогенное действие. Степень и характер альтерации зависит от интенсивности и от качества флогогенного фактора, а также от локализации и площадиповреждения, реактивности и резистентности поврежденных структур и организма в целом.
Вторичная альтерация возникает под влиянием различных патогенетических факторов: как местных изменений (физико-химических факторов, количества и активности медиаторов воспаления, сосудистых реакций), так и системных (нервной и гуморальной, в том числе эндокринной и иммунной ) реакций.
Соотношение выраженности первичной и вторичной альтерации может быть различным. Это соотношение обусловлено объемом и характером ткани, главным образом, объемом вовлечения в патологический процесс сосудов (кровеносных и лимфатических) и нервных структур. Обычно, чем больше первичная альтерация, тем больше и вторичная альтерация. Но при чрезмерно выраженной первичной альтерации (глубокий некроз, обугливание, промерзание) вторичная альтерация может быть не большей, а такой же или даже значительно меньшей степени. Наиболее выражены процессы альтерации в паренхиматозных органах, а также при кожных аллергических реакциях.
По мере развития воспаления в очаге первичного повреждения и прилегающих к нему участках ткани развиваются нарушения кровообращения, нервной трофики, гипоксия, ацидоз, появляются токсины. Эти изменения являются важными патогенетическими факторами, вызывающими новую волну альтерации (то есть, вторичную альтерацию).
Нарушение обмена веществ и физ-хим изменения в очаге альтерации.
Комплекс физико-химический изменении включает нарастающие в динамике воспалительного процесса: ацидоз (снижение РН); гиперионию (увеличение количества Ка+, К+, Са+ , СГ, НРО4~ и др.); дисионию (увеличение внеклеточного К+ и внутриклеточного №+ ); гиперосмию (увеличение осмотического давления), гиперонкию (увеличение онкотического давления); увеличение дисперсности и гидрофильности белков паренхиматозных, нервных и, особенно, соединительно-тканных структур и т.д. Достаточно высока роль физико-химических изменений в очаге воспаления для увеличения образования и изменения активности медиаторов воспаления.
Комплекс метаболических изменений является следствием как структурных, так и физико-химических изменений, главным образом, митохондрий и лизосом в клетках. Он, в частности включает:активацию катаболизма белков, липидов, углеводов и их соединений; торможение анаболических процессов; усиление аэробного и, особенно, анаэробного гликолиза; повышение тканевого дыхания, сменяющегося его снижением; активацию процесса окислительного фосфорилирования (сопровождающегося увеличением синтеза макроэргов), сменяющегося его снижением и разобщением (при этом нарастает дефицит АТФ);усиление процесса теплопродукции, сменяющегося его ослаблением; накопление разнообразных недоокисленных продуктов метаболизма (вследствие повышения содержания лактата, пирувата, кетоновых тел, кетокислот и др.).Большинство из перечисленных выше метаболических изменений способствуют активизации образования медиаторов воспаления.
Медиаторы воспаления. Происхождение и особенности действия медиаторов. Модуляторы воспаления.
Медиаторы воспаления - биологически активные вещества, которые синтезируются в клетках или в жидкостях организма и оказывают непосредственное влияние на воспалительный процесс.
Источники медиаторов воспаления: белки крови и межклеточной жидкости; белки, в том числе все клетки крови, клетки соединительной ткани, нервные клетки, другие клетки; неклеточные элементы соединительной ткани.
Химическая природа медиаторов воспаления. Роль медиаторов воспаления выполняют: моноамины, пептиды, белки, липиды, нуклеозиды и нуклеотиды, протеогликаны.
К медиаторам воспаления относят различные по химическому строению, интенсивности, длительности действия и месту образования ФАВ. Эти ФАВ опосредуют многообразное действие на организм как самих флогогенных факторов, так и патогенетических факторов, формирующихся в динамике воспаления. Следует отметить, что все медиаторы бывают синтезированы в тех или иных клетках.
Различают медиаторы воспаления клеточного (образуются в клетках) и плазменного (образуются и поступают из плазмы крови) происхождения.
Клеточные медиаторы воспаления: биогенные амины (гистамин, серотонин); нейромедиаторы и нейропептиды (норадреналин, адреналин, ацетилхолин); петиды и белки (лейкокины, цитокины, ферменты); нуклеотиды и нуклеозиды (аденилнуклеозиды, циклические нуклеотиды, свободные нуклеотиды); производные ВЖК и липидов (простогландины, лейкотриены, липопероксиды), оксид азота.
Биогенные амины. Гистамин. Источник – базофилы и тучные клетки. Действие гистамина опосредуют Н1 и Н2-рецептовы на клетках-мишенях. Н1-рецепторы активируют малые дозы гистамина. Эффекты их активации – ощущение боли, жжения, зуда, напряжения. Н2-рецепторыактивируются гистамином в высокой концентрации. Эффекты – повышение проницаемости стенок сосудов микроциркуляторного русла, активация миграции макрофагов, эозинофилов в очаг воспаления, сокращение ГМК. Серотонин. Источник – тромбоциты, тучные клетки, нейроны, энтероэндокринные клетки. Эффекты – повышает в очаге воспаления проницаемость микрососудов, активирует сокращение ГМК венул (способствует развитию венозной гиперемии), приводит к формированию чувства боли, активирует процессы тромбообразования.
Нейромедиаторы. Норадреналин и адреналин (катехоловые амины). Синтезируются из тирозина в нейронах ГМ, симпатической НС и мозговом веществе надпочечников. Эффекты передаются через α- и/или β-адренорецепторы. Источники в очаге воспаления: норадреналин выделяется из окончаний нейронов симпатической НС, катехоловые амины надпочечникового происхождения поступают к тканям с кровью. Эффекты – активация гликолиза, липолиза; увеличение транспорта Са++ в клетки; сокращение ГМК стенок артериол, уменьшение просвета артериол и развитие ишемии; регуляция эмиграции лейкоцитов из сосудов в ткань в течение фагоцитарной реакции. Ацетилхолин. Синтезируется в нейронах из холина и ацетилкоэнзима А при участии холинацетилтрансферазы, выделяется из окончаний нейронов парасимпатической НС и реализует свои эффекты через холинорецепторы. Эффекты – снижение тонуса ГМК артериол, расширение их просвета и развитие артериальной гиперемии; регуляция процессов эмиграции лейкоцитов в очаг воспаления; стимуляция фагоцитоза; активация пролиферации и дифференцировки клеток.
Пептиды и белки. 1) Нейропептиды (вещество Р – нейропетид из семейства тахикининов, продуцируемый как нейронами, так и нервными клетками; эффекты - усиливает проницаемость стенки сосудов кожи, стимулирует секрецию слюнных желез и сокращение ГМК воздухоносных путей и ЖКТ). 2) Цитокины играют важную роль в защитном ответе организма (в т.ч. иммунном, аллергическом и при воспалении), регулируют дифференцировку, пролиферативную активность и экспрессию фенотипа клеток-мишеней: Интерлейкины – синтезируются моноцитами, макрофагами, лимфоцитами; в очаге воспаления ИЛ регулируют взаимодействие лейкоцитов между собой и с другими клетками. Эффекты – хемотаксис лейкоцитов; стимуляция синтеза пг клетками эндотелия; стимуляция пролифирации и дифференцировки различных клеток; потенцирование микротромбообразования; развитие лихорадки. Интерфероны – гликопротеиды, вырабатываются различными клетками и имеют антивирусную активность. В очаге воспаления стимулируют фагоцитоз, активируют цитотоксическую активность лейкоцитов, регулируют иммунные и аллергические реакции. Хемокины – низкомолекулярные секреторные пептиды, регулируют перемещение лейкоцитов. Имеют большое значение для иммуногенеза, иммуномодуляции, воспаления и патогенеза.
Липидные медиаторы воспаления – производные арахидиновой кислоты - простогландины, тромбоксаны и лейкотриены, обладающие вазо- и бронхоактивными свойствами. Простогландины - источники Пг в очаге воспаления - тромбоциты, активированные лейкоциты, клетки эндотелия, тучные клетки. Эффекты: регуляция тонуса и проницаемости стенок микрососудов; кровотока микрососудов; системы гомеостаза; эмиграции лейкоцитов и фагоцитоза; деление и созревание клеток. Лейкотриены – продукты липооксигеназного превращения арахидиновой кислоты в лейкоцитах, тучных клетках. Эффекты: длительное сокращение гладкомышечных клеток в стенке микрососудов; развитие ишемии тканей; регуляция эмиграции лейкоцитов и фагоцитоза; лабилизация мембран лизосом лейкоцитов.
Нуклеотиды и нуклеозыды – обладают высокой биологической активностью, принимают непосредственное участие в развитии воспалительной реакции. АТФ обеспечивает энергетическую поддержку и тем самым функции клеток и пластических процессов в них, регуляцию тонуса сердца, изменения агрегатного состояния крови, регуляцию местного кровотока. АДФ стимулирует адгезию, агрегацию и агглютинацию форменных элементов крови. Это вызывает тромбирование, формирование сладжа, нарушение крово- и лифотока в сосудах микроциркуляторного русла. Аденозин, высвобождающийся из клеток, оказывает существенный сосудорасширяющий эффект, сопровождающийся развитием артериальной гиперемии.
Плазменные медиаторы воспаления: кинины (брадикинин, каллидин), факторы системы комплемента и факторы гемостаза (прокоагулянты, антикоагулянты, фибринолитики).
Кинины. Образуются из кининогенов, синтезируются в основном в печени. В небольших количествах образуются в тканях легких, почек, сердца, кожи и некоторых других органов. Каллидин – декапептид, образуется г.о. под влиянием тканевых калликриенов. Под действием тканевых и плазменных аминопептидаз каллидин превращается в брадикинин. Брадикинин – нонапептид, образуется преимущественно под влиянием плазменных калликриенов. Эффекты: повышение проницаемости стенок микрососудов; потенцирование развития отека и микрогеморрагий; расширение просвета артериол за счет непосредственного воздействия на ГМК. Этот эффект в свою очередь способствует развитию артериальной гиперемии; стимуляция миграции фагоцитов в очаг воспаления. Факторы системы комплемента – при воспалении играют существенную роль в неспецифической инактивации и деструкции флогогенного агента, поврежденных и погибших клеток тканей. Происхождение в очаге воспаления – синтезируются в основном клетками печени, а также костного мозга и селезенки и поступают в очаг воспаления с кровью; другая часть продуцируется и выделяется местно – мононуклеарными фагоцитами, находящимися в воспаленной ткани. Эффекты: активация хемотаксиса; цитологические аспекты, патологический аспекты; регуляция образования кининов, факторов системы гемостаза, а также активности Т- и В-лимфоцитов. Факторы гемостаза можно подразделить на три группы: прокоагулянтные, антикоагулянтные и фибринолитические. Причины активации прокоагулянтных факторов в очаге воспаления: повреждение флогогенным агентом и вториными факторами альтерации тканевых клеток; повреждение эндотелия. Одновременно с этим активируются антикоагулянтные и фибринолитические факторы. Последствия активации: образование тромбов; нарушение кровообращения в очаге воспаления - ишемия, венозная гиперемия и стаз.
Т.о., медиаторы воспаления обусловливают развитие и/или регуляцию как процессов альтерации (включая изменения обмена веществ, физико-химических параметров, структуры и функции), так и сосудистых реакций, экссудации жидкости и эмиграции клеток крови, фагоцитоза, пролиферации и репаративных процессов в очаге воспаления.
Модуляторы воспаления - практически все медиаторы являются и модуляторами воспаления, т.е. способны усиливать или ослаблять выраженность воспалительных явлений.
К медиаторам воспаления относятся также циклические нуклеотиды, которые правильнее было бы назвать не медиаторами, а модуляторами, так как они не создают полной картины воспаления, а могут лишь в той или иной степени преобразовывать ее. Циклические нуклеотиды обусловливают эффект действия других медиаторов, выделение клетками лизосомальных ферментов и др. Отмечено противоположно направленное действие цАМФ и цГМФ. Так, первый подавляет выделение гистамина и лизосомальных ферментов, а второй, наоборот, способствует ему.
Сосудистые изменения в очаге воспаления. Механизм формирования сосудистых реакций и повышения сосудистой проницаемости при воспалении.
Компонент воспаления «сосудистые реакции» является результатом альтерации ткани. Понятие «сосудистые реакции» подразумевает изменения тонуса стенок сосудов, их просвета, крово- и лимфообращения в них, проницаемости сосудистых стенок для клеток жидкой части крови.
Наиболее часто в очаге воспаления встречается следующая динамическая последовательность реакций кровеносных сосудов: 1) Спазм артериол, приводящий, как правило к временной, иногда длительной ишемии (вплоть до прекращения кровотока, то есть, может завершаться ишемическим стазом). Спазм обусловлен увеличением тонуса вазоконстрикторов, который имеет рефлекторный генез. Он приводит к невозможности проникновения повреждающих факторов (микробов, токсинов) в кровоток и распространения с ним по организму. 2) Артериальная гиперемия в динамике воспаления может иметь различный механизм развития: рефлекторный; нейротонический (в основе того и другого механизма лежит преобладание тонуса вазодилататоров над вазоконстрикторами); гуморально-метаболический (увеличение образования недоокисленных продуктов и вазодилататорных ФАВ); нейропаралитический (паралич сосудосуживающих либо и сосудосуживающих, и сосудорасширяющих нервных волокон); миопаралитический (паралич гладких мышц сосудов). 3) Венозная гиперемия в динамике воспаления возникает вследствие несоответствия между притоком и сниженным оттоком крови под влиянием следующих различных механизмов: нарушение структуры вен; паралич нервно-мышечного аппарата вен, сдавление вен образующимся и нарастающим экссудатом; увеличение общей площади сосудистого русла; увеличение адгезии, агрегации и агглютинации тромбоцитов, лейкоцитов и эритроцитов, особенно в венозных микрососудах; микротромбообразование (на внутренних стенках вен); увеличение проницаемости сосудистой стенки (для воды, углеводов, липидов, белков); сгущение и увеличение вязкости крови. На фоне венозного застоя формируется престатическое состояние (сначала толчкообразное, потом маятникообразное движение крови), а затем стаз. 4) Венозный стаз завершает венозную гиперемию и характеризуется полной остановкой кровотока в венах. 5) Истинный стаз может развиваться на различных стадиях воспаления. 6) Лимфообразование и лимфоток в динамике воспаления сначала (при артериальной гиперемии) временно активизируется, а при венозной гиперемии снижаются. Эти расстройства становятся максимальными при стазе (как венозном, так и истинном). Давление лифы может увеличиваться до 120 мм вод столба. Большое число лимфатических сосудов закупориваются белками, хиломикронами, клетками, обломками тканей.
Механизм повышения проницаемости сосудистой стенки при воспалении: 1. Активация микровезикулярного транспорта через эндотелиальные клетки. 2. Образование сквозных трансклеточных каналов в эндотелиоцитах (является следствием значительного усиления микровезикулярного транспорта). 3. Увеличение просвета межэндотелиальных щелей (происходит в результате сокращения и округления эндотелиоцитов). 4. Десквамация (слущивание) эндотелия. Является проявлением первичной и вторичной альтерации. 5. Деполимеризация веществ, соединяющих эндотелиальные клетки и являющихся компонентами базальной мембраны сосудистой стенки.
Причина повышения проницаемости сосудистой стенки при воспалении. К основным причинам повышения проницаемости сосудов относятся: а) продукты дегрануляции тканевых базофилов (гистамин и серотонин); б) кинины (брадикинин и каллидин); в) простагландины и некоторые лейкотриены; г) лизосомальные ферменты (эластаза, колла-геназа, гиалуронидаза) и неферментные катионные белки; д) фи-бринопептиды и продукты деградации фибрина; е) ацидоз.
Экссудация и эмиграция в очаге воспаления, патогенез. Виды экссудатов. Фагоцитоз, стадии, значение для организма.
Экссудация – процесс выхода воспалительной жидкости (экссудата) из крови в ткань в норме капиллярная стенка удерживает в крови 95% белков, при воспалении ее проницаемость для белков сосудистых стенок (капилляров, прекапиллярных артериол и посткапиллярных венул) возрастает в 3-5-7 и более раз. В динамике экссудации сначала увеличивается выход воды, потом солей, затем углеводов и, наконец, липидов и белков (альбуминов, глобулинов) и их комплексных соединений.
Экссудат - воспалительная жидкость (основа воспалительного отека), содержащая большое количество белка, форменные элементы крови, ферменты и соли, накапливающаяся в тканях и/или полостях тела при воспалении. Виды экссудата определяются его составом: серозный экссудат содержит 3 и более процента белков, значительное количество различных клеток, рН равен 6-7 и выше, удельный вес 1,108 и выше; фибринозный экссудат содержит большое количество белков, особенно фибриногена и фибрина; геморрагический экссудат содержит белки и различные клетки крови, особенно эритроциты; гнойный – огромное количество белков (до 6-8%), погибших лейкоцитов (г.о. нейтрофилов) и клеток поврежденный тканей, а также м/о; гнилостный – большое количество белков, погибших клеток и, особенно, анаэробных гнилостных м/о; смешанный – разное сочетание выше перечисленных видов экссудатов.
Биологическое значение экссудации: 1. Обеспечение поставки в ткани плазменных медиаторов воспаления для интенсификации следующих процессов: фагоцитоза и эмиграции лейкоцитов в очаг воспаления. 2. Удаление из крови в очаг продуктов обмена и токсинов (дренажная функция). 3. Усугубление венозного застоя, тромбирование вен и лимфотических сосудов с целью задержки в очаге микробов, токсинов, продуктов обмена веществ. 4. Локализация воспалительного процесса.
Негативные последствия экссудации: 1. Поступление экссудата в полости тела с образованием абсцесса, эмпиемы, флегмоны, пиемии или развитием плеврита, перикардита, перитонита. 2. Образование спаек. Может привести к смещению органов и нарушению их функций.
Эмиграция – процесс выхода лейкоцитов из просвета сосудов в ткани, главным образом, в очаг воспаления. Первыми (в течение 4-6 часов) выходят гранулоциты (нейтрофилы, эозинофилы, базофилы), позднее (5-12 часов) – моноциты, еще позже (12-24 часа) – лимфоциты. Гранулоциты и моноциты эмигрируют межэндотелиально, лимфоциты - трансцеллюлярно (через энделиоциты путем пиноцитоза).
В процессе эмиграции лейкоцитов, выделяют несколько стадий: 1) краевое стояние (которое увеличивается особенно в сосудах, прилегающих к зоне повреждения), 2) адгезия (прилипание лейкоцитов к внутренней поверхности эндотелиоцитов), сначала адгезия слабая (отмечается прокатывание лейкоцитов по поверхности эндотелиоцитов), затем прочная (лейкоцит не движется); 3) проникновение лейкоцита через стенку микрососуда;4) направленное движение лейкоцитов в сторону очага воспаления.
Развитию первых двух стадий эмиграции способствует образование навнутренней поверхности эндотелиоцитов бахромчатых образований в виде хлопьевидных нитей, сгущение и повышение вязкости крови, снижение кровотока в микрососудах и, особенно, образование и активизация молекул адгезии, селектинов, интегринов и других ФАВ. Развитие третьей стадии эмиграции, совершающейся за 3-6 мин, происходит под влиянием следующих хемоаттрактантов: фактора комплемента СЗа и, особенно, С 5а, фактора 4 тромбоцитов; метаболитов арахидоновой кислоты; интерферонов и интерлейкинов; интегринов и их взаимодействием с молекулами адгезии; гидролитических ферментов; выделяемых лейкоцитами (коллагеназы, эластазы, гиалуронидазы и др.); острофазовых белков; иммуноглобулинов и др. Эмиграции способствует также движение экссудата из сосудов в интерстиций в сторону повреждения, имеющего более высокое осмотическое и онкотическое давление. Развитие четвертой стадии эмиграции лейкоцитов (микро - и макрофагов) в очаг повреждения клеточно-тканевых структур обеспечивается активным, с затратой энергии, амебоидным движением лейкоцитов. Последний осуществляется благодаря: 1) переходу их гиалоплазмы из состояния геля в золь; 2) снижению поверхностного натяжения цитолеммы «головного» полюса клеток; 3) сокращению актомиозина «хвостового» полюса лейкоцитов.
Фагоцитоз – активный биологический процесс, заключающийся в поглощении чужеродного материала и его внутриклеточной диструкции специализированными клетками организма – фагоцитами. Благодаря фагоцитозу ограничивается дальнейшее местное повреждение тканей флогогенными агентами для защиты целостного организма.
Стадии: 1 стадия – приближении фагоцита к объекту фагоцитоза (антигену); 2 стадия - прилипание (адгезия) фагоцита к чужеродному объекту (после распознавания последнего); 3 стадия – поглощение чужеродного объекта фагоцитом (с помощью образования фаголизосомы и при участии протеинкиназы С и ионов Са2+); 4 стадия – внутриклеточное переваривание чужеродного объекта (с полным или неполным разрушением последнего с помощью кислородзависимой и кислороднезависимой цитотоксичности фагоцитов).
Фагоцитоз сопряжен с процессом передачи информации об Аг лимфоцитам. Это происходит тогда, когда объектом фагоцитоза являлся носитель чужеродной антигенной информации (клетки, м/о, опухолевые и вируссодержащие клетки, белковые неклеточные структуры). В этом случае Аг после его модификации в фагоците (процессинг) экспрессируется на поверхности клетки. Такой Аг значительно более иммуногенен, чем интактный Аг. Фагоцитирующие клетки, осуществляющие процессинг, называют антигенпредставляющими клетками. При этом фагоцит представляет (презентирует) клеткам иммунной системы двоякую информацию: о чужеродном Аги о собственных Аг, кодируемых генами HLA и необходимых для сравнения их с чужими Аг.
Фагоциты также продуцируют и выделяют в межклеточную жидкость ряд БАВ, регулирующих развитие либо иммунитета, либо аллергии, либо состояния толерантности. Т.о., воспаление непосредственно связано с формированием иммунитета или иммунологической реакции в организме.
Биологическое значение воспаления: 1. воспаление есть защитно-приспособительная реакция организма, выработанная в процессе эволюции. 2. при воспалении создаётся барьер между здоровой и повреждённой тканью. Очаг воспаления вместе с флогогеном отрганичен от неповреждённой ткани. 3. Воспаление не является физиологической защитной реакцией, так как в ходе воспаления возникают повреждения тканей. Это типовой патологический процесс.
Пролиферативные и восстановительные функции в очаге воспаления.
Пролиферация – процесс новообразования клеток путем их размножения (деления). Основу пролиферации в очаге воспаления составляет репаративная регенерация - процесс восстановления поврежденных клеточно-тканевых структур. При воспалении процесс репаративной регенерации активизируется за счет эпителиальных и особенно, соединительнотканных структур, в частности, фибробластов. Так, миграция фибробластов в очаг воспаления начинается в 1-2 сутки от момента альтерации, которые в последующие дни начинают активно формировать коллагеновые волокна и другие составляющие экстраклеточного матрикса. Пролиферация возникает с самого начала воспаления (вскоре после альтерации), далее нарастает, а после достижения максимума (через 1-2-3 недели) снижается.
В регуляции пролиферации важную роль играют: 1) продукты метаболизма и распада поврежденных в очаге воспаления клеточно-тканевых структур (эпителиальной и, особенно, соединительной ткани, эндотелиоцитов капилляров, адвентициальных клеток, гистиоцитов, фибробластов, фиброцитов, клеток крови: гранулоцитов, макрофагов, лимфоцитов и др.); 2) разнобразные по строению и механизмам действия регуляторные факторы (иммуноглобулины, мукополисахариды, холин, фактор стимуляции количества и адгезивной способности фибробластов); 3) трефоны (трефоины), являющиеся фрагментами РНК и ДНК и способствующие размножению рядом расположенных (соседних) клеток, главным образом, фибробластов; 4) кейлоны, тормозящие деление соседних клеток; 5) цитокины (интерферон, интерлейкины), обладающие различными механизмами и эффектами действия; 6) ацидоз и другие.
Следует отметить, что в очаге воспаления моноциты и лимфоциты могут претерпевать различные превращения. Так, мигрировавшие в очаг воспаления моноциты дифференцируются в «воспалительные» макрофаги, которые через 1-2 суток становятся доминирующими клеточными элементами. Последние, совместно с другими фагоцитами и ФАВ, обеспечивают не только стерилизацию очага воспаления, но и активизацию репаративных процессов. Из одних лимфоцитов образуются плазмоциты - основные антителообразующие клетки. Другие переходят в прегистиоциты и гистиоциты. Последние могут превращаться в гистиофаги, способные уменьшать количество фибробластов и коллагена, а также увеличивать содержание простагладинов типа Е, стимулирующих размножение и рост клеток и сосудов. Показано, что в превращении гистоцитов принимают участие холин, продукты распада нуклеиновых кислот, кислые мукополисахариды и др. Гистоциты способны также превращаться в фибробласты, которые, во-первых, выделяя фибронектин детерминируют процессы миграции и адгезии лейкоцитов и процесс пролиферации соединительно-тканевых структур, во-вторых, участвуют в синтезе преколлагена и образовании коллагеназы а значит, участвуют в образовании коллагена основного вещества соединительной ткани.
Активность пролиферации зависит от: вида флогогенного фактора, от площади и глубины повреждения, от структурных, метаболических и функциональных особенностей поврежденных структур, от своевременности и правильности выбранного метода лечения.
При незначительных по площади (до 1,0 см) и глубине (0,1-0,2 мм) повреждениях кожи и слизистых происходит полная ликвидация дефекта и восстановление нормального эпителиального слоя. При несколько больших по площади и глубине повреждениях заживление осуществляется под струпом (с сухой корочкой) либо первичным натяжением с образованием нежного соединительно-тканного рубчика, либо вторичным натяжением с образованием плотного соединительного рубца.
Увеличение числа соединительно-тканных клеток, фибробластов, коллагеновых, ретикулярных и эластических волокон начинается уже через 6-12-24 ч. с момента альтерации и далее прогрессивно нарастает. Через 2-3 суток происходит новообразование кровеносных капилляров, в ране появляется грануляционная ткань. После 5-7 суток васкуляаризация быстро прогрессирует и происходит отторжение некротических масс. Фибробласты активно синтезируют коллаген. Рана очищается. Через 9-15 суток грануляционная ткань, состоящая из 6 слоев (лейкоцитарно-некротического, сосудистых петель, вертикальных сосудов, созревающего слоя, горизонтально расположенных фибробластов, фиброзного слоя) быстро разрастается и созревает. Часть грануляций эпителизируется (т.е. завершается полной эпителизацией), а часть превращается в плотный рубец (т.е. завершается рубцеванием поврежденной ткани).
Продолжительность, выраженность, универсальность и индивидуальные особенности основных процессов (компонентов) воспаления существенно зависят от: вида и интенсивности действия флогогенного раздражителя, локализации и характер повреждения, сопутствующих ему внешних и внутренних (генотипических и фенотипических свойств макроорганизма) условий.
По степени задействования различных провоспалительных и противовоспалительных механизмов, в развитии воспаления выделяют два альтернативных варианта: во первых, экссудативно-деструктивное или гнойное воспаление, во вторых, продуктивное или пролиферативно-клеточное воспаление. Главной движущей силой воспаления в первом случае являются обладающие выраженным флогогенным потенциалом нейтрофилы, а также система комплемента и иммуноглобулины (Ig), особенно IgG. Во втором случае отмечается гораздо менее выраженная экссудативно-сосудистая реакция, а преобладающим клеточным элементом инфильтрата является мононуклеары, а в некоторых случаях (например, при гельминтозах) - эозинофилы.
В воспалительном процессе, возникшем в ответ на действие генетически чужеродных агентов (как экзогенного, так и эндогенного происхождения) принимают участие различные регуляторные, исполнительные физиологические и метаболические системы, а также клетки и межклеточные структуры.
Местные и общие проявления воспалительной реакции, их патогенез.
Местные признаки воспаления: 1) краснота, развивающаяся в результате увеличения числа функционирующих сосудов (артериол и преимущественно капилляров), артериализации венозной крови, повышение HbO2, имеющего ярко алый цвет; 2) припухлость, возникающая вследствие увеличения кровенаполнения тканей и формирования отека; 3) жар – повышение температуры тканей, возникающее в результате увеличения притока более горячей артериальной крови, а также вследствие активизации окислительных процессов; 4) боль, формирующаяся вследствие раздражения рецепторов поврежденных тканей из-за сдавления их отеком, действия гипоксии, токсинов, различных физиологически активных гуморальных веществ; 5) нарушение функций, всегда сопровождающее вовлеченные в воспалительный процесс клеточно-тканевые структуры организма. Появление этих признаков обусловлено действием БАВ – медиаторов воспаления, вызывающих воспалительную артериальную гиперемию, повышение проницаемости капилляров и венул, эмиграцию лейкоцитов и увеличение потребления ими кислорода. Данные признаки можно обнаружить в большинстве случаев воспаления поверхностных и доступных осмотру тканей (кожа, подкожные оболочки полости рта, глотки, мочеполового и пищеварительного трактов). Именно их появление в одном месте и заставляет врача установить наличие воспалительного заболевания определенной локализации.
В том случае, если в воспалительный процесс вовлекается значительный объем ткани, возникают общие клинические (и лабораторные) признаки воспаления (системный ответ организма на локальное воспаление): увеличение общей температуры тела (лихорадка), синтез в печени специальных белков, увеличение скорости размножения в костном мозге и выхода в кровь лейкоцитов, слабость, недомогание, отсутствие аппетита и др. Механизм развития указанных симптомов обусловлен поступлением в кровь из очага воспаления цитокинов – одних из медиаторов воспаления.
Лихорадка, определение понятия. Этиология, патогенез, стадии развития лихорадочной реакции.
Лихорадка — увеличение температуры тела теплокровного животного, возникающее вследствие увеличения в крови концентрации интерлейкинов. Лихорадка является одним из общих симптомов воспаления, которые возникают вследствие попадания в кровь цитокинов, выделяющихся макрофагами и лимфоцитами в месте воспаления и развития иммунного ответа. Лихорадка возникает при некрозе, внедрении инфекционных агентов, их антигенов, аллергических и аутоаллергических реакциях. Среди причин лихорадки отдельно стоят гемобластозы — опухоли из кроветворных клеток, клетки которых сами могут выделять цитокины.
Интерлейкины, влияющие на центр терморегуляции гипоталамуса, получили название вторичных (лейкоцитарных) пирогенов. Те вещества, которые активируют иммунокомпетентные клетки и индуцируют выделение ими интерлейкинов, получили название первичныхпирогенов. Первичные пирогены по сути являются антигенами и могут быть: а) экзогенными — вирусные, бактериальные, грибковые, лекарственные, пыльцевые, инсектные и др. (лихорадка при инфекционных и аллергических заболеваниях); б) эндогенными:опухоль-специфические антигены (лихорадка при опухолях); аутоантигены — могут образовываться в организме при нарушении иммунологической толерантности (лихорадка при аутоиммунных заболеваниях), а также модификации собственных антигенов и разрушения собственных клеток в результате действия разнообразных повреждающих факторов, вызывающих некроз:гипоксия (лихорадка после возникновения инфаркта миокарда или инсульта);экзогенные химические вещества, вызывающие деструкцию тканей (лихорадка при отравлении солями тяжелых металлов, при химическом ожоге и др.);высокая и низкая температура (лихорадка после возникновения ожогов и обморожений);ионизирующая радиация (лихорадка при лучевой болезни, при солнечных ожогах) и др.
Патогенез лихорадки. Активированные антигенами, иммунными комплексами, собственными погибшими в ходе некроза клетками макрофаги и лимфоциты очага воспаления и ближайших лимфоузлов (а при циркуляции антигенов и иммунных комплексов в крови — и селезенки) выделяют вторичные пирогены (ИЛ-1, ИЛ-6, ФНО), которые достигают с током крови центра терморегуляции гипоталамуса и связываются с поверхностными рецепторами его термочувствительных нейронов. Это приводит к активации фосфолипазы А2, циклооксигеназы и, соответственно, синтеза простагландинов в нейронах гипоталамуса. Простагландин Е повышает чувствительность нейронов терморегуляторного центра к холодовым и снижает чувствительность к тепловым афферентным стимулам. В результате термоустановочный отдел центра получает ложную информацию о снижении температуры тела и в нем происходит перенастройка на новое, более высокое значение температуры тела. Для достижения нового, повышенного заданного значения температуры тела происходит включение эффекторных звеньев системы терморегуляции, обеспечивающих торможение процессов теплоотдачи и активацию процессов теплопродукции.
Эффекторные механизмы терморегуляции: 1) Влияющие на теплоотдачу: а) непроизвольные:реакция подкожных сосудов, влияющая на интенсивность кровотока в коже;потоотделение, дыхание; б) произвольные — поза, использование одежды и др. 2) Влияющие на теплопродукцию: а) непроизвольные:основной обмен;сократительный (дрожательный) термогенез — мышечная дрожь;несократительный (недрожательный) термогенезвследствие активации симпатоадреналовой системы, приводящей к усилению скорости окислительных реакций в жировой ткани и печени; б) произвольные — двигательная активность.
Стадии развития лихорадки: 1) Повышение температуры тела. Возникает в течение нескольких минут после воздействия интерлейкинов на рецепторы центра терморегуляции. При этом организм ведет себя так, как организм здорового человека при смещении реальной температуры тела ниже нормального значения в условиях внешнего охлаждения. В результате происшедшей активации теплопродукции (сократительный и несократительныйтермогенез) и торможения теплоотдачи (одевание теплых вещей, поза минимальной теплоотдачи, спазм подкожных сосудов, прекращение потоотделения) температура тела быстро увеличивается, достигая нового установочного значения, которое тем выше, чем выше концентрация в крови вторичных пирогенов (цитокинов).2. Стабилизация повышенной температуры тела. После периода разогрева тела до нового заданного значения наступает стабилизация температуры на более высоком уровне за счет уравновешивания теплоотдачи и теплообразования. В этом состоянии организм способен реагировать на изменения внешней температуры, т.к. функция звеньев системы терморегуляции полностью сохранена, хотя и осуществляется на более высоком уровне. Этим лихорадка отличается от гипертермии (общего перегрева) — экстремального теплового стресса, когда увеличение температуры организма вызвано недостаточной теплоотдачей, в силу чего организм не способен поддерживать свою температуру на постоянном уровне.3. Снижение температуры тела.Теплоотдача начинает превышать теплопродукцию, и температура тела снижается. При этом организм ведет себя так, как организм здорового человека при смещении реальной температуры тела выше нормального значения в условиях внешнего перегрева. В эту стадию активируются механизмы, увеличивающие теплоотдачу: возникает поведение, направленное на облегчение теплоотдачи; расширяются сосуды кожи и увеличивается кожный кровоток, усиливается потоотделение. Происходит некоторое уменьшение теплопродукции за счет уменьшения интенсивности обменных процессов в жировой и мышечной тканях. В эту стадию легко может возникать гипотензия и ортостатический коллапс из-за расширения сосудов кожи и уменьшения общего периферического сопротивления.
Биологическое значение лихорадки: 1) Положительное: уменьшение вязкости крови и увеличение реологических свойств крови - улучшает периферическое кровообращение и микроциркуляцию; гибель м/о или замедление скорости их размножения вследствие повышения температуры тела; усиление бактерицидной активности фагоцитов. 2) Отрицательное: увеличение основного обмена, а следовательно, возможное развитие циркуляторной гипоксии вследствие увеличения потребностей тканей в кислороде; тахикардия, приводящая к нарушению минутного объема крови и делающая циркуляторную гипоксию еще более вероятной; нарушения деятельности ЦНС.
Нарушение функции органов и метаболических процессов при лихорадке. Фармкоррекция лихорадки. Биологическое значение лихорадки. Понятие о пиротерапии.
Кроме расстройств терморегуляции, при лихорадке наблюдается и целый ряд других, нетемпературных изменений, в том числе нарушения обмена веществ, сердечно-сосудистой и дыхательной систем, секреторных и экскреторных функций. Возникает целый комплекс явлений, и трудно различить, какое из них зависит от влияния пирогена, интерлейкина-1 и непосредственно от болезни (пневмония, инфаркт, гепатит), при которой возникла лихорадка.
Наиболее отчетливые изменения - в системе кровообращении. Повышение температуры на 1°С сопровождается учащением пульса на 8 — 10 ударов. Поскольку локальное согревание узла — водителя ритма сердца сопровождается учащением сокращений сердца, то этим объясняют и тахикардию при лихорадке. Ударный и минутный объем крови увеличиваются. В I стадии лихорадки артериальное давление может повышаться, происходит сужение сосудов кожи и их расширение во внутренних органах. В III стадии при критическом снижении температуры может наступить коллапс вследствие резкого снижения тонуса артерий. Тахикардия при лихорадке отмечается не всегда. При некоторых инфекционных заболеваниях температура повышается и в то же время наблюдается брадикардия (брюшной и возвратный тиф — заболевания, протекающие с сильной интоксикацией, когда сердце реагирует не столько на высокую температуру, сколько на действие токсических веществ экзогенного и эндогенного происхождения). Внешнее дыхание в I стадии лихорадки несколько замедляется. В дальнейшем, при достижении максимальной температуры, дыхание учащается, иногда в 2 — 3 раза. Система пищеварения — угнетается отделение слюны (язык сухой, обложенный), уменьшается количество и снижается кислотность желудочного сока, ухудшается аппетит. Однако выраженность этих явлений неодинакова и в значительной степени зависит от характера заболевания. Например, при гриппе эти изменения менее выражены, чем при брюшном тифе. Изменения в эндокринной системы — активизируется система гипофиз — надпочечные железы, наблюдаются признаки стресса. При инфекционной лихорадке усиливается выброс гормонов щитовидной железы, что обеспечивает повышение основного обмена. В центральной нервной системе наблюдаются изменения возбудительных и тормозных процессов. На электроэнцефалограмме появляется медленный альфа-ритм, характерный для торможения коры большого мозга. При введении пирогенов у человека могут отмечаться бессонница, чувство разбитости, усталость, головная боль. При инфекционных заболеваниях все эти явления протекают значительно тяжелее: с потерей сознания, бредом, галлюцинациями. Так как эти явления наблюдаются и при умеренном повышении температуры, то они, очевидно, связаны не столько с повышением температуры, сколько с интоксикацией. Основной обмен при лихорадке повышен, хотя прямая связь между активизацией обмена и повышением температуры отсутствует. Азотистый баланс при ряде инфекционных заболеваний становится отрицательным. Для лихорадки характерно изменение водно-электролитного обмена. В I стадии наблюдается увеличение диуреза вследствие повышения артериального давления и прилива крови к внутренним органам. Во II стадии, в результате усиления продуцирования альдостерона, в тканях задерживается натрий, а следовательно и вода. Диурез уменьшен. В III стадии увеличивается выведение хлоридов, в том числе натрия хлорида, вода "покидает" ткани, увеличивается количество мочи и пота.
Фармкоррекция лихорадки. Основным показанием для использования лекарственной и нелекарственной терапии, направленной на ослабление лихорадки, считают наличие у больного высокой, особенно гиперпиретической температуры тела, сопровождающееся тяжёлыми субъективными ощущениями, выраженными расстройствами регуляторных (особенно, центральных нервных образований) и жизненно важных исполнительных (сердечнососудистой и дыхательной) систем, наличие судорог, беременности, бактериального шока и др. В частности, при повышении температуры тела выше 39°С, а особенно выше 40°С и 41°С рекомендуют использование следующих групп антипиретических (жаропонижающих) препаратов: НПВС; стероидные лекарственные средства (кортизол, кортизон, дексаметазон, преднизолон, преднизон и др.). Установлено, что по жаропонижающему действию НПВС можно расположить в следующем порядке: вольтарен > анальгин > индометацин > напроксен > амидопирин > ибупрофен > бутадион > парацетамол > аспирин. Все НПВС, обладая разным по степени выраженности жаропонижающим действием, нередко приводят к развитию кожных аллергических реакций, головных болей, головокружения, ускорению и усилению развития диспепсий, воспалений и изъязвлений слизистых оболочек пищевода, желудка, кишок и кровотечений из них, а также увеличению тяжести бронхиальной астмы и хронических болезней почек и печени.
Биологическое значение лихорадки. При лихорадке, как и при других типических патологических процессах, вредные и полезные факторы находятся в неразрывной связи. Повышенная температура препятствует размножению многих возбудителей — кокков, спирохет, вирусов. Многие м/о способны размножаться при температуре 40°С, но при этом теряют устойчивость к ЛП. Так, чувствительность туберкулезной палочки к действию стрептомицина при 42°С примерно в 100 раз выше, чем при 37°С.
Лихорадка положительно влияет на целый ряд функций организма: возрастает интенсивность фагоцитоза, стимулируется выработка антител, увеличивается выработка интерферона. Искусственное подавление лихорадки приводит к снижению в крови количества нейтрофильных лейкоцитов, к понижению функций макрофагальных элементов.
Обращает на себя внимание связь между лихорадкой и воспалением. Макрофагоциты не только поглощают и обезвреживают бактерии, но и синтезируют пирогены (ИЛ-1). Если еще учесть, что макрофагоциты вместе с лимфоцитами участвуют в процессе выработки антител (клеточная кооперация), то связь между лихорадкой, иммунитетом и воспалением становится более очевидной.
В положительном влиянии лихорадки на течение основного заболевания большое значение принадлежит стрессу (активизация гипоталамо — гипофизарно — надпочечниковой системы), повышающему неспецифическую резистентность организма.
Защитно-приспособительные реакции организма, мобилизующиеся при лихорадке, сопровождающей инфекционное заболевание, могут быть в значительной степени обесценены развитием интоксикации и повреждением жизненно важных органов. В этих случаях повышение температуры может привести к отрицательным последствиям, так как при лихорадке ряд органов функционируют с дополнительной нагрузкой, в первую очередь сердце и сосуды. При недостаточности кровообращения повышение температуры может вызвать тяжелые состояния, которые следует устранить.
Понятие о пиротерапии. В настоящее время с лечебной целью применяют высокоочищенные препараты пирогенов — пирогенал, пирексаль и др. Пиротерапию используют для лечения поздних стадий сифилиса, костно-суставного туберкулеза и других инфекционных заболеваний.
Применение пирогенов при лечении сифилиса эффективно благодаря тому, что на поздних стадиях болезни возбудитель находится в головном мозге, куда затруднен доступ лекарственных препаратов и антител из-за наличия гематоэнцефалического барьера. Проницаемость этого барьера увеличивается при повышении температуры тела, при котором поднимается общая реактивность и улучшается течение болезни.
Инфекционный процесс, этиология, патогенез, стадии развития.
ИП - выработанный в процессе эволюции типовой патологический процесс, возникающий при взаимодействии микроорганизма с м/о, особенно в неблагоприятных условиях внешней и/или внутренней сред.
ИП представляет комплекс патологических и защитно-компенсаторно-приспособительных реакций различных уровней организации взаимосвязанных морфологических, метаболических, исполнительных и регуляторных (особенно иммунной) физиологических систем, лежащих в основе тех или иных инфекционных болезней (ИБ).
Этиология. Причиной возникновения ИП (как и ИБ) являются различные возбудители, действующие обычно неблагоприятные для м/о условиях. Инфекционные возбудители. К ним относятся самые различные микроорганизмы: простейшие, грибы, бактерии, риккетсии, плазмодии, вирусы, арбовирусы, прионы. Каждый из перечисленных возбудителей определяет прежде всего специфические, а также неспецифические черты инфекционной патологии. Характер и выраженность ИП (как и ИБ) зависит от: основных свойств инфекционного возбудителя; патогенности и вирулентности; особенностей взаимодействия м/о и макроорганизма; тропностью м/о к определенным тканям макроорганизма; исходного состояния макроорганизма (особенно его иммунной системы); исходного состояния внешней среды.
Патогенез. В патогенезе развития ИП ведущую роль играют характер и интенсивность взаимодействия возбудителей инфекций и иммунной системы макроорганизма.
Показано, что при снижении иммунитета (клеточного, гуморального, специфического, неспецифического) усиливается патогенное действие микробов на организм человека. Так, снижение количества и активности только фагоцитов (как макро-, так и микрофагов) способствует возникновению и активизации ИП, особенно его патологических проявлений. Некоторые микробы (герпесвирусы, риккетсии Провацека, туберкулезные микобактерии, микобактерии лепры, бруцеллы, лейшмании, трипаносомы и др.) могут внедряться в макрофаги, там размножаться и их повреждать. Многие вирусы способны существенно снижать различные функции полиморфноядерных лейкоцитов в условиях и инвитро, и инвиво. В частности, вирусы гепатита В, гриппа, ЦМВ способны угнетать процессы хемотаксиса, окислительный метаболизм, бактерицидную активность, фагоцитоз гранулоцитов и т.д.
В патогенезе ИП важную роль играют характер, выраженность и длительность воспаления, лихорадки, гипоксии, расстройств метаболизма, функции как исполнительных систем (сердечнососудистой, дыхательной, пищеварительной, выделительной, детоксицирующей), так и регуляторных систем (иммунной, эндокринной, нервной).
В условиях ослабления защитно-компенсаторно-приспособительных реакций и механизмов усиливается повреждающее действие микроорганизмов (их экзо- и эндотоксинов) на метаболизм, структуру и функции различных уровней организации макроорганизма. На фоне ослабления способности последнего локализовать инфекцию наблюдается ее генерализация, приводящая к выраженным и нарастающим не только местным, но и общим расстройствам различных тканей, органов и систем. Это проявляется развитием микробоносительства (бациллоносительства), утяжелением течения, развитием осложнений, ухудшением исхода ИБ вплоть до гибели больного.
Стадии развития ИП. 1) Инкубационный период — интервал времени от инфицирования макроорганизма до появления первых клинических признаков болезни — характеризуется: размножением и избирательным накоплением микроорганизмов в определённых органах и тканях, которые в ходе ИБ более всего и повреждаются; мобилизацией защитных механизмов организма. Длительность инкубационного периода — от нескольких часов (при острых кишечных инфекциях) до нескольких лет (при СПИДе, прионных инфекциях) — определяется в основном биологическими свойствами возбудителей, в силу чего продолжительность этого периода считают их видовым признаком. 2) Продромальный период — этап ИП от появления первых клинических неспецифических проявлений болезни до полного развития её симптомов. Проявления: снижение эффективности реакций защиты организма; нарастание степени патогенности возбудителя (размножение, выработка и высвобождение эндо- и экзотоксинов); клинические проявления на этом этапе ИП не имеют характерных для данного ИП черт. К ним относятся недомогание, дискомфорт, головная боль, лихорадка, мышечные и суставные боли. Продромальный период выявляется не при всех ИБ и обычно длится от нескольких часов до нескольких суток. 3) Период основных проявлений (разгара) болезни характеризуется развитием типичных для данной болезни признаков. Они зависят от: специфических патогенных свойств возбудителя; характера ответных реакций организма, формирующихся на фоне недостаточности его адаптивных механизмов. Продолжительность этого периода зависит от нозологической формы и колеблется в широких пределах. Для многих ИБ (корь, скарлатина, тифы) характерна относительно постоянная длительность этого периода. В развитии ИБ могут регистрироваться обострения или нарастание клинических проявлений болезни (в форме её нового цикла). 4) Период завершения ИБ имеет несколько вариантов: выздоровление, гибель организма, развитие осложнений, а также бациллоносительство. Выздоровление наступает при благоприятном окончании болезни, происходит постепенное снижение выраженности и исчезновение основных клинических признаков ИП. Выздоровление может быть полным и неполным. Полное выздоровление больных является наиболее частым исходом острого ИП и завершается удалением из организма возбудителя (санацией). Для ИБ характерно то, что клиническое выздоровление наступает значительно раньше, чем ликвидируются структурно-функциональные нарушения, возникшие при ИП. Так, период полного восстановления функций печени после вирусных гепатитов составляет от 6 мес до 1 года, тогда как само заболевание (его клиническая манифестация) продолжается 1—1,5 мес. Как правило, ИБ заканчивается формированием иммунитета, обеспечивающего невосприимчивость организма к данной инфекции при его повторном инфицировании. Эффективность и длительность приобретённого иммунитета существенно различаются при различных ИБ: от выраженного и стойкого, практически исключающего возможность повторного заболевания в течение всей жизни (например, при натуральной оспе, кори), до слабого и кратковременного, допускающего повторное возникновение болезни спустя короткое время (например, при дизентерии). Неполное выздоровление характеризуется сохранением остаточных явлений заболевания. Осложнения. В любом периоде ИБ могут развиться специфические и неспецифические осложнения. К специфическим осложнениям относят те, развитие которых непосредственно связано с основными звеньями патогенеза ИП (например, перфорация стенки кишечника и кишечное кровотечение при брюшном тифе, гиповолемический шок при холере и т.д.). К неспецифическим осложнениям относят состояния, вызванные, например, активацией вторичной инфекции или суперинфекцией. Субклинические формы. Помимо клинически выраженных форм, ИБ могут протекать и субклинически. При этом у больных после инфицирования не регистрируются клинические проявления. Однако при исследовании иммунного статуса и ряда показателей жизнедеятельности организма выявляются специфические для данной ИБ изменения. Бациллоносительство. В ряде случаев ИП сопровождается формированием бациллоносительства — определённого вида адаптации и взаимодействия микро- и макроорганизма. Для бациллоносительства характерно отсутствие эффективных специфических иммунных реакций. Оно формируется у практически здоровых людей, развитие ИП у которых ограничилось первичной адгезией возбудителя.
Роль реактивности, специфических и неспецифических факторов защиты в развитии инфекционного процесса. Принципы терапии инфекционных болезней.
Неспецифическая защита организма хозяина от многообразных возбудителей ИП или ИБ включает следующие механизмы: 1. Механические барьеры и бактерицидные факторы кожи и слизистых, представляющие первую линию неспецифической защиты организма от разнообразных м/о: большая часть микробов через неповрежденные кожу и слизистые глаз, воздухоносных путей, пищеварительного тракта (в силу особенностей их строения) не проникает; некоторые м/о не проходят и через ненарушенные гематогистиоцитарные, гематоэнцефалические, гематолабиринтные и др. внутренние барьеры, в том числе и через мембраны клеток; протективную роль выполняет нормальное количество и соотношение микроорганизмов кожи и слизистых оболочек; здоровая кожа и слизистые обладают бактерицидными свойствами. Это обусловлено наличием на их поверхности секретов, содержащих лизоцим, секреторные IgА и IgМ, гликопротеины, жирные кислоты, молочную кислоту; защитную (бактерицидную и бактериостатическую) роль выполняют также желудочный и кишечный сок. 2. Макро- и микрофаги, представляющие важную линию защиты организма от разных возбудителей: макрофаги (моноциты, клетки фон Купфера, клетки Лангерханса, гистиофаги, альвеолоциты и др.) способны эффективно захватывать и внутриклеточно разрушать различные микробы и поврежденные структуры; микрофаги (гранулоциты: нейтрофилы, эозинофилы, базофилы, тромбоциты, эндотелиоциты, клетки микроглии и др.) в меньшей степени, но также способны захватывать и повреждать микробы. 3. Гуморальные бактерицидные и бактериостатические факторы: лизоцим, разрушая мураминовую кислоту пептидогликанов стенки граммположительных бактерий, вызывают их осмотический лизис; лактоферрин, изменяя метаболизм железа в микробах, нарушает их жизненный цикл и нередко приводит к их гибели; β-лизины являются бактерицидными для большинства гр + бактерий; факторы комплемента, оказывая опсонизирующее действие, активизируют фагоцитоз микробов; система интерферонов (особенно α и γ) проявляет отчетливую неспецифическую противовирусную активность; деятельность как микроворсинок и железистых клеток слизистой воздухоносных путей, так и потовых и сальных желез кожи, выделяющих соответствующие секреты (мокроту, пот и сало) способствуют удалению из организма определенного количества различных микроорганизмов.
Специфические формы защиты макроорганизма осуществляются с участием иммунной системы и являются наиболее эффективными механизмами защиты организма при развивающемся ИП. Общеизвестно, что микробы содержат различные чужеродные антигенные детерминанты, которые здоровая иммунная система макроорганизма не только распознает, но и стремится их уничтожить. В ответ на внедрение микроорганизмов в организм человека (через те или иные входные ворота) формируется его иммунный ответ с участием как клеточных, так и гуморальных механизмов. Показано, что в ответ на внедрение микробов, которые размножаются в организме хозяина внеклеточно преимущественно формируется гуморальный иммунный ответ. В ответ же на поступление в макроорганизм микробы, которые размножаются в нем внутриклеточно, преимущественно развивается клеточный иммунный ответ. Возникающие в инфицированном организме (при столбняке, дифтерии, газовой гангрене) экзотоксины со временем нейтрализуются образующимися антитоксинами (специфическими антителами). В этой связи патогенное действие токсинов ослабевает и может исчезать. При гематогенном распространении вирусов по организму (например, при кори, полимиелите, эпидемическом паротите) формируется преимущественно системный гуморальный ответ. При размножении микробов в месте внедрения (например, при гриппе) включаются механизмы местного иммунитета (с участием IgА). При внутриклеточном размножении вирусов, как и при грибковых заболеваниях, активизируется преимущественно клеточный иммунитет. В ответ на внедрение в организм возбудителей протозойных инфекций (например, при глистных инвазиях) активизируется как специфический (с участием IgЕ, а также Т-лимфоцитов), так и неспецифический (с участием различных макро- и микрофагов) иммунный ответ. Доказано, что в ответ на одни инфекционные возбудители может развиваться кратковременный иммунитет, на другие - непродолжительный, на третьи - длительный или пожизненный. Это зависит не только от вида возбудителя, его входных ворот и путей распространения и колонизации, но и от состояния иммунной системы макроорганизма.
Принципы лечения инфекционного процесса. В терапии ИП выделяют: 1) Этиотропная терапия направлена на ослабление жизнедеятельности и повреждения инфекционного возбудителя и на создание благоприятных для жизни макроорганизма условий. Для этого, в частности, назначают следующие группы лекарственных препаратов: противовирусного действия (сыворотки, производные адамантана, ремантадин, интерфероны, ингибиторы траскриптазы и ДНК-полимераз и др.), антибактериального действия (антибиотики, сульфаниламиды, хинолоны, бактериофаги, Ig и др.), противогрибкового действия (азолы, фторцитозин, аморолфин, гризеофульвин и др.), - антипротозойного действия (сульфоны, хинин, метронидазол, хлорохин, сульфаниламиды и др.). 2) Патогенетическая терапия призвана блокировать основное, ведущие и второстепенные звенья патогенеза ИП. Для этого, в частности, назначают следующие средства: детоксицирующего действия (антитоксические сыворотки, гемодиализ, плазмаферез, плазмазамещающие растворы и др.), противовоспалительного действия (ослабляющие процессы альтерации, экссудации, метаболические расстройства, улучшающие процессы микроциркуляции, эмиграции фагоцитов и их фагоциторную активность), иммунотерапевтического действия (введение специфических сывороток, вакцин, интерферонов и др.), иммунокоррегирующего действия (применение иммуномодуляторов, средств десенсибилизирующего воздействия, фитоадаптогенов: препаратов семейства аралиевых, толокнянковых и др.), восстанавливающие основные гомеостатические параметры (в том числе, кислотно-основное состояние, водно-электролитный баланс, РО2, РСО2, ОЦК, реологические свойства крови). 3) Саногенетическая терапия направлена на активизацию защитно-компенсаторно-приспособительных реакций и механизмов, в том числе на ускорение процессов репаративной регенерации. 4) Симптоматическая терапия призвана облегчить общее состояние больного, уменьшить или устранить у него различные симптомы ИП, в том числе субъективно негативные ощущения. Для этого, в частности, назначают мероприятия и средства, ослабляющие или ликвидирующие головную и другие виды боли, страх, нарушения сна, аппетита, общую слабость и др.
Иммунологическая реактивность. Роль Т и В-лимфоцитов в иммунном ответе. Первичные и вторичные иммунные ответы. Понятие об иммунологической толерантности.
Иммунологическая реактивность - способность организма отвечать на действие антигенов образованием антител и комплексом клеточных реакций, специфических по отношению к данному антигену.
Существует два механизма иммунологической реактивности: гуморальный и клеточный. Гуморальный тип иммунного ответа направлен прежде всего на внеклеточные бактерии и вирусы. Эффекторным звеном этого типа ответа являются антитела (иммуноглобулины) — продукты деятельности В-лимфоцитов. Клеточный тип иммунного ответа направлен на защиту от внутриклеточных инфекций и микозов, внутриклеточных паразитов и опухолевых клеток. Его Эффекторным звеном являются иммунные Т-лимфоциты, несущие специфические рецепторы к данному антигену.
Иммунный ответ – реакция клеток иммунной системы (с участием Т и В-лимфоцитов), развивающаяся при контакте с «чужими» или измененными «своими» антигенами и клетками, их несущими. На его начальном этапе происходит распознавание антигена лимфоцитами, имеющими специфические рецепторы к данному антигену. В последующем эти лимфоциты размножаются и дифференцируются в различные эффекторные клетки и клетки памяти. Функции Т-лимфоцитов: 1. Цитотоксичность (киллерная функция) - способность уничтожать (убивать) клетки, несущие на своей поверхности антигены; 2. Кооперативная (хелперная) функция - способность обеспечивать взаимодействие разных субпопуляций Т-лимфоцитов, В-лимфоцитов и макрофагов. 3. Образование БАВ - лимфокинов. 4. Супрессорная функция – угнетение избыточного иммунного ответа, участие Т-лимфоцитов в формировании иммунологической толерантности. Указанные функции выполняют специализированные субполяции Т-лимфоцитов: Т-киллеры, Т-хелперы, Т-продуценты лимфокинов , Т-супрессоры. Функции В-лимфоцитов: образование антител (иммуноглобулинов). Под действием антигенного стимула В-лимфоциты определенного клона претерпевают изменения (бластрансформацию) и превращаются в плазматические клетки. Последние продуцируют иммуноглобулины пяти классов: IgM, IgG, IgE, IgA, IgD.
Первичные и вторичные иммунные ответы.
Первичный иммунный ответ возникает при первой встрече со специфическим антигеном. Хотя антиген распознается почти сразу после попадания в организм, проходит несколько дней, прежде чем выработается достаточное количество иммуноглобулина, чтобы можно было обнаружить увеличение уровня иммуноглобулинов в сыворотке. В течение этого латентного периода те B-клетки, с рецепторами которых прореагировал специфический антиген, проходят от шести до восьми последовательных циклов деления, прежде чем образуется достаточно большой клон плазматических клеток, секретирующих антитела. Выделяют 4 стадии первичного иммунного ответа. На первой стадии, которая занимает 3-4 сут, антитела к соответствующему антигену в сыворотке отсутствуют. На второй стадии появляются IgМ, а спустя 10-14 сут после контакта с антигеном — IgС. На третьей стадии уровень антител остается постоянным. Четвертая стадия первичного иммунного ответа обычно растягивается на месяцы. Она характеризуется постепенным снижением уровня антител. Вторичный иммунный ответ развивается при повторном контакте с антигеном. Антитела, главным образом IgG, появляются быстрее и в более высоком титре, чем при первичном иммунном ответе. Следует также отметить, что распадаются медленнее, чем IgM.
Вторичный иммунный ответ возникает при повторной встрече с антигеном. Повторное распознавание происходит немедленно и производство иммуноглобулинов сыворотки, выявляемое при лабораторных исследованиях, происходит более быстро (за 2-3 дня), чем при первичном ответе. IgG — основной иммуноглобулин, секретируемый во время вторичного ответа. Кроме того, пиковый уровень выше и снижение происходит более медленно, чем при первичном ответе.
Иммунологическая толерантность - это состояние специфической иммунологической ареактивности к данному антигену, обусловленное предыдущим контактом с этим антигеном. При этом способность организма давать иммунный ответ на все остальные антигены сохранена. Механизмы, лежащие в основе иммунологической толерантности: 1. Обусловленная антигеном элиминация или блокада антигенспе-цифичных клонов лимфоцитов (пассивная, "классическая" иммунологическая толерантность). Этот механизм составляет основу естественной иммунологической толерантности к собственным антигенам. 2. Активация антигенспецифичных Т-супрессоров (активная толерантность).
Иммуноциты – клетки иммунной системы. Развитие, функции и взаимодействие иммуноцитов и макрофагов в иммунных реакциях.
Главными "спецагентами" иммунной системы являются лимфоциты (иммуноциты), происходящие из стволовых клеток костного мозга. Лимфоциты подразделяются на В-лимфоциты и Т-лимфоциты. В-лимфоциты продуцируют иммуноглобулины, с действием которых связаны механизмы гуморального иммунитета. Т-лимфоциты подразделяются на субпопуляции по своим функциям и носят названия: Т-хелперы, Т-супрессоры, Т-киллеры и др. Эти клетки обеспечивают реакции клеточного иммунитета. Важной клеткой иммунной системы является макрофаг, который способен захватывать и переваривать микробы, представлять информацию о них другим иммунокомпетентным клеткам в виде антигенов на своей поверхности и синтезировать низкомолекулярные информационные вещества, называемые цитокинами, которые активируют разнообразные иммунные реакции. По современным данным макрофаги являются полифункциональными клетками. Образуются макрофаги из моноцитов после их выхода из кровеносного русла. Макрофаги характеризуются структурной и функциональной гетерогенностью в зависимости от степени зрелости, области локализации, а также от их активации антигенами или лимфоцитами. Защитная функция макрофагов проявляется в разных формах: 1) неспецифическая защита (посредством фагоцитоза экзогенных и эндогенных частиц и их внутриклеточного переваривания); 2) выделение во внеклеточную среду лизосомальных ферментов и других веществ; 3) специфическая (или иммунологическая защита – участие в разнообразных иммунных реакциях).
Иммунокомпетентные клетки составляют основу лимфоидной ткани. В отличие от других органов и систем с определенной "географией", лимфоидная ткань распределена по всему телу в виде структурных образований, подразделяющихся на центральные (костный мозг, вилочковая железа) и периферические (лимфатические узлы, селезенка, миндалины, пейеровы бляшки кишечника, аппендикс, кровь, лимфа) органы иммунной системы. К периферическому отделу иммунной системы относят также лимфоидные скопления в слизистых оболочках кишечника, мочеполового тракта, органов дыхания, иммуноциты кожи.
Лимфоциты и макрофаги входят в структуру органов или циркулируют по организму, осуществляя работу в любом отдаленном уголке, где им приходится бороться с микробами, уничтожать собственные поврежденные или отработавшие свой срок клетки, а также клетки-мутанты, которые способны дать начало опухолевому росту. Клетки иммунной системы участвуют в заживлении ран, разглаживании рубцов и рассасывании спаек. Ни одна болезнь не протекает без участия иммунной системы, и чем более ослаблена или повреждена иммунная система, тем медленней протекает процесс выздоровления.
Иммунодефицитные состояния, виды, этиология, патогенез, клинические проявления.
Иммунодефицитные состояния – самостоятельные заболевания (нозологические формы) и сопутствующие синдромы, характеризующиеся недостаточностью иммунной системы.
Виды: 1) первичные – наследуемые и врожденные (генетические) дефекты иммунной системы; 2) вторичные – иммунная недостаточность развивается вследствие эндо- и экзогенных воздействий на нормальную иммунную систему (например около 90% всех вирусных инфекций сопровождается транзиторной иммунодепрессией); 3) избирательные – вызваны селективным поражением различных популяций иммунокомпетентных клеток; 4) неспецифические – дефекты механизмов неспецифической резистентности организма (неспецифического иммунитета), фагоцитов и комплимента; 5) комбинированные – сочетанное поражение клеточных и гуморальных механизмов иммунитета (например, В- и Т-лимфоцитов).
Этиология: Первичные иммунодефициты проявляются развитием инфекционных поражений организма вскоре после рождения, но могут не иметь клинических проявления и до более позднего возраста. Причина: генные и хромосомные дефекты (многочисленные иммунодефициты разных классов). Вторичные иммунодефициты. Причины: иммуносупрессивные препараты(включая фенитоин, пеницилламин, глюкокортикоиды); недостаточность питания, полостного и мембранного пищеварения, а также кишечного всасывания; наркотики и токсические вещества; лучевое воздействие, химиопрепараты; рост злокачественных опухолей; вирусы (ВИЧ); состояния, приводящие к потере белка (нефротический синдром); гипоксия; гипотиреоз; уремия; аспления.
Патогенез: В основе патогенеза комбинированных ИДС лежит: 1. Недостаточность ферментов пуринового метаболизма; 2. Отсутствие ферментов-рекомбиназ. Эти ферменты отвечают за работу генов, кодирующих структуру антигенраспознающих рецепторов лимфоцитов. При комбинированных ИДС объектом повреждения является стволовая клетка. Ретикулярная дисгенезия: Блокада развития и созревания - на уровне стволовой клетки. Стволовая клетка может: а) отсутствовать; б) утрачивать способности к дифференцировки в Т - и. В лимфоциты и в макрофаги. В организме не могут образовываться ни лимфоциты, ни макрофаги. В результате при поступлении в организм Ag любой способ защиты от него невозможен: отсутствуют клеточный иммунный ответ, гуморальный иммунный ответ и фагоцитоз. У больных ретикулярной дисгенизией: 1) в крови полное или почти полное отсутствие лимфоцитов, фагоцитов, АТ любого класса. 2) со стороны первичных и вторичных лимфатических органов отмечается недоразвитие тимуса, селезенки, лимфатических узлов. 3) Клинически: а) частые бактериальные, вирусные и грибковые заболевания; б) диспепсические расстройства ЖКТ (причина - тяжелый кандидоз пищеварительной системы); в) тяжелое течение вакцинаций, которые часто заканчиваются смертью; г) выраженная задержка роста. 4) реакция отторжения трансплантанта отсутствует, так как не реализуется Т-клеточный ответ иммунной системы. Частый вариабельный иммунодефицит: Наследуется - по аутосомно-рецессивному типу. Основное звено патогенеза: блокада созревания В-лимфоцитов до зрелых форм. Частота - 20-90 случаев на 1 млн населения (высокая). В крови: а) зрелые В-лимфоциты отсутствуют, но постоянно имеются предшественники В-лимфоцитов - лимфобласты. Эти предшественники В-лимфоцитов не дифференцируются до зрелых форм; б) выраженная гипогаммаглобулинемия; в) понижение активности 5-нуклеотидазы в лимфоцитах; г) дефекты развития Т-лимфоцитов.
Тяжелый комбинированный иммунодефицит: В патогенезе - блокада созревания и развития находится на уровне стволовой клетки. Наследование - по аутосомно-рецессивному типу и может быть связано с Х-хромосомой. В основе заболевания лежит: а) дефицит аденозиндезаминазы (АДА); б) дефицит пуриннуклеозиддезаминазы;
в) нарушение антигенраспознающей системы лимфоцитов. У больных с тяжелым комбинированным ИДС выявляют: а) понижение содержания в крови Т- и В-лимфоцитов; б) повышение концентрации в крови всех Ig или полное их отсутствие; в) нарушение клеточного и гуморального иммунного ответа при поступлении Ag в организм; г) угнетение образования ИЛ-2 клетками иммунной системы.
Клинические проявления:
1) врожденных иммунодефицитных состояний очень разнообразны. Они варьируют от тяжелых симптомов, вызванных перенесенными инфекциями или вакцинациями, до средних и легких рецидивирующих и трудно диагностируемых болезненных явлений. Врожденные или первичные иммунодефициты являются одними из частых причин ранней детской смертности. У больных с иммунной недостаточностью в семейном анамнезе имеются сведения о заболеваниях тяжелыми рецидивирующими воспалениями кожи, слизистых, дыхательных и пищеварительных путей (отитах, бронхопневмониях, энтеритах, пиодермиях, кандидозах, сепсисе и др.). При дефиците В-лимфоцитов развиваются бактериальные инфекции, вызванные пневмококками, стрептококками, менингококками. Для дефицита Т-лимфоцитов характерны вирусные, грибковые и микобактериальные инфекции. У детей с дефицитом Т-системы вирусные инфекции протекают в тяжелой форме. При иммунной недостаточности дети трудно переносят противовирусные и противобактериальные вакцинации, причем вплоть до смертельного исхода.
Аутоиммунные состояния, механизмы развития. Лекарственная аллергия.
Эти заболевания могут возникнуть при воздействии неблагоприятных факторов окружающей среды. В основе патогенеза аутоиммунных патологий лежит нарушение работы Т-лимфоцитов (супрессоров). В результате иммунная система начинает проявлять агрессию против собственных (здоровых) клеток своего же организма. Происходит «самоповреждение» тканей или органов.
Аутоиммунные заболевания имеют наследственную предрасположенность. К этим болезням относятся ревматоидный артрит, системная красная волчанка, узелковый периартрит, склеродермия, системные васкулиты, дерматомиозит, ревматизм, анкилозирующий спондилоартрит (болезнь Бехтерева), некоторые заболевания нервной системы (например, рассеянный склероз) и т. д. У всех аутоиммунных заболеваний имеется развитие по принципу порочного круга. Схематично этот круг можно описать следующим образом. Когда чужеродные агенты (бактерии, вирусы, грибок) внедряются в клетку, то развивается воспалительная реакция, имеющая своей целью изолировать, отторгнуть вредный агент. При этом собственная ткань изменяется, отмирает и сама становится для организма инородной, и уже на нее начинается выработка антител, в результате чего вновь развивается воспаление. Когда оно достигает стадии некроза, то некротическая ткань тоже становится антигеном, вредным агентом, на который опять вырабатываются антитела, в результате чего опять возникает воспаление. Антитела и воспаление разрушают эту ткань. И так происходит бесконечно, образуется болезненный и разрушительный круг. Первичного агента (бактерии, вируса, грибка) уже нет, а болезнь продолжает разрушать организм. Группа аутоиммунных заболеваний довольно большая, и изучение механизмов развития этих болезней имеет огромное значение для выработки тактики их лечения и профилактики, так как большинство из этих заболеваний приводят больных к инвалидности.
Особенно значительную долю среди аутоиммунных болезней занимают коллагенозы, васкулиты, ревматические поражения суставов, сердца, нервной системы.
Механизмы развития. А) Связанные с антигенами: 1) демаскирование естественных эндоаллергенов (нарушение целостности специализированных гистогематических барьеров); 2) образование приобретенных эндоаллергенов (действие факторов, изменяющих конформацию собственных белков). Б) Связанные с иммунной системой: 1) отмена иммунологической толерантности к нормальным компонентам клеток (нарушения Т-супрессоров); 2) появление в результате мутации «запретных» клонов лимфоцитов, воспринимающих «свое» как «чужое».
Лекарственная аллергия.
Скорость развития и степень выраженности аллергической реакции нередко определяются способом введения лекарственного препарата. Известно, что при местном использовании лекарственных веществ (в виде аппликаций на слизистую оболочку рта или кожу) возникает самая высокая опасность сенсибилизации. Частота аллергических реакций при внутримышечном введении препаратов ниже, чем при аппликационном. С наименьшей опасностью в этом плане сопряжен пероральный способ введения лекарств. Также доказано, что сенсибилизация развивается чаще всего при высокой дозировке препарата, чем при низкой. Особенно это выражено при местном приеме лекарственных веществ, когда концентрация вещества более важна, чем его абсолютное количество. Патогенез. В патогенезе лекарственной аллергии может лежать любой тип аллергической реакции или чаще их сочетание, что может быть обусловлено индивидуальной реактивностью организма, наличием общесоматических заболеваний, характером лекарственного аллергена, способом его введения и др., поэтому деление аллергических реакций на немедленный и замедленный тип в клинике отчасти условно. Возможно одновременное существование двух видов гиперчувствительности, вызванное действием нескольких детерминантных групп одного или разных лекарственных препаратов. Клинические же проявления и тяжесть течения лекарственной аллергии обусловлены преобладанием какоголибо типа гиперчувствительности в общем течении заболевания или на определенном его этапе.
Лекарственная аллергия может проявиться в виде анафилактического шока, отека Квинке, являющихся преимущественно реакциями немедленного типа , где основную роль играют гуморальные антитела. Однако довольно часто аллергические реакции с лекарственными аллергенами протекают по замедленному типу.
Клинические проявления лекарственной аллергии замедленного типа чрезвычайно многообразны, от локализованного поражения кожи и слизистой оболочки рта до поражения различных органов и систем (желудочнокишечного тракта, органов дыхания, почек и др.).
Аллергия, определение понятия. Классификация аллергенов.
Аллергия – иммунная реакция организма, которая сопровождается повреждением собственных тканей. Это качественно измененная реакция организма на действие веществ антигенной природы, вызывающая различные структурные и функциональные нарушения.
Аллергены – вещества антигенной природы, вызывающие аллергию.
Классификация: 1) В зависимости от строения: полные и неполные (гаптены); 2) В зависимости от происхождения: экзогенные и эндогенные.
Экзогенные аллергены классифицируют: 1) По способу проникновения в организм: а) ингаляционные, б) пищевые, в) контактные, г) инъекционные; 2) По происхождению: а) растительного, б) животного, в) инфекционного происхождения, г) синтетические; 3) В зависимости от источника поступления в организм: а) бытовые (домашняя пыль), б) промышленные (бензол, формалин), в) пищевые, г) лекарственные, д) пыльцевые, е) эпидермальные (шерсть животных).
Эндогенные (аутоаллергены) аллергены делят на: 1) Естественные – нормальные, неизмененные белковые компоненты ряда органов и тканей: мозга, глаз, половых желез, щитовидной железы, внутреннего уха; 2) Приобретенные – собственные белки организма, которые изменили свою конформацию вследствие действия на них факторов внешней среды. В зависимости от природы этих факторов приобретенные эндоаллергены могут быть неинфекционными (ожоговые, холодовые, лучевые) и инфекционными.
Этапы аллергии (сенсибилизация, собственно аллергическая реакция, десенсибилизация), характеристика.
Аллергическая реакция является стадийной, выделяют следующие стадии: сенсибилизация - переход от нормальной реактивности к повышенной к какому-либо веществу. Стадия длится от момента первичного попадания аллергена в организм до формирования иммунной реакции на этот аллерген. Механизмы формируются около 2-х недель, сама сенсибилизация может протекать месяцы, годы и даже всю жизнь. Сенсибилизация может быть активной (сам организм вырабатывает механизмы аллергии) и пассивной (при переливании крови от сенсибилизированных лиц к несенсибилизированным). Факторы сенсибилизации: зависящие от аллергена путь проникновения (чаще парентерально или ингаляторно); доза (чаще на небольшие или сверхбольшие количества - сенсибилизирующая доза); природа аллергена (к некоторым аллергенам - 100%-ая чувствительность); длительность воздействия; от состояния иммунологической реактивности (наследственная предрасположенность к некоторым формам аллергии) В эту стадию нет никаких клинических проявлений, установить можно только с помощью лабораторных методов.
Разрешение - возникает в основном на повторное попадание аллергена или (реже) на тот аллерген, который сохраняется в организме более 2-х недель. Это стадия клинических проявлений, которые могут наступать быстро (от нескольких секунд до 6-и часов), это т.н. гиперчувствительность немедленного типа (ГНТ), или медленно (24 - 48 часов) - это т.н. гиперчувствительность замедленного типа (ГЗТ).
Десенсибилизация - возврат к нормальной реактивности, может происходить: спонтанно и наступает сам по себе после устранения действия аллергена; искусственно - после курса введения аллергена в микродозах.
Аллергические реакции. Классификация. Стадии развития аллергических реакций.
Аллергия – иммунная реакция организма, которая сопровождается повреждением собственных тканей. Это качественно измененная реакция организма на действие веществ антигенной природы, вызывающая различные структурные и функциональные нарушения.
Классификация:
1) По происхождению аллергенов: а) аллергические реакции, вызванные экзогенными аллергенами; б) аутоаллергические реакции.
2) По клиническим признакам: а) аллергические реакции немедленного типа (анафилактический шок, аллергический ринит или конъюнктивит) - между разрешающим воздействием аллергена и появлением клинических симптомов проходит несколько секунд или минут; б) аллергические реакции замедленного типа - начинают выявляться спустя несколько часов или суток после разрешающего воздействия аллергена (реакция отторжения трансплантата, туберкулиновая проба, контактный дерматит).
3) По характеру и месту взаимодействия аллергена с эффекторами иммунной системы (классификация Кумбса и Джелла): а) I тип – анафилактические реакции - характеризуется быстрым развитием иммунологических реакций (в пределах нескольких минут) после соединения антигена с антителами, фиксированными на поверхности тучных клеток или базофилов организма, предварительно сенсибилизированного к антигену. Данные реакции могут иметь как общие, так и местные проявления; б) II тип – цитотоксические реакции - реализуется с помощью антител (IgG, IgM), прямо взаимодействующих с антигеном, присутствующим на поверхности клеток или других тканевых (неклеточных) компонентов; в) III тип – иммунокомплексные реакции - вызываются комплексами «антиген-антитело», циркулирующими в биологических жидкостях, в том числе и в плазме крови. Иммунные комплексы активируют различные сывороточные медиаторы аллергии (главным образом, систему комплемента). Комплексы, образовавшиеся в сыворотке крови, оказывают повреждающий эффект на ткани, в особенности, когда они «осаждаются» в стенке сосудов, или когда они задерживаются в фильтрующих структурах - таких как гломерулярный аппарат почек; г) IV тип – гиперчувствительность замедленного типа - вызывается специфически сенсибилизированными Т-лимфоцитами. По скорости развития проявлений после повторного действия антигена (они начинаются через несколько часов или суток) данный тип относят к замедленной аллергии.
4) По патогенезу: а) аллергические реакции гуморального типа – В-лифоцитозависимы (I, II, III типы реакций по Кумбусу и Джеллу) - могут быть перенесены от сенсибилизированного организма к другому (интактному) организму при помощи сыворотки, содержащей гуморальные антитела. Такой способ воспроизведения аллергии получил название «пассивного переноса», а саму аллергию, получаемую таким способом, называют «пассивной», в отличие от «активной аллергии», вызываемой введением в организм аллергена; б) аллергические реакции клеточного типа – Т-лимфоцитозависимые (IV тип реакций по Кумбусу и Джеллу) - могут быть «пассивно» перенесены от одного организма к другому сенсибилизированными Т-лимфоцитами или экстрактом из таких клеток (например, при переливании крови или введении сывороточных препаратов).
Стадии в патогенезе аллергических реакций:
Иммунологическая – период времени от первого контакта аллергена с организмом до взаимодействия этого же аллергена, обычно при повторном поступлении его в организм, с эффекторами иммунной системы (антителами или Т-лимфоцитами). Сущность – сенсибилизация организма.
Патохимическая – период времени от начала взаимодействия аллергена с эффекторами иммунной системы (антителами или Т-лимфоцитами) до появления биологически активных веществ – медиаторов аллергической реакции. Сущность - образование, высвобождение или активация указанных медиаторов.
Патофизиологическая (стадия клинических проявлений) – период времени от начала действия медиаторов аллергических реакций на клеточные и тканевые структуры организма до появления клинических признаков. Сущность – развитие комплекса структурных и функциональных нарушений в организме.
Аллергические реакции анафилактического типа, механизм развития.
Этот тип аллергии, именуемый анафилактическим, характеризуется быстрым развитием иммунологических реакций (в пределах нескольких минут) после соединения антигена с антителами, фиксированными на поверхности тучных клеток или базофилов организма, предварительно сенсибилизированного к антигену. Данные реакции могут иметь как общие, так и местные проявления. Системные реакции развиваются обычно после внутривенного введения антигена, к которому «хозяин» уже сенсибилизирован Возникновение местных реакций зависит от «входных ворот» аллергена и может принимать формы местного кожного отека (крапивница), поражения слизистой носа и конъюнктивы (аллергический ринит и конъюнктивит), сенной лихорадки, бронхиальной астмы или аллергического гастроэнтерита (пищевая аллергия).
У людей анафилактический тип реакций опосредуется IgE (реагинами). Аллерген (чаще всего пыльца растений, трав, некоторые лекарственные средства, животные и растительные белки) стимулирует продукцию этих иммуноглобулинов B-лимфоцитами (при участии T-хелперов), главным образом, в слизистой оболочке и лимфоузлах вблизи «входных ворот» аллергена. Продуцированные подобным образом IgE фиксируются на поверхности тучных клеток и базофилов, имеющих рецепторы, которые обладают высоким сродством к IgE. Не исключено, что некоторое количество таких рецепторов имеется также на поверхности тромбоцитов, макрофагов и гладкомышечных клеток.
Когда тучные клетки или базофилы, «нагруженные» антителами, подвергаются повторной атаке того же аллергена, взаимодействие последнего с включенными в рецепторы IgE сопровождается активацией этих клеток. При этом запускаются два параллельных и взаимозависимых процесса: 1. Дегрануляция тучных клеток и освобождение предсуществующих (первичных) медиаторов; 2. Синтез и освобождение вторичных медиаторов, таких как метаболиты арахидоновой кислоты. Именно эти высокоактивные медиаторы аллергии являются ответственными за клиническую манифестацию реакций анафилактического типа.
К первичным медиаторам, содержащимся в гранулах тучных клеток, относятся: а) биогенные амины (гистамин, серотонин) и аденозин. Первые из названных медиаторов вызывают интенсивное сокращение гладких мышц (особенно бронхов), увеличивают проницаемость сосудов и стимулируют секрецию желез, локализованных в слизистой носа, бронхов и желудка. Аденозин стимулирует высвобождение медиаторов из тучных клеток, вызывает бронхоконстрикцию и ингибирует агрегацию тромбоцитов; б) медиаторы хемотаксиса эозинофилов и нейтрофнлов; в) ферменты, включая протеазы и кислые гидролазы, которые способствуют генерации кининов и активации C3a-комплемента; г) протеогликаны, в том числе и гепарин.
Ко вторичным медиаторам относятся два класса соединений: а) освобождаемые из клеточных мембран под влиянием фосфолипазы A2 липидные медиаторы (производные арахидоновой кислоты - лейкотриены, простагландины, а также фактор активации тромбоцитов); б) цитокины.
Лейкотриены играют важнейшую роль в патогенезе аллергических реакций анафилактического типа. Лейкотриены С4 и D4 являются самыми мощными спазмогенными и вазоактивными агентами. Они в несколько тысяч раз более активны, чем гистамин, по своей способности повышать сосудистую проницаемость и вызывать сокращение гладкой мускулатуры бронхов. Лейкотриен В4 - высокоактивный хемотаксический фактор для нейтрофилов, эозинофилов и моноцитов.
Простагландин D2 вызывает интенсивный бронхоспазм и активирует секрецию слизи.
Фактор активации тромбоцитов (ФАТ) стимулирует агрегацию тромбоцитов, освобождение гистамина и бронхоспазм, усиливает сосудистую проницаемость и вазодилатацию, а также обладает провоспалительным эффектом. Кроме того ФАТ является хемотаксическим фактором для нейтрофилов и эозинофилов.
И, наконец, важная роль цитокинов в реакциях анафилактического типа обусловлена их способностью вовлекать в реакцию и активировать «воспалительные» клетки (гранулоциты, мононуклеары), которые, накапливаясь в тканях, являются дополнительным источником цитокинов и гистамина, что вызывает дальнейшую дегрануляцию тучных клеток. В дополнение к этому заслуживает упоминания и тот факт, что цитокины, секретируемые Т-лимфоцитами, принимают участие в регуляции синтеза IgE, а также роста тучных клеток и эозинофилов. Синтез иммуноглобулинов этого класса регулируется интерлейкинами (IL-4, IL-5, IL-6), секретируемыми T2-лимфоцитами-хелперами. Из этих интерлейкинов IL-4 является абсолютно необходимым для «переключения» В-лимфоцитов на продукцию IgE. Полагают, что склонность некоторых антигенов вызывать аллергические реакции связана с их способностью активировать Т2-лимфоциты-хелперы. В то же время некоторые цитокины, продуцируемые T1-лимфоцитами-хелперами, в частности, γ-интерферон, способны тормозить синтез IgE.
Рост и дифференциация тучных клеток находится под контролем нескольких цитокинов, включая IL-3 и IL-4, а секретируемый Т2-лимфоцитами-хелперами IL-5 является важным фактором дифференцировки и активации эозинофилов.
Соответствующая комбинация отмеченных ранее эффектов медиаторов аллергии определяет клиническую картину того или иного аллергического заболевания.Реакции анафилактического типа могут иметь общие и местные проявления. К системным проявлениям данного типа реакций относится анафилактический шок, а к местным - так называемые атонические формы аллергии.
Аллергические реакции цитотоксического типа, механизм развития.
Этот тип реакций, получивший название цитотоксического или цитолитического, реализуется с помощью антител (IgG, IgM), прямо взаимодействующих с антигеном, присутствующим на поверхности клеток или других тканевых (неклеточных) компонентов.
Различают три категории антигенов, вызывающих цитотоксическую аллергию, и три разных механизма, ее опосредующих. К антигенам, инициирующим реакции данного типа, относят: 1. Компоненты клеточных мембран, имеющие антигенные детерминанты (мембран клеток крови, сперматозоидов, селезенки, почки, печени, сердца, мозга, глаза, щитовидной железы); эти антигены характерны для патогенеза таких состояний, как аутоаллергическая форма гемолитической анемии, лейкопения, тромбоцитопения и др. 2. Экзогенные неклеточные антигены, адсорбированные на клеточной поверхности (чаще всего лекарственные вещества, структурные компоненты микроорганизмов). При реакции антител с такими антигенами, осевшими на поверхности клеток, «обезвреживается» не только чужеродный антиген, но и повреждаются сами нормальные клетки. По такому типу развиваются аутоаллергические формы миокардита, энцефалита, тиреоидита, гепатита. 3. Неклеточные структуры тканей (антигены базальной мембраны клубочков почек, коллагена, миелина), вовлечение которых в аллергические реакции сопровождается повреждением и гибелью расположенных рядом клеток.
К механизмам, реализующим аллергические реакции цитотоксического типа относят: 1. Комплемент-зависимые реакции. Различают два варианта этих реакций: лизис и опсонизацию. В первом варианте антитела реагируют с антигеном, локализованным на поверхности клеток, вызывая активацию системы комплемента и запуская цепь реакций, завершающихся повреждением мембран и гибелью клеток. Во втором, - повышается «восприимчивость» клеток к фагоцитозу путем фиксации антител или С3 фрагмента комплемента на клеточной поверхности (опсонизация). Второй вариант обычно является типичным для вовлечения в аллергические реакции эритроцитов, лейкоцитов и тромбоцитов, а также неклеточных структур тканей (например, базальной мембраны клубочков при гломерулонефрите). Клиническими примерами комплемент-зависимых реакций могут служить: трансфузионные реакции, при которых антигенно-несовместимые клетки донора реагируют с собственными антителами хозяина; эритробластоз плода, при котором имеется антигенная несовместимость между матерью и плодом, и антитела матери (IgG), проникая через плаценту, вызывают деструкцию эритроцитов плода; аутоаллергическая гемолитическая анемия, агранулоцитоз или тромбоцитопения, при которых в организме продуцируются антитела к собственным эритроцитам; отдельные лекарственные реакции. 2. Антитело-зависимые клеточно-опосредованные цитотоксические реакции. При этой форме реакции повреждение клеток происходит без фиксации комплемента, но при участии лейкоцитов. Клетки-мишени, на поверхности которых располагаются IgG, разрушаются под влиянием несенсибилизированных фагоцитов, которые содержат Fc-рецепторы (рецептор к Fc-фрагменту антител, посредством которого происходит связывание антитела, обычно IgG). Посредством Fc-рецепторов фагоциты присоединяются к клеткам-мишеням с последующим лизисом клеток, происходящим без фагоцитоза. Реакции подобного типа могут опосредоваться моноцитами, нейтрофилами, эозинофилами и NK-клетками (естественными клетками-киллерами, оказывающими повреждающее действие на клетки, инфицированные вирусом, и некоторые опухолевые клетки). Антитело-зависимые клеточно-опосредованные реакции используются в тех случаях, когда нужно разрушить клетки-мишени, слишком большие для фагоцитоза (паразиты или опухолевые клетки). Они также играют определенную роль в реакции отторжения трансплантата. 3. Опосредованная антителами дисфункция клеток может возникать в тех ситуациях, когда антитела, реагирующие с находящимися на поверхности клеток рецепторами, нарушают функцию клеток, не вызывая клеточной деструкции или воспаления. Например, при миастении после реакции антител с ацетилхолиновыми рецепторами происходит нарушение нервно-мышечной проводимости, и развивается мышечная слабость.
Аллергические реакции иммуннокомплексного типа, механизмы развития.
Реакции данного типа, обозначаемые как иммунокомплексные или преципитиновые, вызываются комплексами «антиген-антитело», циркулирующими в биологических жидкостях, в том числе и в плазме крови. Иммунные комплексы активируют различные сывороточные медиаторы аллергии (главным образом, систему комплемента). Комплексы, образовавшиеся в сыворотке крови, оказывают повреждающий эффект на ткани, в особенности, когда они «осаждаются» в стенке сосудов, или когда они задерживаются в фильтрующих структурах - таких как гломерулярный аппарат почек.
Повреждения тканей, опосредованные иммунными комплексами, инициируются двумя типами антигенов: 1. Экзогенными - такими как чужеродные белки при инъекциях сыворотки и плазмы крови; инфекционные агенты (бактерии, вирусы, паразиты, грибки); некоторые химические вещества (хинидин, героин). 2. Эндогенными - продуцирующими антитела против собственных тканей.
Клинические проявления патогенного воздействия на организм антигенов, ассоциированных с иммунными комплексами, выражаются в форме гломерулонефритов, инфекционного эндокардита, узелкового периартериита, гемолитической анемии, ревматоидного артрита, системной красной волчанки, сывороточной болезни (подробно рассматривается ниже) и др.
Клиническая симптоматика аллергических реакций иммунокомплексного типа зависит в значительной степени от концентрации антител (IgG и IgM), а также от количества образовавшихся и фиксированных в тканях иммунных комплексов и места их образования. При уже имеющихся в организме антителах экзогенные антигены фиксируются ими в участке инъекции. Развивается местная аллергическая реакция - феномен Артюса-Сахарова, при которой иммунные комплексы образуются и включаются в локальные мелкие кровеносные сосуды кожи. Если антитела к экзогенному или эндогенному аллергену отсутствуют, то последний беспрепятственно попадает в кровоток и оттуда - в различные органы и ткани. Образующиеся в ответ на эту «антигенную агрессию» антитела, а затем и иммунные комплексы, обуславливают развитие генерализованной формы аллергии, например, сывороточной болезни.
Таким образом, расстройства, опосредуемые иммунными комплексами, могут быть общими, если последние образуются в крови и «откладываются» во многих органах, или местными, локализованными в отдельных органах.
Аллергические реакции клеточного типа (гиперчувствительность замедленного типа), механизм развития.
Этот тип аллергии, обозначаемый как клеточно-опосредованный, вызывается специфически сенсибилизированными Т-лимфоцитами. По скорости развития проявлений после повторного действия антигена (они начинаются через несколько часов или суток) данный тип относят к замедленной аллергии. Все аллергические реакции клеточно-опосредованного типа подразделяются на две формы:
1. Замедленные аллергические реакции, инициируемые Т-лимфоцитами совместно с CD4 (CD4 - поверхностная молекула T-лимфоцитов-хелперов, участвующая в их взаимодействии с молекулами главного комплекса гистосовместимости второго класса).
2. Цитотоксические реакции, опосредованные T-киллерами совместно с CD8 (CD8 - поверхностная молекула цитотоксических лимфоцитов, участвующая в их взаимодействии с молекулами главного комплекса гистосовместимости первого класса). Указанные механизмы лежат в основе аллергических реакций к различным микробиологическим агентам, особенно к туберкулезной палочке, а также ко многим вирусам, грибкам, простейшим и паразитам. Другим проявлением клеточно-опосредованных реакций являются контактно-аллергические реакции (контактный дерматит, конъюнктивит), а также реакция отторжения трансплантата.
Патология основного обмена и его коррекция.
Основной обмен — один из показателей интенсивности обмена веществ и энергии в организме; выражается количеством энергии, необходимой для поддержания жизни в состоянии полного физического и психического покоя, натощак, в условиях теплового комфорта. О. о. отражает энергетические траты организма, обеспечивающие постоянную деятельность сердца, почек, печени, дыхательной мускулатуры и некоторых других органов и тканей. Освобождаемая в ходе метаболизма тепловая энергия расходуется на поддержание постоянства температуры тела.
Основной обмен определяют в состоянии бодрствования (во время сна уровень О. о. понижается на 8—10%). Определение О. о. проводят в условиях мышечного покоя; не менее чем через 12—16 ч после последнего приема пищи, при исключении белков из пищевого рациона за 2—3 суток до момента определения О. о.; при внешней температуре комфорта, не вызывающей ощущения холода или жары (18—20°). О.о. обычно определяют методом непрямой калориметрии (по данным газообмена, потреблению О2 и выделению СО2), реже — методом прямой калориметрии (определению изменения температуры, отдаваемой организмом стенкам калориметра).
В условиях патологии основной обмен может, как увеличиваться, так и снижаться. Отчётливые отклонения от нормы энергетического обмена, в частности О.о., — ведущий диагностический признак (клинический симптом) различных заболеваний, особенно нервной, эндокринной, иммунной и пищеварительной систем. Повышение основного обмена обусловленное активацией окислительных процессов, так и разобщением процесса окислительного фосфорилирования, происходит при гипертиреозе, тиреотоксикозе, гиперкатехоламинемии, гиперкортицизме, чрезмерном образовании СТГ, прогестерона, вазопрессина, диэнцефалитах, умеренной гипоксии, стрессе, активации симпатического отдела вегетативной нервной системы, воспалительных заболеваниях, лихорадке, умеренных интоксикациях. Понижение основного обмена, обусловленное угнетением окислительных процессов, отмечают при гипотиреозе, гипокортицизме, чрезмерном образовании катехоламинов, гипо- и авитаминозах, повреждениях гипоталамуса, тяжёлых формах гипоксии, длительном пищевом голодании, хронических воспалительных процессах, переохлаждении организма, отравлении его цианидами и др. Изменения величины основного обмена может происходить в результате нарушений, возникающих на различных этапах энергетических превращений. Они наиболее выражены при расстройствах процессов окисления, сопряжения окисления и фосфорилирования синтеза, транспорта и использования энергии богатых химических (главным образом фосфатных) связей. Это возможно при самых различных видах патологии, возникающих в результате повреждений (например, набуханием, разрушением) митохондрий. Другой выраженный патогенетический механизм, приводящий к существенному уменьшению образования макроэргов (главным образом КРФ и АТФ), а значит и использования их на многообразные специфические и неспецифические функции, в том числе на обеспечение пластического обмена, — разобщение окислительного фосфорилирования. Последнее обычно возникает в результате нарушений в клетках организма дыхательной цепи, главным образом цикла трикарбоновых кислот Кребса. Это происходит под влиянием повреждающего действия вирусов (гриппа и др.), бактерий (например, золотистого стафилококка), токсинов (стафилококкового, дифтерийного и др.), ядов (2,4-динитрофенола, урамицидина и др.). Разобщающим окислительное фосфорилирование действием обладают многие ФАВ, в частности избыточное количество тиреоидных гормонов, прогестерона, СТГ, вазопрессина, а также недостаток некоторых витаминов, особенно В1, В2, В6, Е, С и др.
Коррекция основного обмена. Сбалансированное питание и рациональный режим труда и отдыха.
Основные этапы нарушения белкового обмена в организме. Патология переваривания и всасывания белков.
Этапы нарушения белкового обмена: 1) Несоответствие поступления белка в организм потребностям в белке. Оптимальное общее количество белка, которое должно поступить в организм, колеблется в диапазоне 1,5—2,5 г на 1 кг массы тела в сутки. Белок, поступающий в организм, должен восполнять как общий его расход, так и потребность в незаменимых аминокислотах, которые не синтезируются в организме и поступают только с пищей. Следовательно, в организм должно вводиться такое количество белоксодержащих продуктов, которое обеспечивает необходимое количество каждой из незаменимых аминокислот. Виды несоответствия количества и состава белка потребностям организма: а) недостаток поступления белка в организм (проявления: несбалансированная алиментарная недостаточность белка – квашикор; сбалансированная алиментарная недостаточность белка – алиментарная дистрофия); б) избыток поступления белка в организм (проявления: положительный азотистый баланс, диспепсия, дисбактериоз, отвращение к белковой пище); в) нарушение аминокислотного состава потребляемого белка (проявления: отрицательный азотистый баланс, замедление роста и развития организма, недостаточность процессов регенерации тканей, уменьшение массы тела, снижение аппетита и усвоения белка). 2) Нарушение расщепления белка в ЖКТ. К расстройствам пищеварения, приводящим к нарушению обмена белка, относят: а) нарушения расщепления белка в желудке. Причины: гипоацидные состояния (например, при атрофии слизистой оболочки); снижение содержания и/или активности пепсина, резекция части желудка. Последствия и проявления: нарушения набухания белка, торможение переваривания коллагенового компонента продуктов, недостаточное расщепление белков мышечных волокон, замедление эвакуации пищи в двенадцатиперстную кишку; б) нарушения переваривания белка в тонкой кишке. Причины: факторы (в том числе наследственные), вызывающие расстройства пищеварения в кишечнике, включая синдромы мальабсорбции (синдромы нарушенного всасывания). Проявления: креаторея, целиакия глютеновая — синдром, характеризующийся нарушением полостного и мембранного переваривания белков, а также торможением всасывания аминокислот, недостаточность энтерокиназы (причина — мутация гена) приводит к существенному снижению протеолитической активности кишечного сока. Это проявляется гипотрофией органов и тканей, снижением массы тела, вторичными иммунодефицитами, гипопротеинемией, отёками, дисбактериозом, осмотической диареей, расстройства пищеварения в тонкой кишке имеются и при других заболеваниях: язвенном колите, хронических энтеритах, дивертикулах кишечника, панкреатитах. 3) Нарушения содержания белков в плазме крови. Уровень протеинемии является результатом соотношения процессов протеосинтеза и протеолиза в различных тканях и органах. В норме содержание белков в плазме крови составляет 1% её массы (альбумины около 56%, а четыре фракции глобулинов [α1, α2, β1 и γ] примерно 44%). В состав каждой фракции входят белки, выполняющие различные функции (транспортную, ферментативную, иммунную и др.). Виды: а) гиперпротеинемии – увеличение общего содержания белков в плазме крови, б) гипопротеинемия – уменьшение общей концентрации белков в плазме крови, в) паропротеинемии - наблюдаются при: миеломной болезни – опухолевые плазмоциты продуцируют аномальные легкие или тяжелые цепи молекул Ig; лимфомах – синтезируются аномальные Ig, обладающие повышенной агрегируемостью. 4) Нарушения трансмембранного переноса аминокислот. Различные нарушения трансмембранного переноса аминокислот встречаются в общей популяции в 0,3—0,6%. Их причины: мембранопатии различного генеза (первичные — моногенные дефекты и вторичные). Мембранопатии приводят к нарушениям транспорта аминокислот на нескольких этапах: из кишечника в кровь, из крови в гепатоциты, из первичной мочи в кровь, из крови в клетки органов и тканей. Примеры: синдром Фанкони, цистинурия, цистиноз нефропатический, отравления солями тяжёлых металлов (например, меди, кадмия, свинца, ртути), эндотоксинемии (например, интоксикация избытком соединений меди). 5) Расстройства метаболизма аминокислот. Нарушения обмена аминокислот, как правило, существенно изменяют метаболизм белков и приводят к расстройствам обмена нуклеиновых кислот, липидов, витаминов, углеводов, электролитов и воды. Различают первичные (наследственные, врождённые) и вторичные (приобретённые, симптоматические) расстройства метаболизма аминокислот. Примеры первичных расстройств: фенилкетонурия, тирозинопатии (альбинизм, тирозинемии, тирозинозы), алкаптонурия, ацидемия изовалериановая, лейциноз, гомоцистинурия и др.). 6) Расстройства конечных этапов катаболизма белков. Расстройства конечных стадий катаболизма белка характеризуются нарушением образования и дальнейших изменений мочевины, мочевой кислоты, аммиака, креатинина, индикана, а также их выведения из организма.
Патология переваривания и всасывания белков. В пищеварительном тракте белки расщепляются под влиянием протеолитических ферментов. При этом, с одной стороны, белки и другие азотистые соединения, входящие в состав пищи, теряют свои специфические особенности, с другой — из белков образуются аминокислоты, из нуклеиновых кислот — нуклеотиды и т.д. Образовавшиеся при переваривании пищи или находившиеся в ней азотсодержащие вещества с небольшой молекулярной массой подвергаются всасыванию. Различают первичные (при различных формах патологии желудка и кишечника — хронических гастритах, язвенной болезни, раке) и вторичные или функциональные расстройства секреторной и всасывательной функции эпителия в результате отека слизистой оболочки желудка и кишечника, нарушения переваривания белков и всасывания аминокислот в желудочно-кишечном тракте.
Основные причины недостаточного расщепления белков — количественное уменьшение секреции соляной кислоты и ферментов, снижение активности протеолитических ферментов (пепсина, трипсина, химотрипсина) и связанное с этим недостаточное образование аминокислот, уменьшение времени их воздействия (ускорение перистальтики). Так, при ослаблении секреции соляной кислоты снижается рН желудочного сока, что ведет к уменьшению набухания пищевых белков в желудке и ослаблению превращения пепсиногена в его активную форму— пепсин. В этих условиях часть белковых структур переходит из желудка в двенадцатиперстную кишку в неизменном состоянии, что затрудняет действие трипсина, химотрипсина и других протеолитических ферментов кишечника.
Недостаточное образование свободных аминокислот из пищевых белков возможно при ограничении поступления в кишечник секрета поджелудочной железы (панкреатит, сдавление, закупорка протока). Недостаточность функции поджелудочной железы вызывает дефицит трипсина, хемотрипсина, карбоангидразы А, Б и других протеаз, действующих на полипептиды с длинной цепью или расщепляющих короткие олигопеп-тиды, что снижает интенсивность полостного или пристеночного пищеварения.
Недостаточное действие пищеварительных ферментов на белки может возникнуть вследствие ускоренного прохождения пищевых масс по кишечнику при усилении его перистальтики (энтероколиты) либо уменьшении площади всасывания (оперативное удаление значительных участков тонкого кишечника). Это ведет к резкому сокращению времени контакта содержимого химуса с апикальной поверхностью эн-тероцитов, незавершенности процессов энзиматического распада и процессов активного и пассивного всасывания.
Причинами нарушения всасывания аминокислот являются повреждение стенки тонкого кишечника (отек слизистой оболочки, воспаление) или неравномерное по времени всасывание отдельных аминокислот. Это ведет к нарушению (дисбалансу) соотношения аминокислот в крови и нарушению синтеза белка, поскольку незаменимые аминокислоты должны поступать в организм в определенных количествах и соотношениях. Чаще всего отмечается нехватка метионина, триптофана, лизина и ряда других аминокислот.
Нарушения аминокислотного обмена также могут возникнуть в связи с отсутствием конкретной аминокислоты. Так, недостаток лизина (особенно в развивающемся организме) задерживает рост и общее развитие, понижает содержание в крови гемоглобина и эритроцитов. При недостатке триптофана развивается гипохромная анемия. Дефицит аргинина приводит к нарушению сперматогенеза, а гистидина — к развитию экземы, отставанию в росте, угнетению синтеза гемоглобина.
Кроме того, недостаточное переваривание белка в верхних отделах желудочно-кишечного тракта сопровождается увеличением перехода продуктов его неполного расщепления в толстый кишечник и усилением процесса бактериального расщепления аминокислот. Это ведет к увеличению образования ядовитых ароматических соединений (индол, скатол, фенол, крезол) и развитию интоксикации организма этими продуктами гниения.
Голодание. Механизм развития нарушений при синдроме белковой недостаточности.
Голодание — это типический патологический процесс, возникающий вследствие полного отсутствия пищи или недостаточного поступления в организм питательных веществ, а также в условиях резкого нарушения состава пищи и ее усвоения.
Классификация: 1) По происхождению выделяют физиологическое, патологическое и лечебное голодание. Физиологическое голодание характерно для некоторых видов животных во время зимней (сурки, суслики) или летней (пресмыкающиеся) спячки. 2) В зависимости от содержания выделяют следующие виды голодания: а) Полное голодание: а) с употреблением воды; б) без употребления воды (абсолютное), б) Неполное голодание (недоедание), в) Частичное голодание (качественное).
Механизм развития нарушений при синдроме белковой недостаточности.
Белковая недостаточность может быть следствием количественного или качественного несоответствия питания возрасту, например преимущественного использования продуктов с низким содержанием белка (каши) или содержащих белки с низкой биологической ценностью.
Причинами белковой недостаточности могут быть также врожденные нарушения обмена аминокислот, нарушения всасывания белка в кишечнике (например, при глютеновой болезни, энтеропатии экссудативной), повышенные потери белка с мочой при нефротическом синдроме, нарушение синтеза белка, например при хронических болезнях печени. В ряде случаев белковая недостаточность развивается при тяжелых инфекционных болезнях, кровотечениях, ожогах.
Недостаточность белка, часто сочетающаяся с дефицитом энергии, витаминов и микроэлементов, приводит к нарушению развития ребенка, дистрофическим изменениям органов и тканей. Ведущим в патогенезе К. является недостаток в организме ребенка пластических веществ и ферментов, Особенно легко К. развивается у детей раннего возраста, т.к. для обеспечения интенсивных процессов роста и развития необходимо поддержание постоянного положительного азотистого баланса в организме (поступление белков должно превышать их расходование).
Прогноз при квашиоркоре неблагоприятный (в связи со значительной атрофией тонкой кишки и ахилией), а смертность высокая (в основном от инфекций в связи с выраженным иммунодефицитом).
Патология белкового состава плазмы крови. Причины и механизмы развития гипопротеинемий, гиперпротеинемий, парапротеинемий. Понятие о диспротеинемиях.
Изменения в количественном и качественном соотношении белков крови наблюдаются почти при всех патологических состояниях, которые поражают организм в целом, а также при врожденных аномалиях синтеза белков. Нарушение содержания белков плазмы крови может выражаться изменением общего количества белков (гипопротеинемия, гиперпротеинемия) или соотношения между отдельными белковыми фракциями (диспротеинемия) при нормальном общем содержании белков.
Гипопротеинемия возникает главным образом за счет снижения количества альбуминов и может быть приобретенной (при голодании, заболеваниях печени, нарушении всасывания белков) и наследственной. К гипопротеинемии может привести также выход белков из кровеносного русла (кровопотеря, плазмопотеря, экссудация, транссудация) и потеря белков с мочой (протеинурия).
Гиперпротеинемия чаще бывает относительной (сгущение крови). Абсолютная Гиперпротеинемия обычно связана с гиперглобулинемией, как правило, с увеличением уровня утлобулинов (как компенсаторная реакция при пониженном содержании альбуминов в крови, усилении синтеза антител).
Парапротеинемия - появление в крови структурно аномальных и функционально неполноценных белковых тел из группы иммуноглобулинов при миеломной и некоторых других болезнях.
Диспротеинемия сопровождается изменением соотношения различных фракций белков как без изменения, так и с изменением содержания общего количества белков, например, увеличение или снижение альбумин/глобулинового (А/Г) коэффициента, в норме составляющего (1,2 -1,8):1.
В условиях патологии наиболее часто развивается снижение А/Г коэффициента как за счет уменьшения альбуминемии, так и за счет увеличения глобулинемии.
Снижение содержания в крови альбуминов возникает при многих заболеваниях и патологических процессах, в частности, при алиментарном (главным образом, белковом голодании), при обширных воспалительных процессах, ожогах, тяжелых и длительно протекающих инфекционных заболеваниях, нефрозах, циррозах печени и т.д.
Увеличение количества а1- и а2-глобулинов отмечается при многих острых инфекционных и деструктивно-некротических заболеваниях, остром ревматизме, нефрозах, различных злокачественных опухолях, особенно, при карциноме и т.д.
Повышение β-глобулинов в крови возникает при гепатитах, β-миеломе, нефрозах и др.
Возрастание содержания γ-глобулинов в крови обнаруживается при различных хронических воспалительных заболеваниях, циррозах печени, γ-миеломе и т.д. γ-гобулинемии бывают: физиологическими и патологическими, врожденными и приобретенными, количественными и качественными.
Гипо-α1 -лобулинемия характеризуется уменьшением, а гипер-а1 глобулинемия — увеличением способности плазмы переносить α1 липопротеиды, α1гликопротеиды, транскортин (α1-глобулин, связывающий кортикостероидные гормоны) и др.
Гипо- α2-глобулинемия сопровождается снижением, а гипер- α2-глобулинемия - повышением способности плазмы транспортировать а2-липопротеиды, гаптоглобин (α2-гликопротеид, способный связываться с гемоглобином, особенно при гемолизе, с образованием соединения, обладающего пероксидазной активностью), церулоплазмин (Сu2+-содержащий окислительный фермент), а также связываться с гемом гемоглобина, содержащим Fе + и др.
При дефиците β-глобулинов в крови наблюдается уменьшение, а при их повышении - увеличение содержания в плазме β-липопротеинов, трансферина (белка, транспортирующего железо в организме) и др.
Гипогаммаглобулинемия развивается за счет снижения одного или нескольких иммуноглобулинов (IgG, IgМ, IgА). Это сопровождается угнетением как системного, так и локального иммунитета, в частности, уменьшением выработки антител против вирусных и бактериальных токсинов, а также антител против некоторых видов микроорганизмов.
Нередко при дефиците белка в плазме крови и нарушении в ней соотношения белковых фракций (альбуминов, α1, α2, β1, β2 ,γ-глобулинов) в организме возникают множественные порочные круги, способствующие усилению гипо- и диспротеинемии, а также развитию анемии, снижению количества и активности различных (структурных, транспортных и/или ферментных) белков, в том числе переваривающей, моторной, всасывательной, экскреторной и инкреторной активности пищеварительного тракта, еще больше нарушающих белковый обмен, а значит и различных как биологических, так и физиологических процессов.
Нарушение образования и выведения конечных продуктов белкового обмена. Гиперазотемия, виды, патогенез.
Основным конечными продуктами белкового обмена являются аммиак, мочевина и мочевая кислота. Аммиак образуется в результате окислительного дезаминирования, он токсичен, поэтому по мере образования его происходит связывание - мочевинообразование в печени. В других органах и тканях аммиак связывается с помощью реакции амидирования свободных дикарбоновых аминокислот (присоединение аммиака к карбоксильной группе). Главным субстратом амидирования, особенно в нервной ткани, служит глютаминовая кислота, превращающаяся в глютамин присоединяя аммиак. Этот процесс катализируется глютаминазой + АТФ. В структуре глютамина совершается транспорт аммиака в печень и почки, где вновь освобождающийся из глютамина аммиак входит в состав мочевины (в печени) и аммонийных солей (в почках). При усилении дезаминирования содержание глютамина в крови повышается. При длительном возбуждении ЦНС образуется много аммиака и глютаминовой кислоты может не хватить для связывания, что приводит к интоксикации аммиаком. При этом, возможно, снижается еще и активность ферментативных систем, обеспечивающих реакцию амидирования глютаминовой кислоты. Нарушение образования мочевины наблюдается при: 1) поражении печени; 2) белковой недостаточности. Нарушается ферментные системы мочевинообразования, пере- и дезаминирования, развивается недостаток АТФ в результате белковой недостаточности. В крови увеличивается уровень аммиака и свободных аминокислот. Развивается аммиачная интоксикация (нарушение функции ЦНС) - возбуждение вплоть до комы и смерти. 3) Относительная недостаточность мочевинообразования и дезаминирования аминокислот может возникать при значительном усиленном распаде белков в организме (интоксикациях, кахексии при злокачественных новообразованиях, раневое истощение). При этом в кровь поступают и увеличивается содержание: 1) аминокислот; 2) аммиака; 3) продуктов неполного гидролиза - полипептиды - токсическое действие на сосудистую систему - увеличение проницаемости, падение кровяного давления. Все это – продукционная гиперазотемия (при нормальной клубочковой фильтрации), то есть увеличение в крови аминокислот, аммиака, полипептидов и уменьшение азота мочевины. Ретенционная гиперазотемия развивается при патологии почек (при снижении уровня клубочковой фильтрации) - нарушение выделения конечных продуктов белкового обмена. В крови в основном увеличивается азот мочевины. Гипохлоремическая гиперазотемия - сочетание продукционного и ретенционного механизмов. Она развивается при сильных рвотах (беременность, стеноз привратника, непроходимость кишечника) - теряется натрий - эксикоз -усиливается распад белка. Сочетание сгущения крови и накопление в ней азотистых шлаков повышает ее коллоидно-осмотическое давление и понижает гидростатическое давление -уменьшается выделительная функция почек. Гиперазотемия - повышенное содержание в крови азотистых продуктов белкового метаболизма: индикана, мочевины, креатинина и др. Причиной гиперазотемии является нарушение функции почек либо избыточное поступление в кровь азотсодержащих веществ при усиленном белковом распаде. В связи с этим различают гиперазотемию ретеншгонную и продукционную ().
Нарушения образования и выделения мочевой кислоты.Мочевая кислота — это конечный продукт обмена пуриновых оснований, входящих в структуру нуклеиновых кислот. Нарушения образования и выделения мочевой кислоты могут наблюдаться при заболеваниях почек, при лейкозах. Однако наиболее ярко эти нарушения проявляются при подагре. К подагре существует предрасположение в виде доминантно наследуемого повышения уровня мочевой кислоты в крови и, возможно, изменения факторов, поддерживающих мочевую кислоту в растворенном состоянии. Факторами риска возникновения подагры могут быть избыточное поступление пуринов в организм (употребление в пищу большого количества мяса, особенно с вином и пивом); избыточное поступление в организм молибдена, который входит в состав ксантиноксидазы, переводящей ксантин в гипоксантин, который затем превращается в мочевую кислоту; пол (чаще болеют мужчины); пожилой возраст, для которого характерна возрастная гиперурикемия. Механизм повышения уровня мочевой кислоты в крови у больных не совсем ясен. Определенная роль в этом отводится как нарушению выделения мочекислых соединений почками, так и усиленному образованию их из глицерина и других предшественников. Гиперурикемия может сопровождаться отложением солей мочевой кислоты в суставах и хрящах, где в силу слабого кровоснабжения всегда имеется тенденция к закислению среды, что способствует выпадению солей в осадок (особенно при дефекте факторов, поддерживающих их в растворенном состоянии). Отложение солей вызывает острое подагрическое воспаление, сопровождающееся болью, лихорадкой, а также аллергическими проявлениями и заканчивающееся образованием подагрических узлов и деформацией суставов.
Основные этапы нарушения жирового обмена в организме. Нарушение переваривания, всасывания и депонирования липидов.
Жировой обмен - совокупность процессов переваривания и всасывания нейтральных жиров (триглицеридов) и продуктов их распада в желудочно-кишечном тракте, промежуточного обмена жиров и жирных кислот и выведение жиров, а также продуктов их обмена из организма. Понятия «жировой обмен» и «липидный обмен» часто используются как синонимы, т.к. входящие в состав тканей животных и растений входят нейтральные жиры и жироподобные соединения, объединяются под общим названием липиды. Нарушения жирового обмена служат причиной или являются следствием многих патологических состояний.
Нарушение переваривания: происходят в тонких кишках и возникают в результате снижения количества и активности липазы, главным образом, поджелудочного, а также кишечного соков. Это приводит к уменьшению образования продуктов деградации триглицеридов (жирных кислот, р-моноглицеридов, глицерил-фосфохолина). Реализация гидролитического действия липазы может нарушаться не только из-за уменьшения ее количества, но и в результате предварительного снижения эмульгирования жиров. Последнее происходит из-за дефицита желчи и ее основных эмульгаторов - желчных кислот, особенно их солей, лизофосфолипида, углекислого газа, образующегося в результате нейтрализации желудочной соляной кислоты бикарбонатами желчи, поджелудочного и кишечного соков, а также из-за дефицита соляной кислоты желудочного сока. В результате снижения процесса эмульгирования жиров происходит уменьшение доступности жиров (в силу наличия более крупных жировых капелек) для липазы. В силу снижения секреции поджелудочной и кишечными железами холестеринэстеразы и ее активности существенно тормозится расщепление эфиров холестерина.
Нарушение всасывания: происходит в тонких кишках и возникает вследствие: 1) торможения или чрезмерной активизации моторики кишечника; 2) механических, воспалительных, токсических или опухолевых повреждении микро- и макроворсинок, возникающих при острых и хронических энтеритах, болезни спру, брюшном тифе, дисбактериозах, гипокортицизме, длительном лечении антибиотиками и т.д.); 3) дефицита желчных кислот в просвете и на слизистой кишок и торможения образования здесь мицелярных комплексов, состоящих из жирных и желчных кислот, фосфолипидов и холестерина; 4) липидного, белкового, углеводного и витаминного голодания; 5) угнетения как пассивного транспорта мономеров липидов в виде мицелл и даже внемицелярных коротких жирных кислот, так, особенно, активного их транспорта (происходящих в результате избытка двухвалентных ионов, особенно кальция и магния, и их солей (образующих с жирными кислотами плотные мыла, которые не всасываются), и/или недостатка макроэргов (из-за нарушения, главным образом, процессов фосфорилирования). Важно отметить, что липиды в виде ТГ (всосавшихся в нерасщепленном виде и ресинтезированных в стенке кишок), жирных кислот, фосфолипидов после всасывания поступают в кровь воротной вены (10 %) и лимфу (до 90 %) в комплексе с белками. При нарушениях как расщепления, так и всасывания поступивших с пищей липидов, как правило, развивается стеаторея (жидкий, жирный, зловонный, часто выделяющийся кал, который может быть либо обесцвеченным, светлым — при дефиците желчи, либо необесцвеченным, темным — при дефиците поджелудочного сока). Потеря липидов организмом может быть связана не только с нарушением их всасывания через стенку кишечника, но и с выведением их мочой (липидурия), а также с выходом липидов из депо (травматизация больших участков жировой ткани, костного мозга). Липиды теряются в ряде случаев сальными железами кожных покровов. Потеря липидов организмом ведет к развитию гиповитаминозов, ограниченному всасыванию полиненасыщенных высших жирных кислот. Возникает большой дефицит группы предшественников БАВ типа простагландинов, лейкотриентов и других веществ, осуществляющих адаптационные и гомеостатические функции организма.
Нарушения депонирования: избыточное накопление липидов в тканях, не относимых к жировой, происходит в результате развития в различных тканях и органах липидной (жировой) инфильтрации и дистрофии. Липидная инфильтрация — поступление и накопление липидов в различных тканях, не относимых к жировой, и органах. Развивается вследствие постоянной элиминации разнообразных липидов из крови, особенно на фоне торможения их расщепления путём окисления и снижения выведения из тканей липидов (как ранее поступивших из крови, так и ресинтезированных в этих тканях). Липидная дистрофия, или липидоз, — различные по интенсивности и характеру нарушения обмена липидов в клетках организма, возникающие на фоне липидной инфильтрации и характеризующиеся расстройствами структуры (в том числе её белкового компонента) и функций клеток вплоть до образования аномальных видов липидов и их комплексных соединений.
В этиологии избыточного накопления липидов в тканях, не относимых к жировой, важную роль играют такие события: избыток поступающих с пищей липидов, а также углеводов, превышающих энергетические затраты организма; недостаток в организме метионина, липокаина и других ФАВ; интенсивные и длительно действующие стрессорные факторы, вызывающие состояние хронического дистресса; тяжёлые (как острые, так и хронические) инфекционно-токсические факторы; различные виды интенсивной гипоксии; действие разных патогенных факторов, вызывающих как переохлаждение, так и перегревание организма и др.
Ведущие патогенетические факторы, ответственные за избыточное накопление липидов в различных тканях: подавление процессов окислительного фосфорилирования, особенно в митохондриях; угнетение активности окислительных, гидролитических ферментов, в том числе липопротеидлипазы; усиление мобилизации липидов из жировых депо (жировой клетчатки кожи, органов брюшной полости и др.) в результате активизации симпатической нервной системы, симпато-адреналовой системы, синтеза и действия СТГ, АКТГ, ТТГ, тиреоидных гормонов и др.; увеличение образования ЛПОНП, ЛППП, ЛПНП и уменьшение ЛПВП и др.
Этиология и патогенез ожирения и исхудания. Принципы терапии нарушений жирового обмена.
Нормальное содержание жировой ткани у мужчин составляет 15—20% массы тела, у женщин — 20—30%.
Ожирение — избыточное (патологическое) накопление жира в организме в виде триглицеридов. При этом масса тела увеличивается более чем на 20—30%. По данным экспертов ВОЗ, в развитых странах Европы избыточную массу тела имеют от 20 до 60% населения, в России — около 60%. Само по себе увеличение массы жировой ткани не представляет опасности для организма, хотя и снижает его адаптивные возможности. Однако ожирение увеличивает риск возникновения ИБС (в 1,5 раза), атеросклероза (в 2 раза), гипертонической болезни (в 3 раза), СД (в 4 раза), а также некоторых новообразований (например, рака молочной железы, эндометрия и простаты). Причины ожирения: 1) Причина первичного ожирения — нарушение функционирования системы «гипоталамус—адипоциты». Это является результатом дефицита лептина и/ или недостаточности эффектов лептина (по подавлению выработки нейронами гипоталамуса нейропептида Y, повышающего аппетит и усиливающего чувство голода). 2) Вторичное ожирение развивается при избыточной калорийности пищи и пониженном уровне энергозатрат организма. Энергозатраты зависят от степени активности (прежде всего физической) и образа жизни человека. Недостаточная физическая активность является одной из важных причин ожирения. Патогенез ожирения. Выделяют нейрогенные, эндокринные и метаболические механизмы возникновения ожирения. 1) Нейрогенные механизмы ожирения: а) центрогенный (расстройство психики →постоянное непреодолимое стремление к приему пищи →прием пищи →активация системы формирования чувства удовольствия, комфорта →получение удовольствия от съеденной пищи → ожирение); б) гипоталамический (повреждение нейронов гипоталамуса→повышение синтеза и секреции нейропептида Y→стимуляция чувства голода, повышение аппетита→гипосенситизация нейронов гипоталамуса к ингибиторам синтеза нейропептида Y→прием избытка пищи→ожирение). 2) Эндокринные механизмы ожирения: а) лептиновый (абсолютная или относительная лептиновая недостаточность→нарастание чувства голода →повышение аппетита →избыточное потребление пищи→ожирение); б) гипотиреоидный (недостаточность эффекта тиреоидных гормонов→снижение интенсивности липолиза→подавление метаболизма в тканях→снижение энергозатрат организма→ожирение); в) надпочечниковый (активация гликогенеза→гипергликемия→повышение транспорта глюкозы в адипоциты→активация гликолиза в них→ожирение); г) инсулиновый (увеличение числа и/или гиперсинтезация рецепторов инсулина→активация липогенеза в адипоцитах→ожирение). 3) Метаболические механизмы: запасы углеводов в организме относительно малы. Они примерно равны их суточному приему с пищей. В связи с этим выработался механизм экономии углеводов; при повышении в рационе доли жиров скорость окисления углеводов снижается. Об этом свидетельствует уменьшение дыхательного коэффициента (отношение скорости образования СО2 к скорости потребления О2); если этого не происходит (при расстройстве механизма ингибирования гликогенолиза в условиях высокой концентрации жиров в крови), активируется механизм, обеспечивающий повышение аппетита и увеличение приема пищи, направленное на обеспечение необходимого количества в организме углеводов; в этих условиях жиры накапливаются в виде триглицеридов, развивается ожирение.
Истощение и кахексия — патологическое снижение массы жировой ткани ниже нормы. При истощении дефицит жировой ткани может составлять 20—25% и более (при индексе массы тела ниже 20 кг/м2), а при кахексии — ниже 50%. При истощении и особенно при кахексии наблюдаются существенные расстройства жизнедеятельности организма, могущие привести к смерти.
Причины и виды истощения и кахексии: 1) экзогенные причины: а) вынужденное или осознанное полное либо частичное голодание (в последнем случае чаще всего с целью похудания): полное голодание — состояние, при котором в организм не поступают продукты питания (например, при их отсутствии, отказе от еды, невозможности приёма пищи); неполное голодание — состояние, характеризующееся значительным дефицитом пластических веществ и калорий в пище (например, при неполноценном в количественном и качественном отношении питании, однородной пище, вегетарианстве); б) низкая калорийность пищи, не восполняющая энергозатрат организма. 2) эндогенные причины:истощение эндогенного генеза подразделяют на первичное и вторичное. Причины первичного (гипоталамического, диэнцефального) истощения: а) факторы подавляющие синтез нейропептида Y в гипоталамусе: травмы мозга, ишемия гипоталамуса, сильный затяжной психогенный стресс→истощение; б) гипосинтезация клеток-мишеней к нейропептиду Y→истощение. Причины вторичного (симптоматического) истощения: мальабсорбция, дефицит глюкокортикоидов, гипоинсулинизм, гиперпродукция соматостатина, гиперпродукция клетками опухолей ФНОα, повышение синтеза глюкагона → истощение. Патогенез истощения. 1)экзогенное истощение и кахексия - отсутствие или значительный дефицит продуктов питания приводит к развитию цепи последовательных и взаимозависимых процессов: истощение запасов жира→недостаточность биологического окисления→подавление пластических процессов и полиорганная недостаточность→прогрессирующее уменьшение массы тела и нарушение обмена веществ→прогрессирующее уменьшение массы тела. 2) первичные эндогенные формы истощения: а) гипоталамическая - снижение или прекращение синтеза и выделения в кровь нейронами гипоталамуса пептида Y, это приводит к следующим последовательным процессам: прекрашение транс- и парагипофизарной активации эндокринных желез→снижение эффективности реакции метаболитов→торможение процессов накопления жира в адипоцитах→прогрессирующее уменьшение массы тела; б) кахектиновая: подавление синтеза нейропептида Y в гипоталамусе→угнетение активности протеинкиназ, процесса липогенеза→торможение синтеза жирных кислот в адипоциты→истощение запасов жира→прогрессирующее снижение массы тела; в) анорексическая: повторные, эмоционально-негативные стресс-реакции ведут к: избыточной продукции веществ, подавляющих аппетит (серотонина, холецистокинина), повышению продукции кохектина, снижению синтеза нейропептида Y в гипоталамусе, все это ведет к анорексии, которая ведет к прогрессирующему уменьшению массы тела. 3) вторичные эндогенные формы истощения: мальабсорбция, рост новообразований, гипоинсулинизм, гипокортицизм, недостаток эффектов гомонов тимуса ведут к прогрессирующему снижению массы тела.
Принципы профилактики и лечения ожирения: Профилактические и лечебные мероприятия и используемые средства должны быть комплексными и сводится к: назначению низкокалорийной диеты, включающей, во-первых, ограниченное количество не только липидов, но и углеводов, и поваренной соли, во-вторых, увеличенное количество богатых растительной клетчаткой продуктов; соблюдению режима питания, включающего не менее 4-5 разового питания, и использованию большей части суточного количества пищи в первой половине дня; повышению длительной активности (длительная ходьба, плавание, физические упражнения, игры); ослаблению интенсивности и длительности психоэмоционального напряжения, имеющего отрицательное биологическое значение; уменьшению действия на организм разнообразных (физических, химических, биологических, психогенных) патогенных факторов; назначению средств, ограничивающих всасывание и ускоряющих выведение как липидных, так и углеводных моно-, ди- и полимеров; применению средств, восстанавливающих нарушенный как промежуточный, так и конечный обмен липидов, углеводов и белков; устранение или ослабление имеющихся ферментопатий (как приобретенного, так и наследственного происхождения).
Профилактика и лечение истощения должна проводиться как можно раньше, комплексно, эффективно и включать: профилактику и терапию основного и сопутствующих заболеваний и патологических процессов, вызвавших истощение организма; создание положительного пластического и энергетического баланса в организме; дробное, частое, оптимальное в количественном и качественном отношении назначение питательных продуктов животного и растительного происхождения, сбалансированных по белкам, липидам, углеводам, витаминам, ФАВ, макро- и микроэлементам; восстановление нарушенных морфологических, метаболических и физиологических процессов, в том числе устранение или ослабление имеющихся ферментопатий; восстановление основных гомеостатических показателен жизненно важных физиологических и функциональных систем и т. д.
Патология транспортных форм липидов. Гиперлипидемия, ее виды, этиология, патогенез. Понятие о жировой инфильтрации и жировой дистрофии печени.
В кровяное русло липиды поступают из кишечника в воде хиломикронов. Из подкожной жировой клетчатки, легких, костного мозга мобилизуются неэтерифицированные жирные кислоты (НЭЖК), из печени – липопротеиды различной плотности. В норме содержание нейтральных жиров в крови 1-2г/л. Одним из показателей нарушения жирового обмена является гиперлипидемия (свыше 3,5 — 8 г/л). Виды: алиментарная (пищевая) - наблюдается через 2 — 3 ч после нагрузки жиром, достигая максимума через 4 — 6 ч. Через 9 ч содержание жира в крови возвращается к норме. Блокада системы мононуклеарных фагоцитов, спленэктомия, нарушение образования гепарина, активирующего липопротеидлипазу, способствуют более высокой и длительной гиперлипемии. Такой же эффект вызывают натрия хлорид, желчные кислоты, которые являются ингибиторами липопротеидлипазы; транспортная (при перемещении жира из депо в печень) - при обеднении печени гликогеном (голодание, сахарный диабет), а также при повышенном образовании адреналина, кортикотропина, соматотропина, тироксина и 0-липотропина. Введение глюкозы может тормозить транспорт липидов, поскольку из глюкозы при наличии инсулина синтезируются гликоген и триглицериды; ретенционная (вследствие задержки жира в крови, например, в связи с изменением соотношения белковых фракций крови при постгеморрагической анемии, нефротическом синдроме). Так, при атеросклерозе гиперлипемия связана с уменьшением в крови содержания гепарина и низкой активностью липопротеидлипазы, при диабете — дефицитом липокаической субстанции и торможением поступления в кровь фермента.
Жировая инфильтрация и дистрофия. Поступающие в ткани жиры подвергаются окислению или депонируются. Если накапливание происходит вне клеток жировой ткани, то говорят о жировой инфильтрации. Сочетание инфильтрации с нарушением структуры протоплазмы жировых клеток определяется как жировая дистрофия. Возможна также жировая декомпозиция, при которой жиры обнаруживаются в клетке в связи с нарушением белково-липидных комплексов.
Причиной жировой инфильтрации нередко является снижение активности гидролитических или окислительных ферментов (при отравлении фосфором, мышьяком, хлороформом, при вирусной инфекции, авитаминозах).
Чаще всего жировая инфильтрация наблюдается в печени. Причиной жирового перерождения печени может быть любое нарушение, которое дезинтегрирует обмен и синтез липидов в печени: 1) усиленный печеночный липогенез; 2) снижение окисления жирных кислот; 3) повышенный липолиз жировой ткани; 4) замедление выделения липопротеидов очень низкой плотности (ЛПОНП).
Продукция ЛПОНП в печени требует сочетания процессов липидного и белкового синтеза, и их нарушение приводит к аккумуляции жира в печени. Недостаточное питание и дефицит аминокислот нарушают синтез аполипопротеидов и снижают выработку липопротеидов. К такому же результату приводит усиленный липолиз в жировой ткани при голодании или сахарном диабете, когда нарушается включение липидных и белковых предшественников в обмен липопротеидов.
В патогенезе жировой инфильтрации большое значение имеет нарушение образования фосфолипидов. Достаточное содержание их в печени обеспечивает тонкое диспергирование жира и возможность удаления его из печени. Фосфолипиды входят в состав β-липопротеидов и облегчают их выход из клеток печени. Часть жирных кислот участвует в образовании фосфолипидов и в их составе покидает печень. Кроме того, в молекуле фосфолипидов жирные кислоты лучше окисляются. Необходимыми компонентами основного фосфолипида печени — лецитина — являются холин и метионин, который дает свои метильные группы для образования холина. Поэтому недостаток в пище холина, метионина и других липотропных веществ (инозит, нуклеиновые кислоты) приводит к развитию алипотропной жировой инфильтрации печени. К такому же результату приводит дефицит эндогенного липотропного фактора — липокаина, который образуется в эпителии мелких протоков поджелудочной железы. Липокаин активизирует образование фосфолипидов в печени, окисление в ней жирных кислот и предохраняет печень от ожирения. Недостаточность этого фактора играет важную роль в патогенезе ожирения печени при сахарном диабете.
Нарушение образования холина возможно при дефиците витамина В , фолиевой и пантотеновой кислоты.
Нарушения переваривания и всасывания углеводов, этиология, патогенез, последствия.
Переваривание углеводов и их всасывание нарушается при недостаточности амилолитических ферментов пищеварительного тракта. При этом поступающие с пище ди- и полисахариды не расщепляются до моносахаридов и не всасываются.
Всасывание глюкозы страдает при нарушении ее фосфорилирования в кишечной стенке. В основе лежит недостаточность фермента гексокиназы, развивающаяся при отравлении некоторыми ядами, при тяжелых воспалительных процессах в кишечнике. Нефосфорилированная глюкоза не проходит через кишечную стенку и не усваивается. Переваривание и всасывание глюкозы особенно легко нарушается у детой первого года жизни, у которых еще не вполне сформировались ферменты пищеварительного тракта, в частности амилолитические, а также гексокиназа и фосфатаза кишечной стенки. Описана врожденная недостаточность фермента лактазы, ведущая к неусвоению лактозы. Нарушения всасывания углеводов ведут к углеводному голоданию и к гипогликемии.
Этиология. В основе патологии переваривания и всасывания углеводов могут быть причины двух типов: дефекты ферментов, участвующих в гидролизе углеводов в кишечнике; нарушение всасывания продуктов переваривания углеводов в клетки слизистой оболочки кишечника. В обоих случаях возникает осмотическая диарея, которую вызывают нерасщеплённые дисахариды или невсосавшиеся моносахариды. Эти невостребованные углеводы поступают в дистальные отделы кишечника, изменяя осмотическое давление содержимого кишечника. Кроме того, оставшиеся в просвете кишечника углеводы частично подвергаются ферментативному расщеплению микроорганизмами с образованием органических кислот и газов. Всё вместе приводит к притоку воды в кишечник, увеличению объёма кишечного содержимого, усилению перистальтики, спазмам и болям, а также метеоризму. Термином "мальабсорбция" называют недостаточное всасывание переваренных продуктов углеводов. Но поскольку клинические проявления при недостаточном переваривании и всасывании сходны, то термином "мальабсорбция" называют оба вида нарушений.
Патология обмена гликогена. Гликогенозы.
Синтез гликогена может изменяться в сторону как снижения, так и усиления.
Усиление распада гликогена происходит при стрессе, эмоциональном напряжении (активации симпатических нервных путей), тяжелой мышечной работе, голодании, повышении активности гормонов, стимулирующих гликогенолиз (глюкагон, адреналин), диабетическом кетоацидозе.
Снижение синтеза гликогена наблюдается при тяжелом поражении печеночных клеток, например при гепатитах, когда нарушается их глико-генообразовательная функция. Синтез гликогена снижается при гипоксии, так как в условиях гипоксии уменьшается образование АТФ, необходимой для синтеза гликогена.
При уменьшении в организме гликогена наблюдается гипогликемия, а энергетический обмен обеспечивается за счет жирового и белкового обмена. В результате развиваются накопление кетоновых тел, кетоацидоз, интоксикация и потеря пластического материала клетками.
Значительное усиление синтеза гликогена ведет к его избыточному накоплению в органах и тканях и их повреждению. Это происходит при гликогенозах (гликогенной болезни) – типовая форма патологии углеводного обмена наследственного или врожденного генеза, характеризующаяся накоплением избытка гликогена в клетках, что приводит к нарушению жизнедеятельности организма.
Гликогенозы развиваются вследствие мутации генов, кодирующих синтез ферментов расщепления (реже - образования) гликогена. Это приводит к отсутствию или низкой активности ферментов гликогенолиза, реже – синтеза гликогена (гликогеноз IV типа). Почти все гликогенозы наследуются по аутосомно-рецессивному типу. Описано 12 типов гликогенозов, часть из них наблюдается очень редко.
Гликогеноз I типа (болезнь Гирке). В основе этой патологии лежит врожденный дефицит в печени и почках фермента глюкозо-6-фосфатазы. Данный фермент отщепляет свободную глюкозу от глюкозо-6-фосфата, что делает возможным ее трансмембранный переход из клеток печени и почек в кровь. При недостаточности глюкозо-6-фосфатазы в клетках печени и почек (особенно в ядре клеток) накапливается гликоген. Печень и почки увеличиваются в размере. Развивается гипогликемия. Больные вынуждены очень часто принимать пищу. В крови возрастает содержание молочной кислоты, в которую при дефиците глюкозо-6-фосфатазы усиленно переходит глюкозо-6-фосфат. Развивается метаболический ацидоз. Больные дети, как правило, рано умирают от интеркуррентных заболеваний или от ацидотической комы.
Гликогеноз II типа (болезнь Помпе) наблюдается при врожденном дефиците кислой 1,4-глюкозидазы. Этот фермент содержится в лизосомах. Он отщепляет глюкозные остатки от молекул гликогена и расщепляет мальтозу. В лизосомах клеток различных тканей и органов накапливается гликоген, который оттесняет цитоплазму, заполняет всю клетку и разрушает ее. Симптомы гликогеноза появляются через несколько суток или недель после рождения. Отложение гликогена в языке ведет к его увеличению, в диафрагме — к нарушению дыхания и т.д. Ведущим симптомом является увеличение сердца (кардиомегалия) вследствие отложения в нем гликогена. Больные дети рано умирают от сердечной недостаточности.
Гликогеноз III типа (болезнь Кори) возникает при полной или частичной недостаточности фермента амило-1,6-глюкозидазы, его проявления (гипогликемия, мышечная слабость, кетоз) напоминают гликогеноз I типа. Однако прогноз благоприятный, так как в пубертатном периоде развитие болезни замедляется.
Гликогеноз IV типа (болезнь Андерсена) — диффузный гликогеноз с циррозом печени. В его основе лежит врожденный дефицит фермента Д-1,4-глюкано-α-глюкозилтрансферазы, обеспечивающего ветвление гликогена. В печени, селезенке и других тканях накапливается измененный гликоген — с малым числом точек ветвления. Функция органов, в особенности печени, нарушается. Признаки гликогеноза проявляются вскоре после рождения. Развиваются цирроз печени и желтуха, выражена гипогликемия. Больные дети обычно погибают на первом году жизни.
Указанные виды гликогенозов развиваются либо с нарушением структуры гликогена (III, IV типы), либо без таковой (I, II типы). Кроме приведенных, описаны более редкие, а также смешанные формы гликогенозов.
Гипергликемия, определение понятия, виды. Причины и механизмы развития отдельных видов гипергликемий.
Гипергликемия – состояние, характеризующееся увеличением уровня глюкозы выше нормы (6,05ммоль/л).
Виды: Физиологическая гипергликемия имеет приспособительное значение, так как обеспечивает доставку тканям легко утилизируемого энергетического материала.
Алиментарная гипергликемия появляется после приема большого количества легко усвояемых углеводов (сахар, конфеты, мучные изделия и др.), при этом из кишечника быстро всасывается большое количество глюкозы, превышающее возможности печени и других тканей ассимилировать ее. Если это количество превышает 8,88 ммоль/л (почечный порог), то сахар появляется в моче (глюкозурия). Используют в качестве одного из тестов для оценки состояния углеводного обмена (сахарная нагрузка).
Эмоциональная гипергликемия развивается при волнениях, эмоциональном возбуждении, сильной боли. Процесс возбуждения из коры головного мозга иррадиирует на подкорковую область. Импульсы по симпатическим путям идут к печени, где усиливают гликогенолиз и тормозят липогенез (переход углеводов в жир).
При стойком нарушении того или иного звена регуляции углеводного обмена возникают патологические гипергликемии.
Гормональная гипергликемия обусловливается нарушением функции эндокринных желез, гормоны которых участвуют в регуляции углеводного обмена. Так, при глюкагономе — опухоли из клеток Лангерганса, возрастает продукция глюкагона, при болезни и синдроме Иценко—Кушинга — глюкокортикоидов; при феохромоцитоме — адреналина. Избыток этих гормонов через механизмы, описанные выше, приводит к повышению концентрации глюкозы в крови, несмотря на нормальный или даже увеличенный уровень инсулина.
Гипергликемия при недостаточности инсулина является наиболее выраженной и стойкой. Она может сопровождаться определенными симптомами — сухостью во рту, жаждой, полиурией, похуданием.
Гипергликемия при судорожных состояниях, когда происходит расщепление гликогена мышц и образование больших количеств молочной кислоты, из которой в печени синтезируется глюкоза.
Гипергликемия при некоторых видах наркоза (например, эфирном или морфинном) м.б. вызвана возбуждением симпатических центров и выходом адреналина из надпочечников; при хлороформном наркозе к этому присоединяется нарушение гликогенобразовательной функции печени.
Причины: 1) эндокринопатии (наиболее частая причина): избыток гипергликемизирующих факторов (или их эффектов) и дефицит инсулина (или его эффектов). Гипергликемирующие факторы – глюкокортикоиды, йодсодержащие гормоны щитовидки, СТГ, катехоловые амины и глюкагон. Избыток гипергликемирующих факторов: глюкагон (в результате гиперплазии α-клеток островков Лангерханса) стимулирует глюконеогенез и гликогенолиз, как результат развитие гипергликемии; глюкокортикоиды (при гипертрофии или опухолях коры надпочечников – б-нь Иценко-Кушинга) активируют глюконеогенез и ингибируют активность гексокиназы; катехоламины (феохромацитома – гормонально-активная опухоль мозгового вещества надпочечников) приводят к гипергликемии за счет активации гликогенолиза; СТГ (при опухоли аденогипофиза), гипергликемия в условиях избытка СТГ является в основном результатом активации гликогенолиза и торможения утилизации глюкозы в ряде тканей. Недостаток инсулина: наиболее часто гипергликемия наблюдается при СД; гипергликемия при гипоинсулинизме является результатом: снижения утилизации глюкозы клетками, активации глюконеогенеза, усиления гликогенолиза. 2) неврологические и психологические расстройства: нейро- и психогенные расстройства (стресс-реакции) характеризуются активацией симпатико-адреналовой, гипоталамо-нипофизарно-надпочечниковой и тиреоидной систем. Гормоны этих систем (катехоламины, глюкокортикоиды, Т3 и Т4) вызывают ряд эффектов (активация гликогенолиза, торможение гликогенеза, стимуляция глюконеогенеза), приводящих к значительной гипергликемии. 3) переедание: глюкоза быстро всасывается в кишечнике, ГПК (глюкоза плазмы крови) повышается и превышает возможность гепатоцитов включать ее в процесс гликогенеза. Кроме того, избыток углеводсодержащей пищи в кишечнике стимулирует гликогенолиз в гепатоцитах, потенцируя гипергликемию. 4) Патология печени: при печеночной недостаточности может развиваться переходящая гипергликемия в связи с тем, что гепатоциты не способны трансформировать глюкозу в гликоген. Обычно это наблюдается после приема пищи.
Механизмы развития: 1) Рабочие (испольнительные): а) избыточное, в сравнении с потребностями организма, поступление сахара с пищей и сладкими напитками. Это, так называемая алиментарная гипергликемия, которая может быть временной (преходящей) и постоянной (особенно, при булимии); б) усиление процесса гликогенолиза (распада гликогена), главным образом, в печени и скелетных мышцах; в) торможение процесса образования и отложения гликогена (угнетение процесса гликогенеза); г) активирование процесса глюконеогенеза (образования сахаров из несахаров, в частности из липидов и глюкогенных аминокислот); д) снижение использования (утилизации) сахаров тканями; е) угнетение процессов расщепления глюкозы (гликолиза) осуществляемые как аэробным, так и анаэробными путями; ж) ослабление процесса выведения углеводов из организма (в результате снижения проницаемости фильтрующей мембраны клубочков почек, но, главное, вследствие активизации процесса их реабсорбции в канальцах почек).
2) Регуляторные механизмы: а) возбуждение ЦНС, главным образом, симпатических центров автономной нервной системы; б) превалирование активности симпатической нервной системы над парасимпатической; в) активизация симпато-адреналовой системы при травмах, интоксикациях, стрессе; г) повышенная продукция и/или биологическая активность контринсулярных гормонов (АКТГ, глюкокортикоидов, катехоламинов, ТГГ, тироксина, глюкагона, СТГ), отмечаемых при разной патологии, в частности, при болезни и синдроме Иценко-Кушинга, опухолях мозгового вещества надпочечников (феохромоцитомах), тиреотоксикозе, Базедовой болезни, гиперплазии а-клеток островков Лангерганса, гигантизме или акромегалии и т.д. д) пониженная продукция и/или биологическая активность инсулина при инсулиновой недостаточности как панкреатического, так и внепанкреатического происхождения (при этом гипергликемия является более выраженной и стойкой).
41. Глюкозурия, определение понятия. Виды, патогенез.
Глюкозурия - наличие глюкозы в моче. Причины: физиологическая гипергликемия (напр., при избыточном употреблении в пищу углеводов), сахарный диабет, синдром Иценко - Кушинга, гипертиреоз, почечная недостаточность и др.
В норме глюкоза содержится в провизорной моче. В канальцах она реабсорбируется в виде глюкозофосфата, для образования которого необходима гексокиназа, и после дефосфорилирования поступает в кровь. Таким образом, в окончательной моче сахара в нормальных условиях не содержится. При диабете процессы фосфорилирования и дефосфорилирования глюкозы в канальцах почек не справляются с избытком глюкозы в первичной моче. Развивается глюкозурия. При тяжелых формах сахарного диабета содержание сахара в моче может достигать 8—10%. Осмотическое давление мочи повышено; в связи с этим в окончательную мочу переходит много воды. Суточный диурез возрастает до 5—10 л и более (полиурия). Развивается обезвоживание организма и как следствие его — усиленная жажда (полидипсия).
Механизм глюкозурии: как указано выше, в начальном (проксимальном) отделе канальца глюкоза реабсорбируется из первичной мочи, проходя через эпителий, выстилающий канальцы, назад в кровоток. Проблема в том, что проксимальные канальцы способны реабсорбировать лишь ограниченное количество глюкозы. Дело в том, что для реабсорбции глюкозы необходимо связывание каждой ее молекулы с молекулой переносчика, поэтому транспорт глюкозы является насыщаемым. Когда гликемия превышает некоторый критический уровень (обычно 8,9-10,0 ммоль/л или 160—180 мг/дл), проксимальные канальцы оказываются «перегруженными» — а весь излишек глюкозы попадает во вторичную (выделяемую в мочевой пузырь) мочу.
Эта критическая точка получила условное название «почечный порог». Он индивидуален для каждого человека, но, как правило, укладывается в вышеуказанный диапазон концентрации глюкозы крови. Считается, что у детей и беременных женщин «почечный порог» может быть снижен (менее ~7 ммоль/л).
Причины глюкозурии при сахарном диабете:
При сахарном диабете дефицит функции инсулина в сочетании с увеличением в плазме адреналина, кортизола, гормона роста и глюкагона приводит к усилению образования и затруднению поглощения глюкозы тканями, а, следовательно, к гипергликемии и увеличению осмолярности плазмы. Глюкозурия возникает, когда уровень глюкозы в плазме превышает «почечный порог». В результате осмотического диуреза появляются полиурия, дегидратация (обезвоживание) и компенсаторная полидипсия. Эти последовательные изменения, особенно обезвоживание, представляют собой физиологический стресс, приводящий к гиперсекреции «стрессорных» гормонов — катехоламинов и кортизола, что ещё более усиливает декомпенсацию обмена веществ.
42. Гипогликемия, определение понятия, причины, механизм развития, последствия. Понятие о гипогликемической коме. Фармкоррекция гипогликемических состояний.
Гипогликемия – состояния, характеризующиеся снижением уровня глюкозы плазмы крови ниже нормы (3,58ммоль/л).
Причины: 1) патология печени: наследственная и приобретенная (хронические гепатиты, циррозы печени, гепатодистрофии, острые токсические поражения печени, ферментопатии и мембранопатии гепатоцитов) – к гипогликемии приводят нарушения транспорта глюкозы из крови в гепатоциты, снижения активности гликогенеза в них и отсутствие депонированного гликогена; 2) расстройства пищеварения (полостного переваривания углеводов – недостаточность а-амилазы поджелудочной железы, недостаточное содержание и/или активность амилолитических ферментов кишечника, пристеночного расщепления и абсорбции углеводов - недостаточность дисахаридаз, расщепляющих углеводы до моносахаридов, недостаточность ферментов трансмембранного переноса глюкозы и других моносахаридов), также гипогликемия развивается при хронических энтеритах, алкогольном панкреатите, опухолях поджелудочной, синдромах нарушенного всасывания; 3) длительная значительная физическая нагрузка – гипергликемия развивается в результате истощения запасов гликогена, депонированного в печени и скелетных мышцах; 4) патология почек (снижение реабсорбции глюкозы в проксимальном отделе канальцев); 5) углеводное голодание – в результате длительного общего голодания, в том числе углеводного; дефицит в пище только углеводов не приводит к гипогликемии; 6) эндокринопатии (недостаточность гипергликемизирующих гормонов, гиперинсулинизм). Недостаток гипогликемирующих факторов: глюкокортикоидная недостаточность (гипокортицизм вследствие гипотрофии и гипоплазии коры надпочечников) – гипогликемия развивается в результате торможения глюконеогенеза и дефицита гликогена; дефицит тироксина и трийодтиронина (при мексидеме), гипогликемия при гипотиреозах являчется результатом торможения процесса гликогенолиза в гепатоцитах; недостаток СТГ (гипотрофия аденогипофиза, кровоизлияние в гипофиз) гипогликемия развивается в связи с торможением гликогенолиза и трансмембранного переноса глюкозы; дефицит катехоламинов (туберкулез с развитием надпочечниковой недостаточности) гипогликемия является следствием пониженной активности гликогенолиза; недостаток глюкагона (деструкция α-клеток поджелудочной в результате аутоиммунной агрессии) гипогликемия развивается в связи с торможением глюконеогенеза и гликогенолиза. Избыток инсулина: причины гипогликемии: активация утилизации глюкозы клетками организма, торможение глюконеогенеза, подавление гликогенолиза. Указанные эффекты наблюдаются при инсулиномах и передозировке инсулина.
Механизмы развития: 1) Уменьшение поступления глюкозы в кровь. Это бывает при голодании, нарушениях пищеварения (недостаточность амилолитических ферментов, расстройства всасывания), при наследственных и приобретенных нарушениях гликогенолиза и глюконеогенеза в печени. 2) Усиленное использование глюкозы на энергетические потребности организма (например, тяжелая физическая работа). 3) Потеря глюкозы (глюкозурия) или использование ее не по назначению (злокачественные опухоли).
Гипогликемическяа кома – состояние, характеризующееся падением глюкозы плазмы крови ниже нормы (менее 2,0-1,5 ммоль/л), потерей сознания, значительными расстройствами жизнедеятельности организма. Механизмы развития: а) нарушение энергетического обеспечения нейронов, а также клеток других органов вследствие: недостатка глюкозы; дефицита короткоцепочечных метаболитов свободных жирных кислот – ацетоуксусной и β-гидроксималяной, которые эффективно окисляются в нейронах. Они могут обеспечить нейроны энергией даже в условиях гипогликемии. Однако кетонемия развивается лишь через несколько часов и при острой гипогликемии не м.б. механизмом предотвращения энергодефицита в нейронах; нарушения транспорта АТФ и расстройств использования энергии АТФ эффекторными структурами; б) повреждение мембран и ферментов нейронов и других клеток организма; в) дисбаланс ионов и воды в клетках: потеря ими калия, и накопление водорода, натрия, кальция и воды; г) нарушение электрогенеза.
Фармкоррекция гипогликемических состояний: введение в организм глюкозы: в/в (для устранения острой гипогликемии одномоментно 25-50г в виде 50% раствора, в последующем инфузия глюкозы в меньшей концентрации продолжается до восстановления сознания у пациента); с пищей и напитками, это необходимо в связи с тем, сто при в/в введении глюкозы не восстанавливается депо гликогена в печени (!); терапия основного заболевания, вызвавшего гипогликемию (болезней печени, почек, ЖКТ, желез внутренней секреции).
43. Сахарный диабет, виды, этиология, патогенез. Виды инсулиновой недостаточности. Экспериментальные модели диабета.
СД – заболевание, которое характеризуется нарушением всех видов метаболизма и расстройством жизнедеятельности организма; развивается в результате гипоинсулинизма (т.е. абсолютной или относительной инсулиновой недостаточности).
Виды: 1. Спонтанный сахарный диабет (первичный) — представляет собой самостоятельную нозологическую единицу. На его долю приходится около 90% всех случаев сахарного диабета. Выделяют две разновидности спонтанного диабета: тип I, или инсулинозависимый (юношеский), и тип II, или инсулиннезависимый (диабет взрослых). 2. Вторичный сахарный диабет — является только признаком других заболеваний. Он, в частности, развивается при поражениях поджелудочной железы, эндокринных болезнях, сопровождающихся увеличением секреции контринсулярных гормонов, при сложных наследственно обусловленных синдромах (например, атаксия-телеангияктазия).
Этиология:Причины диабета I типа(ИНД): ДиабетIтипа - заболевание с генетической предрасположенностью, в возникновении которого важная роль принадлежит факторам внешней среды.Наследственная предрасположенность к диабету I типа обусловлена антигенассоциированным характером этого заболевания. Так, доказана связь между возникновением сахарного диабета I типа и наличием определенных НLА-генов (В8, Вw15, ВwЗ, Вw4) в главном комплексе гистосовместимости (МНС). Это наводит на мысль о значении аутоиммунных механизмов в развитии этой болезни. Среди факторов внешней среды, способных повреждать (β-клетки панкреатических островков, большое значение имеют (β-цитотропные вирусы (вирусы Коксаки, эпидемического паротита, кори) и (β-цито-тропные химические агенты (например, аллоксан, стрептозотоцин). Причины диабета II типа (ИЗД): 1) Наследственная предрасположенность (не связана с генами главного комплекса гистосовместимости (МНС)). 2) Ожирение – отмечается у 80% больных, поэтому выделяют две формы СД II типа: с ожирением и без ожирения. Факторы внешней среды не имеют особого значения в этиологии диабета II типа.
Патогенез: В патогенезе сахарного диабета выделяют два основных звена: 1) недостаточное производство инсулина эндокринными клетками поджелудочной железы; 2) нарушение взаимодействия инсулина с клетками тканей организма как следствие изменения структуры или уменьшения количества специфических рецепторов для инсулина, изменения структуры самого инсулина или нарушения внутриклеточных механизмов передачи сигнала от рецепторов органеллам клетки. Существует наследственная предрасположенность к сахарному диабету. Если болен один из родителей, то вероятность унаследовать диабет первого типа равна 10%, а диабет второго типа — 80%.
Виды инсулиновой недостаточности: Панкреатическая недостаточность (1-й тип диабета). Первый тип нарушений характерен для диабета 1-го типа (устаревшее название – инсулинозависимый диабет). Отправным моментом в развитии этого типа диабета является массивное разрушение эндокринных клеток поджелудочной железы (островков Лангерганса) и, как следствие, критическое снижение уровня инсулина в крови. Массовая гибель эндокринных клеток поджелудочной железы может иметь место в случае вирусных инфекций, онкологических заболеваний, панкреатита, токсических поражений поджелудочной железы, стрессовых состояний, различных аутоиммунных заболеваний, при которых клетки иммунной системы вырабатывают антитела против β-клеток поджелудочной железы, разрушая их. Этот тип диабета, в подавляющем большинстве случаев, характерен для детей и лиц молодого возраста (до 40 лет). человека это заболевание зачастую является генетически детерминированным и обусловленным дефектами ряда генов, расположенных в 6-й хромосоме. Эти дефекты формируют предрасположенность к аутоиммунной агрессии организма к клеткам поджелудочной железы и отрицательно сказываются на регенерационной способности β-клеток. В основе аутоиммунного поражения клеток лежит их повреждение любыми цитотоксическими агентами. Данное поражение вызывает выделение аутоантигенов, которые стимулируют активность макрофагов и Т-киллеров, что в свою очередь, приводит к образованию и выделению в кровь интерлейкинов в концентрациях, оказывающих токсическое действие на клетки поджелудочной железы. Также клетки повреждаются находящимися в тканях железы макрофагами. Также провоцирующими факторами могут являться длительная гипоксия клеток поджелудочной железы и высокоуглеводистая, богатая жирами и бедная белками диета, что приводит к снижению секреторной активности островковых клеток и в перспективе к их гибели. После начала массивной гибели клеток запускается механизм их аутоиммунного поражения.
Внепанкреатическая недостаточность (2-й тип диабета).Для диабета 2-го типа (устаревшее название – инсулинонезависимый диабет) характерны нарушения, указанные в пункте 2. При этом типе диабета инсулин производится в нормальных или даже в повышенных количествах, однако нарушается механизм взаимодействия инсулина с клетками организма (инсулинорезистентность). Главной причиной инсулинрезистентности является нарушение функций мембранных рецепторов инсулина при ожирении (основной фактор риска, 80% больных диабетом имеют избыточную массу тела) – рецепторы становятся неспособными взаимодействовать с гормоном в силу изменения их структуры или количества. Также при некоторых видах диабета 2-го типа может нарушаться структура самого инсулина (генетические дефекты). Наряду с ожирением, пожилой возраст, вредные привычки, артериальная гипертония, хроническое переедание, малоподвижный образ жизни также являются факторами риска для сахарного диабета 2-го типа. В целом этот вид диабета наиболее часто поражает людей старше 40 лет. Доказана генетическая предрасположенность к диабету 2-го типа, на что указывает 100% совпадение наличия заболевания у гомозиготных близнецов. При сахарном диабете 2 типа часто наблюдается нарушение циркадных ритмов синтеза инсулина и относительно длительное отсутствие морфологических изменений в тканях поджелудочной железы. В основе заболевания лежит ускорение инактивации инсулина или же специфическое разрушение рецепторов инсулина на мембранах инсулинзависимых клеток. Ускорение разрушения инсулина зачастую происходит при наличии портокавальных анастомозов и, как следствие, быстрого поступления инсулина из поджелудочной железы в печень, где он быстро разрушается. Разрушение рецепторов к инсулину является следствием аутоиммунного процесса, когда аутоантитела воспринимают инсулиновые рецепторы как антигены и разрушают их, что приводит к значительному снижению чувствительности к инсулину инсулинзависимых клеток. Эффективность действия инсулина при прежней концентрации его в крови становится недостаточной для обеспечения адекватного углеводного обмена.
Экспериментальные модели диабета: 1. Панкреатический сахарный диабет — удаление у собак 9/10 поджелудочной железы (Меринг и Минковский, 1889). 2. Аллоксановый сахарный диабет — однократное введение животным аллоксана — вещества, избирательно повреждающего β -клетки островков поджелудочной железы. 3. Стрептозотоциновый сахарный диабет — введение животным антибиотика — стрептозотоцина, избирательно повреждающего β-клетки островков. 4. Дитизоновый сахарный диабет — введение животным дитизона — вещества, связывающего цинк и таким образом нарушающего депонирование и секрецию инсулина. 5. Иммунный сахарный диабет — введение животным антител против инсулина. 6. Метагипофизарный сахарный диабет — длительное введение животным гормонов аденогипофиза — соматотропного гормона, АКТГ. 7. Метастероидный сахарный диабет — длительное введение животным глюкокортикоидов.8. Генетические модели сахарного диабета — выведение чистых линий мышей и других животных с наследственно обусловленной формой болезни.
