
- •Передмова
- •Предмет та задачі аналітичної хімії
- •Глава 1. Деякі положення теорії електролітичної дисоціації
- •1.1. Електроліти, ступінь електролітичної дисоціації
- •1.2. Водневий показник водних розчинів електролітів (рН)
- •Практична робота складання рівнянь реакцій у молекулярній та іонній формах
- •Приклад
- •Завдання для самостійної роботи
- •Практична робота обчислення концентрації іонів гідрогену та гідроксид-іонів, рН та рОн у розчинах сильних електролітів
- •Приклади
- •Задачі для самостійної роботи
- •Глава 2. Кислотно-основна рівновага
- •2.1. Хімічна рівновага. Константа хімічної рівноваги
- •2.2. Рівновага в розчинах слабких електролітів
- •2.3. Рівновага в розчинах солей, що гідролізуються
- •2.4. Буферні системи
- •Практична робота рівновага в розчинах амфотерних електролітів
- •Завдання для самостійної роботи
- •Глава 3. Рівновага в гетерогенних системах
- •3.1. Добуток розчинності
- •3.2. Порядок дробного (вибіркового) осадження
- •3.3. Чинники, що впливають на осадження осадів та їх розчинність
- •Розв’язання
- •Завдання для самостійної роботи
- •Глава 4. Рівновага в окисно-відновних системах
- •4.1. Окисно-відновні системи
- •4.2. Окисно-відновний потенціал (редокс-потенціал)
- •4.3. Константа рівноваги редокс-реакції
- •Завдання для самостійної роботи
- •Глава 5. Рівновага комплексоутворення
- •5.1. Поняття про комплексні сполуки
- •Класифікація комплексних сполук
- •5.2.Рівноваги в розчинах комплексних сполук. Константи стійкості та нестійкості
- •5.3. Вплив різних чинників на процес комплексоутворення
- •5.4. Способи руйнування та утворення комплексів. Використання комплексних сполук в практиці аналізу
- •Розв'язання
- •Розв'язання
- •Задачі для самостійної роботи
- •Основні поняття
- •Дробний аналіз
- •Систематичний аналіз
- •IV. В залежності від способу виконання розрізняють реакції, що виконані:
- •Аналітичні ознаки реакцій
- •Правила роботи і техніка безпеки в хімічній лабораторії
- •Перша допомога при нещасних випадках
- •Якісний аналіз неорганічних сполук
- •Аналіз катіонів
- •Лабораторна робота
- •Загальна характеристика
- •Реакції Калій-катіона
- •1. Дія натрій гексанітрокобальтату(ііі) Na3[Co(nо2)6 ] (фармакопейна реакція)
- •2. Дія натрій гідрогентартрату NaHc4h4o6 (фармакопейна реакція)
- •3. Дія натрій тетрафенілборату Na[b(c6h5)4] (фармакопейна реакція)
- •4. Реакція забарвлення полум'я (реакція фармакопейна)
- •Реакції Натрій-катіона
- •1. Дія розчину метоксифенілацетатної кислоти c6h5ch(och3)cooh (фармакопейна реакція)
- •2. Дія калій гексагідроксостибату(V) k[Sb(oh)6] (фармакопейна реакція)
- •3. Дія цинктриураніл октаацетату Zn(uo2)3(ch3coo)8.
- •4. Реакція забарвлення полум’я (реакція фармакопейна)
- •Реакції амоній-катіона
- •1. Дія лугів (фармакопейна реакція)
- •3. Дія магній оксиду MgO (фармакопейна реакція)
- •Біологічна роль та практичне використання катіонів і аналітичної групи та їх сполук в медицині та фармації
- •Лабораторна робота
- •Загальна характеристика
- •1. Дія 2 м розчину хлоридної кислоти hCl (дія групового реагенту)
- •Плюмбум(іі) гідроксид має амфотерні властивості і розчиняється в надлишку реагенту:
- •3. Дія розчину калій йодиду кі
- •4. Дія розчину калій хромату k2CrO4
- •Реакція Аргентум(і)-катіона
- •Реакції Плюмбум(іі)-катіона
- •1. Дія розчину калій йодиду ki
- •Реакції димеркурій(і)-катіона
- •1. Дія розчину калій йодиду кі
- •Контрольні питання
- •Біологічна роль та практичне використання катіонів II аналітичної групи та їх сполук у медицині та фармації
- •Лабораторна робота
- •Загальна характеристика
- •Загальноаналітичні реакції катіонів III групи
- •1. Дія 1м розчину сульфатної кислоти h2so4 (дія групового реагенту)
- •2. Дія карбонатів
- •3. Дія хроматів
- •Реакції Барій-катіона
- •1. Дія дихромат-іону
- •2. Реакція забарвлення полум’я (фармакопейна реакція)
- •Реакції Кальцій-катіона
- •1. Дія розчину сульфатної кислоти h2so4
- •2. Дія розчину амоній оксалату (nh4)2c2o4 (фармакопейна реакція)
- •3. Дія розчину гліоксальгідроксіанілу (фармакопейна реакція)
- •4. Дія розчину калій гексаціаноферату(іі) k4[Fe(cn)6] (фармакопейна реакція)
- •5. Реакція забарвлення полум’я (фармакопейна реакція)
- •Реакції Стронцій-катіона
- •1. Реакція з гіпсовою водою
- •2. Реакція забарвлення полум'я
- •Контрольні запитання
- •Біологічна роль та практичне використання катіонів III аналітичної групи та їх сполук у медицині та фармації
- •Лабораторна робота реакції катіонів IV аналітичної групи
- •Загальна характеристика
- •Загальноаналітичні реакції катіонів IV аналітичної групи
- •1. Дія 6м розчину лугу (дія групового реагенту)
- •Реакція Станум(іі)-катіона
- •1. Дія надлишку лугу в присутності розчиненої солі бісмут(ііі) нітрату Ві(no3)3.
- •Реакція Хром(ііі)- катіона
- •1. Дія гідроген пероксиду h2o2 в присутності надлишку лугу
- •Реакції Цинк(іі)-катіона
- •1. Дія розчину калій гексаціаноферату(II) (фармакопейна реакція)
- •2. Дія сульфідів (фармакопейна реакція)
- •3. Дія дитизону
- •Реакції Алюміній(ііі)-катіона
- •1. Дія алізарину (1,2-діоксіанрахінону)
- •2. Дія розчину натрій ацетату
- •Реакції сполук Арсену
- •1. Дія розчину натрій дигідрогенфосфіту NaH2po2 (фармакопейна реакція)
- •2. Дія розчину натрій сульфіду Na2s (фармакопейна реакція)
- •3. Дія розчину магній сульфату MgSo4 (фармакопейна реакція)
- •Визначення домішок сполук Арсену(ііі) та Арсену(V) у лікарських засобах.
- •Контрольні питання
- •Біологічна роль та практичне використання катіонів IV аналітичної групи та їх сполук у медицині і фармації
- •Лабораторна робота реакції катіонів V аналітичної групи
- •Загальна характеристика
- •Загальноаналітичні реакції катіонів V аналітичної групи
- •1. Дія розчину амоніаку nh3·h2o (дія групового реагенту)
- •2. Дія рочину лугу NaOh або кон
- •Реакції Магній(іі)-катіона
- •1. Дія розчину натрій гідрогенфосфату Na2hpo4 (фармакопейна реакція)
- •2. Дія розчину 8-гідроксихіноліну (фармакопейна реакція)
- •Реакція Ферум(іі)-катіона
- •1. Дія розчину калій гексаціаноферату(ііі) k3[Fe(cn)6] (фармакопейна реакція)
- •Реакції Ферум(ііі)-катіона
- •1. Дія розчину калій гексаціаноферату(іі) k4[Fe(cn)6] (фармакопейна реакція)
- •2. Дія розчину амоній тіоціанату nh4ncs (фармакопейна реакція)
- •3. Дія розчину тіогліколевої кислоти hsch2cooh (фармакопейна реакція)
- •Реакція Манган(іі)-катіона
- •1. Дія діамоній гексаоксопероксидисульфату (nh4)2s2o8
- •Реакції Бісмут(ііі)-катіона
- •1. Дія свіжоприготованого натрій тетрагідроксостаніту(іі) Na2[Sn(oh)4]
- •2. Гідроліз солей Бісмуту
- •3. Дія розчину тіосечовини (nh2)2cs (фармакопейна реакція)
- •4. Дія розчину натрій сульфіду Na2s (фармакопейна реакція)
- •Контрольні питання
- •Біологічна роль та практичне застосування катіонів V аналітичної групи та їх сполук у медицині та фармації
- •Лабораторна робота аналіз суміші катіонів V аналітичної групи
- •Лабораторна робота реакції катіонів VI аналітичної групи
- •Загальноаналітичні реакції катіонів VI аналітичної групи
- •1. Дія розчину амоніаку (дія групового реагенту)
- •Реакції Купрум(іі)-катіона
- •1. Дія надлишку розчину амоніаку nн3·н2о
- •2. Дія розчину натрій тіосульфату Na2s2o3
- •Реакції Кобальт(іі)-катіона
- •1. Дія розчину амоній тіоціанату nh4ncs
- •Реакція Нікол(іі)-катіона
- •1. Дія диметилгліоксиму (реактиву Чугаєва) (фармакопейна реакція)
- •Реакції Меркурій(іі)-катіона
- •1. Дія розчину лугу (фармакопейна реакція)
- •2. Дія розчину калій йодиду кі (фармакопейна реакція)
- •3. Реакція з міддю та іншими металами (фармакопейна реакція)
- •Дія розчину натрій сульфіду Na2s
- •Аналіз аніонів
- •Лабораторна робота реакції аніонів і аналітичної групи
- •Загальна характеристика
- •Дія групового реагенту
- •Реакції сульфат-іона
- •Реакції сульфіт - іона
- •1. Дія мінеральної кислоти (фармакопейна реакція)
- •2. Дія розчину дийоду і2 (фармакопейна реакція)
- •Реакції тіосульфат-іона
- •1. Дія хлоридної кислоти hCl
- •2. Дія розчину дийоду і2
- •3. Дія аргентум (і) нітрату AgNo3
- •Реакції карбонат- та гідрогенкарбонат- іонів
- •1. Дія мінеральних кислот
- •2. Дія магній сульфату MgSo4 (фармакопейна реакція)
- •3. Дія фенолфталеїну (реакція фармакопейна)
- •Реакції фосфат- та гідрогенфосфат- іонів
- •1. Дія аргентум(і) нітрату AgNo3 (фармакопейна реакція)
- •2. Дія розчину магнезіальної суміші (MgCl2, nh4Cl, nh3·h2o)
- •Реакції тетраборат- та метаборат-іонів
- •1. Дія солей Барію
- •2. Реакція забарвлення полум'я (фармакопейна реакція)
- •Реакції хромат- та дихромат-іонів
- •1. Дія розчину солей Барію
- •2. Дія розчину калій йодиду кі
- •Реакція оксалат-іона
- •1. Дія розчину кальцій хлориду СаСl2
- •Контрольні питання
- •Біологічна роль і практичне використання аніонів і аналітичної групи та їх сполук у медицині та фармації
- •Реакції хлорид-іона
- •Реакції бромід-іона
- •1. Дія аргентум(і) нітрату AgNo3 (фармакопейна реакція)
- •2. Дія окисників
- •2.1. Дія хлорної води
- •2.2. Дія калій преманганату
- •Реакції йодид-іона
- •1. Дія окисників (фармакопейна реакція)
- •2. Дія солей Плюмбуму(іі)
- •Реакція сульфід-іона
- •1. Дія мінеральних кислот
- •Контрольні питання
- •Біологічна роль і практичне використання аніонів II аналітичної групи та їх сполук у медицині та фармації
- •1. Дія дифеніламіну (фармакопейна реакція)
- •2. Дія Ферум(іі)-катіонів
- •Реакції нітрит-іона
- •1. Дія кислоти
- •2. Реакція з антипірином (фармакопейна реакція)
- •Реакції ацетат-іона
- •1. Реакція естерифікації (фармакопейна реакція)
- •2. Дія ферум(III) хлориду (фармакопейна реакція)
- •Контрольні питання
- •Біологічна роль і практичне використання аніонів ш аналітичної групи та їх сполук у медицині та фармації
- •3.2 Відкриття аніонів
- •Контрольні завдання
- •Додатки
- •Забарвлення полум'я сполуками деяких елементів
- •Способи виразу вмісту компонентів у розчині
- •Кількісні характеристики процесу гідролізу солей
- •Аніони, які утворюють газоподібні продукти
- •Глава 1. Деякі положення теорії електролітичної дисоціації
- •Глава 2. Кислотно-основна рівновага
- •Глава 3. Рівновага в гетерогенних системах
- •Глава 4. Рівновага в окисно-відновних системах
- •Глава 5. Рівновага комплексоутворення
Практична робота рівновага в розчинах амфотерних електролітів
Мета: Навчитися складати рівняння хімічних реакцій в розчинах амфотерних електролітів.
Катіони IV аналітичної групи з розчинами лугів утворюють гідроксиди, які мають амфотерні властивості, тобто розчиняються як у кислотах, так і у надлишку розчину лугу з утворенням гідроксоаніонів.
Наприклад:
ZnCl2 + 2NaOH → Zn(OH)2 ↓ + 2NaCl
Zn2+ + 2OH- → Zn(OH)2↓
Zn(OH)2↓ + 2NaOH → Na2[Zn(OH)4]
Zn(OH)2↓ + 2 ОH- → [Zn(OH)4]2- (тетрагідроксоцинкат-аніон)
Zn(OH)2↓ + 2HNO3 → Zn(NO3)2+2H2O
Zn(OH)2↓ +2H+ → Zn2++2H2O
Гідроксоаніони стійкі тільки у лужному середовищі. При зменшенні рН розчинів, наприклад, при додаванні хлоридної кислоти, вони спочатку утворюють осади відповідних гідроксидів:
Na2[Zn(OH)4] + 2HCl → Zn(OH)2↓ + 2H2O + 2NaCl
[Zn(OH)4]2- + 2H+ → Zn(OH)2↓ + 2H2O
При цьому встановлюється рівновага, напрямок якої можна змінювати регулюванням рН середовища.
При подальшому додаванні хлоридної кислоти осади розчиняються.
Zn(OH)2↓ + 2HCl →ZnCl2+2H2O
Zn(OH)2↓ + 2H+ → Zn2+ + 2H2O
Явище амфотерності відіграє велику роль у хімічному аналізі. Наприклад, для того щоб відокремити катіони IV аналітичної групи (Zn2+, Cr3+, A13+, Sn2+, Sn(IV)) від катіонів V і VІ аналітичних груп.
Завдання для самостійної роботи
Записати рівняння хімічних реакцій у молекулярному та молекулярно-іонному виглядах одержання гідроксидів наданних катіонів:
Zn2+; Cr3+; Al3+; Sn2+; Pb2+
2. Довести амфотерні властивості одержаних гідроксидів.
Глава 3. Рівновага в гетерогенних системах
3.1. Добуток розчинності
Гетерогенною називають систему, яка складається з кількох фаз (рідкої, твердої чи газоподібної), які мають поверхню поділу між фазами. Наприклад, з двох рідин, що не змішуються або твердої та рідкої фази.
Закон діючих мас застосовується і для гетерогенних систем.
Гетерогенна рівновага – це рівновага, яка встановлюється на межі поділу фаз.
Найчастіше в практиці аналітичної хімії зустрічаються гетерогенні системи типу: осад (тверда фаза) речовини, що знаходиться в рівновазі з його насиченим розчином (рідка фаза). Абсолютно нерозчинних речовин не існує, тому, якщо утворюється осад, то рідина над розчином – це насичений розчин малорозчинного електроліту.
Наприклад:
BaSO4(т) F Ba2+ + SO42–
Молярною розчинністю речовини S називають число моль розчиненої речовини, яка міститься в 1 дм3 його насиченого розчину:
![]() ,
моль/ дм3
,
моль/ дм3
Добуток
розчинності малорозчинного
–це величина, яка дорівнює добутку
рівноважних концентрацій іонів даного
електроліту в його насиченому розчині,
взятих в ступенях, що дорівнюють
відповідним стехіометричним коефіцієнтам.
Позначається символами ДР,L,
K![]()
Будемо дотримуватись позначення, рекомендованого ІЮПАК - K .
Запишемо вираз константи гетерогенної рівноваги для BaSO4
![]()
Оскільки для малорозчинної речовини можна вважати концентрацію майже незмінною, вносимо [BaSO4] під знак константи, отримуючи нову сталу величину:
![]()
Правило добутку розчинності (В.Нернст, 1889):
Д обуток
концентрацій малорозчинної сполуки в
її насиченому розчині при постійній
температурі є величина стала.
обуток
концентрацій малорозчинної сполуки в
її насиченому розчині при постійній
температурі є величина стала.
Згідно з рівнянням BaSO4(т) F Ba2+ + SO42–,
[Ba2+] = [SO42–]= S(BaSO4)
Тоді :
![]()
Знаючи довідникове значення K , можна визначити розчинність
![]()
В загальному випадку для гетерогенної рівноваги
KnAm ↔ nKm+ + mAn+
Добуток розчинності
![]()
Тоді формула для визначення молярної розчинності:
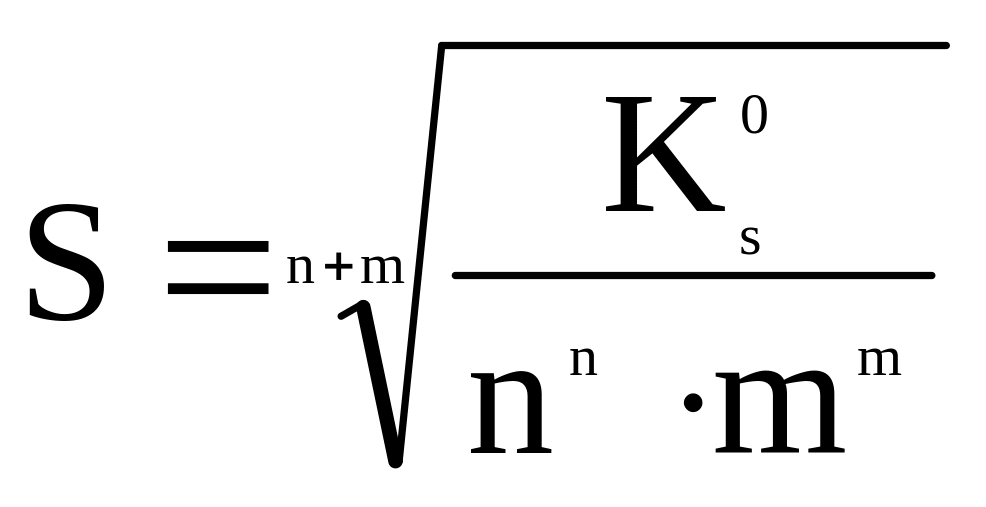 ,
моль/дм3
,
моль/дм3
Добуток розчинності дозволяє визначити умови утворення насичених, ненасичених та пересичених розчинів.
Так, для розчину умовного електроліту KnAm, якщо:

З ненасиченого розчину осад випадати не буде.
Якщо іонний добуток буде більше за добуток розчинності (розчин пересичений), то осад випадатиме. І це буде відбуватись доти, поки концентрації іонів в розчині не будуть дорівнювати їх розчинності в насиченому розчині.
Таким чином, умова утворення осаду:
![]() >
K
>
K
