
- •Передмова
- •Предмет та задачі аналітичної хімії
- •Глава 1. Деякі положення теорії електролітичної дисоціації
- •1.1. Електроліти, ступінь електролітичної дисоціації
- •1.2. Водневий показник водних розчинів електролітів (рН)
- •Практична робота складання рівнянь реакцій у молекулярній та іонній формах
- •Приклад
- •Завдання для самостійної роботи
- •Практична робота обчислення концентрації іонів гідрогену та гідроксид-іонів, рН та рОн у розчинах сильних електролітів
- •Приклади
- •Задачі для самостійної роботи
- •Глава 2. Кислотно-основна рівновага
- •2.1. Хімічна рівновага. Константа хімічної рівноваги
- •2.2. Рівновага в розчинах слабких електролітів
- •2.3. Рівновага в розчинах солей, що гідролізуються
- •2.4. Буферні системи
- •Практична робота рівновага в розчинах амфотерних електролітів
- •Завдання для самостійної роботи
- •Глава 3. Рівновага в гетерогенних системах
- •3.1. Добуток розчинності
- •3.2. Порядок дробного (вибіркового) осадження
- •3.3. Чинники, що впливають на осадження осадів та їх розчинність
- •Розв’язання
- •Завдання для самостійної роботи
- •Глава 4. Рівновага в окисно-відновних системах
- •4.1. Окисно-відновні системи
- •4.2. Окисно-відновний потенціал (редокс-потенціал)
- •4.3. Константа рівноваги редокс-реакції
- •Завдання для самостійної роботи
- •Глава 5. Рівновага комплексоутворення
- •5.1. Поняття про комплексні сполуки
- •Класифікація комплексних сполук
- •5.2.Рівноваги в розчинах комплексних сполук. Константи стійкості та нестійкості
- •5.3. Вплив різних чинників на процес комплексоутворення
- •5.4. Способи руйнування та утворення комплексів. Використання комплексних сполук в практиці аналізу
- •Розв'язання
- •Розв'язання
- •Задачі для самостійної роботи
- •Основні поняття
- •Дробний аналіз
- •Систематичний аналіз
- •IV. В залежності від способу виконання розрізняють реакції, що виконані:
- •Аналітичні ознаки реакцій
- •Правила роботи і техніка безпеки в хімічній лабораторії
- •Перша допомога при нещасних випадках
- •Якісний аналіз неорганічних сполук
- •Аналіз катіонів
- •Лабораторна робота
- •Загальна характеристика
- •Реакції Калій-катіона
- •1. Дія натрій гексанітрокобальтату(ііі) Na3[Co(nо2)6 ] (фармакопейна реакція)
- •2. Дія натрій гідрогентартрату NaHc4h4o6 (фармакопейна реакція)
- •3. Дія натрій тетрафенілборату Na[b(c6h5)4] (фармакопейна реакція)
- •4. Реакція забарвлення полум'я (реакція фармакопейна)
- •Реакції Натрій-катіона
- •1. Дія розчину метоксифенілацетатної кислоти c6h5ch(och3)cooh (фармакопейна реакція)
- •2. Дія калій гексагідроксостибату(V) k[Sb(oh)6] (фармакопейна реакція)
- •3. Дія цинктриураніл октаацетату Zn(uo2)3(ch3coo)8.
- •4. Реакція забарвлення полум’я (реакція фармакопейна)
- •Реакції амоній-катіона
- •1. Дія лугів (фармакопейна реакція)
- •3. Дія магній оксиду MgO (фармакопейна реакція)
- •Біологічна роль та практичне використання катіонів і аналітичної групи та їх сполук в медицині та фармації
- •Лабораторна робота
- •Загальна характеристика
- •1. Дія 2 м розчину хлоридної кислоти hCl (дія групового реагенту)
- •Плюмбум(іі) гідроксид має амфотерні властивості і розчиняється в надлишку реагенту:
- •3. Дія розчину калій йодиду кі
- •4. Дія розчину калій хромату k2CrO4
- •Реакція Аргентум(і)-катіона
- •Реакції Плюмбум(іі)-катіона
- •1. Дія розчину калій йодиду ki
- •Реакції димеркурій(і)-катіона
- •1. Дія розчину калій йодиду кі
- •Контрольні питання
- •Біологічна роль та практичне використання катіонів II аналітичної групи та їх сполук у медицині та фармації
- •Лабораторна робота
- •Загальна характеристика
- •Загальноаналітичні реакції катіонів III групи
- •1. Дія 1м розчину сульфатної кислоти h2so4 (дія групового реагенту)
- •2. Дія карбонатів
- •3. Дія хроматів
- •Реакції Барій-катіона
- •1. Дія дихромат-іону
- •2. Реакція забарвлення полум’я (фармакопейна реакція)
- •Реакції Кальцій-катіона
- •1. Дія розчину сульфатної кислоти h2so4
- •2. Дія розчину амоній оксалату (nh4)2c2o4 (фармакопейна реакція)
- •3. Дія розчину гліоксальгідроксіанілу (фармакопейна реакція)
- •4. Дія розчину калій гексаціаноферату(іі) k4[Fe(cn)6] (фармакопейна реакція)
- •5. Реакція забарвлення полум’я (фармакопейна реакція)
- •Реакції Стронцій-катіона
- •1. Реакція з гіпсовою водою
- •2. Реакція забарвлення полум'я
- •Контрольні запитання
- •Біологічна роль та практичне використання катіонів III аналітичної групи та їх сполук у медицині та фармації
- •Лабораторна робота реакції катіонів IV аналітичної групи
- •Загальна характеристика
- •Загальноаналітичні реакції катіонів IV аналітичної групи
- •1. Дія 6м розчину лугу (дія групового реагенту)
- •Реакція Станум(іі)-катіона
- •1. Дія надлишку лугу в присутності розчиненої солі бісмут(ііі) нітрату Ві(no3)3.
- •Реакція Хром(ііі)- катіона
- •1. Дія гідроген пероксиду h2o2 в присутності надлишку лугу
- •Реакції Цинк(іі)-катіона
- •1. Дія розчину калій гексаціаноферату(II) (фармакопейна реакція)
- •2. Дія сульфідів (фармакопейна реакція)
- •3. Дія дитизону
- •Реакції Алюміній(ііі)-катіона
- •1. Дія алізарину (1,2-діоксіанрахінону)
- •2. Дія розчину натрій ацетату
- •Реакції сполук Арсену
- •1. Дія розчину натрій дигідрогенфосфіту NaH2po2 (фармакопейна реакція)
- •2. Дія розчину натрій сульфіду Na2s (фармакопейна реакція)
- •3. Дія розчину магній сульфату MgSo4 (фармакопейна реакція)
- •Визначення домішок сполук Арсену(ііі) та Арсену(V) у лікарських засобах.
- •Контрольні питання
- •Біологічна роль та практичне використання катіонів IV аналітичної групи та їх сполук у медицині і фармації
- •Лабораторна робота реакції катіонів V аналітичної групи
- •Загальна характеристика
- •Загальноаналітичні реакції катіонів V аналітичної групи
- •1. Дія розчину амоніаку nh3·h2o (дія групового реагенту)
- •2. Дія рочину лугу NaOh або кон
- •Реакції Магній(іі)-катіона
- •1. Дія розчину натрій гідрогенфосфату Na2hpo4 (фармакопейна реакція)
- •2. Дія розчину 8-гідроксихіноліну (фармакопейна реакція)
- •Реакція Ферум(іі)-катіона
- •1. Дія розчину калій гексаціаноферату(ііі) k3[Fe(cn)6] (фармакопейна реакція)
- •Реакції Ферум(ііі)-катіона
- •1. Дія розчину калій гексаціаноферату(іі) k4[Fe(cn)6] (фармакопейна реакція)
- •2. Дія розчину амоній тіоціанату nh4ncs (фармакопейна реакція)
- •3. Дія розчину тіогліколевої кислоти hsch2cooh (фармакопейна реакція)
- •Реакція Манган(іі)-катіона
- •1. Дія діамоній гексаоксопероксидисульфату (nh4)2s2o8
- •Реакції Бісмут(ііі)-катіона
- •1. Дія свіжоприготованого натрій тетрагідроксостаніту(іі) Na2[Sn(oh)4]
- •2. Гідроліз солей Бісмуту
- •3. Дія розчину тіосечовини (nh2)2cs (фармакопейна реакція)
- •4. Дія розчину натрій сульфіду Na2s (фармакопейна реакція)
- •Контрольні питання
- •Біологічна роль та практичне застосування катіонів V аналітичної групи та їх сполук у медицині та фармації
- •Лабораторна робота аналіз суміші катіонів V аналітичної групи
- •Лабораторна робота реакції катіонів VI аналітичної групи
- •Загальноаналітичні реакції катіонів VI аналітичної групи
- •1. Дія розчину амоніаку (дія групового реагенту)
- •Реакції Купрум(іі)-катіона
- •1. Дія надлишку розчину амоніаку nн3·н2о
- •2. Дія розчину натрій тіосульфату Na2s2o3
- •Реакції Кобальт(іі)-катіона
- •1. Дія розчину амоній тіоціанату nh4ncs
- •Реакція Нікол(іі)-катіона
- •1. Дія диметилгліоксиму (реактиву Чугаєва) (фармакопейна реакція)
- •Реакції Меркурій(іі)-катіона
- •1. Дія розчину лугу (фармакопейна реакція)
- •2. Дія розчину калій йодиду кі (фармакопейна реакція)
- •3. Реакція з міддю та іншими металами (фармакопейна реакція)
- •Дія розчину натрій сульфіду Na2s
- •Аналіз аніонів
- •Лабораторна робота реакції аніонів і аналітичної групи
- •Загальна характеристика
- •Дія групового реагенту
- •Реакції сульфат-іона
- •Реакції сульфіт - іона
- •1. Дія мінеральної кислоти (фармакопейна реакція)
- •2. Дія розчину дийоду і2 (фармакопейна реакція)
- •Реакції тіосульфат-іона
- •1. Дія хлоридної кислоти hCl
- •2. Дія розчину дийоду і2
- •3. Дія аргентум (і) нітрату AgNo3
- •Реакції карбонат- та гідрогенкарбонат- іонів
- •1. Дія мінеральних кислот
- •2. Дія магній сульфату MgSo4 (фармакопейна реакція)
- •3. Дія фенолфталеїну (реакція фармакопейна)
- •Реакції фосфат- та гідрогенфосфат- іонів
- •1. Дія аргентум(і) нітрату AgNo3 (фармакопейна реакція)
- •2. Дія розчину магнезіальної суміші (MgCl2, nh4Cl, nh3·h2o)
- •Реакції тетраборат- та метаборат-іонів
- •1. Дія солей Барію
- •2. Реакція забарвлення полум'я (фармакопейна реакція)
- •Реакції хромат- та дихромат-іонів
- •1. Дія розчину солей Барію
- •2. Дія розчину калій йодиду кі
- •Реакція оксалат-іона
- •1. Дія розчину кальцій хлориду СаСl2
- •Контрольні питання
- •Біологічна роль і практичне використання аніонів і аналітичної групи та їх сполук у медицині та фармації
- •Реакції хлорид-іона
- •Реакції бромід-іона
- •1. Дія аргентум(і) нітрату AgNo3 (фармакопейна реакція)
- •2. Дія окисників
- •2.1. Дія хлорної води
- •2.2. Дія калій преманганату
- •Реакції йодид-іона
- •1. Дія окисників (фармакопейна реакція)
- •2. Дія солей Плюмбуму(іі)
- •Реакція сульфід-іона
- •1. Дія мінеральних кислот
- •Контрольні питання
- •Біологічна роль і практичне використання аніонів II аналітичної групи та їх сполук у медицині та фармації
- •1. Дія дифеніламіну (фармакопейна реакція)
- •2. Дія Ферум(іі)-катіонів
- •Реакції нітрит-іона
- •1. Дія кислоти
- •2. Реакція з антипірином (фармакопейна реакція)
- •Реакції ацетат-іона
- •1. Реакція естерифікації (фармакопейна реакція)
- •2. Дія ферум(III) хлориду (фармакопейна реакція)
- •Контрольні питання
- •Біологічна роль і практичне використання аніонів ш аналітичної групи та їх сполук у медицині та фармації
- •3.2 Відкриття аніонів
- •Контрольні завдання
- •Додатки
- •Забарвлення полум'я сполуками деяких елементів
- •Способи виразу вмісту компонентів у розчині
- •Кількісні характеристики процесу гідролізу солей
- •Аніони, які утворюють газоподібні продукти
- •Глава 1. Деякі положення теорії електролітичної дисоціації
- •Глава 2. Кислотно-основна рівновага
- •Глава 3. Рівновага в гетерогенних системах
- •Глава 4. Рівновага в окисно-відновних системах
- •Глава 5. Рівновага комплексоутворення
Класифікація комплексних сполук
а) за характером заряду комплексної сполуки:
катіонні [Ag(NH3)2]Cl, [Sr(OH2)6]Cl2
аніонні K4[Fe(CN)6] , Na3 [Со(NО2)6]
нейтральні [Pt(NH3)2Cl2], [Co(NH3)3(NO2)3]
б) за типом утворення
1. Утворені за типом приєднання, наприклад:
HCl + FeCl3 = H[FeCl4]
До цієї групи комплексних сполук відносяться:
ціанокомплекси, наприклад K3[Fe(CN)6], K2[Ni(CN)6]
тіоціанокомплекси, наприклад (NH4)2[Co(NCS)4]
галогенокомплекси, наприклад Na3 [AlCl6]; H[FeСl4]
нітрокомплекси, наприклад Na3[Со(NО2)6] та інші.
У цих випадках утворюється комплексні аніони.
2. Утворені за типом втілення, наприклад:
ZnCl2 + 4NH3 = [Zn(NH3)4]Cl2
До цієї групи комплексних сполук відносять:
амінокомплекси, наприклад [Со(NН3)4]SO4; [Ni(NH3)6]Сl4
аквакомплекси, наприклад [Аl(Н2О)6]Сl3 та інші.
У цих випадках утворюється комплексний катіон.
5.2.Рівноваги в розчинах комплексних сполук. Константи стійкості та нестійкості
Катіонні та аніонні комплексні сполуки, як правило, розчинні у воді. При цьому спочатку відбувається первинна електролітична дисоціація – відщеплюються іони зовнішньої сфери, тобто дисоціація йде за типом сильного електроліту:
[Zn(NH3)4]Cl2 → [Zn(NH3)4]2+ + 2Cl-
Na3[Со(NО2)6] → 3Na+ + [Co(NO2)6]3–
За певних умов відбувається вторинна дисоціація комплексного іона – за типом слабкого електроліту – ступінчасто відщеплюються ліганди внутрішньої сфери. Кожна ступінь характеризується своєю константою хімічної рівноваги , яку називають константою нестійкості комплексу Кнест
[Ag(NH3)2]+
F
[Ag(NH3)]+
+ NH3
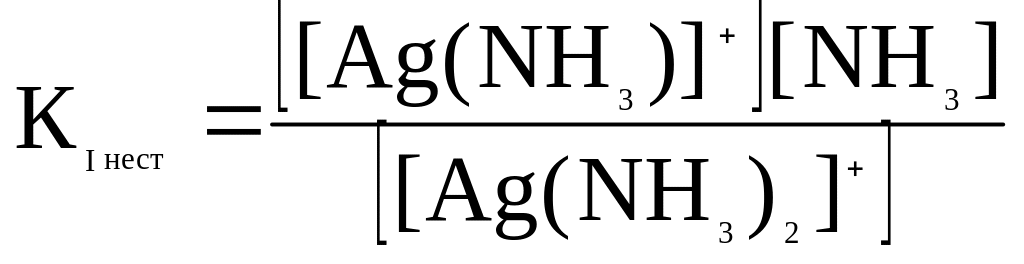
[Ag(NH3)]+
F
Ag+
+
NH3

С умарна
реакція процесу дисоціації
умарна
реакція процесу дисоціації
[Ag(NH3)2]+
F
Ag+
+
2NH3
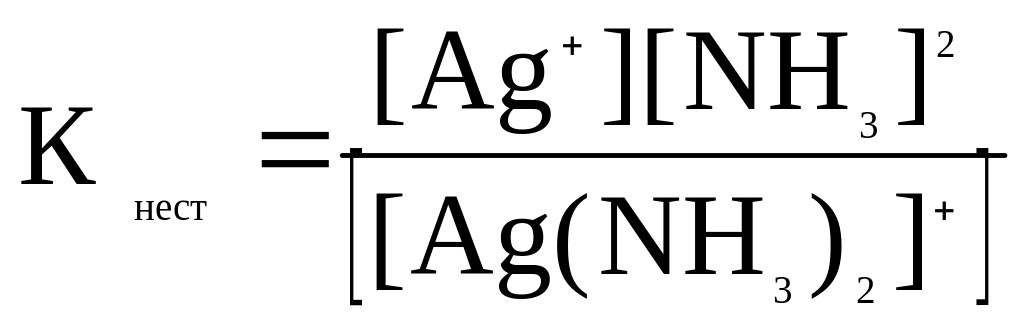
Добуток всіх ступінчастих констант нестійкості дорівнює повній константі нестійкості комплексу:
КІ нест·КІІнест = Кнест
Величина оборотна константі нестійкості називається константою стійкості комплексу. Позначається β = 1/ Кнест
Значення констант наведені в довідниках. Часто наведені показники констант: рКнест = - lgКнест
Чим менше величина константи нестійкості, тим стійкіше комплексний іон.
Знання констант нестійкості дозволяє розрахувати рівноважні концентрації іонів в розчині, проводити порівняння міцності різних комплексів. Використання комплексних сполук має і медико-біологічне значення: так, якщо, організм перенасичений сполуками якого-небудь металу, отруюючи його, то вводять антидоти – нетоксичні ліганди, які утворюють стійкі комплекси з цим металом, які потім виводяться з організму. При дефіциті в організмі якого-небудь металу, його вводять у вигляді комплексної сполуки.
5.3. Вплив різних чинників на процес комплексоутворення
а) Вплив рН середовища
Такий вплив має місце особливо в тому випадку, коли в реакціях утворення комплексів або в побічних реакціях лігандів беруть участь катіони Гідрогену.
Так, [Ag(NH3)2]+ може існувати в нейтральних та слабко лужних середовищах, а в кислому він руйнується з утворенням осаду:
[Ag(NH3)2]++ 2H+ + Cl– F AgCl↓ + 2NH4+
Часто для повноти зв'язування катіону в комплекс
Ag++ 2NH3 F [Ag(NH3)2]+
реакцію комплексоутворення проводять в слабко лужному середовищі. При цьому гідроксильні-групи заважають взаємодії лігандів з іонами Гідрогену, зростає концентрація лігандів, а значить рівновага зміщується в бік утворення комплексу.
В сильно-лужному середовищі реакцію комплексоутворення не проводять, щоб запобігти гідролізу іонів металу та утворенню гідроксидів.
б) Вплив концентрації ліганду
Чим більше концентрація ліганду, тим повніше зв'яжеться метал в комплекс. Згідно з правилом Ле Шательє, при збільшенні концентрації вихідної речовини рівновага зміщується в бік перебігу прямого процесу, тобто утворення комплексної сполуки.
в) Вплив сторонніх іонів, що утворюють малорозчинні сполуки з металом-комплексоутворювачем
Як приклад розглянемо рівновагу
[Ag(NH3)2]+ F Ag+ + 2NH3
Цей комплекс достатньо стійкий: при кімнатній температурі Кнест= 6,1·10-8. Тобто рівновага зміщена в бік існування комплексу.
При введенні в розчин йодид-іонів можливе випадіння осаду
Ag+ + I– F AgI↓
Добуток
розчинності цього осаду має дуже мале
значення
![]() = 8,3·10-17.
= 8,3·10-17.
Кнест([Ag(NH3)2]+) > (AgI) = 8,3·10-17
тому комплекс буде руйнуватись і буде випадати осад.
г) Вплив температури
Як і будь-які константи хімічної рівноваги, константи нестійкості залежать від температури. Рівновага комплексоутворення зміщується в той чи іншій бік в залежності від природи речовин.
