
- •Передмова
- •Предмет та задачі аналітичної хімії
- •Глава 1. Деякі положення теорії електролітичної дисоціації
- •1.1. Електроліти, ступінь електролітичної дисоціації
- •1.2. Водневий показник водних розчинів електролітів (рН)
- •Практична робота складання рівнянь реакцій у молекулярній та іонній формах
- •Приклад
- •Завдання для самостійної роботи
- •Практична робота обчислення концентрації іонів гідрогену та гідроксид-іонів, рН та рОн у розчинах сильних електролітів
- •Приклади
- •Задачі для самостійної роботи
- •Глава 2. Кислотно-основна рівновага
- •2.1. Хімічна рівновага. Константа хімічної рівноваги
- •2.2. Рівновага в розчинах слабких електролітів
- •2.3. Рівновага в розчинах солей, що гідролізуються
- •2.4. Буферні системи
- •Практична робота рівновага в розчинах амфотерних електролітів
- •Завдання для самостійної роботи
- •Глава 3. Рівновага в гетерогенних системах
- •3.1. Добуток розчинності
- •3.2. Порядок дробного (вибіркового) осадження
- •3.3. Чинники, що впливають на осадження осадів та їх розчинність
- •Розв’язання
- •Завдання для самостійної роботи
- •Глава 4. Рівновага в окисно-відновних системах
- •4.1. Окисно-відновні системи
- •4.2. Окисно-відновний потенціал (редокс-потенціал)
- •4.3. Константа рівноваги редокс-реакції
- •Завдання для самостійної роботи
- •Глава 5. Рівновага комплексоутворення
- •5.1. Поняття про комплексні сполуки
- •Класифікація комплексних сполук
- •5.2.Рівноваги в розчинах комплексних сполук. Константи стійкості та нестійкості
- •5.3. Вплив різних чинників на процес комплексоутворення
- •5.4. Способи руйнування та утворення комплексів. Використання комплексних сполук в практиці аналізу
- •Розв'язання
- •Розв'язання
- •Задачі для самостійної роботи
- •Основні поняття
- •Дробний аналіз
- •Систематичний аналіз
- •IV. В залежності від способу виконання розрізняють реакції, що виконані:
- •Аналітичні ознаки реакцій
- •Правила роботи і техніка безпеки в хімічній лабораторії
- •Перша допомога при нещасних випадках
- •Якісний аналіз неорганічних сполук
- •Аналіз катіонів
- •Лабораторна робота
- •Загальна характеристика
- •Реакції Калій-катіона
- •1. Дія натрій гексанітрокобальтату(ііі) Na3[Co(nо2)6 ] (фармакопейна реакція)
- •2. Дія натрій гідрогентартрату NaHc4h4o6 (фармакопейна реакція)
- •3. Дія натрій тетрафенілборату Na[b(c6h5)4] (фармакопейна реакція)
- •4. Реакція забарвлення полум'я (реакція фармакопейна)
- •Реакції Натрій-катіона
- •1. Дія розчину метоксифенілацетатної кислоти c6h5ch(och3)cooh (фармакопейна реакція)
- •2. Дія калій гексагідроксостибату(V) k[Sb(oh)6] (фармакопейна реакція)
- •3. Дія цинктриураніл октаацетату Zn(uo2)3(ch3coo)8.
- •4. Реакція забарвлення полум’я (реакція фармакопейна)
- •Реакції амоній-катіона
- •1. Дія лугів (фармакопейна реакція)
- •3. Дія магній оксиду MgO (фармакопейна реакція)
- •Біологічна роль та практичне використання катіонів і аналітичної групи та їх сполук в медицині та фармації
- •Лабораторна робота
- •Загальна характеристика
- •1. Дія 2 м розчину хлоридної кислоти hCl (дія групового реагенту)
- •Плюмбум(іі) гідроксид має амфотерні властивості і розчиняється в надлишку реагенту:
- •3. Дія розчину калій йодиду кі
- •4. Дія розчину калій хромату k2CrO4
- •Реакція Аргентум(і)-катіона
- •Реакції Плюмбум(іі)-катіона
- •1. Дія розчину калій йодиду ki
- •Реакції димеркурій(і)-катіона
- •1. Дія розчину калій йодиду кі
- •Контрольні питання
- •Біологічна роль та практичне використання катіонів II аналітичної групи та їх сполук у медицині та фармації
- •Лабораторна робота
- •Загальна характеристика
- •Загальноаналітичні реакції катіонів III групи
- •1. Дія 1м розчину сульфатної кислоти h2so4 (дія групового реагенту)
- •2. Дія карбонатів
- •3. Дія хроматів
- •Реакції Барій-катіона
- •1. Дія дихромат-іону
- •2. Реакція забарвлення полум’я (фармакопейна реакція)
- •Реакції Кальцій-катіона
- •1. Дія розчину сульфатної кислоти h2so4
- •2. Дія розчину амоній оксалату (nh4)2c2o4 (фармакопейна реакція)
- •3. Дія розчину гліоксальгідроксіанілу (фармакопейна реакція)
- •4. Дія розчину калій гексаціаноферату(іі) k4[Fe(cn)6] (фармакопейна реакція)
- •5. Реакція забарвлення полум’я (фармакопейна реакція)
- •Реакції Стронцій-катіона
- •1. Реакція з гіпсовою водою
- •2. Реакція забарвлення полум'я
- •Контрольні запитання
- •Біологічна роль та практичне використання катіонів III аналітичної групи та їх сполук у медицині та фармації
- •Лабораторна робота реакції катіонів IV аналітичної групи
- •Загальна характеристика
- •Загальноаналітичні реакції катіонів IV аналітичної групи
- •1. Дія 6м розчину лугу (дія групового реагенту)
- •Реакція Станум(іі)-катіона
- •1. Дія надлишку лугу в присутності розчиненої солі бісмут(ііі) нітрату Ві(no3)3.
- •Реакція Хром(ііі)- катіона
- •1. Дія гідроген пероксиду h2o2 в присутності надлишку лугу
- •Реакції Цинк(іі)-катіона
- •1. Дія розчину калій гексаціаноферату(II) (фармакопейна реакція)
- •2. Дія сульфідів (фармакопейна реакція)
- •3. Дія дитизону
- •Реакції Алюміній(ііі)-катіона
- •1. Дія алізарину (1,2-діоксіанрахінону)
- •2. Дія розчину натрій ацетату
- •Реакції сполук Арсену
- •1. Дія розчину натрій дигідрогенфосфіту NaH2po2 (фармакопейна реакція)
- •2. Дія розчину натрій сульфіду Na2s (фармакопейна реакція)
- •3. Дія розчину магній сульфату MgSo4 (фармакопейна реакція)
- •Визначення домішок сполук Арсену(ііі) та Арсену(V) у лікарських засобах.
- •Контрольні питання
- •Біологічна роль та практичне використання катіонів IV аналітичної групи та їх сполук у медицині і фармації
- •Лабораторна робота реакції катіонів V аналітичної групи
- •Загальна характеристика
- •Загальноаналітичні реакції катіонів V аналітичної групи
- •1. Дія розчину амоніаку nh3·h2o (дія групового реагенту)
- •2. Дія рочину лугу NaOh або кон
- •Реакції Магній(іі)-катіона
- •1. Дія розчину натрій гідрогенфосфату Na2hpo4 (фармакопейна реакція)
- •2. Дія розчину 8-гідроксихіноліну (фармакопейна реакція)
- •Реакція Ферум(іі)-катіона
- •1. Дія розчину калій гексаціаноферату(ііі) k3[Fe(cn)6] (фармакопейна реакція)
- •Реакції Ферум(ііі)-катіона
- •1. Дія розчину калій гексаціаноферату(іі) k4[Fe(cn)6] (фармакопейна реакція)
- •2. Дія розчину амоній тіоціанату nh4ncs (фармакопейна реакція)
- •3. Дія розчину тіогліколевої кислоти hsch2cooh (фармакопейна реакція)
- •Реакція Манган(іі)-катіона
- •1. Дія діамоній гексаоксопероксидисульфату (nh4)2s2o8
- •Реакції Бісмут(ііі)-катіона
- •1. Дія свіжоприготованого натрій тетрагідроксостаніту(іі) Na2[Sn(oh)4]
- •2. Гідроліз солей Бісмуту
- •3. Дія розчину тіосечовини (nh2)2cs (фармакопейна реакція)
- •4. Дія розчину натрій сульфіду Na2s (фармакопейна реакція)
- •Контрольні питання
- •Біологічна роль та практичне застосування катіонів V аналітичної групи та їх сполук у медицині та фармації
- •Лабораторна робота аналіз суміші катіонів V аналітичної групи
- •Лабораторна робота реакції катіонів VI аналітичної групи
- •Загальноаналітичні реакції катіонів VI аналітичної групи
- •1. Дія розчину амоніаку (дія групового реагенту)
- •Реакції Купрум(іі)-катіона
- •1. Дія надлишку розчину амоніаку nн3·н2о
- •2. Дія розчину натрій тіосульфату Na2s2o3
- •Реакції Кобальт(іі)-катіона
- •1. Дія розчину амоній тіоціанату nh4ncs
- •Реакція Нікол(іі)-катіона
- •1. Дія диметилгліоксиму (реактиву Чугаєва) (фармакопейна реакція)
- •Реакції Меркурій(іі)-катіона
- •1. Дія розчину лугу (фармакопейна реакція)
- •2. Дія розчину калій йодиду кі (фармакопейна реакція)
- •3. Реакція з міддю та іншими металами (фармакопейна реакція)
- •Дія розчину натрій сульфіду Na2s
- •Аналіз аніонів
- •Лабораторна робота реакції аніонів і аналітичної групи
- •Загальна характеристика
- •Дія групового реагенту
- •Реакції сульфат-іона
- •Реакції сульфіт - іона
- •1. Дія мінеральної кислоти (фармакопейна реакція)
- •2. Дія розчину дийоду і2 (фармакопейна реакція)
- •Реакції тіосульфат-іона
- •1. Дія хлоридної кислоти hCl
- •2. Дія розчину дийоду і2
- •3. Дія аргентум (і) нітрату AgNo3
- •Реакції карбонат- та гідрогенкарбонат- іонів
- •1. Дія мінеральних кислот
- •2. Дія магній сульфату MgSo4 (фармакопейна реакція)
- •3. Дія фенолфталеїну (реакція фармакопейна)
- •Реакції фосфат- та гідрогенфосфат- іонів
- •1. Дія аргентум(і) нітрату AgNo3 (фармакопейна реакція)
- •2. Дія розчину магнезіальної суміші (MgCl2, nh4Cl, nh3·h2o)
- •Реакції тетраборат- та метаборат-іонів
- •1. Дія солей Барію
- •2. Реакція забарвлення полум'я (фармакопейна реакція)
- •Реакції хромат- та дихромат-іонів
- •1. Дія розчину солей Барію
- •2. Дія розчину калій йодиду кі
- •Реакція оксалат-іона
- •1. Дія розчину кальцій хлориду СаСl2
- •Контрольні питання
- •Біологічна роль і практичне використання аніонів і аналітичної групи та їх сполук у медицині та фармації
- •Реакції хлорид-іона
- •Реакції бромід-іона
- •1. Дія аргентум(і) нітрату AgNo3 (фармакопейна реакція)
- •2. Дія окисників
- •2.1. Дія хлорної води
- •2.2. Дія калій преманганату
- •Реакції йодид-іона
- •1. Дія окисників (фармакопейна реакція)
- •2. Дія солей Плюмбуму(іі)
- •Реакція сульфід-іона
- •1. Дія мінеральних кислот
- •Контрольні питання
- •Біологічна роль і практичне використання аніонів II аналітичної групи та їх сполук у медицині та фармації
- •1. Дія дифеніламіну (фармакопейна реакція)
- •2. Дія Ферум(іі)-катіонів
- •Реакції нітрит-іона
- •1. Дія кислоти
- •2. Реакція з антипірином (фармакопейна реакція)
- •Реакції ацетат-іона
- •1. Реакція естерифікації (фармакопейна реакція)
- •2. Дія ферум(III) хлориду (фармакопейна реакція)
- •Контрольні питання
- •Біологічна роль і практичне використання аніонів ш аналітичної групи та їх сполук у медицині та фармації
- •3.2 Відкриття аніонів
- •Контрольні завдання
- •Додатки
- •Забарвлення полум'я сполуками деяких елементів
- •Способи виразу вмісту компонентів у розчині
- •Кількісні характеристики процесу гідролізу солей
- •Аніони, які утворюють газоподібні продукти
- •Глава 1. Деякі положення теорії електролітичної дисоціації
- •Глава 2. Кислотно-основна рівновага
- •Глава 3. Рівновага в гетерогенних системах
- •Глава 4. Рівновага в окисно-відновних системах
- •Глава 5. Рівновага комплексоутворення
1. Дія дифеніламіну (фармакопейна реакція)
Нітрат-іони окиснюють дифеніламін, при цьому утворюється сполука синього кольору:
NO
+ дифеніламін
![]() синє забарвлення
синє забарвлення
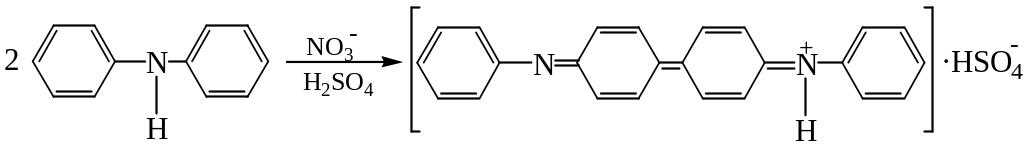
Виконання досліду: на годинникове скло нанести 2-3 краплі дифеніламіну і 1 краплю розчину, що містить нітрат-іони, перемішати. Спостерігати зміну забарвлення розчину у синій колір.
2. Дія Ферум(іі)-катіонів
Нітрат-іони з іонами Fe2+ в присутності концентрованої сульфатної кислоти утворюють коричневе кільце [Fe(NO)]SO4 на межі розподілу двох рідин різної густини:
6FeSO4 + 4H2SO4 + 2NaNO3 → 3Fe2(SO4)3 + 2NO↑ + Na2SO4 + 4H2O
 Fe2+
–
1ē
F
Fe3+
3
Fe2+
–
1ē
F
Fe3+
3
NO + 4H+ + 3ē F NO↑ + 2H2O 1
3Fe2+ + NO + 4H+ → 3Fe3+ +NO↑ + 2H2O
В кислому середовищі нітратна кислота та її солі відновлюються до нітроген(ІІ)оксиду (NO), який утворює з FeSO4 комплексну сполуку бурого кольору.
SO + Fe2+ + NO F [Fe(NO)]SO4
Виконання досліду: до 2-3 крапель розчину, що містить нітрат-іони, додати 2-3 краплі концентрованої сульфатної кислоти H2SO4, потім додати 3-4 краплі солі, що містить Ферум(ІІ)-катіони. Спостерігати появу кільця та його колір.
Реакції нітрит-іона
1. Дія кислоти
Нітрит-іони при дії сильних кислот утворюють нестійку нітритну кислоту, яка розкладається з утворенням нітроген(ІІ) та нітроген(IV) оксидів.
2NaNO2 + H2SO4 → Na2SO4 + 2HNO2
NO + H+ F HNO2
2HNO2 → NO2↑ + NO↑ + H2O
 NO
– 1ē
F
NO2↑ 1
NO
– 1ē
F
NO2↑ 1
N O + 2H+ + 1ē F NO↑ + H2O 1
2NO + 2Н+ → NO↑ + NO2↑ + H2O
Виконання досліду: до 2-3 крапель розчину, що містить нітрит-іони, додати 2-3 краплі сульфатної кислоти H2SO4. Спостерігати виділення газу бурого кольору.
2. Реакція з антипірином (фармакопейна реакція)
Нітрит-іони у кислому середовищі реагують з антипірином з утворенням нітрозоантипірину смарагдово-зеленого кольору:
NaNO2 + HCl → HNO2 + NaCl
NO + H+ F HNO2

Виконання досліду: до 2-3 крапель розчину, що містить нітрит-іони, додати 2-3 краплі розведеної хлоридної кислоти HCl та декілька кристалів антипірину. Спостерігати появу смарагдово-зеленого розчину. NO3– -іони не заважають виявленню NO2– -іонів цим реагентом.
Реакції ацетат-іона
1. Реакція естерифікації (фармакопейна реакція)
Ацетат-іони в присутності концентрованої сульфатної кислоти і етилового спирту при нагріванні утворюють етилацетат з характерним запахом.
2CH3COONa + H2SO4 → 2CH3COOH + Na2SO4
CH3COO- + H+ F CH3COOH
CH3СOOH
+
C2H5OH
![]() CH3COOC2H5
+
Н2О
CH3COOC2H5
+
Н2О
Виконання досліду: до 3-4 крапель розчину, що містить ацетат-іони, додати 5-6 крапель етилового спирту та 3-4 краплі концентрованої сульфатної кислоти. Суміш нагрівати протягом 1-2 хвилин і вилити у склянку з холодною водою, відчувається характерний запах етилацетату.
2. Дія ферум(III) хлориду (фармакопейна реакція)
Ацетат-іони з іонами Fe3+ при рН 5-8 дає розчинний темно-червоний ферум(ІІІ) ацетат.
FeCl3 +3CH3COONa → Fe(CH3COO)3 + 3NaCl
Fe3+ + 3CH3COO- F Fe(CH3COO)3
У водному розчині він частково гідролізується; підкислення подавляє гідроліз, при цьому зникає червоне забарвлення. При кип'ятінні розчину ферум(ІІІ) ацетату за рахунок глибокого гідролізу випадає осад ферум(ІІІ) дигідроксоацетат червоно-бурого кольору:
Fe(CH3COO)3+2H2О F Fe(OH)2CH3COO↓ +2СН3СООН
Виконання досліду: до 5-6 крапель розчину натрій ацетату додати 3-4 краплі приблизно 3% розчину ферум(ІІІ) хлориду. Одержаний розчин розвести в 2 раза і нагріти на водяній бані. Спостерігати випадіння червоно-бурого осаду основної солі ферум(ІІІ) дигідроксоацетату.
