
- •Передмова
- •Предмет та задачі аналітичної хімії
- •Глава 1. Деякі положення теорії електролітичної дисоціації
- •1.1. Електроліти, ступінь електролітичної дисоціації
- •1.2. Водневий показник водних розчинів електролітів (рН)
- •Практична робота складання рівнянь реакцій у молекулярній та іонній формах
- •Приклад
- •Завдання для самостійної роботи
- •Практична робота обчислення концентрації іонів гідрогену та гідроксид-іонів, рН та рОн у розчинах сильних електролітів
- •Приклади
- •Задачі для самостійної роботи
- •Глава 2. Кислотно-основна рівновага
- •2.1. Хімічна рівновага. Константа хімічної рівноваги
- •2.2. Рівновага в розчинах слабких електролітів
- •2.3. Рівновага в розчинах солей, що гідролізуються
- •2.4. Буферні системи
- •Практична робота рівновага в розчинах амфотерних електролітів
- •Завдання для самостійної роботи
- •Глава 3. Рівновага в гетерогенних системах
- •3.1. Добуток розчинності
- •3.2. Порядок дробного (вибіркового) осадження
- •3.3. Чинники, що впливають на осадження осадів та їх розчинність
- •Розв’язання
- •Завдання для самостійної роботи
- •Глава 4. Рівновага в окисно-відновних системах
- •4.1. Окисно-відновні системи
- •4.2. Окисно-відновний потенціал (редокс-потенціал)
- •4.3. Константа рівноваги редокс-реакції
- •Завдання для самостійної роботи
- •Глава 5. Рівновага комплексоутворення
- •5.1. Поняття про комплексні сполуки
- •Класифікація комплексних сполук
- •5.2.Рівноваги в розчинах комплексних сполук. Константи стійкості та нестійкості
- •5.3. Вплив різних чинників на процес комплексоутворення
- •5.4. Способи руйнування та утворення комплексів. Використання комплексних сполук в практиці аналізу
- •Розв'язання
- •Розв'язання
- •Задачі для самостійної роботи
- •Основні поняття
- •Дробний аналіз
- •Систематичний аналіз
- •IV. В залежності від способу виконання розрізняють реакції, що виконані:
- •Аналітичні ознаки реакцій
- •Правила роботи і техніка безпеки в хімічній лабораторії
- •Перша допомога при нещасних випадках
- •Якісний аналіз неорганічних сполук
- •Аналіз катіонів
- •Лабораторна робота
- •Загальна характеристика
- •Реакції Калій-катіона
- •1. Дія натрій гексанітрокобальтату(ііі) Na3[Co(nо2)6 ] (фармакопейна реакція)
- •2. Дія натрій гідрогентартрату NaHc4h4o6 (фармакопейна реакція)
- •3. Дія натрій тетрафенілборату Na[b(c6h5)4] (фармакопейна реакція)
- •4. Реакція забарвлення полум'я (реакція фармакопейна)
- •Реакції Натрій-катіона
- •1. Дія розчину метоксифенілацетатної кислоти c6h5ch(och3)cooh (фармакопейна реакція)
- •2. Дія калій гексагідроксостибату(V) k[Sb(oh)6] (фармакопейна реакція)
- •3. Дія цинктриураніл октаацетату Zn(uo2)3(ch3coo)8.
- •4. Реакція забарвлення полум’я (реакція фармакопейна)
- •Реакції амоній-катіона
- •1. Дія лугів (фармакопейна реакція)
- •3. Дія магній оксиду MgO (фармакопейна реакція)
- •Біологічна роль та практичне використання катіонів і аналітичної групи та їх сполук в медицині та фармації
- •Лабораторна робота
- •Загальна характеристика
- •1. Дія 2 м розчину хлоридної кислоти hCl (дія групового реагенту)
- •Плюмбум(іі) гідроксид має амфотерні властивості і розчиняється в надлишку реагенту:
- •3. Дія розчину калій йодиду кі
- •4. Дія розчину калій хромату k2CrO4
- •Реакція Аргентум(і)-катіона
- •Реакції Плюмбум(іі)-катіона
- •1. Дія розчину калій йодиду ki
- •Реакції димеркурій(і)-катіона
- •1. Дія розчину калій йодиду кі
- •Контрольні питання
- •Біологічна роль та практичне використання катіонів II аналітичної групи та їх сполук у медицині та фармації
- •Лабораторна робота
- •Загальна характеристика
- •Загальноаналітичні реакції катіонів III групи
- •1. Дія 1м розчину сульфатної кислоти h2so4 (дія групового реагенту)
- •2. Дія карбонатів
- •3. Дія хроматів
- •Реакції Барій-катіона
- •1. Дія дихромат-іону
- •2. Реакція забарвлення полум’я (фармакопейна реакція)
- •Реакції Кальцій-катіона
- •1. Дія розчину сульфатної кислоти h2so4
- •2. Дія розчину амоній оксалату (nh4)2c2o4 (фармакопейна реакція)
- •3. Дія розчину гліоксальгідроксіанілу (фармакопейна реакція)
- •4. Дія розчину калій гексаціаноферату(іі) k4[Fe(cn)6] (фармакопейна реакція)
- •5. Реакція забарвлення полум’я (фармакопейна реакція)
- •Реакції Стронцій-катіона
- •1. Реакція з гіпсовою водою
- •2. Реакція забарвлення полум'я
- •Контрольні запитання
- •Біологічна роль та практичне використання катіонів III аналітичної групи та їх сполук у медицині та фармації
- •Лабораторна робота реакції катіонів IV аналітичної групи
- •Загальна характеристика
- •Загальноаналітичні реакції катіонів IV аналітичної групи
- •1. Дія 6м розчину лугу (дія групового реагенту)
- •Реакція Станум(іі)-катіона
- •1. Дія надлишку лугу в присутності розчиненої солі бісмут(ііі) нітрату Ві(no3)3.
- •Реакція Хром(ііі)- катіона
- •1. Дія гідроген пероксиду h2o2 в присутності надлишку лугу
- •Реакції Цинк(іі)-катіона
- •1. Дія розчину калій гексаціаноферату(II) (фармакопейна реакція)
- •2. Дія сульфідів (фармакопейна реакція)
- •3. Дія дитизону
- •Реакції Алюміній(ііі)-катіона
- •1. Дія алізарину (1,2-діоксіанрахінону)
- •2. Дія розчину натрій ацетату
- •Реакції сполук Арсену
- •1. Дія розчину натрій дигідрогенфосфіту NaH2po2 (фармакопейна реакція)
- •2. Дія розчину натрій сульфіду Na2s (фармакопейна реакція)
- •3. Дія розчину магній сульфату MgSo4 (фармакопейна реакція)
- •Визначення домішок сполук Арсену(ііі) та Арсену(V) у лікарських засобах.
- •Контрольні питання
- •Біологічна роль та практичне використання катіонів IV аналітичної групи та їх сполук у медицині і фармації
- •Лабораторна робота реакції катіонів V аналітичної групи
- •Загальна характеристика
- •Загальноаналітичні реакції катіонів V аналітичної групи
- •1. Дія розчину амоніаку nh3·h2o (дія групового реагенту)
- •2. Дія рочину лугу NaOh або кон
- •Реакції Магній(іі)-катіона
- •1. Дія розчину натрій гідрогенфосфату Na2hpo4 (фармакопейна реакція)
- •2. Дія розчину 8-гідроксихіноліну (фармакопейна реакція)
- •Реакція Ферум(іі)-катіона
- •1. Дія розчину калій гексаціаноферату(ііі) k3[Fe(cn)6] (фармакопейна реакція)
- •Реакції Ферум(ііі)-катіона
- •1. Дія розчину калій гексаціаноферату(іі) k4[Fe(cn)6] (фармакопейна реакція)
- •2. Дія розчину амоній тіоціанату nh4ncs (фармакопейна реакція)
- •3. Дія розчину тіогліколевої кислоти hsch2cooh (фармакопейна реакція)
- •Реакція Манган(іі)-катіона
- •1. Дія діамоній гексаоксопероксидисульфату (nh4)2s2o8
- •Реакції Бісмут(ііі)-катіона
- •1. Дія свіжоприготованого натрій тетрагідроксостаніту(іі) Na2[Sn(oh)4]
- •2. Гідроліз солей Бісмуту
- •3. Дія розчину тіосечовини (nh2)2cs (фармакопейна реакція)
- •4. Дія розчину натрій сульфіду Na2s (фармакопейна реакція)
- •Контрольні питання
- •Біологічна роль та практичне застосування катіонів V аналітичної групи та їх сполук у медицині та фармації
- •Лабораторна робота аналіз суміші катіонів V аналітичної групи
- •Лабораторна робота реакції катіонів VI аналітичної групи
- •Загальноаналітичні реакції катіонів VI аналітичної групи
- •1. Дія розчину амоніаку (дія групового реагенту)
- •Реакції Купрум(іі)-катіона
- •1. Дія надлишку розчину амоніаку nн3·н2о
- •2. Дія розчину натрій тіосульфату Na2s2o3
- •Реакції Кобальт(іі)-катіона
- •1. Дія розчину амоній тіоціанату nh4ncs
- •Реакція Нікол(іі)-катіона
- •1. Дія диметилгліоксиму (реактиву Чугаєва) (фармакопейна реакція)
- •Реакції Меркурій(іі)-катіона
- •1. Дія розчину лугу (фармакопейна реакція)
- •2. Дія розчину калій йодиду кі (фармакопейна реакція)
- •3. Реакція з міддю та іншими металами (фармакопейна реакція)
- •Дія розчину натрій сульфіду Na2s
- •Аналіз аніонів
- •Лабораторна робота реакції аніонів і аналітичної групи
- •Загальна характеристика
- •Дія групового реагенту
- •Реакції сульфат-іона
- •Реакції сульфіт - іона
- •1. Дія мінеральної кислоти (фармакопейна реакція)
- •2. Дія розчину дийоду і2 (фармакопейна реакція)
- •Реакції тіосульфат-іона
- •1. Дія хлоридної кислоти hCl
- •2. Дія розчину дийоду і2
- •3. Дія аргентум (і) нітрату AgNo3
- •Реакції карбонат- та гідрогенкарбонат- іонів
- •1. Дія мінеральних кислот
- •2. Дія магній сульфату MgSo4 (фармакопейна реакція)
- •3. Дія фенолфталеїну (реакція фармакопейна)
- •Реакції фосфат- та гідрогенфосфат- іонів
- •1. Дія аргентум(і) нітрату AgNo3 (фармакопейна реакція)
- •2. Дія розчину магнезіальної суміші (MgCl2, nh4Cl, nh3·h2o)
- •Реакції тетраборат- та метаборат-іонів
- •1. Дія солей Барію
- •2. Реакція забарвлення полум'я (фармакопейна реакція)
- •Реакції хромат- та дихромат-іонів
- •1. Дія розчину солей Барію
- •2. Дія розчину калій йодиду кі
- •Реакція оксалат-іона
- •1. Дія розчину кальцій хлориду СаСl2
- •Контрольні питання
- •Біологічна роль і практичне використання аніонів і аналітичної групи та їх сполук у медицині та фармації
- •Реакції хлорид-іона
- •Реакції бромід-іона
- •1. Дія аргентум(і) нітрату AgNo3 (фармакопейна реакція)
- •2. Дія окисників
- •2.1. Дія хлорної води
- •2.2. Дія калій преманганату
- •Реакції йодид-іона
- •1. Дія окисників (фармакопейна реакція)
- •2. Дія солей Плюмбуму(іі)
- •Реакція сульфід-іона
- •1. Дія мінеральних кислот
- •Контрольні питання
- •Біологічна роль і практичне використання аніонів II аналітичної групи та їх сполук у медицині та фармації
- •1. Дія дифеніламіну (фармакопейна реакція)
- •2. Дія Ферум(іі)-катіонів
- •Реакції нітрит-іона
- •1. Дія кислоти
- •2. Реакція з антипірином (фармакопейна реакція)
- •Реакції ацетат-іона
- •1. Реакція естерифікації (фармакопейна реакція)
- •2. Дія ферум(III) хлориду (фармакопейна реакція)
- •Контрольні питання
- •Біологічна роль і практичне використання аніонів ш аналітичної групи та їх сполук у медицині та фармації
- •3.2 Відкриття аніонів
- •Контрольні завдання
- •Додатки
- •Забарвлення полум'я сполуками деяких елементів
- •Способи виразу вмісту компонентів у розчині
- •Кількісні характеристики процесу гідролізу солей
- •Аніони, які утворюють газоподібні продукти
- •Глава 1. Деякі положення теорії електролітичної дисоціації
- •Глава 2. Кислотно-основна рівновага
- •Глава 3. Рівновага в гетерогенних системах
- •Глава 4. Рівновага в окисно-відновних системах
- •Глава 5. Рівновага комплексоутворення
Реакція Нікол(іі)-катіона
1. Дія диметилгліоксиму (реактиву Чугаєва) (фармакопейна реакція)
Диметилгліоксим в амоніачному середовищі утворює з Ni2+ червоний осад внутрішньокомплексної солі – нікол(ІІ) диметилгліоксимату:
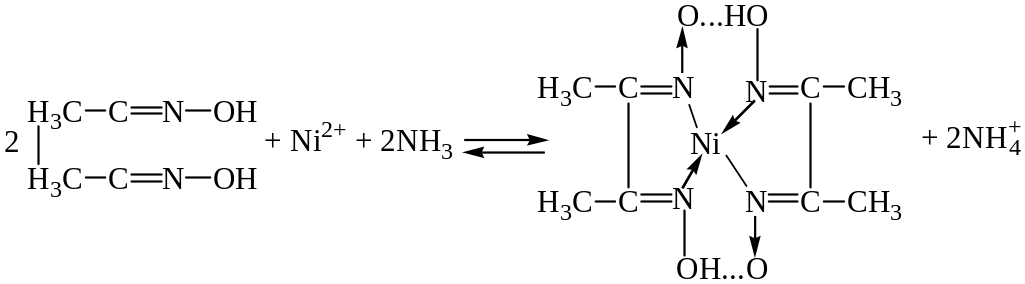
Ця реакція є селективною для визначення нікол(ІІ)-катіонів
Виконання досліду: на фільтрувальний папірець нанести 1-2 краплі розчину солі Ніколу(ІІ)-катіонів, 1-2 краплі диметилгліоксиму та подержати папірець над парами амоніаку. Спостерігати появу червоної плями.
Реакції Меркурій(іі)-катіона
1. Дія розчину лугу (фармакопейна реакція)
Натрій гідроксид NaOH або калій гідроксид КОН утворює з катіонами Hg2+ білий осад меркурій(II) гідроксиду, який швидко розкладається на оксид, що має жовтий колір, і воду:
HgCl2 + 2NaOH → Hg(OH)2↓ + 2NaCl
Hg2+ + 2OH- F Hg(OH)2↓
Hg(OH)2↓ → HgO↓ + H2O
Виконання досліду: до 1-2 крапель розчину солі Hg2+ додати 2-3 краплі розчину лугу. Спостерігати появу осаду і зазначити його колір.
2. Дія розчину калій йодиду кі (фармакопейна реакція)
Калій йодид утворює з катіонами Hg2+ осад оранжево-червоного кольору, який розчиняється в надлишку реагенту з утворенням розчинної комлексної солі:
HgCl2 + 2KI → HgI2↓ + 2KCl
Hg2+ + 2I- F HgI2↓
HgI2↓ + 2KІ → K2[HgI4]
HgI2↓ + 2І- F [HgI4]2-
Виконання досліду: до 2 крапель розчину солі Меркурій(ІІ)-катіонів додати 2 краплі розчину калій йодиду КІ. Спостерігати утворення осаду. Додати ще декілька крапель калій йодиду. Спостерігати розчинення осаду.
3. Реакція з міддю та іншими металами (фармакопейна реакція)
Метали, що знаходяться в електрохімічному ряду стандартних електродних потенціалів ліворуч ртуті (Cu, Zn тощо), витискають її з відповідних солей.
HgCl2 + Cu→ Hg↓ + CuCl2
Cu0 – 2ē F Cu2+ 1
HgCl2 + 2ē F Hg↓ + 2Cl- 1
H gCl2
+ Cu0
→ Hg↓ + Cu2+
+ 2Cl-
gCl2
+ Cu0
→ Hg↓ + Cu2+
+ 2Cl-
Виконання досліду: 1-2 краплі розчину HgCl2 помістити на ретельно очищену мідну фольгу. Спостерігати появу темно-сірої плями, яка при натиранні стає блискучою. При нагріванні пляма зникає.
Реакції Кадмій(ІІ)-катіона
Дія розчину натрій сульфіду Na2s
Катіони Cd2+ утворюють осад жовтого кольору з натрій сульфідом Na2S.
CdCl2 + Na2S → CdS↓ + 2NaCl
Cd2+ + S2- F CdS↓
Виконання досліду: до 1-2 крапель розчину солі Кадмій(ІІ)-катіонів додати 2-3 краплі розчину Na2S. Спостерігати появу осаду жовтого кольору.
Контрольні питання
Назвіть груповий реагент катіонів VI аналітичної групи.
Напишіть рівняння реакцій катіонів VI аналітичної групи з груповим реагентом.
Поясніть роль процесів комплексоутворення в аналізі катіонів VI аналітичної групи.
4. Наведіть рівняння реакцій виявлення катіонів Cu2+, Co2+, Cd2+, Ni2+, Hg2+. Вкажіть аналітичні ефекти.
Біологічна роль і практичне використання катіонів VI аналітичної
групи та їх сполук у медицині та фармації
Купрум відноситься до групи життєво необхідних мікроелементів і, як біогенний елемент, виграє дуже важливу біологічну роль у всіх процесах, які протікають в організмі людини. Вміст Купруму в органах і тканинах людини коливається від 6,5 до 60 мг на 1 кг сухої тканини, загальна масова частка складає 1·10-4 %. Менш за все його у кістках, більш за все – у печінці. Добова потреба дорослої людини у міді дорівнює 2-3 мг. Купрум зв'язаний з ферментами, вітамінами, гормонами та іншими біологічно активними речовинами, посилює дію інсуліну і гормонів гипофізу, які стимулюють розвиток функції статевих залоз. Солі Купруму позитивно впливають на ріст і розвиток організму; тому припускають, що Купрум сприяє синтезу білка і впливає на білковий обмін.
Купрум специфічно сприяє на синтез гемоглобіну, володіє інсуліноподібною дією. Купрум у вигляді ацетату прискорює виведення води з організму, не впливаючи на виведення хлоридів, а додавання до харчового раціону купрум (ІІ) сульфату затримує в організмі Кальцій і Фосфор, таким чином мідь впливає на водний і мінеральний обміни.
Купрум є металокомпонентом багатьох ферментних систем і виступає у ролі незамінного активатора.
Купрум(II) сульфат CuSO4 у концентрації 0,003-0,25 мг% підвищує імунобіологічну реактивність організму. Встановлено, що накопичування міді в тканинах мозку веде до послаблення процесів збудження і посиленню гальмування у корі великих півкуль.
Мідь та її препарати знаходять важливе застосування у медичній практиці для лікування багатьох захворювань. Купрум(II) сульфат CuSO4 є фармакопейним препаратом як антисептичний, в'яжучий і припікаючий засіб. У мікродозах мідь вживають для лікування анемій. Препарати Купруму призначаються також для боротьби зі збудливістю у психічно хворих та для профілактики і лікування ендемічного зобу.
Купрум(II) сульфат (добова доза Сu 0,6 мг) сумісно з манган(ІІ) і кобальт(ІІ) сульфатами призначається при функціональних кровотечах. На в'яжучій і припікаючій дії купрум(ІІ) сульфату засновано його використання у вигляді очних крапель при кон’юнктивітах, а також у вигляді олівців для лікування трахоми.
Кобальт. Масова частка Кобальту в організмі людини складає 1·10-5%. Більш за все його в печінці, нирках, підшлунковій залозі. Добова потреба організму у Кобальті складає 0,05-0,1 мг. Кобальт – мікроелемент, який відрізняється різноманітним впливом на життєві процеси, які протікають в організмі. Кобальт пов'язаний з діяльністю ферментів, вітамінів, гормонів, впливає на білковий, жировий, вуглеводний і мінеральний обмін, а також на функції розмноження і росту.
При недостатності у раціоні солей Кобальту (а також солей Мангану), у крові тварин знижується кількість гемоглобіну і еритроцитів і збільшується число еозинофілів. Кобальт позитивно впливає на обмін вітамінів, наприклад, аскорбінової кислоти (вітаміну С), на синтез нікотинової кислоти (вітаміну РР) і, особливо, ціанокобаламіну (вітаміну В12), до складу якого він входить у кількості 4,5%.
Кобальт(II) сульфат CоSO4 позитивно впливає на засвоєння кальцію і фосфору. Іони Со2+ в організмі утворюють велику кількість комплексів, вони є обов'язковим компонентом багатьох ферментних систем. Іони Кобальту Co2+ і Co3+ є також каталізаторами гідролітичних, окислювально-відновних та інших ферментів.
У медичній практиці застосовується декілька препаратів Кобальту. Ціанокобаламін (вітамін В12), коамід (комплексний препарат Co2+ з амідом нікотинової кислоти) разом з препаратами заліза вживають при анеміях, захворюваннях печінки, нервових захворюваннях, у дерматології і т.д. Кобальт(ІІ) сульфат застосовується при лікуванні анемій, пов'язаних з вагітністю і пологами, а також сумісно з Магній і Купрум(ІІ) сульфатами при функціональних кровотечах. Кобальт(П) хлорид СоСl2 стимулює пологову діяльність, особливо швидкий ефект спостерігається при стимулюванні пологової діяльності хініном на фоні кобальт(ІІ) хлориду.
Кадмій. Масова частка Кадмію в організмі людини складає 1·10-4 %. Він концентрується, головним чином, у печінці та нирках. Біологічна роль Кадмію вивчена недостатньо. На відміну від Цинку, активатора багатьох ферментів, Кадмій є інгібітором більшості ферментів, особливо тіолових. Солі Кадмію знижують вміст аскорбінової кислоти в органах і тканинах, а також холестерину у крові. Кадмій впливає на вуглеводний обмін.
Також Кадмій впливає на фосфорно-кальцієвий обмін. Оскільки радіус іона Сd2+ близький до радіуса іона Са2+ , то іони Cd2+ можуть витиснювати іони Са2+ з сполук, які входять до складу кісток і накопичуються у них, у результаті чого може виникнути ламкість кісток.
Розчини солей Кадмію, у залежності від концентрації, впливають як в'яжучий, подразнюючий і антисептичний засіб.
Кадмій токсичний і володіє кумулятивними властивостями. Між Кадмієм і Цинком є фізіологічний антагонізм: так, загальна токсична дія Кадмію знижується при додаванні до дієти підвищеної кількості цинк ацетату.
Меркурій. Загальна масова частка Меркурію в організмі людини складає 1·10-6 %. Щодоби до організму потрапляє з їжею у середньому 0,02-0,05 мг Меркурію. Більш за все ртуть концентрується у нирках, менш за все у печінці. Біологічна роль ртуті до кінця не вивчена. Меркурій позитивно впливає на фагоцитарну активність лейкоцитів і підвищує імунобіологічну стійкість організму до впливів навколишнього середовища. Ртуть впливає на процеси кровотворення.
При місцевому застосуванні Меркурій діє як протимікробний і слабкий подразнюючий засіб. Ртуть і розчинні солі Меркурію дуже токсичні, причому токсичність солей зростає у разі збільшення розчинності їх у воді.
Комплексні сполуки Меркурію(ІІ) ([Hg(NCS)4]2-; K=l,29·10-22) більш стійкі, ніж цинку ([Zn(NCS)4]2-; K=5,0·10-2) і кадмію ([Cd(NCS)4]2-; K=l,67·10-2), що призводить до міцного зв'язування ферментів з Hg(II) і їх інгібіюванню. Цим можна також пояснити токсичність сполук Меркурію. Зв'язування сполук Меркурію(ІІ) з білками у міцні комплекси, а також їх денатурація призводить до накопичування в організмі солей Меркурію(II), які важко виводяться. Протиотрутою при отруєнні сполуками Hg2+ є сполуки Селену, однак це питання потребує подальшого вивчення.
Тимчасово припустима тижнева доза загальної кількості Меркурію для людини складає 0,3 мг. Ця кількість еквівалентна відповідно 0,005 мг на 1 кг маси тіла.
Ртуть відома з найдавнішого часу. У XVI віці препарати Меркурію були введені до медицини. До 1909 р. (відкриття сальварсану) ртуть була одним із найбільш ефективних засобів лікування сифілісу.
У медицині препарати Меркурію використовуються як антисептичний, протипаразитарний, протисифілітичний, а також сечогінний та проносний засоби. Меркурій(II) дихлорид (сулема) HgCl2 (отрута!) у концентрації 1:1000 застосовується для дезинфекції і як антисептик.
Меркурій(II) дийодид і ртутна сіркова мазь застосовуються при лікуванні сифілісу. Меркурій(ІІ) амідохлорид HgNH2Cl у вигляді мазей застосовується у дерматології.
Нікол. Добова потреба організму у Ніколі складає 0,63 мг. Загальна масова частка Ніколу в організмі людини – 1·10-6%. Більш за все Ніколу у печінці та нирках, а також у підшлунковій залозі та гипофізі. У інфікованих хворих Нікол нормалізує вміст гемоглобіну. При призначенні здоровим людям солей Ніколу у їх організмах прискорюється регенерація білків плазми крові. Нікол не впливає на кров'яний тиск. Він впливає на вуглеводневий обмін. У організмі іони Ni2+ утворюють комплекси з NH3·H2O, етилендіаміном і т.д. Нікол є активатором таких ферментів, як карбоксилаза, трипсін, лецитин та ін. Нікол специфічно впливає на фермент уреазу, яка каталізує розщеплення сечовини на NH3 і СО2.
