
- •Передмова
- •Предмет та задачі аналітичної хімії
- •Глава 1. Деякі положення теорії електролітичної дисоціації
- •1.1. Електроліти, ступінь електролітичної дисоціації
- •1.2. Водневий показник водних розчинів електролітів (рН)
- •Практична робота складання рівнянь реакцій у молекулярній та іонній формах
- •Приклад
- •Завдання для самостійної роботи
- •Практична робота обчислення концентрації іонів гідрогену та гідроксид-іонів, рН та рОн у розчинах сильних електролітів
- •Приклади
- •Задачі для самостійної роботи
- •Глава 2. Кислотно-основна рівновага
- •2.1. Хімічна рівновага. Константа хімічної рівноваги
- •2.2. Рівновага в розчинах слабких електролітів
- •2.3. Рівновага в розчинах солей, що гідролізуються
- •2.4. Буферні системи
- •Практична робота рівновага в розчинах амфотерних електролітів
- •Завдання для самостійної роботи
- •Глава 3. Рівновага в гетерогенних системах
- •3.1. Добуток розчинності
- •3.2. Порядок дробного (вибіркового) осадження
- •3.3. Чинники, що впливають на осадження осадів та їх розчинність
- •Розв’язання
- •Завдання для самостійної роботи
- •Глава 4. Рівновага в окисно-відновних системах
- •4.1. Окисно-відновні системи
- •4.2. Окисно-відновний потенціал (редокс-потенціал)
- •4.3. Константа рівноваги редокс-реакції
- •Завдання для самостійної роботи
- •Глава 5. Рівновага комплексоутворення
- •5.1. Поняття про комплексні сполуки
- •Класифікація комплексних сполук
- •5.2.Рівноваги в розчинах комплексних сполук. Константи стійкості та нестійкості
- •5.3. Вплив різних чинників на процес комплексоутворення
- •5.4. Способи руйнування та утворення комплексів. Використання комплексних сполук в практиці аналізу
- •Розв'язання
- •Розв'язання
- •Задачі для самостійної роботи
- •Основні поняття
- •Дробний аналіз
- •Систематичний аналіз
- •IV. В залежності від способу виконання розрізняють реакції, що виконані:
- •Аналітичні ознаки реакцій
- •Правила роботи і техніка безпеки в хімічній лабораторії
- •Перша допомога при нещасних випадках
- •Якісний аналіз неорганічних сполук
- •Аналіз катіонів
- •Лабораторна робота
- •Загальна характеристика
- •Реакції Калій-катіона
- •1. Дія натрій гексанітрокобальтату(ііі) Na3[Co(nо2)6 ] (фармакопейна реакція)
- •2. Дія натрій гідрогентартрату NaHc4h4o6 (фармакопейна реакція)
- •3. Дія натрій тетрафенілборату Na[b(c6h5)4] (фармакопейна реакція)
- •4. Реакція забарвлення полум'я (реакція фармакопейна)
- •Реакції Натрій-катіона
- •1. Дія розчину метоксифенілацетатної кислоти c6h5ch(och3)cooh (фармакопейна реакція)
- •2. Дія калій гексагідроксостибату(V) k[Sb(oh)6] (фармакопейна реакція)
- •3. Дія цинктриураніл октаацетату Zn(uo2)3(ch3coo)8.
- •4. Реакція забарвлення полум’я (реакція фармакопейна)
- •Реакції амоній-катіона
- •1. Дія лугів (фармакопейна реакція)
- •3. Дія магній оксиду MgO (фармакопейна реакція)
- •Біологічна роль та практичне використання катіонів і аналітичної групи та їх сполук в медицині та фармації
- •Лабораторна робота
- •Загальна характеристика
- •1. Дія 2 м розчину хлоридної кислоти hCl (дія групового реагенту)
- •Плюмбум(іі) гідроксид має амфотерні властивості і розчиняється в надлишку реагенту:
- •3. Дія розчину калій йодиду кі
- •4. Дія розчину калій хромату k2CrO4
- •Реакція Аргентум(і)-катіона
- •Реакції Плюмбум(іі)-катіона
- •1. Дія розчину калій йодиду ki
- •Реакції димеркурій(і)-катіона
- •1. Дія розчину калій йодиду кі
- •Контрольні питання
- •Біологічна роль та практичне використання катіонів II аналітичної групи та їх сполук у медицині та фармації
- •Лабораторна робота
- •Загальна характеристика
- •Загальноаналітичні реакції катіонів III групи
- •1. Дія 1м розчину сульфатної кислоти h2so4 (дія групового реагенту)
- •2. Дія карбонатів
- •3. Дія хроматів
- •Реакції Барій-катіона
- •1. Дія дихромат-іону
- •2. Реакція забарвлення полум’я (фармакопейна реакція)
- •Реакції Кальцій-катіона
- •1. Дія розчину сульфатної кислоти h2so4
- •2. Дія розчину амоній оксалату (nh4)2c2o4 (фармакопейна реакція)
- •3. Дія розчину гліоксальгідроксіанілу (фармакопейна реакція)
- •4. Дія розчину калій гексаціаноферату(іі) k4[Fe(cn)6] (фармакопейна реакція)
- •5. Реакція забарвлення полум’я (фармакопейна реакція)
- •Реакції Стронцій-катіона
- •1. Реакція з гіпсовою водою
- •2. Реакція забарвлення полум'я
- •Контрольні запитання
- •Біологічна роль та практичне використання катіонів III аналітичної групи та їх сполук у медицині та фармації
- •Лабораторна робота реакції катіонів IV аналітичної групи
- •Загальна характеристика
- •Загальноаналітичні реакції катіонів IV аналітичної групи
- •1. Дія 6м розчину лугу (дія групового реагенту)
- •Реакція Станум(іі)-катіона
- •1. Дія надлишку лугу в присутності розчиненої солі бісмут(ііі) нітрату Ві(no3)3.
- •Реакція Хром(ііі)- катіона
- •1. Дія гідроген пероксиду h2o2 в присутності надлишку лугу
- •Реакції Цинк(іі)-катіона
- •1. Дія розчину калій гексаціаноферату(II) (фармакопейна реакція)
- •2. Дія сульфідів (фармакопейна реакція)
- •3. Дія дитизону
- •Реакції Алюміній(ііі)-катіона
- •1. Дія алізарину (1,2-діоксіанрахінону)
- •2. Дія розчину натрій ацетату
- •Реакції сполук Арсену
- •1. Дія розчину натрій дигідрогенфосфіту NaH2po2 (фармакопейна реакція)
- •2. Дія розчину натрій сульфіду Na2s (фармакопейна реакція)
- •3. Дія розчину магній сульфату MgSo4 (фармакопейна реакція)
- •Визначення домішок сполук Арсену(ііі) та Арсену(V) у лікарських засобах.
- •Контрольні питання
- •Біологічна роль та практичне використання катіонів IV аналітичної групи та їх сполук у медицині і фармації
- •Лабораторна робота реакції катіонів V аналітичної групи
- •Загальна характеристика
- •Загальноаналітичні реакції катіонів V аналітичної групи
- •1. Дія розчину амоніаку nh3·h2o (дія групового реагенту)
- •2. Дія рочину лугу NaOh або кон
- •Реакції Магній(іі)-катіона
- •1. Дія розчину натрій гідрогенфосфату Na2hpo4 (фармакопейна реакція)
- •2. Дія розчину 8-гідроксихіноліну (фармакопейна реакція)
- •Реакція Ферум(іі)-катіона
- •1. Дія розчину калій гексаціаноферату(ііі) k3[Fe(cn)6] (фармакопейна реакція)
- •Реакції Ферум(ііі)-катіона
- •1. Дія розчину калій гексаціаноферату(іі) k4[Fe(cn)6] (фармакопейна реакція)
- •2. Дія розчину амоній тіоціанату nh4ncs (фармакопейна реакція)
- •3. Дія розчину тіогліколевої кислоти hsch2cooh (фармакопейна реакція)
- •Реакція Манган(іі)-катіона
- •1. Дія діамоній гексаоксопероксидисульфату (nh4)2s2o8
- •Реакції Бісмут(ііі)-катіона
- •1. Дія свіжоприготованого натрій тетрагідроксостаніту(іі) Na2[Sn(oh)4]
- •2. Гідроліз солей Бісмуту
- •3. Дія розчину тіосечовини (nh2)2cs (фармакопейна реакція)
- •4. Дія розчину натрій сульфіду Na2s (фармакопейна реакція)
- •Контрольні питання
- •Біологічна роль та практичне застосування катіонів V аналітичної групи та їх сполук у медицині та фармації
- •Лабораторна робота аналіз суміші катіонів V аналітичної групи
- •Лабораторна робота реакції катіонів VI аналітичної групи
- •Загальноаналітичні реакції катіонів VI аналітичної групи
- •1. Дія розчину амоніаку (дія групового реагенту)
- •Реакції Купрум(іі)-катіона
- •1. Дія надлишку розчину амоніаку nн3·н2о
- •2. Дія розчину натрій тіосульфату Na2s2o3
- •Реакції Кобальт(іі)-катіона
- •1. Дія розчину амоній тіоціанату nh4ncs
- •Реакція Нікол(іі)-катіона
- •1. Дія диметилгліоксиму (реактиву Чугаєва) (фармакопейна реакція)
- •Реакції Меркурій(іі)-катіона
- •1. Дія розчину лугу (фармакопейна реакція)
- •2. Дія розчину калій йодиду кі (фармакопейна реакція)
- •3. Реакція з міддю та іншими металами (фармакопейна реакція)
- •Дія розчину натрій сульфіду Na2s
- •Аналіз аніонів
- •Лабораторна робота реакції аніонів і аналітичної групи
- •Загальна характеристика
- •Дія групового реагенту
- •Реакції сульфат-іона
- •Реакції сульфіт - іона
- •1. Дія мінеральної кислоти (фармакопейна реакція)
- •2. Дія розчину дийоду і2 (фармакопейна реакція)
- •Реакції тіосульфат-іона
- •1. Дія хлоридної кислоти hCl
- •2. Дія розчину дийоду і2
- •3. Дія аргентум (і) нітрату AgNo3
- •Реакції карбонат- та гідрогенкарбонат- іонів
- •1. Дія мінеральних кислот
- •2. Дія магній сульфату MgSo4 (фармакопейна реакція)
- •3. Дія фенолфталеїну (реакція фармакопейна)
- •Реакції фосфат- та гідрогенфосфат- іонів
- •1. Дія аргентум(і) нітрату AgNo3 (фармакопейна реакція)
- •2. Дія розчину магнезіальної суміші (MgCl2, nh4Cl, nh3·h2o)
- •Реакції тетраборат- та метаборат-іонів
- •1. Дія солей Барію
- •2. Реакція забарвлення полум'я (фармакопейна реакція)
- •Реакції хромат- та дихромат-іонів
- •1. Дія розчину солей Барію
- •2. Дія розчину калій йодиду кі
- •Реакція оксалат-іона
- •1. Дія розчину кальцій хлориду СаСl2
- •Контрольні питання
- •Біологічна роль і практичне використання аніонів і аналітичної групи та їх сполук у медицині та фармації
- •Реакції хлорид-іона
- •Реакції бромід-іона
- •1. Дія аргентум(і) нітрату AgNo3 (фармакопейна реакція)
- •2. Дія окисників
- •2.1. Дія хлорної води
- •2.2. Дія калій преманганату
- •Реакції йодид-іона
- •1. Дія окисників (фармакопейна реакція)
- •2. Дія солей Плюмбуму(іі)
- •Реакція сульфід-іона
- •1. Дія мінеральних кислот
- •Контрольні питання
- •Біологічна роль і практичне використання аніонів II аналітичної групи та їх сполук у медицині та фармації
- •1. Дія дифеніламіну (фармакопейна реакція)
- •2. Дія Ферум(іі)-катіонів
- •Реакції нітрит-іона
- •1. Дія кислоти
- •2. Реакція з антипірином (фармакопейна реакція)
- •Реакції ацетат-іона
- •1. Реакція естерифікації (фармакопейна реакція)
- •2. Дія ферум(III) хлориду (фармакопейна реакція)
- •Контрольні питання
- •Біологічна роль і практичне використання аніонів ш аналітичної групи та їх сполук у медицині та фармації
- •3.2 Відкриття аніонів
- •Контрольні завдання
- •Додатки
- •Забарвлення полум'я сполуками деяких елементів
- •Способи виразу вмісту компонентів у розчині
- •Кількісні характеристики процесу гідролізу солей
- •Аніони, які утворюють газоподібні продукти
- •Глава 1. Деякі положення теорії електролітичної дисоціації
- •Глава 2. Кислотно-основна рівновага
- •Глава 3. Рівновага в гетерогенних системах
- •Глава 4. Рівновага в окисно-відновних системах
- •Глава 5. Рівновага комплексоутворення
2.3. Рівновага в розчинах солей, що гідролізуються
Гідроліз («розкладення водою») – оборотна взаємодія іонів солі в розчині з полярними молекулами води. Гідролізу підлягають солі, що містять катіони слабких основ та аніони слабких кислот.
В розчинах солей, в яких перебігає гідроліз, встановлюється гідролітична рівновага. Константа гідролітичної рівноваги Кh називається константою гідролізу.
Ступенем гідролізу h називається величина, що дорівнює відношенню числа гідролізованих іонів сh до загальної концентрації с0 вихідних іонів:
![]()
Ступінь гідролізу залежить від концентрації розчину та температури: вона збільшується зі зменшенням концентрації та збільшенням температури.
За звичайних умов, гідролізується дуже незначна кількість іонів: h<<1.
2.3.1. Гідроліз солі, утвореної сильною основою та слабкою кислотою
Наприклад: гідроліз натрій ацетату
В розчині ця сіль дисоціює за рівнянням:
CH3COONa →CH3COO– + Na+
Гідроліз таких солей відбувається за «слабкою складовою» – аніоном:
CH3COO– + НОН ↔ CH3COOН + ОН–
Середовище в такому розчині обумовлює наявність гідроксильних груп, тобто лужне.
Вираз для константи гідролізу:

Якщо помножити чисельник та знаменник на [H+]
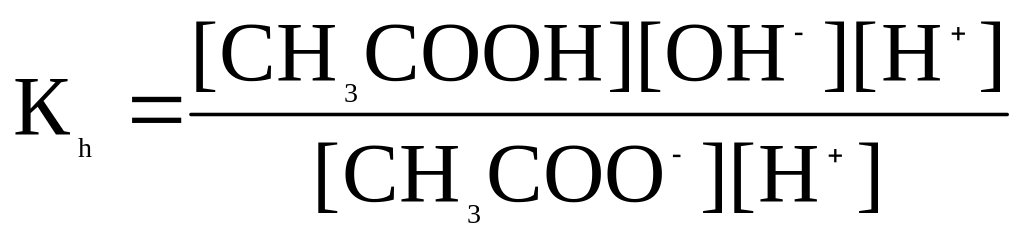
та після нескладних математичних перетворень, враховуючи, що
[H+]·[OH-] = Kw, отримаємо
![]()
де: Kа- константа іонізації кислоти
Ступінь гідролізу солі, що гідролізується за аніоном, обчислюють за формулою:
![]()
Значення рН в розчині таких солей визначається за формулою:
![]()
2.3.2. Гідроліз солі, утвореної сильною кислотою та слабкою основою
Наприклад: гідроліз амоній хлориду
В розчині ця сіль дисоціює за рівнянням:
NH4Cl → NH4+ + Cl–
Гідроліз солей цього типу відбувається за катіоном:
NH4+ + НОН ↔ NH3·Н2О + Н+
Середовище в розчині обумовлене наявністю протонів Н+ – кисле.
Вираз для константи гідролізу:
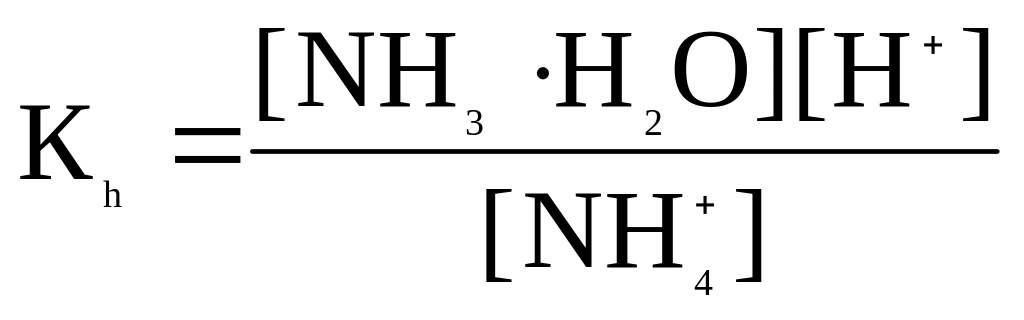
Помножимо чисельник та знаменник на [ОH-]

Враховуючи, що [H+]·[OH-]=Kw, отримаємо
![]()
де Kb- константа іонізації основи
Ступінь гідролізу обчислюють за формулою:
![]()
Значення рН в розчині солей, утворених слабкою основою та сильною кислотою визначається за формулою:
![]()
2.3.3. Гідроліз солі, утвореної слабкою кислотою та слабкою основою
Наприклад: гідроліз амоній ацетату
В розчині ця сіль дисоціює за рівнянням:
CH3COONH4 → CH3COO– + NH4+
Гідроліз таких солей відбувається і за аніоном, і за катіоном:
CH3COO– + NH4+ + НОН ↔ CH3COOН + NH3·Н2О
В результаті гідролізу утворилася слабка кислота та слабка основа, тому рН розчину можна визначити, порівнюючи константи іонізації кислоти та основи.
В даному випадку,
К(CH3COOН) = 1,74·10-5
К(NH3·Н2О) = 1,76·10-5
Тобто, фактично К(CH3COOН) ≈ К(NH3·Н2О), значить реакція середовища близька до нейтральної: рН ≈ 7.
Вираз для константи гідролізу:
![]()
Якщо помножити чисельник та знаменник на [H+] та [OH-] та після математичних перетворень, аналогічним попереднім випадкам, отримаємо
![]()
де: Kа, Кb – константи іонізації кислоти та основи
Ступень гідролізу солі, що гідролізується за катіоном та аніоном, обчислюють за формулою, яка має непростий вигляд:

Значення рН в розчині таких солей визначається за формулою:
![]()
Всі наведені формули для солей, що гідролізуються, зведені в таблицю додатку 3.
2.3.4. Зміщення рівноваги при гідролізі
Оскільки одним з продуктів гідролізу є катіони Гідрогену або гідроксильні групи, то на стан рівноваги процесу гідролізу суттєво впливає зміна рН розчину. Таким чином, змінюючи рН розчину можна або посилити, або подавити гідроліз. Цей прийом досить широко застосовується в практиці аналізу.
Наприклад, при приготуванні розчину солі ферум (ІІ) хлорид гідроліз є небажаним явищем, оскільки в результаті його перебігу ( за звичайних умов по першому ступеню) концентрація ферум(ІІ)-іонів знижується за рахунок утворення основної солі:
Fe2+ + H2O F Fe(OH)+ + H+
FeCl2 + H2O F Fe(OH)Cl + HCl
Згідно з принципом зміщення рівноваги – принципом Ле Шательє, підвищивши концентрацію одного з продуктів реакції, можна досягти зміщення рівноваги в бік перебігу оборотної реакції. Тому, якщо додатково ввести в розчин H+ , тобто підкислити його, гідроліз буде подавлятись, в розчині переважатимуть Fe2+.
Відповідно, якщо будемо мати сіль, яка гідролізується за аніоном, одним з продуктів гідролізу є гідроксильна група. Наприклад, гідроліз натрій карбонату за звичайних умов проходить за першим ступенем з утворенням гідрокарбонат-аніону та гідроксильних груп:
CO32– +H2O F HCO3– + OH–
Na2CO3 + H2O F NaHCO3 + NaOH
Тому для припинення гідролізу необхідно додати розчин лугу – підлужити розчин.
