
- •Глава 1. Гипертоническая болезнь (эссенциальная гипертензия)
- •Глава 2. Стенокардия......................................................................................................................48
- •2.4.1.3. Ингибиторы ангиотензинпревращающего фермента...............................................................71
- •Глава 3 Инфаркт миокарда ........................................................................................................88
- •Глава 4. Осложнения инфаркта миокарда ........................................................................136
- •Глава 5. Нрс ……………………………………………………………...............................157
- •Глава 6. Недостаточность кровообращения ......................................................................230
- •7.4. Аортальная недостаточность...........................................................................................................267
- •Глава 1 Гипертоническая болезнь (эссенциальная гипертензия) и симптоматические гипертензии
- •1.1. Классификация гипертонической болезни
- •I стадия II стадия III стадия
- •1.2. Патогенез гипертонической болезни
- •2. Факторы, связанные с образом жизни:
- •1.3. Клиническая картина и особенность течения гипертонической болезни
- •1.4.1. Электрокардиографические признаки гипертрофи левого желудочка
- •1.4.2. Рентгеноскопия и рентгенография грудной клетки
- •1.4.3. Эхокардиографические критерии гипертрофии левого желудочка
- •1.4.4. Оценка состояния глазного дна
- •1.4.5. Изменение почек при гипертонической болезни
- •1.5. Симптоматические артериальные гипертензии
- •1.5.1. Почечные артериальные гипертензии
- •1.5.2. Вазоренальная артериальная гипертензия
- •1.5.2.1. Атеросклероз почечных артерий
- •1.5.2.2. Фибромускулярная дисплазия почечный артерий
- •1.5.3. Болезнь Такаясу
- •1.5.4. Эндокринные артериальные гипертензии
- •1.5.4.1. Акромегалия
- •1.5.4.2. Болезнь и синдром Иценко-Кушинга
- •1.5.4.3. Феохромоцитома
- •1.5.4.4. Синдром Конна
- •1.5.4.5. Диффузный или диффузно-узловой токсический зоб
- •1.5.4.6. Гиперпаратиреоз
- •1.5.4.7. Климактерическая артериальная гипертензия
- •1.5.4.8. Артериальная гипертензия при использовании гормональных контрацептивов
- •1.5.5. Церебральные артериальные гипертензии
- •1.5.6.. Гемодинамические артериальные гипертензии
- •1.5.6.1. Склеротическая систолическая артериальная гипертензия
- •1.5.6.2. Коарктация аорты
- •1.5.6.3. Аортиты
- •1.5.6.4. Аортальная недостаточность
- •1.5.6.5. Атриовентрикулярная блокада III степени
- •1.5.6.7. Застойная артериальная гипертензия при сердечной недостаточности
- •1.5.7. Артериальная гипертензия лекарственного генеза
- •1.6. Принципы дифференциальной диагностики симптоматических гипертензий
- •Лечение гипертонической болезни
- •1 Изменение образа жизни в лечении гипертонической болезни:
- •1.7.1. Характеристика гипотензивных средств
- •1.7.1.1. Бета-адреноблокаторы
- •1.7.2. Альфа-1-адреноблокаторы
- •1.7.3. Антагонисты кальция
- •1.7.4. Диуретики
- •1.7.5. Ингибиторы ангиотензинпревращающего фермента
- •1.7.6. Монотерапия гипертонической болезни
- •1.7.7. Комбинированное использование антигипертензивных препаратов
- •1.7.8. Лечение изолированной систолической артериальной гипертензии у пожилых больных
- •1.7.9. Гипертензивные (гипертонические) кризы и их лечение
- •Глава 2 Стенокардия
- •2.1. Классификация и клинические формы стенокардии
- •2.1.1. Стабильная стенокардия
- •2.1.2. Нестабильная стенокардия
- •2.1.3. Острая коронарная недостаточность
- •2.2. Диагностика стенокардии
- •2.2.1. Диагностика стенокардии с помощью нагрузочных проб
- •2.2.1.1. Пробы, проводимые при отсутствии изменений конечной части желудочкового комплекса – зубца т и сегмента s-t
- •2.2.1.2. Функциональные нагрузочные пробы при наличии изменения конечного комплекса qrs-t (подъем или депрессия сегмента s-t или инверсия зубца т)
- •2.3. Дифференция диагностика стенокардии (кардиалгий)
- •II группа. Основной клинический синдром – постоянные боли в области грудной клетки, длительностью от нескольких суток до нескольких недель или месяцев, не купирующиеся приемом нитроглицерина.
- •III группа. Основной клинический синдром – боли в грудной клетке, появляющиеся при физической нагрузке, стрессе, в покое длительностью от нескольких минут до 1 ч, уменьшающиеся в покое.
- •IVб подгруппа. Основной клинический синдром – развитие болей в грудной клетке при приеме пищи, уменьшающихся в покое, не купирующихся приемом нитроглицерина.
- •2.4. Лечение больных стенокардией
- •2.4.1 Антиангинальные препараты
- •2.4.1.1. Нитросоединения (нитраты)
- •2.4.1.2. Бета-адреноблокаторы и антагонисты кальция
- •2.4.1.3. Ингибиторы ангиотензинпревращающего фермента
- •2.4.1.4. Антиагреганты
- •2.4.2. Выбор препаратов при лечении стенокардии
- •2.4.3. Оперативное лечение больных стенокардией
- •2.4.4. Использование низкоинтенсивного лазерного излучения в терапии стенокардии
- •Глава 3 Инфаркт миокарда
- •3.1. Этиология инфаркта миокарда
- •3.2. Диагностика инфаркта миокарда
- •3.2.1. Электрокардиографическая диагностика инфаркта миокарда
- •3.2.1.1. Крупноочаговый инфаркт миокарда
- •3.2.1.2. Мелкоочаговый инфаркт миокарда
- •3.2.1.3. Атипичные формы первого инфаркта миокарда
- •3.2.1.4. Изменения электрокардиограммы при повторных инфарктах миокарда
- •3.2.2. Биохимическая диагностика инфаркта миокарда
- •3.2.3. Сцинтиграфия миокарда
- •3.2.4. Эхокардиографическая диагностика
- •3.3. Дифференциальная диагностика инфаркта миокарда
- •3.4. Неосложненный инфаркт миокарда
- •3.4.1. Резорбционно-некротический синдром при инфаркте миокарда
- •3.4.2. Лечение неосложненного инфаркта миокарда
- •R Комментарии к лечению больных неосложненным инфарктом миокарда
- •R Наблюдение за больными инфарктом миокарда
- •R Уровень активности больных инфарктом миокарда
- • Анальгезия и использование антидепрессантов при инфаркте миокарда
- •R Магнезия (MgS04 25% раствор)
- •3.5. Инфаркт правого желудочка и его дисфункция
- •3.6. Подготовка к выписке больных инфарктом миокарда из стационара
- •3.7. Вторичная профилактика у больных инфарктом миокарда после выписки из стационара
- •3.8. Длительное ведение больных инфарктом миокарда
- •Глава 4 Осложнения инфаркта миокарда
- •4.1. Осложнения инфаркта миокарда
- •4.1.2. Кардиогенный шок.
- •4.1.3. Сердечная астма и отек легких.
- •4.1.4. Нарушения сердечного ритма и проводимости
- •4.1.4.1. Тахисистолические нарушения сердечного ритма
- •1 Лечение фибрилляции и трепетания предсердий, пароксизмальной наджелудочковой тахикардии
- •1 Желудочковая тахикардия и фибрилляция желудочков.
- •4.1.4.2. Брадиаритмии и блокады сердца
- •4.1.5. Разрывы миокарда
- •4.1.5.1. Острая митральная регургитация
- •4.1.5.2. Постинфарктный дефект перегородки
- •4.1.5.3. Разрыв свободной стенки левого желудочка
- •4.1.6. Аневризма левого желудочка
- •4.1.7. Тромбоэмболия легочной артерии
- •4.1.8. Перикардит
- •2 Лечение перикардита при инфаркте миокарда.
- •4.1.9. Острая язва желудка
- •4.1.10. Атония мочевого пузыря
- •4.1.11. Парез желудочно-кишечного тракта
- •4.1.12. Синдром Дресслера (постинфарктный синдром)
- •4.1.13. Хроническая недостаточность кровообращения
- •4.1.14. Показания для экстренного проведения аортокоронарного шунтирования при инфаркте миокарда
- •4.1.15. Рецидивирующий инфаркт миокарда
- •Глава 5 Нарушения сердечного ритма и проводимости: диагностика и лечение
- •5.1. Классификация антиаритмических средств и характеристика основных противоаритмических препаратов
- •5.2. Экстрасистолия
- •5.2.1. Электрокардиографическая диагностика желудочковой и наджелудочковой экстрасистолии
- •5.2.2. Лечение и профилактика наджелудочковой и желудочковой экстрасистолии в зависимости от механизмов их развития
- •5.2.2.1. Оценка механизмов развития экстрасистолии
- •5.3. Диагностика и лечение пароксизмальных тахикардий
- •5.3.1. Диагностика наджелудочковых тахикардий
- •5.3.1.1. Электрокардиографические критерии однофокусных предсердных тахикардий
- •5.3.1.2. Электрокардиографические критерии постоянно-возвратной или экстрасистолической формы предсердной тахикардии (форма Gallaverdin)
- •5.3.1.3. Электрокардиографические критерии многофокусной (политопной) или хаотической предсердной тахикардии
- •5.3.1.4. Электрокардиографические критерии реципрокных атриовентрикулярных тахикардий
- •5.3.2. Электрокардиографические признаки желудочковой тахикардии
- •5.3.3.1. Лечение атриовентрикулярных, очаговых (реципрокных) предсердных тахикардий
- •5.3.3.3. Лечение многофокусной, политопной или хаотической пароксизмальной предсердной тахикардии
- •5.3.4. Лечение желудочковых тахикардий
- •5.3.4.1. Лечение экстрасистолической или возвратной формы пароксизмальной желудочковой тахикардии
- •5.4. Фибрилляция (мерцание) и трепетание предсердий
- •5.4.1. Электрокардиографическая диагностика фибрилляции и трепетания предсердий
- •5.4.1.1. Электрокардиографическая диагностика трепетания предсердий
- •5.4.1.2. Электрокардиографические диагностические критерии фибрилляции (мерцания) предсердий
- •5.4.2. Классификация мерцания и трепетания предсердий
- •5.4.3. Лечение и профилактика пароксизмов фибрилляции и трепетания предсердий
- •5.4.3.1. Лечение и профилактика пароксизмов трепетания предсердий
- •I тип II тип эит (кардиоверсия) 150-400 j
- •5.4.3.2. Лечение и профилактика мерцания (фибрилляции) предсердий
- •2. Особенность течения пароксизмов мерцания предсердий:
- •5.5. Использование лазеротерапии для лечения нарушений сердечного ритма
- •5.6. Аритмии, обусловленные нарушением функции проводимости
- •. Алгоритм диагностики брадисистолических форм нарушений сердечного ритма, в том числе характерных для синдрома слабости синуовго узла, представлен на рис. 5.28.
- •5.6.2. Атриовентрикулярная блокада
- •5.6.3. Лечение синдрома слабости синусового узла и атриовентрикулярных блокад
- •5.6.3.1. Электрокардиостимуляция
- •Глава 6
- •6.1. Причины сердечной недостаточности
- •2. Некардиальные:
- •6.2. Патогенез недостаточности кровообращения
- •Митральная регургитация
- •1 Классификация недостаточности кровообращения.
- •Классификация недостаточности кровообращения в.Х. Василенко, н.Д. Стражеско при участии г.Ф. Ланга (1935) с дабавлениями н.М. Мухарлямова (1978).
- •I стадия. Подразделяется на период а и б.
- •6.4. Лечение хронической сердечной недостаточности
- •6.4.1. Фармакотерпия сердечной недостаточности
- •6.4.1.1. Применение ингибиторов ангиотензинпревращающего фермента для лечения сердечной недостаточности
- •6.4.1.2. Применение диуретиков для лечения сердечной недостаточности
- •1 Тактика назначения диуретиков:
- •1 Причины резистентности к диуретикам:
- •Выбор диуретика в зависимости от стадии (функционального класса) сердечной недостаточности.
- •6.4.1.3. Применение b-адреноблокаторов для лечения сердечной недостаточности
- •1 Противопоказания к использованию b-адреноблокаторов при сердечной недостаточности (помимо общих противопоказаний):
- •6.4.1.4. Применение сердечных гликозидов для лечения сердечной недостаточности
- •1 Взаимодействие сердечных гликозидов с другими препаратами:
- •6.4.1.5. Принципы лечения недостаточности кровообращения в зависимости от стадии заболевания
- •1 Принципы лечения недостаточности кровообращения в зависимости от стадии заболевания (Smith j.W. Et al., 1997).
- •2. Диуретики;
- •3. Диуретики;
- •1 Критерии стабильного клинического состояния при недостаточности кровообращении (Stevenson l.W. Et al., 1998)
- •6.4.2. Хирургическое лечение сердечной недостаточности
- •Глава 7 Приобретенные пороки сердца
- •7.1. Митральный стеноз
- •2 Классификация митрального стеноза по а.Н. Бакулеву и е.А. Дамир (1955).
- •Осложнения митрального стеноза
- •7.2. Митральная недостаточность
- •2 Показание к оперативному лечению:
- •7.3. Аортальный стеноз
- •7.4. Аортальная недостаточность
- •Основные клинические симптомы аортальной недостаточности, выявляемые при объективном обследовании:
- •7.5. Трикуспидальные пороки сердца
- •7.5.1. Трикуспидаольный стеноз.
- •7.5.2. Трикуспидальная недостаточность
- •2Этиология трикуспидальной недостаточности.
- •7.6. Дифференциальная диагностика пороков сердца
2. Особенность течения пароксизмов мерцания предсердий:
- в тех случаях, когда больные субъективно не ощущают аритмию, ее выявляют при случайном обследовании (II группа);
- когда больные субъективно не отмечают аритмию, они обращаются за медицинской помощью при развитии осложнений, таких, как прогрессирующая сердечная недостаточность, инсульт, а также при тромбоэмболических осложнениях и др. (III и IV группы).
Анализ лечения пароксизмов мерцания предсердий показал, что эффективность различных групп противоаритмических средств при купировании этой аритмии зависит как от ее продолжительности до начала лечения, так и объема и характера терапии антиаритмическими средствами. Учитывая вышеуказанные данные, т.е. в зависимости от времени, требующееся больному для принятия решения об обращении за медицинской помощью при развитии пароксизма мерцания и трепетания предсердий, особенностей течения приступов этой аритмии у отдельных групп пациентов (II и III группы), а также, используя ранее полученные результаты о эффективности противоаритмических средств для ее купирования в зависимости от продолжительности пароксизма аритмии (Сметнев А.С. и соавт., 1990, Шабров А.В. и соавт., 1998, Кушаковский М.С., 1999, Levy S. et al., 1996, 1998), продолжительность мерцания предсердий (от начала пароксизма), когда достаточно эффективны различные противоаритмические мероприятия для ее устранения (до 1 года от начала аритмии), была распределена на 5 временных отрезков: до 30 мин., от 30 мин. до 3 ч, от 3 ч. до 7 суток, от 7 суток до 6 месяцев и от 6 месяцев до 1 года. Эффективность (в %) антиаритмических средств при купировании пароксизмов мерцания предсердий в зависимости от длительности аритмии до начала лечения представлены на рис. 5.19.
Как видно из представленных данных, в первые 30 мин. от начала пароксизма мерцания предсердий эффективны практически все антиаритмические средства, причем положительный результат сублингвальной терапии анаприлином в дозе 20-40 мг, атенололом в дозе 50-100 мг, метопрололом в дозе 50-100 мг, этацизином в дозе 150-200 мг и соталолом в дозе 80-120 мг сопоставим внутривенной терапией и хинидином в сочетании с верапамилом. От 30 мин. до 3 ч от начала пароксизма аритмии эффективность сублингвального приема -адреноблокаторов не превышает 30%, в то время как сохраняется положительный антиаритмический эффект (77%) при применении этацизина, соталола, а также остальных используемых средств. От 3 ч до 7 суток эффективна только внутривенная терапия хлорида калия с сульфатом магнезии в дозе 1,5–2,0 г и 5,0 г соответственно в сочетании с новокаинамидом в дозе 1,0-2,0 г, или пропафеноном в дозе 210-280 мг, или флекаинидом в дозе 100-200 мг, или кордароном в дозе 300-600 мг, а также использование хинидина с верапамилом и электроимпульсной терапией (электрическая кардиоверсия). Следует отметить, что снижение эффективности (с 84% до 78%) внутривенной терапии в первые 3 ч течения пароксизма мерцания предсердий в сравнении с ее использованием в первые 30 мин. и до 7 суток, по-видимому, обусловленотем, что до ее проведения больные в большинстве случаев самостоятельно применяли различные препараты, включая -адреноблокаторы и т.д., что снижало эффективность проведения этой терапии. От 7 суток до 6 месяцев течения мерцания предсердий оказалась эффективной только терапия хинидином в сочетании с верапамилом и элктроимпульсная терапия; от 6 месяцев до 1 года – только электрическая кардиоверсия.
Рис. 5.19. Эффективность (в %) антиаритмических средств при купировании пароксизмов мерцания предсердий в зависимости от длительности аритмии до начала лечения.
| Начало пароксизма мерцательной аритмии
|______________________________________________________________________
| до 30 мин. от 30 мин. до 3 ч от 3 ч до 7 сут. от 7 сут. до 6 мес. от 6 мес. до 1 года
|______________________________________________________________________
| 1 – 73% 1 – 30% 1 – 2% 1 – 0,01% 1 - (-)
| 2 – 85% 2 – 77% 2 – 4% 2 – 0,01% 2 - (-)
| 3 – 84% 3 – 78% 3 – 83% 3 – 5% 3 - (-)
| 4 - 90% 4 – 93% 4 – 92% 4 – 85% 4 - 34%
| 5 - 99% 5 – 99% 5 – 98% 5 – 96% 5 – 88%
|______________________________________________________________________
Наиболее эффективная терапия для купирования мерцания предсердий:
1 – сублингвальная терапия -адреноблокаторами: анаприлин (20-40 мг),
атенолол (50-100 мг), метопролол (50-100 мг), соталол (80-120 мг);
2 – сублингвальная терапия этацизином (150-200 мг), соталолом (80-120 мг);
3 – внутривенная терапия: KCL 1,5 – 2,0 г + MgS04 5,0 г в сочетании с новокаинамидом (1,0- 2,0 г) или пропафеноном (210-280 мг) или флекаинидом (100-200 мг) или кордароном (300-600 мг);
4 – хинидин (кинелентин, хинидин-дурулес) + верапамил;
5 – электроимпульсная терапия (электрическая кардиоверсия).
________________________________________________________________________
Примечание: в % указана средняя эффективность противоаритмических средств; (-) – антиаритмический эффект препаратов отсутствует (противоаритмический эффект антиаритмических препаратов для купирования пароксизмов мерцания предсердий считается положительным, если он составляет более 40%).
Комментарии к рисунку 5.19. (к терапии, направленной на купирование пароксизмов мерцания предсердий).
- учитывая достаточно высокую эффективность сублингвальной терапии пароксизмов мерцания предсердий в первые 3 ч от начала приступа, врачу необходимо объяснить пациентам, что необходимо принимать в первые минуты и часы от начала аритмии. Кроме того, следует помнить, что -адреноблокаторы эффективны только в первые 30 минут от начала пароксизма, причем, наиболее активными являются анаприлин (пропранолол) и метопролол, а также соталол. Если эти препараты не помогают или прошло более 30 минут (до 3 ч) от начала пароксизма мерцания предсердий наиболее эффективным является этацизин в дозе 150-200 мг (однократный прием 3-4 таб. сублингвально). Сублингвальная терапия может быть использована как метод для самостоятельного купирования аритмии у больных I группы.
- при отсутствии эффекта сублингвальной терапии или в тех случаях, когда прошло более 3 ч (но до 7-10 суток) от начала пароксизма мерцания предсердий, используют внутривенную терапию хлорида калия с сульфатом магнезии в дозе 1,5–2,0 г и 5,0 г соответственно в сочетании с новокаинамидом в дозе 1,0-2,0 г, или пропафеноном в дозе 210-280 мг, или флекаинидом в дозе 100-200 мг, или кордароном в дозе 300-600 мг. При проведении внутривенной терапии следует использовать дифференцированный подход к назначению этих препаратов в зависимости от клинических особенностей течения пароксизмов мерцания предсердий и состояния гемодинамики в момент аритмии. По нашим данным, в момент пароксизма могут наблюдаться гипер-, нормо- и гипокинетический гемодинамические варианты. У всех больных при гиперкинетическомгемодинамическом типе наблюдалось повышение систолического артериального давления свыше 160 мм рт. ст. и акцент II тона над аортой, у 92% - полиурия, у 86% - боли в области сердца, у 60% - головная боль и возбуждение, а также у всех пациентов при этом варианте отмечалось тахисистолическое мерцание предсердий (в среднем, частота сердечных сокращений в момент аритмии составляла более 120 ударов в минуту) и гипокалиемия (содержание калия в крови было < 3,5 ммоль/л); при гипокинетическом варианте – у 31% отмечалась одышка в покое или удушье, незвучные влажные хрипы в нижних отделах легких, у 55% - акцент II тона над легочной артерий, у 19% - снижение систолического артериального давления менее 90 мм рт. ст. (до 80 мм рт. ст.), у 64% - увеличение частоты сердечных сокращений в момент аритмии (более 90 ударов в минуту). При нормокинетическом варианте, кроме субъективного ощущения сердцебиения в момент аритмии, характерных клинических проявлений выявлено не было. Следует отметить, что гипокалиемия при гиперкинетическом варианте обусловлена полиурией, по-видимому, вследствие повышения клубочковой фильтрации из-за увеличения минутного объема крови, также выделения натрий-уретического фактора, а снижение сократительной функции сердечной мышцы при гипокинетическом варианте приводит к застою крови в малом кругу кровообращения, что способствует дилатации и растяжению миокарда предсердий, поддержанию и появлению в них новых эктопических очагов (Олесин А.И., Ловкачева М.К., 1988). Эффективность лечения пароксизмов мерцания предсердий в зависимости от состояния гемодинамики в момент аритмии представлена на рис. 5.20.
Рис. 5.20. Эффективность лечения пароксизмов мерцания предсердий в зависимости от состояния гемодинамики в момент аритмии
Гиперкинетический Нормокинетический Гипокинетический
синдром в момент синдром в момент синдром в момент
аритмии аритмии аритмиио
KCL 1,5-2,0 г KCL 1,5-2,0 г KCL 1,5-2,0 г
+ MgSO4 5,0 г + MgSO4 5,0 г + MgSO4 5,0 г
внутривенно* (80%) внутривенно* (20%) внутривенно* +
строфантин или
дигоксин 0,25 мг (31%)
Новокаинамид 1,0-2,0 г Новокаинамид 1,0-2,0 г Пропафенон*** 210-
внутривенно** (100%) внутривенно** (100%) 280 мг внутривенно (25%)
Кордарон 300-600 мг
внутривенно (35%)
Примечание: - указывает на продолжение терапии, при отсутствии эффекта при предыдущем лечении; % - эффективность использованных методов лечения в процентах; о – методом выбора является электроимпульсная терапия (электрическая кардиоверсия); * - KCL в дозе 1,5-2,0 г + MgSO4 5,0 г (25% -5,0) вводится внутривенно в разведении на 200 мл физиологического раствора или 5% глюкозы в течение 30-50 мин., ** - при наличии факторов риска развития возможных осложнений при применении новокаинамида целесообразно использовать пропафенон или флекаинид и (или) кордарон, причем, при нормокинетическом синдроме новокаинамид эффективен в качестве монотерапии аритмии (без хлорида калия и магнезии) только в первые 4-6 ч от начала пароксизма мерцания предсердий; *** - вместо пропафенона можно использовать новокаинамид в тех случаях, когда после введения сердечных гликозидов отмечается нормализация гемодинамики и исчезают симптомы сердечной недостаточности, при отсутствии факторов риска развития возможных осложнений при применении новокаинамида.
Комментарии к рис. 5.20.
1. Эффективность использования дифференцированной терапии пароксизмов мерцания предсердий в зависимости от состояния гемодинамики в момент аритмии, по нашим данным, составляет, в среднем, 95% (Олесин А.И. и соавт., 1988, 1996).
2. К факторам риска развития возможных осложнений при применении новокаинамида относятся такие, как (Олесин А.И. и соавт, 1983, 1988, 1994, 1996):
- увеличение интервала Q-T электрокардиограммы на 20% от нормальных величин, скорректированных по частоте сердечных сокращений;
- транзиторная блокада ножек пучка Гиса;
- гипокинетический вариант гемодинамики в момент пароксизма мерцания предсердий;
- увеличение аритмического индекса Шломка-Рейнделя, определяемого по разнице между максимальным и минимальным интервалом R-R, отнесенный к среднему интервалу R-R при регистрации электрокардиограммы за 1 мин. при мерцании предсердий и отражающего проведение по атриовентрикулярному соединению в момент этой аритмии, более, чем на 0,3 и более в сравнении с должной величиной свидетельствует о высоком риске развития атриовентрикулярных блокад. при терапии новокаинамидом пароксизмов мерцания предсердий (Олесин А.И. и соавт., 1983). Должную величину аритмического индекса Шломка-Рейнделя определяют для частоты желудочкового ритма в момент мерцания предсердий с частотой до 100 ударов в мин. по формуле: [Lg(100-ЧCC)-0,5]0,1 и при ритме более 100 уд/мин – [0,5+0,1(ЧСС –100/20)] 0,1, где ЧСС – частота сердечных сокращений при мерцании предсердий;
- в тех случаях, когда давность аритмии можно определить приблизительно, с точностью до месяцев и недель (II группа), а также при отсутствии эффекта при применении внутривенной терапии используется комбинированное лечение хинидином (хинид-дурулес, кинилентин) в сочетании с верапамилом. В возрасте до 60 лет хинидин назначают в следующих дозировках: 1 день – 1000 мг (5 таблеток по 200 мг), 2 день – 1400 мг (7 таблеток по 200 мг), в остальные дни – ежедневное увеличение дозы на 200 мг до достижения суммарной дозы 2000 мг или купирования аритмии (хинидин принимается в сочетании с ежедневным приемом верапамила в дозе 160 мг: 80 мг утром (в 9оо) и 80 мг – вечером (в 21оо); в возрасте старше 60 лет – начальная доза 600-800 мг (3-4 таблеток по 200 мг), с последующим ежедневным увеличением дозы хинидина на 200 мг (1 таблетка по 200 мг) также до достижения суммарной дозы 2000 мг или купирования аритмии (хинидин принимается в сочетании с ежедневным приемом верапамила в дозе 160 мг: 80 мг утром (в 9оо) и 80 мг – вечером (в 21оо);
- у больных III группы (осложненное течение мерцательной аритмии) купирование пароксизмов мерцания предсердий проводится после устранения осложнений таких, как сердечная недостаточность, инсульта, тромбоэмболии легочной артерии и т.д.;
- у больных IV группы (больные с постоянной формой или с мерцательной аритмии неизвестной давности) проводится терапия хлоридом калия и сердечными гликозидами (лучше использовать дигоксин с медленным темпом насыщения), причем в 65% случаев, по нашим данным, если мерцательная аритмия неизвестной давности является пароксизмом, она купируется.
Профилактика пароксизмов мерцания (фибрилляции) предсердий.
Сохранение синусового ритма с помощью антиаритмической терапии у больных с пароксизмальной формой мерцания предсердий – сложная и до сих пор нерешенная задача.
Для оценки объема и характера противорецидивной антиаритмической терапии пароксизмов мерцания предсердий необходимо учитывать предикторы ее перехода в хроническую форму. Среди них можно выделить анатомические (структурные) и электрофизиологические предикторы.
r Анатомические предикторы перехода мерцания предсердий в хроническую форму:
- продолжительность аритмии более 7 суток (90%);
- увеличение объема предсердий, чаще левого (по данным эхокардиографии – более 4,0 см) (85%);
- систолическая или диастолическая дисфункция левого желудочка (80%);
- кальциноз аорты, аортального и митрального клапанов (65%);
- вегетативный дисбаланс, в частности, ночные пароксизмы мерцательной аритмии, обусловленные избыточным влиянием n. Vagus, например, при заболеваниях желудочно-кишечного тракта - желчнокаменной болезни, хронического холецистита, язвенной болезни и т.д. (55%);
- синдром слабости синусового узла (20%);
- внутрипредсердные тромбы и опухоли (10%).
Примечание: в процентах указана прогностическая значимость каждого показателя.
Одним из ведущих мест среди этих предикторов отводится расширению левого предсердия, которое многие авторы называют аритмогенным (М.С. Кушаковский, 1998, 1999; Rensma P., 1987). Расширение левого предсердия, по данным М.С. Кушаковского (1999), обнаруживается примерно у 4/5 больных, переносивших пароксизмы мерцания предсердий. Основными причинами его расширения являются: митральный стеноз, повышение конечного диастолического давления в полости левого желудочка, митральная регургитация, выраженная гипертрофия стенок левого желудочка.
Кроме вышеуказанных факторов, увеличение размеров левого предсердия может быть за счет следующих причин:
- частые и (или) продолжительные пароксизмы мерцания предсердий, длительный аритмический анамнез (фибрилляции предсердий);
- нарушение диастолической функции левого желудочка с расширением полости левого предсердия;
- усиление ригидности (жесткости) стенок, обызвествление (кальциноз) кольца митрального клапана, создающие затруднения для оттока крови из левого предсердия в левый желудочек,
- первичное («миодистрофическое») расширение левого предсердия, развивающееся без ретроградного влияния со стороны левого желудочка и митрального кольца;
- степень тяжести сердечной недостаточности.
Определенную роль в развитии пароксизмов мерцания предсердий играет увеличение ушка левого предсердия. По данным некоторых авторов (Кушаковский М.С., 1998, 1999; Omran Н. et al., 1997), сохранение хорошей функции ушка левого предсердия может указывать на потенциальную обратимость мерцания предсердий. Однако не все исследователи придерживаются этой точки зрения (Nerhorst Р. et al., 1995). Вместе с тем, нет противоречий в оценке роли ушка левого предсердия в процессах внутрисердечного тромбообразования, осложняющегося возникновением тромбоэмболических осложнений.
r Электрофизиологические факторы риска пароксизмов мерцания предсердий
Было замечено, что у 1/5 больных, переносивших пароксизмы мерцания, имеют нормальный или незначительно увеличенный размер левого предсердия. Однако у таких больных могут быть частые пароксизмы этой аритмии. Причины «готовности» этой группы пациентов связаны с особенностями измененного электрогенеза мышечных клеток левого предсердия. К числу электрофизиологических предикторов мерцания предсердий относятся следующие:
- предсердные (внутри- и межпредсердные) блокады, увеличение продолжительности зубца Р > 1040 мс предсказывает развитие пароксизма мерцания предсердий с чувствительностью 78% и специфичностью 71% (Andrikopolous G. et al., 1998);
- неоднородная предсердная рефрактерность (W. Lammers et al., 1986);
- повышенная уязвимость предсердий по результатам кардиостимуляции (Пучков А.Ю., 1995, Шабров А.В. и соавт., 1999, Олесин А.И. и соавт., 2000);
- наличие поздних потенциалов предсердий, указывающих на фрагментированную активность миокарда предсердий (Николин К.М., 1996; Волков В.Н., 1998; Аsanin М.et al., 1998; R. Archboid et al., 1998).
Анализ многочисленных данных рандомизированных исследований за последние 20 лет показал, что в настоящее время нет такого препарата, которым не пытались предупредить развитие рецидивов мерцания предсердий. Результаты международного исследования “NISA”, оценивающего частоту использования антиаритмических препаратов в разных странах, показали, что для предупреждения развития мерцания предсердий в Италии чаще всего используют пропафенон и флекаинид, во Франции – хинидин и другие препараты IА класса или препараты III класса (соталол и кордарон), в Германии, Испании – кордарон, в Италии – -адреноблокаторы (метопролол), причем, авторы, анализирующие частоту использования противоаритмических средств в разных странах отмечают, что разница в выборе препаратов, по-видимому, может быть объяснена чисто коммерческими интересами (Bracchetti D. et al., 1996). Остальные противоаритмические средства для предупреждения клинических рецидивов мерцания предсердий такие, как дизопирамид, верапамил и т.д., не применяются из-за низкой их противорецидивной активности (Егоров Д.Ф., 1998, Кушаковский М.С., 1999, Bracchetti D. et al., 1996). Обобщая результаты многоцентровых исследований, проведенных за последние 20 лет и посвященных профилактике пароксизмов мерцания предсердий, можно сделать вывод, что положительный противорецидивный эффект всех наиболее часто применяемых препаратов в разных странах мира (см. выше), за исключением кордарона, составляет в первые 3 месяца (от начала ихиспользования), в среднем, 40-70%, через 6 месяцев – 30-50% и через 1-1,5 года – меньше 20-40%. Через 2-3 года приема этих препаратов положительный эффект практически отсутствует. Следует отметить, что при длительном «аритмическом анамнезе» до начала лечения, например, при исходной рефрактерности к терапии препаратами IA подкласса, эффективность большинства антиаритмических средств значительно ниже. Кроме того, побочные, включая аритмогенный, эффекты этих препаратов составляют от 4% до 30%, а некоторые авторы указывают – до 50%, что требует их отмены (Руда М.Я. и соавт, 1996, Розен М.Р., 1996, Егоров Д.Ф., 1998, Кушаковский М.С., 1999, Campbell R.W.F., 1996, Camm A.M., 1997). Наибольший положительный эффект при профилактике мерцания предсердий, по мнению многих авторов, можно достичь только применяя кордарон. Так, в клинике под руководством М.С. Кушаковского (1990, 1999) за 20 летний период применения кордарона противорецидивный эффект этого препарата наблюдался практически в 80% случаев (в 60% - полное устранение приступов и у 20% - их урежение до 2-3 раз в год) на протяжении от 1 до 6 лет. Сходные данные были получены в других многочисленных исследованиях (Недоступ А.В. и соавт., 1990, Олейников В.Э. и соавт., 1995, Howard P.A. et al., 1995, Campbell R.W.F., 1996, Camm A.M., 1997). Следует отметить, что вышеуказанный противорецидивный эффект кордарона практически не меняется при предшествующей резистентности ко многим противоаритмическим средствам. Многие исследователи указывают, что эффективность антиаритмических средств, включая кордарон, различна в зависимости от нозоологии: максимальный эффект (до 80-90%) отмечается при идиопатическом мерцании предсердий и артериальной гипертензии, а минимальный (до 60-70%) – при клапанном поражении сердца (Кушаковский М.С., 1999, Criyns H.J. et al., 1991, 1997).
Многочисленные публикации, основанные на исследованиях CASH и CASH-II (1989-1994), DIAMONO (1997), свидетельствуют о высоком риске аритмогенного эффекта и внезапной аритмической смерти при длительном применении препаратов I класса для профилактики аритмий, включая мерцание предсердий. Поэтому в настоящее время считается, что, во-первых, необходим индивидуальный выбор противорецидивной антиаритмической терапии пароксизмов мерцания предсердий путем использования различных электрофизиологических тестов, включая тестирование антиаритмических препаратов с помощью чреспищеводной или внутрисердечной электрокардиостимуляции. Следует отметить, что при назначении препаратов I класса, особенно IC подкласса, для предупреждения пароксизмов мерцания предсердий необходим неоднократный контроль (не реже 1 раза в месяц), включая суточное мониторирование электрокардиограммы, для исключения аритмогенного эффекта. Во-вторых, необходимо разрабатывать неинвазивные, не уступающие по эффективности электрофизиологическим тестам, методы контроля и оценки эффективности профилактической терапии пароксизмов мерцания предсердий. В-третьих, открываются широкие возможности для немедикаментозных способов предупреждения пароксизмов мерцания предсердий таких, как абляция атриовентрикулярного соединения, постоянная электрокардиостимуляция, а также использования различных видов лазеротерапии.
В настоящее время подбор противорецидивной терапии пароксизмов мерцания предсердий проводится путем тестирования антиаритмических средств с помощью чреспищеводной электрокардиостимуляции. За 7-10 дней до исследования (или через 5-7 периодов полувыведения) отменяются противоаритмические препараты. Для индуцирования мерцания предсердий обычно используют залповую или медленно-нарастающую сверхчастую стимуляции (Олесин А.И. и соавт., 2000). Залповую стимуляцию проводят с частотой от 300 до 1200 имп/мин с дисперсностью 50 имп/мин, медленно-нарастающую сверхчастую стимуляцию – путем постепенного увеличения частоты стимуляции (за 15 сек.) с базисного ритмовождения (обычно со 100 имп/мин,) до 200-800 имп/мин с дисперсностью 50 имп/мин. (Гросу А.А. и соавт., 1989, Татарченко И.П. и соавт., 1993, Олесин А.И. и соавт., 2000, Buxton A.E. et al., 1989). Частота, на которой индуцируется мерцание предсердий, обозначается как частотный порог индуцирования аритмии. Возникновение пароксизмов мерцания предсердий при проведении сверхчастой стимуляции зависит как от частоты, так и от длительности проведения процедуры. Для медленно-нарастающей свехчастой стимуляции порог индуцирования аритмии расчитывается по формуле: ПИА = N.Т, где ПИА – частотный порог индуцирования аритмии в имп.с, N - число импульсов за время стимуляции, Т - время стимуляции в сек., а для залповой ПИА = 15,7 + (ЧТ2)К, где ПИА – частотный порог индуцирования аритмии в имп.с, Т - время залповой стимуляции в сек., Ч – частота залповой стимуляции в имп/мин., К – коэффициент, равный 1,03 (Олесин А.И. и соавт., 2000).
Нами наблюдалось 218 больных с часто рецидивирующими пароксизмами мерцания предсердий(в среднем, 51 приступов в месяц) в возрасте от 38 до 75 лет (в среднем, 52,33,1 года). Длительность «аритмического анамнеза» до начала исследования составила 0,5-2 года. У 85(38,99%) больных основным заболеванием была выявлена гипертоническая болезнь I-II стадии по критериям ВОЗ, у 95(43,58%) – ИБС: стенокардия II-III функционального класса, у 20(9,17%) - инфаркт миокарда в анамнезе. Диагноз ИБС основывался на критериях ВОЗ. У 135(61,93%) больных наблюдалось сочетание гипертонической болезни и ИБС. Хроническую сердечную недостаточность I-II функционального класса по классификации NYHA диагностировали у 115(52,75%) больных. Контрольную группу составили 58 пациентов с гипертонической болезнью и ИБС без нарушений сердечного ритма в возрасте от 40 до 55 лет (в среднем, 462 года).
Выбор противорецидивной антиаритмической терапии пароксизмов мерцания предсердий проводился с учетом клинической формы аритмии (вагусная, адренергическая или смешанная), функции синусового узла (Кушаковский М.С., 1999), в том числе основываясь на результаты анализа спектральных компонентов вариабельности сердечного ритма, определяемых по данным суточного мониторирования электрокардиограммы (система Кардиотехника-4000, АОЗТ «ИНКАРТ» НИИ кардиологии МЗ и МП России, С-Петербург), состояния гемодинамики, характера дисфункции левого желудочка, а также антигипертензивного, антиангинального действия, хронотропных эффектов противоаритмических средств и по результатам тестирования противоаритмических препаратов с помощью чреспищеводной электрокардиостимуляции.
Всем больным на первом этапе пароксизмы мерцания предсердий вначале индуцировались с помощью залповой сверхчастой стимуляции, а в тех случаях, когда аритмии в этом режиме не вызвать удалось, использовалась медленно нарастающая сверхчастая стимуляция по методике, описанной нами выше. Пароксизмы аритмии считали устойчивыми при их длительности более 1 минуты и неустойчивыми - менее 1 минуты.
Для определения противорецидивной антиаритмической терапии пароксизмов мерцания предсердий вначале тестировали препараты II и IV классов: анаприлин в дозе 60-120 мг в сутки, атенолол в дозе 100-150 мг в сутки, дилтиазем в дозе 180-240 мг в сутки, верапамил в дозе 160-240 мг в сутки, а затем - препараты Ia, Ic и III классов: этацизин в дозе 150 мг в сутки, аллапинин – 75 мг в сутки, соталол - 120-240 мг в сутки, хинидин (кинилентин или хинидин-дурулес) - 1200 мг в сутки, пропафенон - 400-600 мг, дизопирамид - 600-800 мг в сутки и в последнюю очередь - кордарон - 600 - 800 мг в сутки. Противоаритмическая терапия проводилась на фоне использования базисной антиангинальной и антигипертензивной терапии, включающей нитраты пролонгированного действия, антиагреганты, ингибиторы АПФ (капотен, эднит, энап и др.) и т.д. За 7-10 дней перед тестированием противоаритмических средств у всех больных оценивалась эффективность базисной терапии. Длительность применения антиаритмических средств составила 4 - 5 дней, а кордарона - 8 - 10 дней. В последний день приема каждого препарата повторяли чреспищеводную электрокардиостимуляцию. Препарат, на фоне применения которого порог индуцирования аритмии возрастал на 70% и более сравнении с исходной частотой или пароксизм аритмии не индуцировался, назначался для предупреждения рецидивов аритмии. Критерием положительного эффекта при длительном применении определенной терапии явилось уменьшение рецидивирования пароксизмов мерцания предсердий в 2 раза и более, сохранение значений порога индуцирования аритмии при повторном исследовании (через 1,3, 6 месяцев и более) в сравнении с исходными данными. Длительность наблюдения обследованных больных составила от 1 года до 6 лет.
Контроль за состоянием больных, регистрацию электрокардиограммы проводили 1 раз в месяц. Регулярный контроль артериального давления и частоты сердечных сокращений пациенты осуществляли самостоятельно.
Результаты исследования показали, что наиболее эффективной при выборе противорецидивной противоаритмической терапии пароксизмов мерцания предсердий у больных ИБС, согласно полученным нами данным, является применение медленно-нарастающей сверхчастой стимуляции, причем у 88,17% больных при ее использовании была определена терапия, оказавшаяся эффективной более 1 года, а у 69,05% из них - от 3 до 6 лет (в среднем, 4,10,3 года). У 35,71% больных при использовании залповой сверхчастой стимуляции отмечался ложноположительный результат в выборе противорецидивной антиаритмической терапии: у этих пациентов были определены как наиболее эффективные препараты II и IV классов, однако положительный результат при их применении наблюдался от 1 до 2 месяцев. Однако при повторном тестировании с помощью медленно-нарастающей сверхчастой стимуляции наибольшая противорецидивная активность у них была выявлена только при применении препаратов Ia, Ic и III классов. Поэтому при выборе противорецидивной противоаритмической терапии пароксизмов мерцания предсердий у больных ИБС предпочтение следует отдать препаратам Ia, Ic и III классов, а тестировать с помощью кардиостимуляции противоаритмические средства II и IV классов нецелесообразно из-за низкой их противорецидивной активности в отношении этих аритмий. Они по показаниям могут быть использованы без тестирования, в частности у пациентов с впервые возникшими пароксизмами мерцания предсердий в качестве базисной антиаритмической терапии или как препараты «первой ступени».
Меньшую результативность залповой сверхчастой стимуляции при выборе противорецидивной антиаритмической терапии пароксизмов мерцания предсердий у больных ИБС можно объяснить, во-первых, наличием индивидуального, возможно, строго фиксированного, частотного порога индуцирования аритмии, во-вторых, изменением рефрактерности миокарда предсердий в результате нарушения внутри- и межпредсердной проводимости, различных метаболических сдвигов, дисфункции левого желудочка, синусового узла и некоторых других факторов. Следует подчеркнуть, что сама процедура чреспищеводной электрокардиостимуляции, а также используемые фармакологические средства, вероятно, разнонаправленно изменяют электрофизиологические свойства миокарда предсердий. Поэтому при повторном исследовании, по-видимому, из-за фиксированной частоты залповой сверхчастой стимуляции аритмия может не индуцироваться, что приводит к снижению ее воспроизводимости и ложноположительному результату при определении противоаритмической терапии. Следует отметить, что при назначении на длительный период антиаритмических препаратов, особенно Iс класса у больных ИБС, вначале их приема необходимо неоднократно проводить суточное мониторирование электрокардиограммы для исключения аритмогенного действия этих препаратов.
Несмотря на успехи в выборе противоаритмической терапии пароксизмов мерцания предсердий с помощью электрофизиологических тестов, эта методика имеет ряд недостатков таких, как болезненность при проведении процедуры, необходимость тестирования от 2-3 до 5-10 противоаритмических средств, на что требуется от 1 –2 недель до 1-2 месяцев.
Нами предложен неинвазивный оригинальный метод, позволяющий выявить нарушения предсердной проводимости путем оценки скорости и направления распространения возбуждения по предсердиям с расчетом (в %) количества сегментов сердечной мышцы предсердий с антеградным и ретроградным проведением возбуждения, определить адекватную противорецидивную терапию пароксизмов мерцания предсердий, а также проконтролировать ее эффективность (Олесин А.И. и соавт., 1996, Шабров А.В. и соавт., 1999).
Метод заключается в том, что больному на синусовом ритме (после купирования аритмии), проводили эхокардиографическое с одновременным электрокардиографическим исследованием в «М» и «В» режимах по общепринятой методике (Feigenbaum H., 1994, 1996). Затем определяли значения показателя внутрипредсердной проводимости (в сек.) от начала электрического возбуждения предсердий (волны «Р») до начала механического сокращения левого или правого предсердий в «М» режиме, причем установку курсора в этих отделах предсердия проводили в «В» режиме перпендикулярно стенке правого и левого предсердий в 4 точках: одна в верхней, две в средней и последняя – в нижней трети (от верхушки до основания) с делением предсердий на сегменты по описанной ранее методике (Шабров А.В. и соавт., 1999). Все значения внутрипредсердной проводимости усредняли по частоте сердечных сокращений. Направление распространения возбуждения определяли от минимального к максимальному показателю внутрипредсердной проводимости в соседних точках: за антеградное проведение возбуждения принимали увеличение значений этого показателя от верхушки до основания, а за ретроградное - от основания до верхушки. Затем для каждого сегмента определяли возможность формирования кругов рециркуляции и их протяженность по формуле: = РП х Vмин., где - длина петли рециркуляции в м., Vмин. – минимальная скорость проведения возбуждения в м/сек, РП – длительность рефрактерного периода сердечной мышцы предсердий, в которой развивается рециркуляция, равная, в среднем, как 1/3 разницы проведения возбуждения между двумя соседними исследуемыми точками внутрипредсердной проводимости (в сек.) (Сперлаксис Н., 1990, Шабров А.В. и соавт., 1999, Олесин А.И. и соавт., 2000). Как показали многочисленные экспериментальные и клинические исследования, при снижении скорости распространения возбуждения до 0,4 м/с и менее оказывается достаточным для развитияаритмии с длиной петли re-entry 9 см и менее (Allessie M.A. et al., 1990, 1995). Затем определяли время проведения возбуждения и частоту рециркуляции по каждой возможной петле re-entry и сравнивали с частотой и продолжительностью волн f-f электрокардиограммы, регистрируемых преимущественно с помощью чреспищеводных отведений в течение 1 мин. и более.
Нами наблюдалось 238 больных с впервые возникшими пароксизмами мерцания предсердий (в среднем, 41 приступа в месяц) в возрасте от 38 до 75 лет (в среднем, 53,63,2 года). У 87(36,55%) больных основным заболеванием была выявлена гипертоническая болезнь I-II стадии по критериям ВОЗ, у 95(39,92%) – ИБС: стенокардия II-III функционального класса, у 21(8,82%) - инфаркт миокарда в анамнезе. Диагноз ИБС основывался на критериях ВОЗ. У 145(60,92%) больных наблюдалось сочетание гипертонической болезни и ИБС. Хроническую сердечную недостаточность I-II функционального класса по классификации NYHA диагностировали у 109(45,80%) больных. Контрольную группу составили 58 пациентов с гипертонической болезнью и ИБС без нарушений сердечного ритма в возрасте от 40 до 55 лет (в среднем, 462 года). Купирование впервые возникших пароксизмов мерцания предсердий у всех больных проводилось с учетом неблагоприятных признаков развития возможных осложнений противоаритмической терапии, состояния гемодинамики в момент аритмии и длительности аритмии до начала лечения (Олесин А.И. и соавт., 1996, Шабров А.В. и соавт., 1998).
У 42(17,65%) больных длительность аритмии до начала лечения составила до 1 суток, у 115(48,32%) - от 1 до 7 суток (в среднем, 2,80,9 суток). У 10(4,20%) больных пароксизмы мерцания предсердий были купированы анаприлином, у 18(7,56%) – пропафеноном, у 47(19,75%) - соталолом, у 16(6,72%) - внутривенным введением хлорида калия с новокаинамидом, у 18(7,56%) – хинидином, у 79(33,19%) - хинидином в сочетании с верапамилом, у 30(12,61%) – кордароном, у 11(4,62%) – кордароном в сочетании с дилтиаземом или аллапинином, у остальных - аритмия купировалась самостоятельно.
У 58(24,37%) больных при назначении препаратов II и IV классов пароксизмы мерцания предсердий не наблюдались в течение 1 года и более (в среднем 2,10,1 года) после первых клинических рецидивов аритмии, в то время как у остальных обследуемых пациентов наиболее эффективными оказались антиаритмические препараты I и (или) III классов, и частота пароксизмов мерцания предсердий уменьшалась в 2-5 раз (в среднем, 3,20,1 раза). Все обследуемые больные, согласно классификации S. Levy (1995, 1998), были разделены на две группы. В I группу вошло 58(24,37%) больных, которым проводилась терапия ингибиторами АПФ в сочетании с препаратами II или IV классов (что соответствует IIв подгруппе, в которой пароксизмы мерцания предсердий рецидивируют менее 1 раза в 3 месяца при назначении -адреноблокаторов или блокаторов кальциевых каналов): 22(37,93%) из этих 58 пациентов получали метопролол, остальные - дилтиазем-ретард (алтиазем-РР), во II группу было включено 180(75,63%) больных, получавших наряду с ингибиторами АПФ противоаритмические препараты I и (или) III классов (что соответствует IIIв подгруппе, в которой пароксизмы мерцания предсердий рецидивируют менее 1 раза в 3 месяца при назначении блокаторов натриевых и (или) калиевых каналов): у 21(11,67%) из этих больных проводилась терапия хинидином, у 40(22,22%) – соталолом, у 27(5,56%) - этацизином, у 31(17,22%) - пропафеноном, у 51(28,33%) - кордароном. У 2(1,11%) и у 8(4,44%) больных II группы наиболее эффективной оказалась комбинированная антиаритмическая терапия: кордарон+аллапинин и кордарон+этацизин соответственно. Достоверного различия по полу, возрасту, сопутствующим заболеваниям, функции синусового узла у больных I и II группы как между собой, так и в сравнении с контрольной группой выявлено не было.
У всех больных I группы после купирования первого пароксизма мерцания предсердий было выявлено от 2 до 5 возможных петель re-entry с частотой рециркуляции 240-750 в мин., а у 76(42,22%) и у 104(57,78%) больных II группы соответственно – от 4 до 7 и от 6 до 12 кругов re-entry с частотой рециркуляции 370-1500 в мин. У всех обследуемых больных количество петель re-entry высоко коррелировало с числом участков миокарда предсердий с ретроградным проведением возбуждения (r=0,91). У всех больных I группы частота волн f-f электрокардиограммы в момент приступа аритмии варьировала от 250 до 840 сокращений в мин., а у всех больных II группы – от 340 до 1700 сокращений в мин. Следует отметить, что у больных I и II группы наиболее продолжительный диапазон частот волн f-f составил 250-430 в мин. (в среднем, 33015 в мин.) и 410-1400 в мин. (в среднем 78045 в мин.) соответственно (p<0,001), которые регистрировались, в среднем, на протяжении 75,261,14% записи чреспищеводных отведений электрокардиограммы, причем, корреляция между частотой волн f-f и рециркуляцией по вероятным кругам re-entry у больных I и II группы, в среднем, составилаr=0,91 и r= 0,87 соответственно. У 43(74,14%) больных I группы наиболее эффективной оказалась терапия хлоридом калия с новокаинамидом, хинидином, пропафеноном, в то время как у 75(41,67%) больных II группы – монотерапия соталолом и кордароном, а у остальных – комбинированное лечение хинидином с верапамилом или кордароном в сочетании с дилтиаземом или аллапинином. Следует отметить, что у больных I и в большей степени - II группы увеличение количества кругов рециркуляции и участков с ретроградным проведением возбуждения коррелировали с такими независимыми предикторами трансформации в хроническую форму мерцания предсердий, как дилатация левого предсердия (r=0,89), большая продолжительность тахиаритмии (r=0,77), кальциноз митрального клапана (r=0,84), снижение фракции выброса левого желудочка (r=0,72), ухудшение спектра трансмитрального потока (r=0,92).
У 18(31,03%) больных I и контрольной группы наблюдалось антеградное, а у остальных больных этой и у всех пациентов II группы - ретроградное проведение возбуждения по миокарду предсердий, причем, порог индуцирования аритмии и скорость распространения возбуждения в антеградном направлении были достоверно меньше в сравнении с контрольной группой (см. рис. 5.21.). С увеличением участков ретроградного проведения возбуждения уменьшался порог индуцирования аритмии (r = 0,92), уменьшалась скорость распространения возбуждения в антеградном направлении (r = 0,86), причем, эти изменения были более выражены у больных II группы (см. рис. 5.21.).
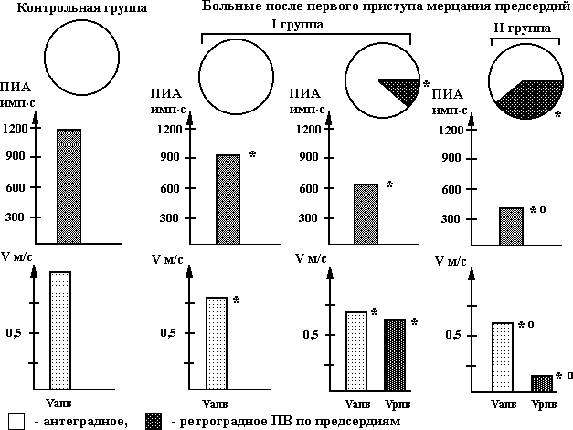
Рис. 5.21. Состояние проведения возбуждения, порога индуцирования аритмии (ПИА) у больных I и II группы после купирования первого пароксизма мерцания предсердий.
Vапв - скорость проведения возбуждения в антеградном направлении, Vрпв - скорость проведения возбуждения в ретроградном направлении; ПВ - проведение возбуждения по предсердиям; * - достоверность раздичия показателей в сравнении с контрольной группой, о - I группой (при р < 0,01).
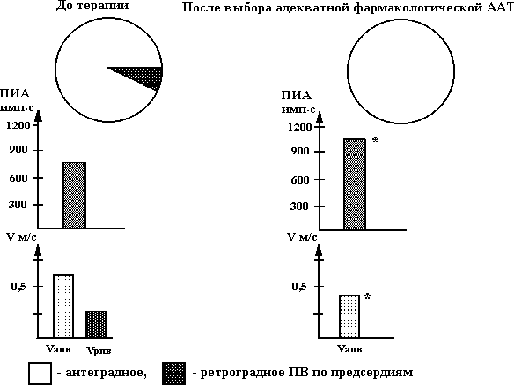
Рис. 5.22. Состояние проведения возбуждения, порога индуцирования аритмии (ПИА) у больных I группы при положительном эффекте противорецидивной антиаритмической терапии.
Vапв - скорость проведения возбуждения в антеградном направлении, Vрпв - скорость проведения возбуждения в ретроградном направлении; ПВ - проведение возбуждения по предсердиям;* - достоверность раздичия показателей в сравнении с исходными данными (при Р < 0,01).
У больных I группы при положительном эффекте противорецидивной антиаритмической терапии отмечается переход из ретроградного проведения возбуждения в антеградный или сохранение антеградного распространения возбуждения, увеличение порога индуцирования аритмии и снижение скорости проведения возбуждения в антеградном направлении (см. рис. 5.22.). У пациентов II группы, несмотря на выбор адекватной антаритмической терапии и увеличение порога индуцирования аритмии, наблюдалось уменьшение количества участков с ретроградным проведением возбуждения, причем, положительный клинический эффект был, по-видимому, связан с уменьшением скорости распространения возбуждения в антеградном и увеличением - в ретроградном направлении (см. рис. 5.23.). Следует отметить, что после отмены противоаритмической терапии у больных II группы пароксизмы мерцания предсердий практически сразу рецидивировали.
В большинстве случаев развитие мерцания предсердий обусловлено механизмом re-entry, причем, устойчивое мерцание предсердий наблюдается при формировании 3 и больше кругов рециркуляции (Allessie M.A., 1990, 1995). Нами были получены аналогичные данные.
В настоящее время известно, что, несмотря на то, что пароксизмы мерцания и трепетания предсердий редко непосредственно угрожают жизни, их симптомы значительно беспокоят пациентов и изменяют их образ жизни, который значительно улучшается при восстановлении и сохранении синусового ритма. Положительный опыт использования у человека имплантируемого предсердного дефибриллятора для лечения приступов мерцания предсердий открывают новые перспективы для ничтожно малой части больных с тяжелым побочным действием или резистентностью к противоаритмической терапии. Поэтому подавляющему большинству пациентов для предупреждения часто рецидивирующих пароксизмов мерцания предсердий по-прежнему придется назначать антиаритмическую терапию, что, по меньшей мере, улучшит качество их жизни.
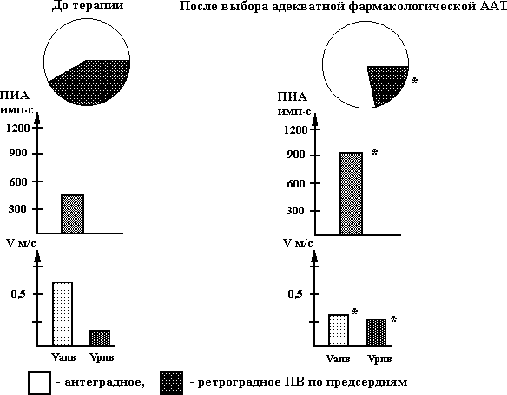
Рис. 5.22. Состояние проведения возбуждения, порога индуцирования аритмии (ПИА) у больных II группы при положительном эффекте противорецидивной антиаритмической терапии.
Vапв - скорость проведения возбуждения в антеградном направлении, Vрпв - скорость проведения возбуждения в ретроградном направлении; ПВ - проведение возбуждения по предсердиям;* - достоверность раздичия показателей в сравнении с исходными данными (при Р < 0,01).
Полученные нами данные показали, что реальный положительный клинический эффект противорецидивный антиаритмической терапии после первого пароксизма мерцания предсердий наблюдался только у больных I группы, который был, по-видимому, обусловлен нормализацией распространения возбуждения по предсердиям или уменьшением до 9% количества участков с ретроградным проведеним возбуждения. У больных II группы, несмотря на проводимую адекватную антиаритмическую терапию, сохраняется аритмогенный субстрат в виде участков с ретроградным проведением возбуждения, причем, у этих пациентов положительный противорецидивный эффект был связан, по нашим данным, с уменьшением скорости проведения в антеградном направлении и увеличением – в ретроградном, что создает минимальные условия для формирования петель re-entry, причем, при отмене антиаритмических препаратов – пароксизмы мерцания предсердий у них практически сразу рецидивируют.
Следует отметить, что соотношение между участками сердечной мышцы предсердий с быстрым и медленным проведением возбуждения меняется, причем, замедление проведения отмечается, по нашим данным, в большей мере в ретроградном направлении, создавая условия для формирования петли re-entry (Allessie M.A., 1990, 1995). Поэтому у таких пациентов, по-видимому, имеется исходная готовность к развитию аритмии, причем, вероятность ее появления повышается при увеличении разницы между скоростью проведения возбуждения по миокарду предсердий в антеградном и ретроградном направлениях. Следует подчеркнуть, что, согласно полученным нами результатам, при увеличении соотношения скорости антеградного и ретроградного распространения возбуждения более чем в 3 раза, количество клинических рецидивов пароксизмов мерцания предсердий увеличивается прямо пропорционально с повышением значений этого показателя. Кроме того, уменьшение соотношения этих скоростей или нормализация распространения возбуждения по предсердиям, возможно, может служить одним из критериев, свидетельствующих о положительном противорецидивном эффекте антиаритмического лечения этой аритмии.
Анализ результатов медикаментозной антиаритмической терапии больных ИБС с пароксизмами мерцания предсердий, по данным разных авторов, показал, что их выживаемость в большей степени зависит от того, какими препаратами проводится вторичная профилактика самой аритмии, так и коррекция дисфункции левого желудочка. Доводом для раннего начала противорецидивной фармакологической терапии может служить тот факт, что пароксизмы этой аритмии могут поддерживаться не только из-за прогрессирующей дилатации, но и вследствие уменьшения рефрактерности сердечной мышцы предсердий.
Результаты нашего исследования показали, что у 73,25% больных с частыми приступами пароксизмов мерцания предсердий (с межприступным периодом рецидивов аритмии менее 6 месяцев) уже после первого приступа аритмии наблюдалось ретроградное проведение возбуждения по предсердиям, систолическая или диастолическая дисфункция, кальциноз митрального и (или) аортального клапанов и т.д. Поэтому противорецидивную антиаритмическую терапию пароксизмов мерцания предсердий у больных ИБС с дилатацией и дисфункцией левого желудочка целесообразно начинать сразу после первого приступа аритмии. Другим важным важным доводом раннего начала противорецидивного лечения аритмии у этих пациентов может служить сохранность, по нашим данным, у них систолической функции левого желудочка и наличие легкой степени сердечной недостаточности, что снижает риск аритмогенного действия противоаритмических средств. Развитие диастолической дисфункции левого желудочка и дилатация левого предсердия у этих больных, по-видимому, обусловлены прогрессированием артериальной гипертензии и (или) усугублением ишемии, в том числе бессимптомной, миокарда. Поэтому больным ИБС для предупреждения рецидивов пароксизмов мерцания предсердий, после купирования первого приступа аритмии, при выявлении только нарушений ПВ по предсердиям показано применение вначале адекватной гипотензивной и антиангинальной терапии, а при наличии нарушений предсердной проводимости и структурных нарушений миокарда, таких, как дилатации и диастолической дисфункции левого желудочка, дилатации левого предсердия, кальциноз аорты, митрального клапана, нарушения функции синусового узла, а также длительной тахиаритмии, по нашим данным, более 7 суток и т.д. - в сочетании с антиаритмической терапией.
Принципы назначения противорецидивной антиаритмической терапии после купирования первого пароксизма мерцания предсердий представлены на рис. 5.24., 5.25.
Рис. 5.24. Противорецидивная терапия после купирования первого пароксизма мерцания предсердий у больных ИБС*
СН I-II функционального класса СН III-IV функционального класса
____________________________________
СДЛЖ ДДЛЖ СДЛЖ
Ингибиторы АПФ Ингибиторы АПФ Ингибиторы АПФ
-адреноблокаторы1 Дилтиазем-ретард2 Сердечные гликозиды,
(алтиазем-РР) препараты калия,
диуретики
_______________________________
Препараты резерва: соталол, кордарон Кордарон
Примечание: СДЛЖ – систолическая дисфункция левого желудочка, ДДЛЖ – диастолическая дисфункция левого желудочка, СН – сердечная недостаточность, * - лечение пароксизмов мерцания предсердий проводится при использовании адекватной антиангинальной терапии.
Комментарии к алгоритму 5.15.
1 - -адреноблокаторы принимаются в субтерапевтических дозах, в том числе для предупреждения прогрессирования сердечной недостаточности. Наиболее эффективны следующие препараты: атенолол в дозе 25-50 мг/сутки, метопролол – 12,5-50 мг/сутки и соталол – 40-80 мг/сутки.
2 – для устранения диастолической дисфункции левого желудочка у больных ИБС после первого пароксизма мерцания предсердий наиболее эффективным оказался дилтиазем-ретард (алтиазем-РР) в сравнении с остальными используемыми средствами такими, как -адреноблокаторы, верапамил, неретардные формы дилтиазема (см. рис. 5.25.). Следует отметить, что при назначении этого препарата необходимо не реже 1 раза в месяц проводить эхокардиографическое исследование, так как дилтиазем-ретард (алтиазем-РР) у больных ИБС достаточно быстро (в течение нескольких недель или месяцев) переводит из диастолической в систолическую дисфункцию левого желудочка, при которой уже отмечается отрицательный эффект этого препарата, что требует его замены, например, на -адреноблокаторы.
- Полученные нами данные показали, что у 24,37% больных при применении ингибиторов АПФ в сочетании с -адреноблокаторами и антагонистами кальциевых каналов пароксизмы мерцания предсердий не наблюдались на протяжении 1 года и более. У этих пациентов после первого приступа аритмии была выявлена диастолическая дисфункция левого желудочка, достоверное увеличение объема левого предсердия в сравнении с больными без нарушений сердечного ритма, выявление до 25% участков с ретроградным проведением возбуждения, причем соотношение скоростей в антеградном и ретроградном направлениях до проведения антиаритмической терапии не превышало 5,0.
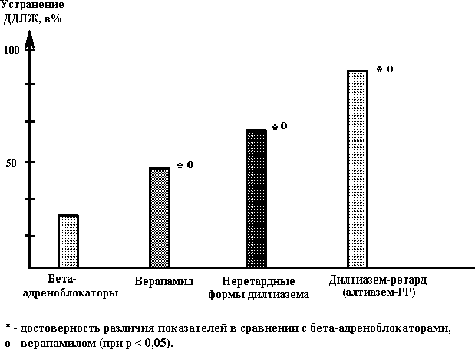
Рис. 5.25. Эффективность (в%) коррекции диастолической дисфункции левого желудочка у больных ИБС после купирования первого пароксизма мерцания предсердий.
* - достоверность различия показателей в сравнении с -адреноблокаторами, о- верапамилом (при р < 0,01).
По нашим данным, у 8(36,36%) из 22 больных и у 6(33,33%) из 18 больных I группы, получавших дилтиазем-ретард (алтиазем-РР) и метопролол соответственно наблюдался переход из ретроградного в антеградное проведение возбуждения по предсердиям, а у остальных пациентов этой группы - достоверно уменьшилось количество участков с ретроградным проведением возбуждения (до 9%), число возможных кругов re-entry, скорость распространения возбуждения в антеградном направлении, и достоверно увеличилась скорость проведения возбуждения в ретроградном направлении в сравнении с исходными данными (р<0,001). Следует отметить, что назначение этих препаратов оправдано тем, что после использования кордарона в качестве противорецидивной терапии пароксизмов мерцания предсердий, остальные антиаритмические препараты, как правило, малоэффективны. Поэтому до назначения препаратов III класса, по-видимому, целесообразно использовать, по показаниям, вначале препараты, позволяющие устранить такие предикторы перехода этой аритмии в хроническую форму, как диастолическая дисфункция левого желудочка (ингибиторы АПФ в сочетании с алтиазем-РР), предупредить прогрессирование начальных классов сердечной недостаточности (игибиторы АПФ в сочетании с -адреноблокаторами). При наличии клинически выраженной сердечной недостаточности, по-видимому, вначале показано устранение проявлений недостаточности кровообращения, а затем – назначение кордарона. Кроме того, у больных ИБС с выявлением после первого пароксизма мерцания предсердий только нарушений проведения возбуждения по предсердиям, без наличия предикторов перехода этой аритмии в хроническую форму, после купирования первого приступа аритмии, по-видимому, показано применение только адекватной гипотензивной и антиангинальной терапии.
Следует подчеркнуть, что для купирования клинических рецидивов пароксизмов мерцания предсердий при выявлении волн f-f электрокардиограммы в наиболее продолжительном диапазоне частот от 250 до 430 в мин., наиболее эффективными оказались -адреноблокаторы и препараты Ia и Ic подклассов, а в диапазоне частот 410-1400 в мин. – III класса, а также комбинации хинидина с верапамилом и кордарона с дилтиаземом или аллапинином.
При наличии 2-3 предикторов у больных ИБС, выявляемых после первого приступа мерцания предсердий таких, как:
длительность пароксизма мерцания предсердий более 7 суток в сочетании, например, с кальцинозом митрального клапана, аорты и (или) систолической дисфункцией левого желудочка – показана терапия препаратами III класса (вначале используя соталол, при отсутствии противопоказаний, а затем – кордарон) в сочетании с терапией сердечной недостаточности - ингибиторами АПФ, диуретиками;
кальциноз митрального клапана, аорты и (или) диастолическая дисфункция левого желудочка – показана терапия препаратами III класса в сочетании с терапией сердечной недостаточности - ингибиторы АПФ, диуретики, дилтиазем-ретард (алтиазем-РР), а при их неэффективности – препараты III класса.
У больных с некоронарогенной патологией наиболее эффективными на первом этапе, по нашим данным, оказались препараты I класса такие, как пропафенон, хинидин, флекаинид т.д., причем, при отсутствии положительного результата при их применении, препаратами резерва являются средства III класса – соталол и кордарон. Следует отметить, что у пациентов ИБС и с некоронарогенной патологией с избыточной вагусной активностью целесообразно вначале использовать препараты с ваголитическим действием такие, как хинидин, дизопирамид и т.д., регистрируя, не реже 1 раза в месяц суточное мониторирование электрокардиограммы для выявления возможного аритмогенного эффекта этих средств.
