
- •Часть I. Механизмы хранения и реализации генетической информации 17
- •Предисловие автора
- •Часть I. Механизмы хранения и реализации генетической информации введение
- •Средний размер гаплоидного генома у некоторых групп организмов
- •Гены и хромосомы
- •Геном прокариот
- •Геном вирусов
- •Нуклеоид бактериальной клетки
- •Геном архебактерий
- •Минимальный размер генома одноклеточных организмов
- •Геном эукариот
- •Последовательности нуклеотидов эукариотического генома
- •Хроматин
- •Свойства гистонов животных
- •Роль днк-топоизомераз в обеспечении структуры и функционирования хроматина
- •Реализация генетической информации при экспрессии генов
- •Транскрипция
- •Днк-зависимые рнк-полимеразы
- •Характеристики белковых компонентов холофермента рнк-полимеразы II дрожжей
- •Единицы транскрипции (транскриптоны)
- •Этапы транскрипции
- •Субъединичный состав и характеристика основных факторов транскрипции (gtf) рнк-полимеразы II человека
- •Основные факторы элонгации рнк-полимеразы II
- •Хроматин во время транскрипции
- •Субъединичный состав и свойства белковых комплексов Swi/Snf и nurf
- •Котранскрипционные и посттранскрипционные модификации рнк
- •Процессинг рнк у бактерий
- •Редактирование пре-мРнк
- •Различные способы редактирования мРнк
- •Редактирование рнк у животных и их вирусов
- •Другие модификации эукариотических мРнк
- •Сравнение полиаденилирования мРнк у эукариот и прокариот
- •5’-Концевой сайт Точка 3’-Концевой сайт
- •5’–Экзон 1guaugu__...__uacuaac__...__(Py)nAgэкзон 2–3’
- •Механизм прямой и обратной реакций аутосплайсинга интронов группы I
- •Кэп-связывающий комплекс в роли фактора, сопрягающего основные реакции метаболизма транскриптов рнк-полимеразы II
- •Функциональная компартментализация ядра
- •Интерфазные хромосомы в ядре
- •Ядрышко
- •Пространственная организация синтеза мРнк
- •Ядерные тельца и домены
- •Компартментализованное ядро
- •Биосинтез белка рибосомами бактерий
- •Рибосомы
- •Этапы биосинтеза белка
- •Антибиотики, действующие на уровне трансляции
- •Трансляция у эукариот
- •Особенности первичной структуры эукариотических мРнк
- •Инициация биосинтеза белка эукариотическими рибосомами
- •Элонгация полипептидных цепей
- •Терминация трансляции
- •Трансляция в митохондриях
- •Трансляция в хлоропластах.
- •Основные пути регуляции экспрессии генов
- •Регуляция экспрессии генов на уровне транскрипции у прокариот
- •Регуляция на уровне инициации транскрипции
- •Регуляция синтеза рнк на уровне элонгации и терминации
- •Регуляция экспрессии генов на уровне транскрипции у эукариот
- •Передача сигнала и вторичные мессенджеры
- •Рецепторы мембран, осуществляющие трансмембранный перенос сигнала
- •Механизмы позитивной регуляции транскрипции
- •Классификация факторов транскрипции
- •Функциональные домены факторов транскрипции
- •Механизмы негативной регуляции транскрипции
- •Структура хроматина как специфический регулятор экспрессии генов
- •Импринтинг
- •Метилирование днк в регуляции транскрипции
- •Факторы транскрипции позвоночных, на активность которых оказывает влияние метилирование остатков цитозина в узнаваемых ими регуляторных последовательностях нуклеотидов
- •Посттранскрипционная регуляция экспрессии генов
- •Направленный транспорт, внутриклеточная локализация и депонирование мРнк
- •Сплайсинг рнк в регуляции экспрессии генов
- •Избирательная деградация мРнк
- •Регуляция экспрессии генов на уровне трансляции
- •Регуляция инициации трансляции
- •Регуляция элонгации синтеза полипептидных цепей
- •Регуляция терминации трансляции
- •Синтез белков, содержащих остатки селеноцистеина
- •Посттрансляционная регуляция экспрессии генов
- •Последствия фолдинга вновь синтезированных полипептидных цепей
- •Специфические протеиназы в посттрансляционном процессинге белков
- •Убиквитин-зависимая система протеолиза в регулируемой деградации белков
- •Сплайсинг белков
- •Другие посттрансляционные модификации белков
- •Воспроизведение генетической информации
- •Репликация днк
- •Белки, участвующие в репликации днк
- •Белки, входящие в состав репликативных комплексов прокариотических и эукариотических организмов
- •Репликативная вилка e. Coli и бактериофага t4
- •Особенности функционирования репликативной вилки эукариот
- •Эукариотические днк-полимеразы и их функциональные гомологи у прокариот
- •Регуляция репликации днк
- •Инициация репликации днк у e. Coli и ее регуляция
- •Регуляция репликации плазмиды ColE1
- •Особенности репликации линейных геномов
- •Линейные хромосомы бактерий
- •Репликаторы эукариот
- •Репликация теломерных участков эукариотических хромосом
- •Пространственная организация синтеза днк у эукариот
- •Защита генетической информации
- •Мутации
- •Основные источники мутаций и методы определения мутагенной активности
- •Основные классы алкилирующих агентов
- •Метаболиты нормальной микрофлоры человека, обладающие мутагенной и канцерогенной активностями
- •Sos-мутагенез у бактерий
- •Мутаторный фенотип
- •Экспансия днк
- •Адаптивные мутации
- •Механизмы защиты генома от мутаций
- •Репарация днк
- •Основные механизмы репарации поврежденной днк
- •Эксцизионная репарация в клетках животных
- •Днк-гликозилазы и эндонуклеазы клеток микроорганизмов и человека, участвующие в ber
- •Белки животных, участвующие в ner
- •Гомологичная рекомбинация в репарации днк
- •Репарация ошибочно спаренных нуклеотидов
- •Полимераза поли(adp-рибозы) в репарации днк у эукариот
- •Альтруистичная днк
- •Парадокс возможности существования многоклеточных организмов
- •Повышение информационной стабильности генома избыточными последовательностями
- •Селективная защита генов от мутаций
- •Высокоупорядоченное расположение летальных генов на хромосомах
- •Возможный смысл парадокса с
- •Современная концепция гена
- •Часть II основные направления развития прикладной молекулярной генетики Введение
- •Часть II. Искусственные генетические системы
- •Принципы генной инженерии
- •Основные ферменты, используемые в генной инженерии
- •Рестриктазы и днк-метилазы
- •Эффективность расщепления коротких последовательностей днк некоторыми распространенными рестриктазами
- •Днк- и рнк-лигазы
- •Ферменты матричного синтеза днк и рнк
- •Частота ошибок при синтезе днк, осуществляемом термостабильными днк-полимеразами in vitro при проведении пцр в оптимальных условиях
- •Другие ферменты
- •Векторы
- •Плазмидные векторы
- •Векторы на основе фага
- •Космиды и фазмиды
- •Сверхъемкие векторы yac, bac и pac
- •Интегрирующие и челночные (бинарные) векторы
- •Конструирование экспрессирующих векторов и их функционирование
- •Векторы для переноса днк в клетки животных и растений
- •Клонотеки генов
- •Получение клонотек генов
- •Введение рекомбинантных днк в клетки
- •Методы скрининга клонотек генов
- •Эукариотические системы экспрессии рекомбинантных генов, основанные на культурах клеток
- •Клетки яичников китайских хомячков (линия cho)
- •Клетки мышиной миеломы (линия Sp2/0)
- •Клетки селезенки мышей (линия mel)
- •Клетки африканской зеленой мартышки (линия cos)
- •Клетки насекомых, зараженные бакуловирусами
- •Сравнение эффективности рассмотренных систем экспрессии
- •Бесклеточные белоксинтезирующие системы
- •Прокариотические системы
- •Эукариотические системы
- •Проточные системы
- •Другие современные методы исследования генов
- •Рестрикционное картирование генов
- •"Прогулки и прыжки по хромосомам"
- •S1-картирование рнк и днк
- •Футпринтинг
- •Стратегия выделения нового гена
- •Направленный мутагенез и белковая инженерия
- •Методы направленного получения мутаций
- •Получение делеций и вставок
- •Химический мутагенез
- •Сайт-специфический мутагенез с использованием олигонуклеотидов
- •Полимеразная цепная реакция в направленном мутагенезе
- •Белковая инженерия
- •Библиотеки пептидов и эпитопов
- •Белки-репортеры в гибридных белках
- •Гибридные токсины
- •Подходы к созданию новых ферментов
- •Субтилигаза в лигировании пептидов
- •Концепция ксенобиоза
- •Антисмысловые рнк, рибозимы и дезоксирибозимы
- •Антисмысловые рнк и олигонуклеотиды
- •Механизм действия антисмысловых рнк
- •Использование антисмысловых рнк
- •Влияние экспрессии антисмысловых рнк на фенотип трансгенных мышей
- •Природные антисмысловые рнк
- •Антисмысловые рнк и патология: возможный механизм возникновения доминантных мутаций
- •Рибозимы и дезоксирибозимы
- •Типы рибозимов
- •Свойства рибозимов
- •Рибозимы как лекарственные средства
- •Репарация мутантных рнк с помощью рибозимов, осуществляющих транс-сплайсинг
- •Дезоксирибозимы
- •Аптамеры
- •Молекулы рнк у истоков жизни
- •Молекулы рнк в качестве рнк-репликаз
- •Возможность синтеза полипептидных цепей молекулами рнк
- •Трансгенные животные и растения
- •Способы получения трансгенных многоклеточных организмов
- •Экспрессия трансгенов
- •Использование трансгенов у животных
- •Исследование механизмов экспрессии генов
- •Токсигены в исследовании дифференцировки соматических клеток в онтогенезе
- •Изменение физиологического статуса лабораторных и сельскохозяйственных животных
- •Моделирование наследственных и приобретенных заболеваний человека
- •Трансгенные растения
- •Генотерапия наследственных и приобретенных заболеваний
- •Способы доставки новых генов в геном человека
- •Управление экспрессией трансгенов в клетках-мишенях
- •Современные достижения генотерапии онкологических заболеваний
- •Ближайшие перспективы использования генотерапии
- •Успехи генотерапии в модельных экспериментах
- •Проблемы, возникающие в связи с практическим применением генотерапии
- •Днк-диагностика и днк-типирование
- •Днк-диагностика наследственных и приобретенных заболеваний
- •Получение клинического генетического материала
- •Диагностика заболеваний
- •Днк-типирование
- •Днк-типирование микроорганизмов
- •Идентификация личности на основе минисателлитной днк: определение отцовства
- •Микроматрицы и микрочипы днк
- •Методы создания микроматриц днк
- •Ограничения в использовании микроматриц днк
- •Использование микроматриц днк в фундаментальных и прикладных исследованиях
- •Картирование и определение первичной структуры генома человека
- •Основные подходы к картированию генома человека
- •Генетические карты сцепления
- •Современные методы построения генетических карт сцепления
- •Пцр в исследованиях генома человека
- •Физические карты низкого разрешения
- •Физические карты высокого разрешения
- •Определение полной первичной структуры днк генома человека
- •Базы данных получаемой информации
- •Заключение
- •Рекомендуемая литература
Днк- и рнк-лигазы
Создание фосфодиэфирных связей в одноцепочечных разрывах двухцепочечной ДНК с помощью ДНК-лигаз является наряду с рестрикцией одним из важнейших этапов получения рекомбинантных ДНК in vitro. Наибольшее применение в генно-инженерных исследованиях находит ДНК-лигаза бактериофага Т4. Реакция лигирования протекает в два этапа (рис. II.3). Вначале образуется промежуточный комплекс фермент–АМР (этап 1), после чего остаток АМР переносится на 5’-фосфатную группу концевого нуклеотида в точке разрыва ДНК (этап 2). Образовавшаяся фосфодиэфирная связь гидролизуется во время нуклеофильной атаки 3’-ОН группы соседнего нуклеотида, что приводит к образованию новой фосфодиэфирной связи, восстанавливающей целостность сахаро-фосфатного остова ДНК. Т4-ДНК-лигаза осуществляет соединение фрагментов двухцепочечной ДНК, обладающих комплементарными "липкими" или "тупыми" концами. Как следует из механизма реакции, необходимым условием протекания лигирования является наличие 5’-концевого фосфата и 3'-концевого гидроксила в точках разрыва цепей ДНК. При этом эффективность соединения фрагментов ДНК по "тупым" концам Т4-ДНК-лигазой возрастает в присутствии Т4-РНК-лигазы, которая осуществляет ковалентное соединение 5’-фосфорилированных концов одноцепочечных ДНК или РНК с 3’-ОН группами одноцепочечных нуклеиновых кислот.
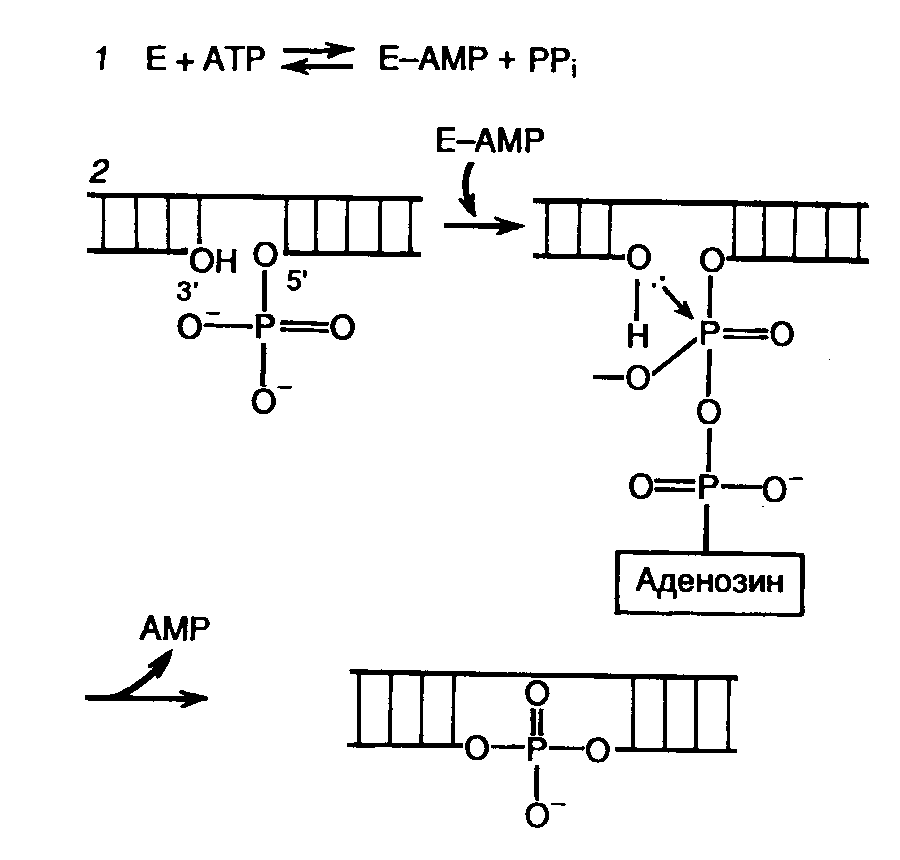
Рис. II.3. Механизм лигирования ДНК Т4-ДНК-лигазой
1 – образование промежуточного комплекса фермент Е–AMP; 2 – образование фосфодиэфирной связи
Ферменты матричного синтеза днк и рнк
К ферментам матричного синтеза нуклеиновых кислот относятся многочисленные ДНК- и РНК-зависимые ДНК- и РНК-полимеразы, осуществляющие зависимый от матричных ДНК или РНК синтез нуклеиновых кислот. Эти ферменты обычно используются в генной инженерии для получения двухцепочечных молекул ДНК из одноцепочечных, а также для обратной транскрипции, т.е. синтеза двухцепочечных ДНК, комплементарных мРНК, которые называют комплементарными ДНК (кДНК).
ДНК-зависимые ДНК-полимеразы. Среди ДНК-зависимых ДНК-полимераз наибольшее применение в генной инженерии находят ДНК-полимераза I E. coli и ее большой фрагмент (фрагмент Кленова), Т4-ДНК-полимераза и в последнее время термостабильные ДНК-полимеразы, особенно ДНК-полимераза Thermus aquaticus (Taq-полимераза). Все эти ферменты в присутствии ионов Mg2+ из четырех дезоксирибонуклеозидтрифосфатов (dATP, dCTP, dGTP и TTP) осуществляют синтез ДНК, комплементарной матричной ДНК, и для функционирования требуют наличия затравки на одноцепочечной матричной ДНК, т.е. олиго- или полидезоксирибонуклеотида со свободным 3’-ОН-концом, комплементарного матричной ДНК. ДНК-полимераза I E.coli состоит из одной полипептидной цепи с молекулярной массой около 109 кДа и обладает тремя активностями: полимеризующей в направлении 5’3’, 5’3’-экзонуклеазной и 3’5’-экзонуклеазной. Большой фрагмент ДНК-полимеразы I E. coli (фрагмент Кленова) является частью полипептидной цепи ДНК-полимеразы I с молекулярной массой около 76 кДа, у которой отсутствует домен, соответствующий 5’3’-экзонуклеазе. Как ДНК-полимераза I, так и ее фрагмент используются для введения радиоактивно меченных дезоксирибонуклеотидов в синтезируемые цепи ДНК путем ник-трансляции, т.е. перемещения одноцепочечного разрыва вдоль молекулы двухцепочечной ДНК, в котором 3’-ОН-конец используется в качестве затравки для ферментов. При этом ДНК-полимераза I прокладывает себе путь с помощью 5’3’-экзонуклеазы, а фрагмент Кленова вытесняет цепь ДНК с 5’-конца. Кроме того, фрагмент Кленова используют для синтеза второй цепи кДНК, секвенирования ДНК по методу Сенгера, заполнения 5’-выступающих "липких" концов ДНК с образованием "тупых" концов, введения концевой радиоактивной метки, а также для удаления 3’-выступающих концов рестрикционных фрагментов ДНК 3’5’-экзонуклеазой этого фермента. Как и ДНК-полимераза I E. coli, Т4-ДНК-полимераза обладает 3’5’- (но не 5’3’-) экзонуклеазной активностью, которая у последней, по крайней мере, в 200 раз выше. Это позволяет использовать Т4-ДНК-полимеразу, в частности, для введения радиоактивной метки путем реакции обмена немеченного 3’-концевого нуклеотида на меченный радиоактивным изотопом.
Полимеразная цепная реакция (ПЦР). Термостабильная Taq-полимераза в настоящее время широко используется для проведения полимеразной цепной реакции (ПЦР), а ее модифицированный аналог – и для секвенирования ДНК по методу Сенгера. Сущность ПЦР заключается в следующем (рис. II.4). Реакционная смесь обычно содержит исследуемую ДНК, dATP, dCTP, dGTP и TTP, Taq-полимеразу и два синтетических олигодезоксирибонуклеотидных праймера длиной 15–30 нуклеотидов, комплементарных участкам противоположных цепей ДНК, фланкирующих исследуемый участок ДНК-матрицы. ПЦР начинается с кратковременного (1–2 мин) прогревания реакционной смеси при 95o, в процессе которого происходит плавление цепей матричной ДНК и инактивация примесных белков, которые могут присутствовать в реакционной смеси, если используется недостаточно очищенная матричная ДНК, например из клинических образцов. Далее реакционную смесь охлаждают до температуры отжига праймеров с матричной ДНК (37–65o). В результате праймеры связываются с комплементарными им местами на матрице и с этого момента начинают служить затравками для синтеза Taq-полимеразой новых цепей ДНК, комплементарных каждой из цепей денатурированной матричной ДНК. Для проведения синтеза ДНК в оптимальных для Taq-полимеразы условиях температуру реакционной смеси поднимают до 72o и при такой температуре проводят элонгацию цепей вновь синтезирующейся ДНК в течение 0,5–2 мин. По окончании стадии синтеза ДНК заканчивается первый цикл ПЦР, после чего проводятся такие же второй, третий и т.д. в автоматическом режиме. По окончании третьего цикла уже образуется дискретный продукт ПЦР – фрагмент двухцепочечной ДНК, содержащий на своих 5’-концах последовательности нуклеотидов праймеров. Количество продукта ПЦР в реакционной смеси после завершения каждого цикла удваивается и, следовательно, по мере прохождения реакции экспоненциально возрастает, достигая нескольких микрограммов в реакционной смеси объемом 25–50 мкл. По окончании ПЦР содержимое реакционной смеси анализируют электрофорезом в агарозном геле в присутствии бромистого этидия, где продукт реакции выявляется в УФ-свете. Продукт ПЦР можно выделить из агарозного геля в чистом виде и работать с ним, как с обычным фрагментом двухцепочечной ДНК, т.е. гидролизовать рестриктазами, клонировать в плазмидных векторах по "липким" и "тупым" концам, секвенировать или использовать в качестве зондов при гибридизации.
С помощью ПЦР можно амплифицировать in vitro сегменты ДНК длиной от 0,1 до 5–7 т.п.о. и более, а для получения положительного результата достаточно присутствия в реакционной смеси одной–двух копий амплифицируемой последовательности нуклеотидов (например геномной ДНК, содержащейся в одной–двух соматических клетках). При этом не возникает необходимости в тщательной очистке матрицы, так как большинство попадающих в реакционную смесь белков и ферментов инактивируется в первых же циклах ПЦР и не оказывает влияния на протекание реакции при высоких температурах. Благодаря таким особенностям, как простота постановки, высокая чувствительность и воспроизводимость, ПЦР в последнее время получила широкое распространение в фундаментальных и прикладных исследованиях по молекулярной биологии и генетике. Возможность амплификации любого сегмента ДНК, последовательность нуклеотидов которого известна, и получение его по завершении ПЦР в гомогенном виде и препаративном количестве делают ПЦР альтернативным методом молекулярного клонирования коротких фрагментов ДНК. При этом не возникает необходимости в применении тех сложных методических приемов, которые используют в генной инженерии при обычном клонировании.
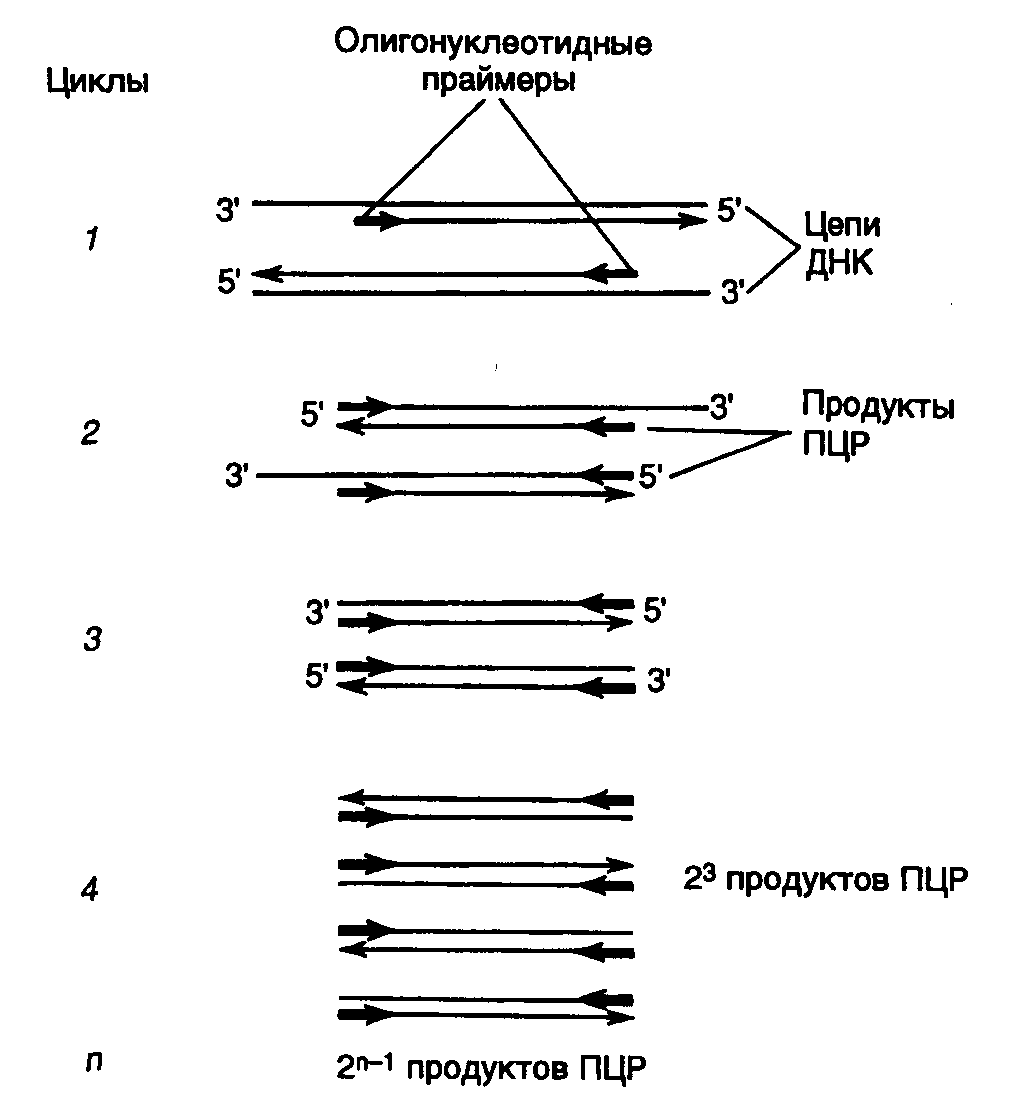
Рис. II.4. Полимеразная цепная реакция (ПЦР)
Поскольку специфичность ПЦР зависит главным образом от соответствия последовательности нуклеотидов праймеров первичной структуре амплифицируемых фрагментов ДНК, эта специфичность приближается к абсолютной при повышении длины праймеров до 17–20 нуклеотидов. Такая высокая специфичность и чувствительность позволяют использовать ПЦР для ДНК-диагностики инфекционных и наследственных заболеваний человека, а также вирусоносительства в тех случаях, когда вирусом в латентной форме заражены лишь отдельные соматические клетки, например в случае вируса иммунодефицита человека (ВИЧ) (см. главу 11). Разработка метода ПЦР во многом расширила методические возможности молекулярной генетики, и в частности генной инженерии, причем настолько, что это кардинально изменило и усилило исследовательский потенциал многих ее направлений.
Точность амплификации ДНК термостабильными ДНК-полимеразами является особенно критическим параметром в том случае, если продукты ПЦР используются далее для конструирования экспрессирующихся генов. Необходимость в уменьшении частоты мутаций стимулирует поиски новых термостабильных ДНК-полимераз, амплифицирующих ДНК с большей точностью. В табл. II.2 приведены результаты испытаний точности синтеза ДНК различными коммерческими ДНК-полимеразами.
Относительно высокая точность синтеза ДНК in vitro ДНК-полимеразами Pfu и Vent обусловлена наличием у них 3’-5’-экзонуклеазной корректирующей активности. Частота ошибочно включенных нуклеотидов в результате одновременного функционирования двух разных ДНК-полимераз в смесях, применяемых для амплификации длинных сегментов ДНК (long PCR), оказывается ниже, чем при использовании Taq-полимеразы, но выше, чем для очищенной ДНК-полимеразы Pfu.
При проведении аллель-специфической ПЦР (см. раздел 11.1) необходимо учитывать способность Taq-полимеразы инициировать синтез ДНК на праймерах, 3’-концевой нуклеотид которых некомплементарен матричной ДНК. При исследовании этого вопроса оказалось, что не все пары
Таблица II.2
