
- •Часть I. Механизмы хранения и реализации генетической информации 17
- •Предисловие автора
- •Часть I. Механизмы хранения и реализации генетической информации введение
- •Средний размер гаплоидного генома у некоторых групп организмов
- •Гены и хромосомы
- •Геном прокариот
- •Геном вирусов
- •Нуклеоид бактериальной клетки
- •Геном архебактерий
- •Минимальный размер генома одноклеточных организмов
- •Геном эукариот
- •Последовательности нуклеотидов эукариотического генома
- •Хроматин
- •Свойства гистонов животных
- •Роль днк-топоизомераз в обеспечении структуры и функционирования хроматина
- •Реализация генетической информации при экспрессии генов
- •Транскрипция
- •Днк-зависимые рнк-полимеразы
- •Характеристики белковых компонентов холофермента рнк-полимеразы II дрожжей
- •Единицы транскрипции (транскриптоны)
- •Этапы транскрипции
- •Субъединичный состав и характеристика основных факторов транскрипции (gtf) рнк-полимеразы II человека
- •Основные факторы элонгации рнк-полимеразы II
- •Хроматин во время транскрипции
- •Субъединичный состав и свойства белковых комплексов Swi/Snf и nurf
- •Котранскрипционные и посттранскрипционные модификации рнк
- •Процессинг рнк у бактерий
- •Редактирование пре-мРнк
- •Различные способы редактирования мРнк
- •Редактирование рнк у животных и их вирусов
- •Другие модификации эукариотических мРнк
- •Сравнение полиаденилирования мРнк у эукариот и прокариот
- •5’-Концевой сайт Точка 3’-Концевой сайт
- •5’–Экзон 1guaugu__...__uacuaac__...__(Py)nAgэкзон 2–3’
- •Механизм прямой и обратной реакций аутосплайсинга интронов группы I
- •Кэп-связывающий комплекс в роли фактора, сопрягающего основные реакции метаболизма транскриптов рнк-полимеразы II
- •Функциональная компартментализация ядра
- •Интерфазные хромосомы в ядре
- •Ядрышко
- •Пространственная организация синтеза мРнк
- •Ядерные тельца и домены
- •Компартментализованное ядро
- •Биосинтез белка рибосомами бактерий
- •Рибосомы
- •Этапы биосинтеза белка
- •Антибиотики, действующие на уровне трансляции
- •Трансляция у эукариот
- •Особенности первичной структуры эукариотических мРнк
- •Инициация биосинтеза белка эукариотическими рибосомами
- •Элонгация полипептидных цепей
- •Терминация трансляции
- •Трансляция в митохондриях
- •Трансляция в хлоропластах.
- •Основные пути регуляции экспрессии генов
- •Регуляция экспрессии генов на уровне транскрипции у прокариот
- •Регуляция на уровне инициации транскрипции
- •Регуляция синтеза рнк на уровне элонгации и терминации
- •Регуляция экспрессии генов на уровне транскрипции у эукариот
- •Передача сигнала и вторичные мессенджеры
- •Рецепторы мембран, осуществляющие трансмембранный перенос сигнала
- •Механизмы позитивной регуляции транскрипции
- •Классификация факторов транскрипции
- •Функциональные домены факторов транскрипции
- •Механизмы негативной регуляции транскрипции
- •Структура хроматина как специфический регулятор экспрессии генов
- •Импринтинг
- •Метилирование днк в регуляции транскрипции
- •Факторы транскрипции позвоночных, на активность которых оказывает влияние метилирование остатков цитозина в узнаваемых ими регуляторных последовательностях нуклеотидов
- •Посттранскрипционная регуляция экспрессии генов
- •Направленный транспорт, внутриклеточная локализация и депонирование мРнк
- •Сплайсинг рнк в регуляции экспрессии генов
- •Избирательная деградация мРнк
- •Регуляция экспрессии генов на уровне трансляции
- •Регуляция инициации трансляции
- •Регуляция элонгации синтеза полипептидных цепей
- •Регуляция терминации трансляции
- •Синтез белков, содержащих остатки селеноцистеина
- •Посттрансляционная регуляция экспрессии генов
- •Последствия фолдинга вновь синтезированных полипептидных цепей
- •Специфические протеиназы в посттрансляционном процессинге белков
- •Убиквитин-зависимая система протеолиза в регулируемой деградации белков
- •Сплайсинг белков
- •Другие посттрансляционные модификации белков
- •Воспроизведение генетической информации
- •Репликация днк
- •Белки, участвующие в репликации днк
- •Белки, входящие в состав репликативных комплексов прокариотических и эукариотических организмов
- •Репликативная вилка e. Coli и бактериофага t4
- •Особенности функционирования репликативной вилки эукариот
- •Эукариотические днк-полимеразы и их функциональные гомологи у прокариот
- •Регуляция репликации днк
- •Инициация репликации днк у e. Coli и ее регуляция
- •Регуляция репликации плазмиды ColE1
- •Особенности репликации линейных геномов
- •Линейные хромосомы бактерий
- •Репликаторы эукариот
- •Репликация теломерных участков эукариотических хромосом
- •Пространственная организация синтеза днк у эукариот
- •Защита генетической информации
- •Мутации
- •Основные источники мутаций и методы определения мутагенной активности
- •Основные классы алкилирующих агентов
- •Метаболиты нормальной микрофлоры человека, обладающие мутагенной и канцерогенной активностями
- •Sos-мутагенез у бактерий
- •Мутаторный фенотип
- •Экспансия днк
- •Адаптивные мутации
- •Механизмы защиты генома от мутаций
- •Репарация днк
- •Основные механизмы репарации поврежденной днк
- •Эксцизионная репарация в клетках животных
- •Днк-гликозилазы и эндонуклеазы клеток микроорганизмов и человека, участвующие в ber
- •Белки животных, участвующие в ner
- •Гомологичная рекомбинация в репарации днк
- •Репарация ошибочно спаренных нуклеотидов
- •Полимераза поли(adp-рибозы) в репарации днк у эукариот
- •Альтруистичная днк
- •Парадокс возможности существования многоклеточных организмов
- •Повышение информационной стабильности генома избыточными последовательностями
- •Селективная защита генов от мутаций
- •Высокоупорядоченное расположение летальных генов на хромосомах
- •Возможный смысл парадокса с
- •Современная концепция гена
- •Часть II основные направления развития прикладной молекулярной генетики Введение
- •Часть II. Искусственные генетические системы
- •Принципы генной инженерии
- •Основные ферменты, используемые в генной инженерии
- •Рестриктазы и днк-метилазы
- •Эффективность расщепления коротких последовательностей днк некоторыми распространенными рестриктазами
- •Днк- и рнк-лигазы
- •Ферменты матричного синтеза днк и рнк
- •Частота ошибок при синтезе днк, осуществляемом термостабильными днк-полимеразами in vitro при проведении пцр в оптимальных условиях
- •Другие ферменты
- •Векторы
- •Плазмидные векторы
- •Векторы на основе фага
- •Космиды и фазмиды
- •Сверхъемкие векторы yac, bac и pac
- •Интегрирующие и челночные (бинарные) векторы
- •Конструирование экспрессирующих векторов и их функционирование
- •Векторы для переноса днк в клетки животных и растений
- •Клонотеки генов
- •Получение клонотек генов
- •Введение рекомбинантных днк в клетки
- •Методы скрининга клонотек генов
- •Эукариотические системы экспрессии рекомбинантных генов, основанные на культурах клеток
- •Клетки яичников китайских хомячков (линия cho)
- •Клетки мышиной миеломы (линия Sp2/0)
- •Клетки селезенки мышей (линия mel)
- •Клетки африканской зеленой мартышки (линия cos)
- •Клетки насекомых, зараженные бакуловирусами
- •Сравнение эффективности рассмотренных систем экспрессии
- •Бесклеточные белоксинтезирующие системы
- •Прокариотические системы
- •Эукариотические системы
- •Проточные системы
- •Другие современные методы исследования генов
- •Рестрикционное картирование генов
- •"Прогулки и прыжки по хромосомам"
- •S1-картирование рнк и днк
- •Футпринтинг
- •Стратегия выделения нового гена
- •Направленный мутагенез и белковая инженерия
- •Методы направленного получения мутаций
- •Получение делеций и вставок
- •Химический мутагенез
- •Сайт-специфический мутагенез с использованием олигонуклеотидов
- •Полимеразная цепная реакция в направленном мутагенезе
- •Белковая инженерия
- •Библиотеки пептидов и эпитопов
- •Белки-репортеры в гибридных белках
- •Гибридные токсины
- •Подходы к созданию новых ферментов
- •Субтилигаза в лигировании пептидов
- •Концепция ксенобиоза
- •Антисмысловые рнк, рибозимы и дезоксирибозимы
- •Антисмысловые рнк и олигонуклеотиды
- •Механизм действия антисмысловых рнк
- •Использование антисмысловых рнк
- •Влияние экспрессии антисмысловых рнк на фенотип трансгенных мышей
- •Природные антисмысловые рнк
- •Антисмысловые рнк и патология: возможный механизм возникновения доминантных мутаций
- •Рибозимы и дезоксирибозимы
- •Типы рибозимов
- •Свойства рибозимов
- •Рибозимы как лекарственные средства
- •Репарация мутантных рнк с помощью рибозимов, осуществляющих транс-сплайсинг
- •Дезоксирибозимы
- •Аптамеры
- •Молекулы рнк у истоков жизни
- •Молекулы рнк в качестве рнк-репликаз
- •Возможность синтеза полипептидных цепей молекулами рнк
- •Трансгенные животные и растения
- •Способы получения трансгенных многоклеточных организмов
- •Экспрессия трансгенов
- •Использование трансгенов у животных
- •Исследование механизмов экспрессии генов
- •Токсигены в исследовании дифференцировки соматических клеток в онтогенезе
- •Изменение физиологического статуса лабораторных и сельскохозяйственных животных
- •Моделирование наследственных и приобретенных заболеваний человека
- •Трансгенные растения
- •Генотерапия наследственных и приобретенных заболеваний
- •Способы доставки новых генов в геном человека
- •Управление экспрессией трансгенов в клетках-мишенях
- •Современные достижения генотерапии онкологических заболеваний
- •Ближайшие перспективы использования генотерапии
- •Успехи генотерапии в модельных экспериментах
- •Проблемы, возникающие в связи с практическим применением генотерапии
- •Днк-диагностика и днк-типирование
- •Днк-диагностика наследственных и приобретенных заболеваний
- •Получение клинического генетического материала
- •Диагностика заболеваний
- •Днк-типирование
- •Днк-типирование микроорганизмов
- •Идентификация личности на основе минисателлитной днк: определение отцовства
- •Микроматрицы и микрочипы днк
- •Методы создания микроматриц днк
- •Ограничения в использовании микроматриц днк
- •Использование микроматриц днк в фундаментальных и прикладных исследованиях
- •Картирование и определение первичной структуры генома человека
- •Основные подходы к картированию генома человека
- •Генетические карты сцепления
- •Современные методы построения генетических карт сцепления
- •Пцр в исследованиях генома человека
- •Физические карты низкого разрешения
- •Физические карты высокого разрешения
- •Определение полной первичной структуры днк генома человека
- •Базы данных получаемой информации
- •Заключение
- •Рекомендуемая литература
Векторы на основе фага
Основным недостатком плазмидных векторов для клонирования является их малая емкость в отношении клонируемых фрагментов ДНК. Размер вставок клонируемой ДНК в плазмидных векторах, которые способны стабильно в них существовать, как правило, не превышает нескольких тысяч пар оснований. Большие вставки ДНК в векторных плазмидах нестабильны, и их размеры постепенно уменьшаются по мере увеличения числа раундов репликации таких рекомбинантных плазмид in vivo. Преимущественное делетирование чужеродной ДНК в плазмидах большого размера связано с тем, что в бактериальных клетках селективное преимущество получают те плазмиды, время репликации которых минимально. Поэтому нуклеотидные последовательности ДНК, не участвующие в репликации векторных плазмид, постепенно элиминируются посредством делеций при длительном культивировании рекомбинантных бактерий.

Рис. II.6. Упаковка рекомбинантной фаговой ДНК в фаговые частицы in vitro
Емкость клонирующих векторов была значительно повышена с появлением векторов, сконструированных на основе хромосомы бактериофага . Получившие широкое распространение векторы серий Charon, gt11 и EMBL обладают, по крайней мере, двумя существенными преимуществами перед плазмидными векторами. Во-первых, векторы на основе ДНК фага обладают значительно большей емкостью, в них можно клонировать фрагменты ДНК длиной от 5 до 25 т.п.о. Во-вторых, фаговые частицы, содержащие упакованную ДНК, способны проходить литический цикл развития внутри бактериальных клеток и, следовательно, образовывать стерильные пятна (бляшки) на газоне бактерий. Такие бляшки содержат в концентрированном виде как сами фаговые частицы с упакованными в них рекомбинантными молекулами ДНК, так и все продукты метаболизма зараженных бактериальных клеток, включая белки и ферменты, которые появляются в результате экспрессии клонированных бактериальных генов. Каждая бляшка возникает вследствие развития индивидуальной фаговой частицы, содержащей рекомбинантную ДНК только одного типа, а, следовательно, все фаговые частицы одной бляшки (~1010) представляют собой, как правило, клон идентичных фаговых частиц (они могут различаться в редких случаях за счет мутационных изменений их генома, произошедших в процессе жизненного цикла фага, либо в том случае, если одна бактериальная клетка заражается несколькими фаговыми частицами одновременно). Все это позволяет легко обнаруживать в фаговых бляшках искомые ферментативные активности или последовательности нуклеотидов и идентифицировать клонированные последовательности ДНК. В основе конструирования фаговых векторов лежит несколько простых принципов (рис. II.6). В середине молекулы -ДНК длиной ~45 т.п.о. расположен участок хромосомы (~15 т.п.о.), который не является необходимым для литического развития бактериофага. Поэтому, в принципе, его можно заменить на любой фрагмент ДНК аналогичного размера и осуществить клонирование фрагмента путем размножения рекомбинантного бактериофага. Поскольку механизм упаковки хромосомной ДНК в фаговые частицы основан на включении ДНК строго определенного размера, рекомбинантные ДНК, содержащие фрагменты клонируемой ДНК, которые не соответствуют оптимальному размеру, не упаковываются и не клонируются. Это позволяет легко освобождаться от фаговых частиц, не содержащих вставки клонируемой ДНК, и оптимизировать процесс клонирования путем снижения в упаковочных экстрактах доли нежизнеспособных фаговых частиц. Процесс упаковки фаговой ДНК в зрелые фаговые частицы осуществляется в смеси бесклеточных экстрактов двух штаммов E. coli, лизогенных по дефектным бактериофагам . В одном штамме амбер-мутацией инактивирован один из белков фагового капсида (продукт гена E), а в другом – ген A, продукт которого необходим для включения фаговой ДНК в головку бактериофага. Имеются и другие пары лизогенных штаммов E. coli, позволяющие производить упаковку ДНК в фаговые частицы с использованием тех же общих принципов. Объединение бесклеточных лизатов обоих штаммов E. coli приводит к взаимной комплементации недостающих функций с помощью соответствующих белков дикого типа. Таким образом, в объединенных экстрактах имеются все компоненты, необходимые для сборки зрелых инфекционных фаговых частиц, в них происходит упаковка рекомбинантной ДНК с эффективностью образования 104–105 фаговых частиц на 1 мкг упаковываемой ДНК. Помимо вышеупомянутых мутаций ДНК -лизогенов содержат температурно-чувствительную мутацию в репрессоре cI, который инактивируется после переноса лизогенных клеток E. coli на непермиссивную температуру (42o), что сопровождается индукцией профага и накоплением внутри бактериальных клеток белковых продуктов, необходимых для упаковки ДНК. ДНК профагов также содержит делецию b2, элиминирующую сайт att, необходимый для интеграции фаговой ДНК в бактериальную хромосому. Это предотвращает выход ДНК профага из бактериальной хромосомы, а следовательно, и ее упаковку in vitro. Кроме того, в хромосоме профага имеется мутация, инактивирующая ген S, кодирующий лизоцим, что препятствует преждевременному лизису бактериальных клеток после индукции профага и позволяет сконцентрировать бактериальные клетки перед получением упаковочных экстрактов. И, наконец, бактериальные лизогенные клетки содержат мутацию recA, которая предотвращает гомологичную рекомбинацию между ДНК профага и рекомбинантными ДНК, упаковываемыми в фаговые частицы.
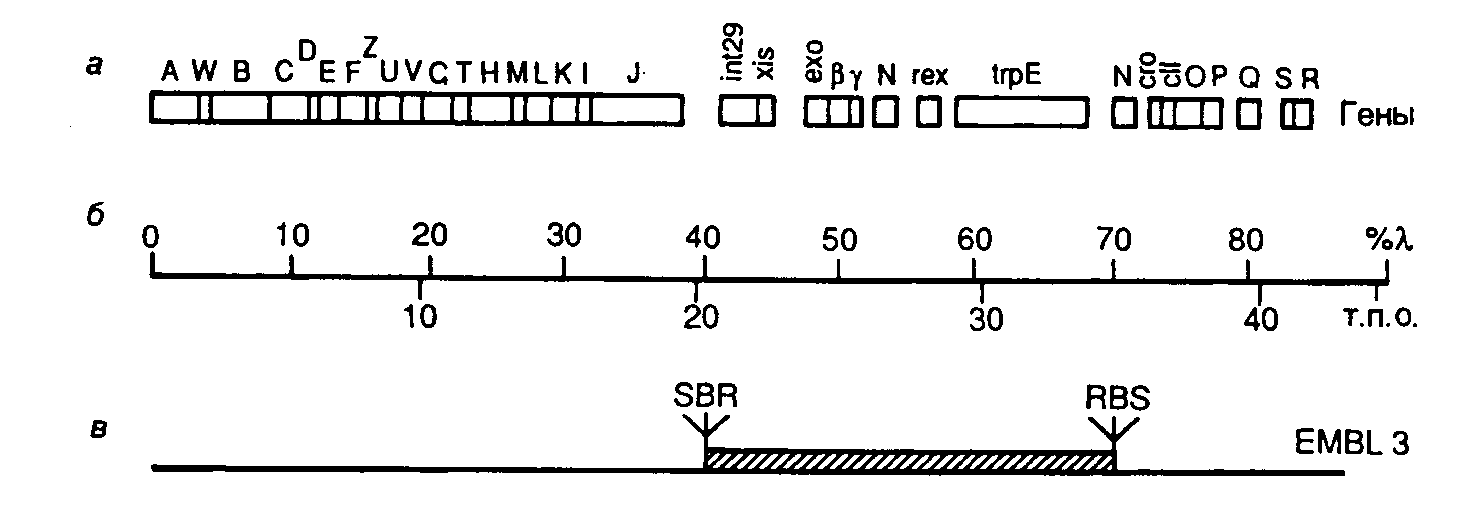
Рис. II.7. Генетическая карта хромосомы бактериофага -EMBL3
а– расположение генов на хромосоме;б– шкала длины хромосомной ДНК в процентах от длины-ДНК и т.п.о.;в– участок генома, замещаемый на клонируемый фрагмент ДНК соответствующего размера. S, B и R – сайты рестрикцииSalGI,BamHI иEcoRI соответственно
В качестве примера рассмотрим генетическую карту векторной ДНК бактериофага -EMBL и кратко обсудим возможности этого вектора (рис. II.7). Векторы серии EMBL являются производными ДНК бактериофага 1059. Их хромосомная ДНК длиной в 42364 п.о. содержит центральный сегмент ДНК длиной ~15 т.п.о., который замещается на клонируемый фрагмент ДНК соответствующего размера. При этом в фаговые частицы может быть упакована рекомбинантная ДНК общей длиной в 9–23 т.п.о. Замещаемый фрагмент фаговой хромосомы фланкирован с обоих концов последовательностями полилинкера, содержащего рестриктазные сайты EcoRI, BamHI и SalGI, по которым встраивают клонируемые фрагменты ДНК. При этом во время подготовки вектора к работе нет необходимости отделять "плечи" вектора от центрального фрагмента. Сначала центральный фрагмент ДНК выщепляется рестриктазой по одному из сайтов полилинкера, а затем смесь образовавшихся фрагментов обрабатывается другой рестриктазой, сайт для которой находится в полилинкере. Образующиеся олигонуклеотидные фрагменты полилинкера удаляются при переосаждении ДНК спиртом, а "липкие" концы "плеч" вектора и центральной последовательности получаются некомплементарными друг другу и не могут объединяться в процессе лигирования с образованием исходной формы ДНК вектора.
