
- •Часть I. Механизмы хранения и реализации генетической информации 17
- •Предисловие автора
- •Часть I. Механизмы хранения и реализации генетической информации введение
- •Средний размер гаплоидного генома у некоторых групп организмов
- •Гены и хромосомы
- •Геном прокариот
- •Геном вирусов
- •Нуклеоид бактериальной клетки
- •Геном архебактерий
- •Минимальный размер генома одноклеточных организмов
- •Геном эукариот
- •Последовательности нуклеотидов эукариотического генома
- •Хроматин
- •Свойства гистонов животных
- •Роль днк-топоизомераз в обеспечении структуры и функционирования хроматина
- •Реализация генетической информации при экспрессии генов
- •Транскрипция
- •Днк-зависимые рнк-полимеразы
- •Характеристики белковых компонентов холофермента рнк-полимеразы II дрожжей
- •Единицы транскрипции (транскриптоны)
- •Этапы транскрипции
- •Субъединичный состав и характеристика основных факторов транскрипции (gtf) рнк-полимеразы II человека
- •Основные факторы элонгации рнк-полимеразы II
- •Хроматин во время транскрипции
- •Субъединичный состав и свойства белковых комплексов Swi/Snf и nurf
- •Котранскрипционные и посттранскрипционные модификации рнк
- •Процессинг рнк у бактерий
- •Редактирование пре-мРнк
- •Различные способы редактирования мРнк
- •Редактирование рнк у животных и их вирусов
- •Другие модификации эукариотических мРнк
- •Сравнение полиаденилирования мРнк у эукариот и прокариот
- •5’-Концевой сайт Точка 3’-Концевой сайт
- •5’–Экзон 1guaugu__...__uacuaac__...__(Py)nAgэкзон 2–3’
- •Механизм прямой и обратной реакций аутосплайсинга интронов группы I
- •Кэп-связывающий комплекс в роли фактора, сопрягающего основные реакции метаболизма транскриптов рнк-полимеразы II
- •Функциональная компартментализация ядра
- •Интерфазные хромосомы в ядре
- •Ядрышко
- •Пространственная организация синтеза мРнк
- •Ядерные тельца и домены
- •Компартментализованное ядро
- •Биосинтез белка рибосомами бактерий
- •Рибосомы
- •Этапы биосинтеза белка
- •Антибиотики, действующие на уровне трансляции
- •Трансляция у эукариот
- •Особенности первичной структуры эукариотических мРнк
- •Инициация биосинтеза белка эукариотическими рибосомами
- •Элонгация полипептидных цепей
- •Терминация трансляции
- •Трансляция в митохондриях
- •Трансляция в хлоропластах.
- •Основные пути регуляции экспрессии генов
- •Регуляция экспрессии генов на уровне транскрипции у прокариот
- •Регуляция на уровне инициации транскрипции
- •Регуляция синтеза рнк на уровне элонгации и терминации
- •Регуляция экспрессии генов на уровне транскрипции у эукариот
- •Передача сигнала и вторичные мессенджеры
- •Рецепторы мембран, осуществляющие трансмембранный перенос сигнала
- •Механизмы позитивной регуляции транскрипции
- •Классификация факторов транскрипции
- •Функциональные домены факторов транскрипции
- •Механизмы негативной регуляции транскрипции
- •Структура хроматина как специфический регулятор экспрессии генов
- •Импринтинг
- •Метилирование днк в регуляции транскрипции
- •Факторы транскрипции позвоночных, на активность которых оказывает влияние метилирование остатков цитозина в узнаваемых ими регуляторных последовательностях нуклеотидов
- •Посттранскрипционная регуляция экспрессии генов
- •Направленный транспорт, внутриклеточная локализация и депонирование мРнк
- •Сплайсинг рнк в регуляции экспрессии генов
- •Избирательная деградация мРнк
- •Регуляция экспрессии генов на уровне трансляции
- •Регуляция инициации трансляции
- •Регуляция элонгации синтеза полипептидных цепей
- •Регуляция терминации трансляции
- •Синтез белков, содержащих остатки селеноцистеина
- •Посттрансляционная регуляция экспрессии генов
- •Последствия фолдинга вновь синтезированных полипептидных цепей
- •Специфические протеиназы в посттрансляционном процессинге белков
- •Убиквитин-зависимая система протеолиза в регулируемой деградации белков
- •Сплайсинг белков
- •Другие посттрансляционные модификации белков
- •Воспроизведение генетической информации
- •Репликация днк
- •Белки, участвующие в репликации днк
- •Белки, входящие в состав репликативных комплексов прокариотических и эукариотических организмов
- •Репликативная вилка e. Coli и бактериофага t4
- •Особенности функционирования репликативной вилки эукариот
- •Эукариотические днк-полимеразы и их функциональные гомологи у прокариот
- •Регуляция репликации днк
- •Инициация репликации днк у e. Coli и ее регуляция
- •Регуляция репликации плазмиды ColE1
- •Особенности репликации линейных геномов
- •Линейные хромосомы бактерий
- •Репликаторы эукариот
- •Репликация теломерных участков эукариотических хромосом
- •Пространственная организация синтеза днк у эукариот
- •Защита генетической информации
- •Мутации
- •Основные источники мутаций и методы определения мутагенной активности
- •Основные классы алкилирующих агентов
- •Метаболиты нормальной микрофлоры человека, обладающие мутагенной и канцерогенной активностями
- •Sos-мутагенез у бактерий
- •Мутаторный фенотип
- •Экспансия днк
- •Адаптивные мутации
- •Механизмы защиты генома от мутаций
- •Репарация днк
- •Основные механизмы репарации поврежденной днк
- •Эксцизионная репарация в клетках животных
- •Днк-гликозилазы и эндонуклеазы клеток микроорганизмов и человека, участвующие в ber
- •Белки животных, участвующие в ner
- •Гомологичная рекомбинация в репарации днк
- •Репарация ошибочно спаренных нуклеотидов
- •Полимераза поли(adp-рибозы) в репарации днк у эукариот
- •Альтруистичная днк
- •Парадокс возможности существования многоклеточных организмов
- •Повышение информационной стабильности генома избыточными последовательностями
- •Селективная защита генов от мутаций
- •Высокоупорядоченное расположение летальных генов на хромосомах
- •Возможный смысл парадокса с
- •Современная концепция гена
- •Часть II основные направления развития прикладной молекулярной генетики Введение
- •Часть II. Искусственные генетические системы
- •Принципы генной инженерии
- •Основные ферменты, используемые в генной инженерии
- •Рестриктазы и днк-метилазы
- •Эффективность расщепления коротких последовательностей днк некоторыми распространенными рестриктазами
- •Днк- и рнк-лигазы
- •Ферменты матричного синтеза днк и рнк
- •Частота ошибок при синтезе днк, осуществляемом термостабильными днк-полимеразами in vitro при проведении пцр в оптимальных условиях
- •Другие ферменты
- •Векторы
- •Плазмидные векторы
- •Векторы на основе фага
- •Космиды и фазмиды
- •Сверхъемкие векторы yac, bac и pac
- •Интегрирующие и челночные (бинарные) векторы
- •Конструирование экспрессирующих векторов и их функционирование
- •Векторы для переноса днк в клетки животных и растений
- •Клонотеки генов
- •Получение клонотек генов
- •Введение рекомбинантных днк в клетки
- •Методы скрининга клонотек генов
- •Эукариотические системы экспрессии рекомбинантных генов, основанные на культурах клеток
- •Клетки яичников китайских хомячков (линия cho)
- •Клетки мышиной миеломы (линия Sp2/0)
- •Клетки селезенки мышей (линия mel)
- •Клетки африканской зеленой мартышки (линия cos)
- •Клетки насекомых, зараженные бакуловирусами
- •Сравнение эффективности рассмотренных систем экспрессии
- •Бесклеточные белоксинтезирующие системы
- •Прокариотические системы
- •Эукариотические системы
- •Проточные системы
- •Другие современные методы исследования генов
- •Рестрикционное картирование генов
- •"Прогулки и прыжки по хромосомам"
- •S1-картирование рнк и днк
- •Футпринтинг
- •Стратегия выделения нового гена
- •Направленный мутагенез и белковая инженерия
- •Методы направленного получения мутаций
- •Получение делеций и вставок
- •Химический мутагенез
- •Сайт-специфический мутагенез с использованием олигонуклеотидов
- •Полимеразная цепная реакция в направленном мутагенезе
- •Белковая инженерия
- •Библиотеки пептидов и эпитопов
- •Белки-репортеры в гибридных белках
- •Гибридные токсины
- •Подходы к созданию новых ферментов
- •Субтилигаза в лигировании пептидов
- •Концепция ксенобиоза
- •Антисмысловые рнк, рибозимы и дезоксирибозимы
- •Антисмысловые рнк и олигонуклеотиды
- •Механизм действия антисмысловых рнк
- •Использование антисмысловых рнк
- •Влияние экспрессии антисмысловых рнк на фенотип трансгенных мышей
- •Природные антисмысловые рнк
- •Антисмысловые рнк и патология: возможный механизм возникновения доминантных мутаций
- •Рибозимы и дезоксирибозимы
- •Типы рибозимов
- •Свойства рибозимов
- •Рибозимы как лекарственные средства
- •Репарация мутантных рнк с помощью рибозимов, осуществляющих транс-сплайсинг
- •Дезоксирибозимы
- •Аптамеры
- •Молекулы рнк у истоков жизни
- •Молекулы рнк в качестве рнк-репликаз
- •Возможность синтеза полипептидных цепей молекулами рнк
- •Трансгенные животные и растения
- •Способы получения трансгенных многоклеточных организмов
- •Экспрессия трансгенов
- •Использование трансгенов у животных
- •Исследование механизмов экспрессии генов
- •Токсигены в исследовании дифференцировки соматических клеток в онтогенезе
- •Изменение физиологического статуса лабораторных и сельскохозяйственных животных
- •Моделирование наследственных и приобретенных заболеваний человека
- •Трансгенные растения
- •Генотерапия наследственных и приобретенных заболеваний
- •Способы доставки новых генов в геном человека
- •Управление экспрессией трансгенов в клетках-мишенях
- •Современные достижения генотерапии онкологических заболеваний
- •Ближайшие перспективы использования генотерапии
- •Успехи генотерапии в модельных экспериментах
- •Проблемы, возникающие в связи с практическим применением генотерапии
- •Днк-диагностика и днк-типирование
- •Днк-диагностика наследственных и приобретенных заболеваний
- •Получение клинического генетического материала
- •Диагностика заболеваний
- •Днк-типирование
- •Днк-типирование микроорганизмов
- •Идентификация личности на основе минисателлитной днк: определение отцовства
- •Микроматрицы и микрочипы днк
- •Методы создания микроматриц днк
- •Ограничения в использовании микроматриц днк
- •Использование микроматриц днк в фундаментальных и прикладных исследованиях
- •Картирование и определение первичной структуры генома человека
- •Основные подходы к картированию генома человека
- •Генетические карты сцепления
- •Современные методы построения генетических карт сцепления
- •Пцр в исследованиях генома человека
- •Физические карты низкого разрешения
- •Физические карты высокого разрешения
- •Определение полной первичной структуры днк генома человека
- •Базы данных получаемой информации
- •Заключение
- •Рекомендуемая литература
Рибозимы как лекарственные средства
На основании результатов рассмотренных опытов, а также других накопленных знаний о рибозимах складывалось мнение о принципиальной возможности использования рибозимов для регуляции активности конкретных генов человека. Область применения рибозимов как лекарственных средств может быть весьма широкой. В качестве возможных сфер их использования в клиниках в настоящее время рассматривают лечение вирусных инфекций, онкологических заболеваний, для которых известны продукты онкогенов, а также патологических состояний организма, вызываемых сверхэкспрессией конкретных генов.
Лечение вирусных заболеваний. Большие усилия предпринимаются для использования рибозимов в лечении СПИДа, вызываемого вирусами иммунодефицита человека (ВИЧ). Уже в 1990 г. Н. Сарвер и соавторы продемонстрировали возможность расщепления геномной ВИЧ-РНК с помощью рибозима in vitro в бесклеточной системе, что сопровождалось снижением уровня р24-антигена на 98%. Длительные эксперименты на культурах клеток показали, что клетки, экспрессирующие такие рибозимы, не изменяли своего обычного фенотипа на протяжении, по крайней мере, 9 месяцев. Одновременно с этим было показано, что клетки линии MT4, стабильно трансфецированные вектором, экспрессирующим рибозим под контролем промотора гена тимидинкиназы вируса простого герпеса, были частично устойчивы к ВИЧ-инфекции. Полностью устойчивыми к заражению ВИЧ оказались клетки, содержащие рибозим под контролем вирусного регуляторного элемента tar, в которых вирус не обнаруживали даже через 22 дня после заражения. В этих клетках высокий уровень индукции синтеза рибозима происходит как раз во время ВИЧ-инфекции. Та же самая стратегия была применена и к рибозимам, образующим структуру типа шпильки. Экспрессия гена рибозима под контролем промотора гена -актина подавляла ВИЧ-инфекцию в культивируемых клетках. При этом продукты расщепления ВИЧ-РНК в таких клетках специфически и быстро деградировали.
Еще одним подходом к преодолению ВИЧ-инфекции является отщепление 5’-концевой кэп-структуры ВИЧ-РНК с помощью рибозимов. Известно, что у большинства изолятов ВИЧ 5’-концевая лидерная последовательность их геномной РНК высококонсервативна. Из всех известных изолятов только штамм MN содержит замену одного нуклеотида в лидерной области РНК, расщепляемой рибозимом. В то же время исследованные штаммы ВИЧ различаются по другим участкам 5’-концевой лидерной последовательности. Эндонуклеазное удаление в составе олигонуклеотида 5’-концевой кэп-группы РНК ВИЧ подавляет трансляцию РНК и делает ее более доступной мишенью для внутриклеточных нуклеаз. Все имеющиеся экспериментальные данные позволяют сегодня сделать вывод о перспективности использования 5’-концевой лидерной последовательности ВИЧ-РНК в качестве мишени для рибозимов.
Основной сложностью, которую приходится преодолевать при конструировании рибозимов, расщепляющих геномную ВИЧ-РНК, является высокая мутабильность этих РНК. Из-за мутационных замен отдельных нуклеотидов в сайтах, по которым происходит расщепление РНК рибозимами, последние утрачивают свою активность по отношению к этим РНК и соответственно противовирусную активность. Новейшая стратегия в решении данной проблемы заключается в создании нескольких рибозимов, действие которых направлено против разных консервативных участков генома ВИЧ, причем отдельные рибозимы должны входить в одну молекулу рекомбинантной РНК ("метод дробовика"). Помимо последовательностей антивирусных рибозимов такие рекомбинантные РНК содержат в себе дополнительные cis-действующие рибозимы, которые осуществляют аутокаталитический процессинг предшественников антивирусных рибозимов с освобождением зрелых рибозимов, действующих на разные участки вирусного генома. Этот метод не позволяет вирусу ВИЧ избежать инактивирующего действия рибозимов путем мутационных преобразований своего генома.
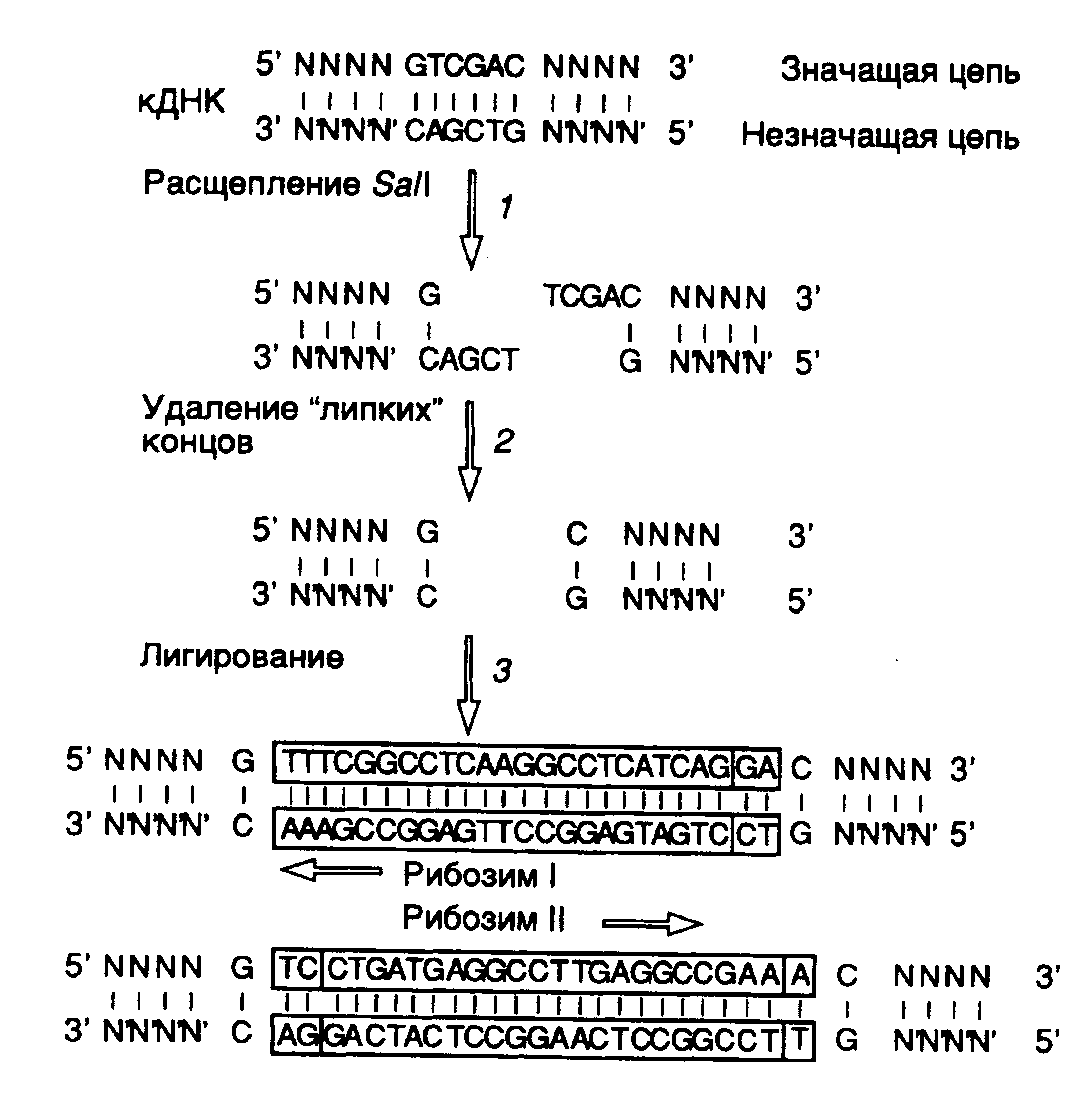
Рис. II.26. Использование сайтов рестрикции для конструирования рибозима, интегрированного в антисмысловую РНК
Недавно была получена кассета из девяти идентичных генов рибозимов, расположенных друг за другом в одном экспрессирующем векторе. Рибозимы такой "полицистронной" РНК, направленные против разных частей ВИЧ-генома, сохраняли внутри клетки свою специфичность, но были более эффективными в пересчете на одну копию РНК полирибозима и не утрачивали своей активности даже в частично деградировавших молекулах РНК.
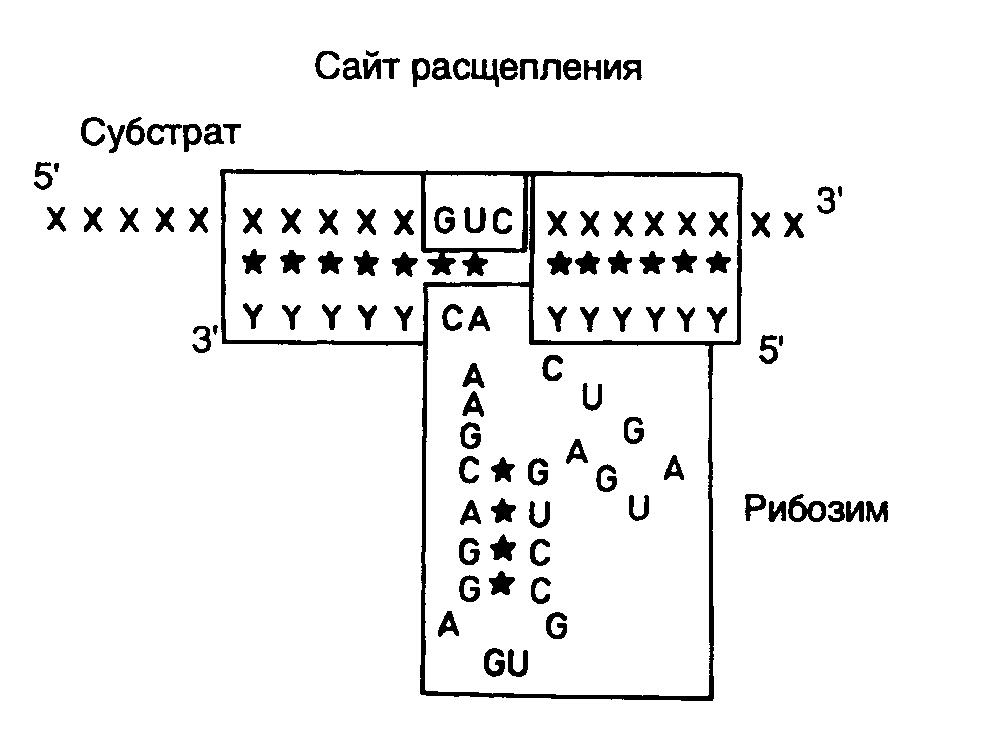
Рис. II.27. Взаимодействие рибозима с РНК-субстратом
В заключение этого раздела рассмотрим пример использования рибозимов против вирусов растений в сельском хозяйстве. Как упоминалось выше, рибозимы, образующие структуру типа "головки молотка", распознают в сайте расщепления РНК-мишени последовательности из трех нуклеотидов, рядом с которой происходит гидролиз цепи РНК. Подобными тринуклеотидами могут быть последовательности AUC, CUA, CUC, GUA, GUC, GUU и UUC. В предложенном подходе РНК-связывающий домен рибозима конструируют таким образом, что распознаваемый тринуклеотид входит в состав последовательности нуклеотидов, которая в двухцепочечной ДНК образует сайт рестрикции. Подобный подход дает возможность встраивать последовательность каталитического домена рибозима по этому сайту рестрикции в кДНК, полученную путем обратной транскрипции РНК-мишени. Следовательно, каталитический домен рибозима оказывается фланкированным последовательностями антисмысловой РНК, комплементарной РНК-мишени, которые автоматически выполняют роль РНК-связывающего домена. При таком подходе отпадает необходимость в синтезе большого числа олигонуклеотидов, и в любом необходимом случае рибозим собирается из готовых блоков. В качестве конкретного примера рассмотрим создание рекомбинантного рибозима, специфически расщепляющего РНК, содержащую последовательность сайта рестрикции SalI (рис. II.26). После расщепления кДНК рестриктазой SalI (этап 1) образовавшиеся "липкие" концы гидролизуют нуклеазой S1 (этап 2) и по образовавшимся "тупым" концам встраивают каталитический домен рибозима, заключенный в двухцепочечном фрагменте ДНК (этап 3). В результате транскрибирования такой конструкции синтезируется антисмысловая РНК, в состав которой включен каталитический домен рибозима. После гибридизации с РНК-мишенью образуется двухцепочечная молекула РНК, на одной из цепей которой формируется структура рибозима типа "головки молотка" (рис. II.27), расщепляющего РНК-мишень в строго определенном месте. Описанный подход был реализован при конструировании рибозима, направленного против геномной РНК одного из вирусов сливы. При этом были получены последовательности нуклеотидов рибозима, пригодные для использования с другими 25 сайтами рестрикции.
Подавление функционирования онкогенов. Одними из основных различий, обнаруживаемых между нормальными и раковыми клетками, являются генетические различия ряда генов, контролирующих пролиферацию. В геноме опухолевых клеток часто обнаруживают мутации в генах двух типов: онкогенах и генах-супрессорах опухолевого роста, или антионкогенах. Онкогены эволюционно консервативны и вызывают неопластическую трансформацию клеток как при ретровирусной инфекции в природных условиях (поскольку они часто бывают включены в состав генома ретровирусов), так и после введения ДНК онкогенов в культивируемые клетки с помощью трансфекции. Большинство онкогенов вначале было обнаружено именно в составе генома онкогенных вирусов, и они являются мутантными производными протоонкогенов, присутствующих в здоровых клетках многоклеточных организмов и активирующихся во время эмбриогенеза, роста клеток или регенерации тканей. Поскольку активированные онкогены в опухолевых клетках, как правило, сверхэкспрессируются и кодируемая ими РНК по своей первичной структуре отличается от РНК протоонкогенов, РНК онкогенов являются хорошей потенциальной мишенью для рибозимов.
Онкоген H-ras. Мутация в кодоне 12 гена H-ras, приводящая к замене GGCGUC, создает консенсусный сайт, по которому HH-рибозим может расщеплять мутантную мРНК. In vitro было продемонстрировано пятикратное различие в эффективности действия рибозима на мутантную H-ras-РНК и соответствующую РНК дикого типа. Получены H-ras-зависимые линии клеток, стабильно трансформированные экспрессирующим вектором, который направлял синтез HH-рибозима под контролем промотора -актинового гена. Для таких клеток характерна пониженная скорость пролиферации, сопряженная с уменьшением внутриклеточных уровней H-ras-РНК и белка р21, кодируемого этим геном. Далее рибозим экспрессировали в клетках линии EJ карциномы мочевого пузыря человека. Введение исходных клеток мышам сопровождалось их быстрой гибелью на фоне развития высокоинвазивных опухолей. В отличие от этого клоны EJ-клеток, экспрессирующих рибозим, в организме мышей обладали резко сниженным опухолевым фенотипом. Образующиеся опухоли были малоинвазивны, и наблюдалось приблизительно двукратное повышение уровня выживаемости мышей с трансплантатами. Гистологические исследования подтверждали слабую способность опухолей к метастазированию. Рибозимы в опухолях обнаруживались методом ПЦР на протяжении 86–90 дней. Таким образом, эти и ряд других экспериментов показали способность рибозимов нормализовать экспрессию активированного H-ras как in vitro, так и in vivo.
Онкоген c-fos. Как уже упоминалось в первой части книги, белковый продукт гена c-fos участвует в передаче сигнала эукариотическими клетками, вовлечен в синтез ДНК и может придавать клеткам устойчивость к противоопухолевым препаратам. Последние два свойства этого белка находят подтверждение, в частности в том факте, что при проведении лечения часто используемым противоопухолевым лекарством цисплатином (цис-диаминодихлорплатина) происходит индукция гена c-fos вслед за генами dTMP-синтазы и ДНК-полимеразы. Рибозим, разрушающий c-fos-мРНК, снижал конечный уровень экспрессии гена c-fos, приводил к повышению чувствительности опухолевых клеток к химиотерапевтическим агентам (включая цис-платину) и значительно подавлял экспрессию генов dTMP-синтазы, ДНК-полимеразы и гена металлотионеина человека hMTII-A.
Онкогены bcr/abl. Аберрантная филадельфийская хромосома образуется в результате транслокации (9;22)(q34;q11) в стволовых клетках костного мозга, что сопровождается слиянием генов bcr и abl с образованием химерного онкогена bcr/abl и развитием хронических миелоидных лейкозов (ХМЛ). Транскрипт химерного гена кодирует белок р210bcr/abl, который обладает повышенной активностью тирозинкиназы. Такие РНК и белок обнаруживаются почти у всех больных с синдромом ХМЛ, а также у 50% пациентов с острым лимфобластоидным лейкозом, у которых имеется филадельфийская хромосома. С помощью рибозимов, специфически расщепляющих последовательность химерной мРНК в месте стыковки последовательностей двух генов, удалось подавить экспрессию химерного гена bcr/abl в культивируемых клетках. Экспрессия рибозимов в культивируемых клетках вызывала снижение уровня bcr/abl-мРНК, полностью блокировала образование химерного белка р210bcr/abl и ингибировала рост клеток на 84%. Эти результаты были значительно лучше эффектов, вызываемых антисмысловыми олигонуклеотидами.
В работах других исследователей был получен рибозим, расщепляющий вышеупомянутую химерную РНК по кодону GUU, расположенному по соседству с местом стыковки последовательностей двух генов. Этот рибозим разрушал соответствующую РНК in vitro и in vivo, а также подавлял тирозинкиназную активность белка р210.
