
- •Федеральное агентство по образованию
- •Микробиология производства хлебопекарных дрожжей
- •Введение
- •1. Характеристика хлебопекарных дрожжей
- •1.1. Строение дрожжевой клетки
- •1.2. Размножение дрожжевых клеток
- •1.3. Химический состав дрожжей
- •Элементный состав сухого вещества дрожжей (массовая доля, % от св дрожжей)
- •1.4. Факторы, влияющие на метаболизм дрожжей Питательные вещества
- •Аминокислотный состав свекловичной мелассы
- •Содержание витаминов в дрожжах, их роль в обмене веществ
- •Содержание ростовых веществ в мелассе
- •Минеральные вещества
- •Ферменты
- •Физико-химические условия
- •Количество вредных веществ, влияющее на рост и размножение дрожжей
- •2. Ведение коллекции штаммов хлебопекарных дрожжей
- •2.1. Определение видовой принадлежности дрожжей
- •2.2. Микробиологический анализ музейных культур
- •2.3. Изучение производственной ценности культур дрожжей
- •2.4. Промышленные штаммы хлебопекарных дрожжей
- •Характеристика промышленных штаммов хлебопекарных дрожжей
- •Паспорт штамма хлебопекарных дрожжей
- •4. Автор или авторский коллектив
- •6. Способ хранения штамма и состав среды:
- •7. Культурально-морфологические особенности:
- •8. Физиолого-биохимические особенности:
- •10. Технологические показатели:
- •11. Особые свойства:
- •Устойчивость дрожжей разных штаммов к мелассе
- •3. Оценка физиологического состояния дрожжей в процессе размножения
- •3.1. Количество почкующихся клеток
- •3.2. Размеры дрожжевых клеток
- •3.3. Количество нежизнеспособных клеток
- •3.4. Характер зернистости клеток
- •3.5. Особенности роста дрожжей
- •4. Микроорганизмы-контаминанты дрожжевого производства
- •4.1. Бактерии
- •Бактерии группы кишечной палочки
- •4.2. Посторонние дрожжи
- •Аспорогенные дрожжи
- •Спорообразующие дрожжи
- •4.3. Мицелиальные грибы
- •5. Влияние посторонней микрофлоры на выход и качество пекарских дрожжей
- •5.1. Влияние бактерий на дрожжи
- •5.2. Влияние посторонних дрожжей на пекарские дрожжи
- •Ферментация некоторых углеводов различными видами диких дрожжей
- •5.3. Влияние мицелиальных грибов на качество дрожжей
- •6. Пути попадания посторонних микроорганизмов в дрожжевое производство
- •6.1. Микрофлора мелассы
- •6.2. Микрофлора солей
- •6.3. Микрофлора воды
- •Нормативные показатели безопасности питьевой воды
- •6.4. Микрофлора воздуха
- •Основные представители микрофлоры воздуха
- •6.5. Микрофлора оборудования
- •7. Методы выявления посторонних микроорганизмов в различных объектах дрожжевого производства
- •7.1. Выявление посторонних микроорганизмов в дрожжах
- •Микробиологические показатели
- •7.2. Микробиологический контроль мелассы
- •7.3. Микробиологический контроль воздуха
- •7.4. Периодичность проведения микробиологического анализа объектов дрожжевого производства
- •Периодичность проведения микробиологических анализов
- •8. Способы предотвращения контаминации дрожжевого призводства
- •8.1. Обеспложивание мелассы
- •8.2. Асептические условия выращивания дрожжей на лабораторных стадиях
- •8.3. Стерилизация микробиологических инструментов, посуды и материалов
- •Продолжительность стерилизации посуды различной вместимости
- •8.4. Стерилизация питательных сред
- •Зависимость температуры от давления пара в автоклаве
- •Температура плавления и цвет химических веществ-индикаторов
- •8.5. Правила работы в микробиологической лаборатории
- •8.6. Основные приемы работы с культурой дрожжей лаборатории
- •8.7. Очистка технически чистой культуры дрожжей от бактерий
- •8.8. Обеззараживание воды
- •8.9. Обеззараживание сжатого воздуха
- •8.10. Способы снижения микробной контаминации воздуха производственных помещений
- •Режимы стерилизации резервуаров различного объема
- •Режимы дезинфекции помещений
- •8.11. Предотвращение развития мицелиальных грибов
- •Режимы применения полигуанидинов
- •9. Мойка производственного оборудования
- •9.1. Виды мойки
- •9.2. Механические аспекты мойки
- •9.3. Моющие средства
- •Щелочные моющие средства
- •Кислотные моющие средства
- •Характеристика моющих средств
- •РН моющих средств
- •Препараты для пенной мойки
- •Препараты для пенной мойки оборудования
- •10. Дезинфекция оборудования и коммуникаций
- •10.1. Механизм действия дезинфицирующих веществ на микробную клетку
- •Механизм действия дезинфицирующих веществ
- •Характеристика дезинфицирующих средств
- •Воздействие на микроорганизмы некоторых дезинфицирующих веществ
- •10.2. Дезинфицирующие препараты
- •11. Средства, сочетающие моющий и дезинфицирующий эффекты
- •11.1. Хлорсодержащие препараты
- •11.2. Щелочные средства
- •Моющие и дезинфицирующие щелочные средства
- •11.3. Средства для кислотной мойки и дезинфекции
- •12. Порядок санитарной обработки оборудования
- •12.1. Асептические мероприятия на стадии выращивания технически чистой культуры дрожжей
- •Продолжительность обработки оборудования
- •12.2. Обработка аппаратов для выращивания коммерческих дрожжей
- •Режим санитарной обработки товарных аппаратов
- •12.3. Аппараты для приготовления и подачи растворов мелассы и минеральных солей
- •Продолжительность санитарной обработки
- •12.4. Санитарная обработка сборников дрожжевого концентрата
- •Продолжительность санитарной обработки сборников дрожжевого концентрата
- •12.5. Кларификаторы (сепараторы растворов мелассы)
- •12.6. Сепараторы для дрожжей
- •12.7. Вакуум-фильтры
- •12.8. Трубопроводы
- •14. Контроль микробиологической чистоты оборудования
- •14.1. Традиционные методы контроля
- •Последовательность проверки чистоты оборудования и коммуникаций
- •14.2. Современные методы контроля
- •15. Возможные риски контаминации дрожжевого производства
- •Порядок микробиологического анализа при выявлении источников инфекции в производстве пекарских дрожжей
- •16. Санитарно-гигиенические требования к дрожжевому предприятию
- •16.1. Санитарные требования к территории
- •16.2. Требования к производственным зданиям
- •Требования к освещению
- •Требования к отоплению и вентиляции
- •Санитарные требования к водоснабжению и канализации
- •16.3. Санитарные требования к производственному оборудованию и технологическому процессу
- •16.4. Санитарные требования к сырью и условиям его хранения
- •16.5. Требования к готовой продукции, ее хранению и транспортировке
- •16.6. Требования к хранению моющих и дезинфицирующих средств
- •16.7. Правила личной и производственной гигиены работников дрожжевых предприятий
- •16.8. Ответственность за соблюдение санитарных правил
- •17. Питательные среды для выявления посторонних микроорганизмов
- •17.1. Приготовление питательных сред
- •Индикаторы рН для питательных сред
- •Условия и сроки хранения лабораторных сред
- •Список литературы
- •Содержание
- •Микробиология производства хлебопекарных дрожжей
10. Технологические показатели:
а) выход биомассы (% от мелассы с 46 % сахара) на стадии:
– получения чистой культуры дрожжей – 90–93 %;
– получения товарных дрожжей – 95–97 %;
б) подъемная сила, мин – 40–45;
в) мальтазная активность, мин – 140–160;
г) содержание трегалозы, % от сухих веществ – 10–12;
д) стойкость дрожжей, ч – свыше 120
11. Особые свойства:
Штамм предназначен для выпуска прессованных дрожжей, используемых в классических (опарных) технологиях приготовления теста, а также для получения замороженных полуфабрикатов и хлебобулочных изделий.
Устойчивость дрожжей разных штаммов к мелассе
Принцип этого метода заключается в определении степени чувствительности дрожжей производственной расы к вредным веществам мелассы или к недостатку в мелассе каких-либо питательных веществ. Сущность метода состоит в том, что дрожжи исследуемой культуры засевают в стерильный раствор мелассы с содержанием 5 % сухих веществ. Пересев дрожжей в свежий раствор мелассы проводят ежесуточно после предварительного подсчета количества клеток дрожжей. Критерием является количество пересевов, которое способны выдержать дрожжи на данной мелассе. На мелассе нормального состава дрожжи одного штамма выдерживают 6 пересевов, на мелассе других составов – меньше.
Для приготовления раствора мелассы 25–30 г мелассы разводят водой до содержания сухих веществ 5 %, разливают в пробирки по 10 см3 и стерилизуют при 121 С в течение 20 мин.
Исследуемую культуру дрожжей с косого агара засевают в жидкое солодовое сусло, содержащее 8 % сухих веществ, инкубируют при 30 С в течение 24 ч. Затем в условиях стерильности сливают сусло, отбирают пипеткой осадок и вносят одну каплю в пробирку с мелассой. Через 24 ч инкубирования содержимое пробирки перемешивают, каплю суспензии выросших дрожжей переносят во вторую пробирку с раствором мелассы и т. д. Одновременно под микроскопом подсчитывают количество дрожжей, выросших в растворе мелассы. При наличии роста в поле зрения может находиться 4–5 клеток, при хорошем росте – 20–30 клеток.
3. Оценка физиологического состояния дрожжей в процессе размножения
Хлебопекарные дрожжи в процессе роста и размножения находятся под воздействием разнообразных условий: изменение качественного и количественного состава питательных веществ, а также физико-химических параметров. Кроме того, в производственных условиях на дрожжи могут оказывать влияние нарушения технологического режима, посторонние микроорганизмы.
Изменение условий культивирования, вызванное любой из перечисленных причин, приводит к физиологическим изменениям в дрожжевой клетке, которые могут отражаться на интенсивности дыхания, брожения, размножения, синтеза различных метаболитов, в том числе и резервных соединений.
В связи с тем, что физиологическая перестройка сопряжена с морфологическими изменениями клеток, такая зависимость дает возможность по морфологии оценивать физиологическое состояние дрожжей.
Морфология клеток является очень важным показателем для оценки процесса культивирования дрожжей. При размножении в различных стадиях (анаэробная, слабо аэробная, аэробная) и фазах роста (лаг-фаза, фаза логарифмического роста, стационарная, фаза отмирания) клетки претерпевают различные морфологические изменения. Изменяется форма, размеры, количество почкующихся и мертвых клеток, состояние протоплазмы (форма и размер вакуоли, зернистость), толщина клеточной оболочки. Оценка морфологии дрожжей дает возможность оперативно охарактеризовать правильность проведения производственного процесса и при необходимости провести его корректировку.
Для оценки физиологического состояния дрожжей используют светлопольную микроскопию, позволяющую исследовать объекты в проходящем свете. Препарат для микроскопирования готовят на предметном стекле толщиной не более 1,4 мм. Покровные стекла обычно используют размером 14 14 и 18 18 мм и толщиной 0,15–0,17 мм. Стекла тщательно очищают кипячением в мыльной дистиллированной воде или в 1 %-м растворе соды в течение 10–20 мин, затем ополаскивают водой и сушат или протирают мягкой полотняной тканью. Предметные стекла хранят сухими, покровные – в 95 %-м спирте или в смеси спирта и эфира (1:1) в банках с притертыми пробками. Стекла следует вынимать пинцетом. Перед использованием их необходимо слегка обжечь над пламенем горелки. Приготовленный препарат просматривают под микроскопом при увеличении в 400–600 раз. При ориентировочном подсчете в нескольких полях зрения (около 10) препарата подсчитывают 100–200 клеток и среди них определяют численность почкующихся, мертвых, крупных, мелких клеток.
Более точное определение числа различных клеток в 1 см3 жидкости можно получить при использовании счетной камеры (Горяева– Тома). Для этого камеру покрывают покровным стеклом и притирают его к боковым пластинкам камеры до образования радужных колец Ньютона. Покровное стекло притирают для того, чтобы высота слоя исследуемой жидкости в камере h была 0,1 мм. Точность определения количества микробных клеток зависит от того, насколько плотно покровное стекло прилегает к поверхности камеры. Затем каплю исследуемой суспензии после тщательного перемешивания помещают под покровное стекло, после чего счетную камеру кладут на столик микроскопа и находят в поле зрения сетку. Легче ее находить при увеличении в 400 раз (окуляр 10, объектив 40). При таком увеличении в поле зрения микроскопа помещается один большой квадрат, состоящий из 16 маленьких квадратов (рис. 3.1).
Подсчитывают все клетки, находящиеся внутри большого квадрата, а также на пограничных линиях, если клетки больше чем наполовину находятся в данном квадрате. Если клетки пересекаются пограничной линией пополам, то их считают только на двух смежных сторонах квадратов, например, правой и верхней.
В каждом препарате подсчитывают клетки в пяти больших квадратах, например, по углам и в центре сетки. Так как в слишком густых суспензиях клетки считать трудно, их следует разбавлять водой и пользоваться такими разведениями, при которых количество клеток в одном большом квадрате будет не более 30. Для того, чтобы результат подсчета был достоверен, необходимо сосчитать не менее 600 клеток.
б
а
в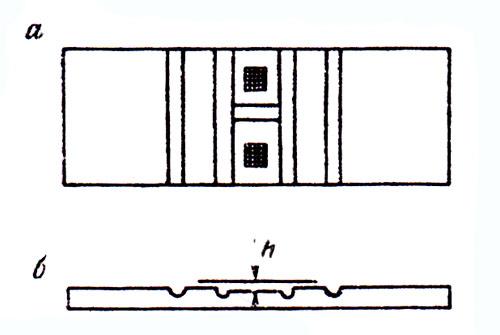
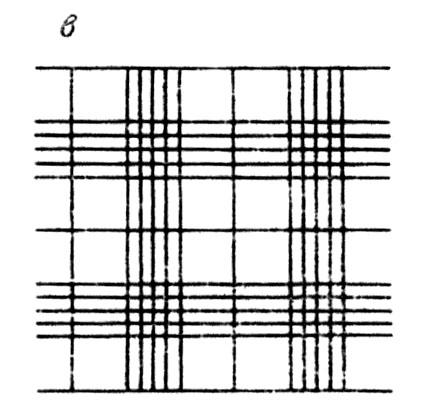
Рис. 3.1. Счетная камера Горяева – Тома: а – вид сверху; б – вид сбоку; в – вид при малом увеличении микроскопа в 400 раз
Объем одного большого квадрата во всех счетных камерах равен 1/250 мм3, следовательно, объем 5 квадратов равен 5/250 или 1/50 мм3. Чтобы определить количество клеток в 1 см3 (в 1000 мм3) исследуемой суспензии, нужно среднюю сумму количества клеток в пяти больших квадратах умножить на 50 000.
Число клеток дрожжей в 1 см3 суспензии (Х) удобно определять по формуле
Х = А 50000 В,
где А – сумма клеток пяти больших квадратов; В – разведение суспензии дрожжей; 50000 – коэффициент пересчета объема пяти больших квадратов на 1 см3.
Полученные данные выражают в млн/см3.
Для подсчета общего количества клеток культур дрожжей, образующих конгломераты, рекомендуется в исследуемую пробу добавлять равное количество 10 %-й серной кислоты и тщательно перемешать для разъединения скопления клеток. Подсчитывая результаты, следует учитывать разбавление вдвое.
