
- •«Ярославская государственная медицинская академия
- •Содержание учебно-методического комплекса
- •Министерство здравоохранения Российской Федерации
- •Оглавление
- •Введение
- •Пояснительная записка.
- •Непрерывное последипломное профессиональное образование по специальности «анестезиология-реаниматология»
- •Консультирование
- •Повышение_квалификации и_подготовка кадров
- •Врач анестезиолог-реаниматолог Первая квалификационная категория
- •Социальная гигиена и организация здравоохранения
- •По специальности
- •Консультирование
- •Повышение квалификации и подготовка кадров
- •Врач анестезиолог-реаниматолог Вторая квалификационная категория
- •Социальная гигиена и организация здравоохранения
- •По специальности
- •Перечень практических навыков по специальности анестезиология-реаниматология
- •Методические рекомендации по преподаванию специальности анестезиология-реаниматология
- •2. Сроки освоения программ послевузовской профессиональной подготовки.
- •Пластическая хирургия
- •Практические навыки
- •Эволюционный формуляр
- •Учебная программа
- •Фармакология
- •Анатомия
- •Биохимия
- •Математика
- •Классификация, рестриктивные нейрологические
- •Сердечно-сосудистая система
- •Премедикация
- •Микроклимат операционной
- •Обеспечение проходимости дыхательных путей
- •Приобретенные пороки сердца и гипертрофическая кардиомиопатия
- •Оценка функции почек
- •Реанимация и интенсивная терапия
- •Принципы лечения кровотечения в послеоперационном периоде.
- •Государственного стандарта послевузовской
- •Профессиональной подготовки специалистов с
- •Высшим медицинским образованием
- •2. Предшествующим уровнем образования для послевузовской
- •3. Общие требования к стандартам послевузовской профессиональной подготовки специалистов с высшим медицинским образованием.
- •4. Требования к обязательному минимуму содержания стандартов послевузовской профессиональной подготовки специалистов с высшим медицинским образованием.***
- •9. Требования к уровню профессиональной подготовленности
- •10.Требования к государственной итоговой аттестации.
- •1. Общие положения.
- •2. Структура, состав и содержание умк.
- •3. Порядок рассмотрения и утверждения умк.
- •Положение
- •Текущий и рубежный контроль учебных достижений
- •Промежуточная аттестация
- •Положение о клинической ординатуре в ярославской государственной медицинской академии Ярославль – 2008
- •I. Общая часть
- •II. Организация обучения в ординатуре
- •III. Права и обязанности врачей ординаторов
- •IV. Целевая клиническая ординатура
- •Учебный план послевузовской профессиональной подготовки специалистов в клинической ординатуре по специальности "Анестезиология и реаниматология"
- •Учебно-тематический план послевузовской профессиональной подготовки в клинической ординатуре по специальности "Анестезиология и реаниматология
- •Учебный план послевузовской профессиональной трехлетней подготовки специалистов в клинической ординатуре (первичная специализация) по специальности "Анестезиология и реаниматология"
- •Ярославская государственная медицинская академия
- •Учебно-методическая карта дисциплины
- •Модульная карта дисциплины
- •Модуль № 1 «Анестезиология и реаниматология в абдоминальной хирургии»
- •Модуль № 2 «Анестезиология и реаниматология в сосудистой и пластической хирургии»
- •Модуль № 3 «Анестезиология и реаниматология в акушерстве и гинекологии»
- •Модуль № 4 «Анестезиология и реаниматология в торакальной и кардиохирургии»
- •Модуль № 5 «Анестезиология и реаниматология в травматологии и ортопедии»
- •Модуль № 6 «Анестезиология и реаниматология в педиатрии и неонатологии»
- •Модуль № 7 «Анестезиология и реаниматология в хирургии головы и шеи»
- •Модуль № 8 «Анестезиология и реаниматология в эндоскопической хирургии и урологии»
- •Модуль № 9 «Интенсивная терапия критических состояний (общая реаниматология)»
- •Модуль № 10 «Анестезиология и реаниматология в условиях центральной районной больницы (практика)»
- •А. Предаттестационные баллы
- •Б. Аттестационные баллы
- •В. Дополнительные баллы
- •Положение об итоговой аттестации клинических ординаторов.
- •Кафедра анестезиологии и реаниматологии с курсом фпдо
- •Фамилия Имя Отчество _____________________________________
- •Задано вопросов ________ Всего утверждений ________Дано ответов _______
- •% Правильных _____________ % эффективности __________ % результ. _________
- •Экзамен по практическим навыкам
- •Устное собеседование
- •Список литературы для клинических ординаторов и врачей
- •Периодические издания
- •Учебные пособия
- •Федерального агентства по здравоохранению
- •Введение
- •Анатомо-физиологические особенности организма ребенка с точки зрения анестезиолога
- •Сосудистый доступ
- •Особенности инфузионной терапии
- •Новорожденные:
- •Обеспечение проходимости дыхательных путей и интраоперационная ивл
- •Внутренний диаметр (мм)
- •Клиническая фармакология
- •Проведение анестезии
- •Ларингоспазм
- •Постинтубационный круп
- •Профилактика гипотермии
- •Анестезия при отдельных заболеваниях
- •Послеоперационное обезболивание
- •Список литературы
- •Федерального агентства по здравоохранению
- •Ярославль, 2006
- •Оглавление
- •Введение
- •Виды нарушений при оказании медицинской помощи.
- •2. Основы законодательства Российской Федерации в здравоохранении.
- •Основы законодательства Российской Федерации при оказании анестезиологической и реаниматологической помощи населению
- •Гражданская ответственность за профессиональные правонарушения
- •Возмещение морального вреда
- •Практика привлечения к ответственности
- •Правонарушения
- •6. Приложения Приложение 1 Заявление об информированном согласии на операцию в условиях общей анестезии
- •Я, пациент (законный представитель),_____________
- •Обоснование медицинского вмешательства без согласия нациента
- •Подписи членов консилиума или дежурного (лечащего) врача __________________________________________________________
- •Приложение 3 Заявление об информированном отказе от операции и анестезии
- •Я, пациент (законный представитель),_________________
- •Отказывается от __________________________________________
- •Зам. Главного врача _________________________________
- •7. Список законодательных и нормативно-правовых актов, использованных в учебном пособии
- •8. Список литературы
- •Федерального агентства по здравоохранению
- •«Ярославская государственная
- •Оглавление
- •Введение
- •Диагностика
- •Алгоритм реанимационных мероприятий
- •В: искусственная вентиляция легких
- •Особые ситуации
- •2. Гипотермия
- •Электромеханическая диссоциация
- •Осложнения слр
- •Показания для прекращения реанимации
- •Приложение:
- •Сердечно-легочная реанимация специализированной бригадой
- •(Стандарт действий)
- •Военно-медицинская академия Санкт-Петербург
- •«Ярославская государственная
- •Оглавление
- •Введение
- •Принципы классификации отравлений
- •Общая характеристика токсического действия ядов на организм
- •Клинические синдромы острых отравлений
- •2. Токсическое поражение сердечно-сосудистой системы.
- •3. Токсическое поражение дыхательной системы.
- •Общие принципы диагностики острых отравлений
- •Формулировка диагноза острых отравлений
- •Детоксикация организма при острых отравлениях
- •1. Сорбционные:
- •2. Диализные и фильтрационные:
- •3. Аферетические:
- •4. Физио и химиогемотерапия при сочетанном применении.
- •1. Магнитная гемотерапия.
- •3. Лазерная гемотерапия
- •Список литературы
- •Федерального агентства по здравоохранению
- •Оглавление
- •Введение Актуальность проблемы
- •Определения основных понятий
- •Предоперационная оценка, подготовка и анестезия у больного с травмой Оценка состояния пациента
- •Защита дыхательных путей
- •Мониторинг пациентов с травмами
- •Инфузионная терапия
- •Премедикация, индукция и поддержание анестезии
- •Алгоритм работы анестезиолога-реаниматолога при поступлении больного с травмой
- •Анестезия при операциях на стопе и кисти
- •Анестезия при травматических повреждениях костей таза
- •Анестезия при травмах органов живота
- •Анестезия при травме позвоночника и спинного мозга
- •Анестезия при ожоговой травме
- •Анестезия при тотальном эндопротезировании тазобедренного сустава
- •Анестезия при операциях по поводу переломов проксимального конца бедренной кости
- •Анестезия при тотальном эндопротезировании коленного сустава
- •Анестезия при артроскопических операциях
- •Федерального агентства по здравоохранению
- •Оглавление
- •1. Введение
- •1.1. Актуальность проблемы
- •1.2. Определения основных понятий
- •1.3. Последствия нутритивной (белково-энергетической) недостаточности
- •1.4. Цели, принципы и результаты нутритивной поддержки
- •Основные принципы проведения нутритивной поддержки
- •1.6. Показания к нутритивной поддержке
- •2. Оценка нутритивного статуса
- •2.1. Определения степени и выраженности белково-энергетической недостаточности
- •2.2. Определение энергопотребности
- •Дыхательный коэффициент (rq)
- •2.3. Определение потребности в основных нутриентах
- •2.4. Определение потребности в питательных веществах Потребность в белках
- •Потребность в углеводах
- •Потребность в жирах
- •Потребности в основных микронутриентах
- •3. Парентеральное питание
- •3.1. Показания к проведению парентерального питания
- •3.2. Противопоказания к проведению парентерального питания
- •3.3. Классификация компонентов парентерального питания
- •I Донаторы пластического материала
- •II Донаторы энергии:
- •Рекомендуемые дозировки углеводов
- •Три поколения жировых эмульсий
- •Рекомендуемые дозировки липидов
- •Растворы кристаллических аминокислот
- •Общие рекомендации по дозировке аминокислот
- •3.6. Правила проведения парентерального питания
- •Двух и трехкомпонентные мешки (методика «Все в одном»)
- •3.8. Осложнения парентерального питания
- •4. Энтеральное питание
- •4.1. Эффекты сбалансированного энтерального питания
- •4.2. Абсолютные противопоказания
- •4.3. Точки приложения энтеральной поддержки
- •(Назодуоденального) зонда и уход за ним.
- •Пути осуществления доступа для энтерального питания
- •4.4. Характеристика сред для энтерального питания
- •Стандарт качества современной энтеральной смеси:
- •Классификация современных энтеральных смесей
- •Варианты энтерального питания:
- •4.6. Пероральное энтеральное питание
- •Правила приема гиперкалорических энтеральных диет:
- •Показания к применению пероральных диет в хирургии
- •Основные эффекты гиперкалорической пероральной нутритивной терапии
- •4.7. Зондовое энтеральное питание
- •4.8. Осложнения энтерального питания и их профилактика
- •1.Механические
- •2. Желудочно- кишечные (неаспирационные)
- •4.9. Синдром кишечной недостаточности при критических состояниях и принципы его коррекции
- •5. Система стандартных лечебных диет
- •Система стандартных диет
- •Характеристика и состав стандартных диет
- •6. Специализированные продукты питания
- •7. Оценка эффективности нутритивной поддержки
- •9. Алгоритм нутритивной поддержки
- •1 Этап - стартовая терапия:
- •Нутритивной поддержки
- •Шаг 5. Нутритивная поддержка не проводится в следующих случаях:
- •10. Фармакоэкономическое
- •11. Список литературы
- •Квалификационный экзамен Раздел «Фундаментальные основы специальности»
- •Квалификационный экзамен Раздел «Фундаментальные основы специальности»
- •Квалификационный экзамен Раздел «Фундаментальные основы специальности»
- •Квалификационный экзамен Раздел «Фундаментальные основы специальности»
- •Квалификационный экзамен Раздел «Фундаментальные основы специальности»
- •Квалификационный экзамен Раздел «Фундаментальные основы специальности»
- •Квалификационный экзамен Раздел «Фундаментальные основы специальности»
- •Квалификационный экзамен Раздел «Клиническая анестезиология»
- •Квалификационный экзамен Раздел «Клиническая анестезиология»
- •Квалификационный экзамен Раздел «Клиническая анестезиология»
- •Квалификационный экзамен Раздел «Клиническая анестезиология»
- •Квалификационный экзамен Раздел «Клиническая анестезиология»
- •Квалификационный экзамен Раздел «Клиническая анестезиология»
- •Квалификационный экзамен Раздел «Клиническая анестезиология»
- •Квалификационный экзамен Раздел «Клиническая реаниматология»
- •Квалификационный экзамен Раздел «Клиническая реаниматология»
- •Квалификационный экзамен Раздел «Клиническая реаниматология»
- •Квалификационный экзамен Раздел «Клиническая реаниматология»
- •"Клинические случаи в анестеЗиологии"
- •Рид а.П., Каплан Дж.А.
- •Перевод с английского –м. Медицина, 1995 г.
- •Ситуационные задачи.
- •Тестовые задания порубежного контроля
- •1. Социальная гигиена является наукой, изучающей
- •Раздел 12
- •Раздел 13
- •Раздел 14
- •Раздел 16
- •Раздел 20
- •Раздел 24
- •Раздел 12 АнестезиЯ, реанимациЯ и интенсивнаЯ терапиЯ в нейрохирургии и патологии нервной системы
- •Раздел 13 АнестезиЯ и интенсивнаЯ терапиЯ при заболеваниЯх эндокринной системы
- •Раздел 14
- •АнестезиЯ и интенсивнаЯ терапиЯ
- •При операциЯх у больных
- •С сопутствующими заболеваниЯми
- •Раздел 16 АнестезиЯ, интенсивнаЯ терапиЯ и реанимациЯ в акушерстве и гинекологии
- •Раздел 20 РеанимациЯ и интенсивнаЯ терапиЯ у детей
- •Раздел 24 Основы радиационной медицины
- •Образцы тестовых вопросов прИведены
- •Вопросы к контрольно – семинарским занятиям «Анестезия в плановой абдоминальной хирургии»
- •«Анестезия в экстренной абдоминальной хирургии»
- •«Наркозно – дыхательная аппаратура»
- •Особенности анестезии при сопутствующем сахарном диабете
- •«Анестезия при эндоскопических операциях. Амбулаторная анестезия. Анестезия в стоматологии и оториноларингологии»
- •«Ит в послеоперационном периоде»
- •«Искусственная вентиляция легких в реаниматологии»
- •«Острые отравления и методы детоксикации»
- •«Осложнения катетеризации центральных вен.»
- •«Плановая анестезиология»
- •«Экстренная анестезиология»
- •«Методы реаниматологии».
- •«Интенсивная терапия»
8. Список литературы
1.Балло А.М. Права пациентов и ответственность пациентов за причиненный вред. СПб, БиС, 2001.
2. Леонтьев О.В. Нарушение норм уголовного права в медицине. СПб, Специалист, 2002
3. Сергеев Ю.Д. Неблагоприятный исход оказания медицинской помощи. М., 2001
4. Старченко А.А. Юридическая ответственность анестезиологов-реаниматологов за профессиональные правонарушения. СПб, Диалог, 2001
5. Старченко А.А. Правовые основы деятельности в экстренной анестезиологии и реаниматологии. Вестник интенсивной терапии, 2005, №6, СС.97-99.
6. Хапий Х.Х Правовые аспекты деятельности врача. М., Интел Тек, 2003
Государственное образовательное учреждение
высшего профессионального образования
«ЯРОСЛАВСКАЯ ГОСУДАРСТВЕННАЯ
МЕДИЦИНСКАЯ АКАДЕМИЯ
Федерального агентства по здравоохранению
и социальному развитию»
Кафедра анестезиологии и реаниматологии
с курсом ФПК и ППСЗ
П.А.Любошевский, А.В.Забусов
СПИНАЛЬНАЯ И ЭПИДУРАЛЬНАЯ
АНЕСТЕЗИЯ
В ПЕРИОПЕРАЦИОННОМ ПЕРИОДЕ
У ХИРУРГИЧЕСКИХ БОЛЬНЫХ
(Учебное пособие
для клинических ординаторов и врачей)
Ярославль, 2006
УДК: 616–009.614 + 617–089
ББК: 54.5
Спинальная и эпидуральная анестезия в периоперационном периоде у хирургических больных - Учебное пособие для клинических ординаторов и врачей, Ярославль, 2006, 40 с., ил.
Авторы:
П.А.Любошевский – ассистент кафедры анестезиологии и реаниматологии Ярославской государственной медицинской академии, кандидат медицинских наук.
А.В.Забусов – заведующий кафедрой анестезиологии и реаниматологии Ярославской государственной медицинской академии, доцент, кандидат медицинских наук, главный специалист Департамента здравоохранения и фармации Администрации Ярославской области.
Рецензент:
А.М.Овечкин, профессор кафедры анестезиологии и реани-матологии Московской медицинской академии им. И.М.Сеченова
В пособии изложены современные представления о клинической эффективности регионарных методов анестезии - спинальной и эпидуральной анестезии. Представлены современные данные по клинической анатомии и клинической фармакологии. Изложена методология проведения спинальной и эпидуральной анестезии, меры профилактики наиболее распространенных осложнений.
Настоящее учебное пособие составлено на кафедре анестезиологии и реаниматологии с курсом ФПК и ППСЗ Ярославской государственной медицинской академии и предназначено для клинических ординаторов и врачей – анестезиологов-реаниматологов.
Рекомендовано к изданию: методическим советом Академии по последипломному образованию.
Протокол № 2 от 15 февраля 2006 г.
Разрешено к печати: центральным координационно-методическим советом и редакционно-издательским советом Академии.
Ярославль, 2006
СОДЕРЖАНИЕ
|
Введение ………………………………………………………….. |
4 |
|
Основы клинической анатомии спинного мозга и его оболочек ……………………………………………………. |
6 |
|
Основы клинической фармакологии местных анестетиков …... |
9 |
|
Показания и противопоказания к спинальной и эпидуральной анестезии ………………………………………………………….. |
14 |
|
Подготовка к проведению регионарной анестезии ……………. |
16 |
|
Профилактика и лечение артериальной гипотензии …………... |
17 |
|
Эпидуральная анестезия …………………………………………. |
19 |
|
Эпидуральная аналгезия в послеоперационном периоде ……... |
25 |
|
Спинальная анестезия ……………………………………………. |
30 |
|
Сравнительная характеристика спинальной и эпидуральной анестезии ……………………………………….. |
36 |
|
Спинально – эпидуральная анестезия …………………………... |
38 |
|
Литература ………………………………………………………... |
39 |
ВВЕДЕНИЕ
В последние годы существенно возрос интерес к проблеме адекватности анестезии и послеоперационного обезболивания, что связано с появлением современных методов анестезии и аналгезии, осознанием роли адекватного обезболивания в послеоперационной реабилитации пациентов, особенно высоких степеней риска. Проведенное в 1990 г. в Великобритании мультицентровое исследование качества послеоперационного обезболивания, принесло ошеломляющие результаты: адекватность аналгезии, по субъективным оценкам пациентов, не превышала 50%.
Современные методики общей анестезии при травматичных оперативных вмешательствах не обеспечивают адекватной защиты структур ЦНС от интраоперационной боли, что создает предпосылки для развития выраженного стресс-ответа и формирования хронических болевых синдромов. Для адекватной послеоперационной аналгезии применение больших доз наркотических аналгетиков ограничено, особенно у больных с сопутствующей патологией и пожилых.
Эндокринный, метаболический и воспалительный ответы на операционную травму определяют совокупность патофизиологических изменений, именуемую хирургическим стресс-ответом. Одним из наиболее мощных пусковых механизмов стресс-ответа является послеоперационная боль, активирующая вегетативную нервную систему и вызывающая ряд серьезных расстройств функционирования внутренних органов и систем. В настоящее время хорошо доказан патогенный характер развернутого хирургического стресс-ответа, способствующего раззвитию послеоперационных хирургических и соматических осложнений и удлиняющего время реабилитации пациентов.
Многие авторы подчеркивают, что одним из наиболее важных факторов, вызывающих дисфункцию сердечно-сосудистой, дыхательной, пищеварительной, мочевыделительной систем в послеоперационном периоде, является активация вегетативной нервной системы на фоне болевого синдрома. Гиперактивация симпатической нервной системы считается одной из главных причин развития гиперкоагуляционного синдрома и реологических нарушений в послеоперационном периоде. Активация симпатической нервной системы может спровоцировать ишемию миокарда, особенно у больных со сниженными функциональными резервами сердечно-сосудистой системы. Следовательно, адекватное лечение болевого синдрома и торможение симпатической активности в интра- и послеоперационном периоде являются важными факторами профилактики кардиальных осложнений.
В связи с этим большой интерес представляет использование эпидуральной аналгезии в комплексе упреждающей аналгезии (preemptive analgesia), направленной на предотвращение развития индуцированных хирургической травмой изменений функциональной активности спинальных нейрональных структур.
Одним из ключевых моментов упреждающей аналгезии является выбор метода анестезии во время операции. На основании современных клинических и экспериментальных исследований установлено, что общая анестезия, устраняя перцепцию боли, не обеспечивает блокаду прохождения ноцицептивных импульсов даже на супрасегментарном уровне, не говоря уже о спинальном уровне. Общая доза опиоидных аналгетиков, введенных в системный кровоток, не обеспечивает достаточной блокады опиатных рецепторов задних рогов спинного мозга. Незащищенный спинной мозг во время операции подвергается мощной бомбардировке повреждающими стимулами, что вызывает пластические изменения ЦНС, способствующие формированию развернутого стресс-ответа и формированию хронического послеоперационного болевого синдрома. Таким образом, степень адекватности анестезии во многом определяется качеством защиты спинного мозга. Поэтому регионарная анестезия с полной блокадой афферентной ноцицептивной импульсации явлется важнейшим компонентом интраоперационной защиты.
Послеоперационная длительная эпидуральная аналгезия является методом выбора у пациентов, перенесших торакальные, абдоминальные, обширные урологические, ортопедические операции, реконструктивные вмешательства на брюшной аорте. Особенно нуждаются в ней больные с высоким риском развития легочных и кардиальных осложнений.
Современные доказательные данные свидетельствуют о высокой эффективности регионарных методов анестезии в защите организма от хирургического стресса, что сопряжено со значительным снижением частоты периоперационных осложнений, в первую очередь, кардиальных, тромбо-эмболических и респираторных, а также снижением летальности в целом. Так, в систематическом обзоре (Rodgers A. et al., 2000), обобщающем результаты 35 рандомизированных контролируемых исследований, было установлено, что общая летальность в послеоперационном периоде была на 1/3 ниже среди больных, оперированных в условиях регионарной анестезии. Также было отмечено снижение частоты тромбозов глубоких вен нижних конечностей на 44%, тромбоэмболий легочной артерии на 50%, частоты послеоперационных пневмоний на 39%, значительное снижение объема интраоперационной кровопотери и, соответственно, потребности в гемотрансфузиях.
Несмотря на значительное улучшение результатов лечения, регионарная анестезия сама по себе сопряжена с определенным риском. Тяжелые осложнения встречаются намного реже, чем при общей анестезии (так, вероятность остановки кровообращения при регионарных методах анестезии в среднем 2 / 10 000, при общей анестезии – 5,6 / 10 000), но, тем не менее, они встречаются.
Значительное количество осложнений связано не с особенностями, присущими методам регионарной анестезии, а с нарушениями их методологии. Снижение их числа является основной целью данного пособия.
Основы клинической анатомии
спинного мозга и его оболочек
Спинной мозг расположен в позвоночном канале, образованном телами и дужками позвонков от большого затылочного отверстия до тела первого поясничного позвонка – так пишут в классических руководствах. Однако по современным патологоанатомическим и рентгенологическим данным, у 20% лиц конус спинного мозга достигает уровня 2-го поясничного позвонка и у 57% - промежутка между 1-м и 2-м поясничными позвонками. Исходя из этого, не рекомендуется выполнение пункции субарахноидального пространства в промежутках LI – LII и даже LII – LIII.
Спинной мозг имеет 3 оболочки. Мягкая интимно связана с тканью мозга. Снаружи от мягкой оболочки расположено субарахноидальное пространство, содержащее ликвор. Оно ограничено паутинной оболочкой, которая связана с твердой мозговой оболочкой. Снаружи от твердой мозговой оболочки расположено эпидуральное пространство, содержащее клетчатку и венозные сплетения (в основном в латеральных отделах). Сзади эпидуральное пространство ограничено желтой связкой позвоночника. Корешки спинного мозга проходят в субарахноидальном пространстве и образуют спинномозговые нервы, которые выходят из позвоночного канала через межпозвоночные отверстия, окруженные дуральными муфтами.
Сагиттальный размер эпидурального пространства уменьшается в ростральном направлении и составляет в поясничном отделе позвоночника 5 – 6 мм, в нижнегрудном 3 – 5 мм, в верхнегрудном 2 – 3 мм и в шейном 1 – 1,5 мм.
При проведении пункции субарахноидального пространства серединным доступом игла последовательно проходит следующие структуры
кожу, подкожную клетчатку
надостистую связку
межостистую связку
желтую связку (ее прохождение ощущается по снижению сопротивления продвижению иглы, ощущению «провала»), после этого игла расположена в эпидуральном пространстве
твердую и паутинную оболочки (прохождение их ощущается по второму снижению сопротивления, т.н. «дуральный щелчок»), после этого игла располагается в субарахноидальном пространстве.
При введении анестетика в субарахноидальное пространство он смешивается с ликвором и непосредственно воздействует на корешки спинномозговых нервов. Действие анестетика, введенного в эпидуральное пространство, связывают с его диффузией в субарахноидальное пространство и воздействием на спинномозговые нервы в области дуральных муфт, окружающих места выхода нервов из позвоночного канала. В связи с этим для эпидуральной анестезии требуются значительно более высокие дозы анестетиков, чем для спинальной. Латентный период при эпидуральной анестезии значительно длиннее, а «плотность» блока, выраженность анестезии обычно ниже, чем при спинальной анестезии.
Для определения уровня пункции используются топографические ориентиры:
Остистый отросток VII шейного позвонка
Линия, соединяющая нижние углы лопаток – промежуток ThVII – ThVIII
XII пара ребер (позвонок ThXII)
Линия, соединяющая гребни подвздошных костей (линия Тюффье) – промежуток LIV – LV.
Наиболее надежным считается использование в качестве ориентира XII пары ребер.
Уровни сегментарной иннервации и выбор уровня пункции
Ч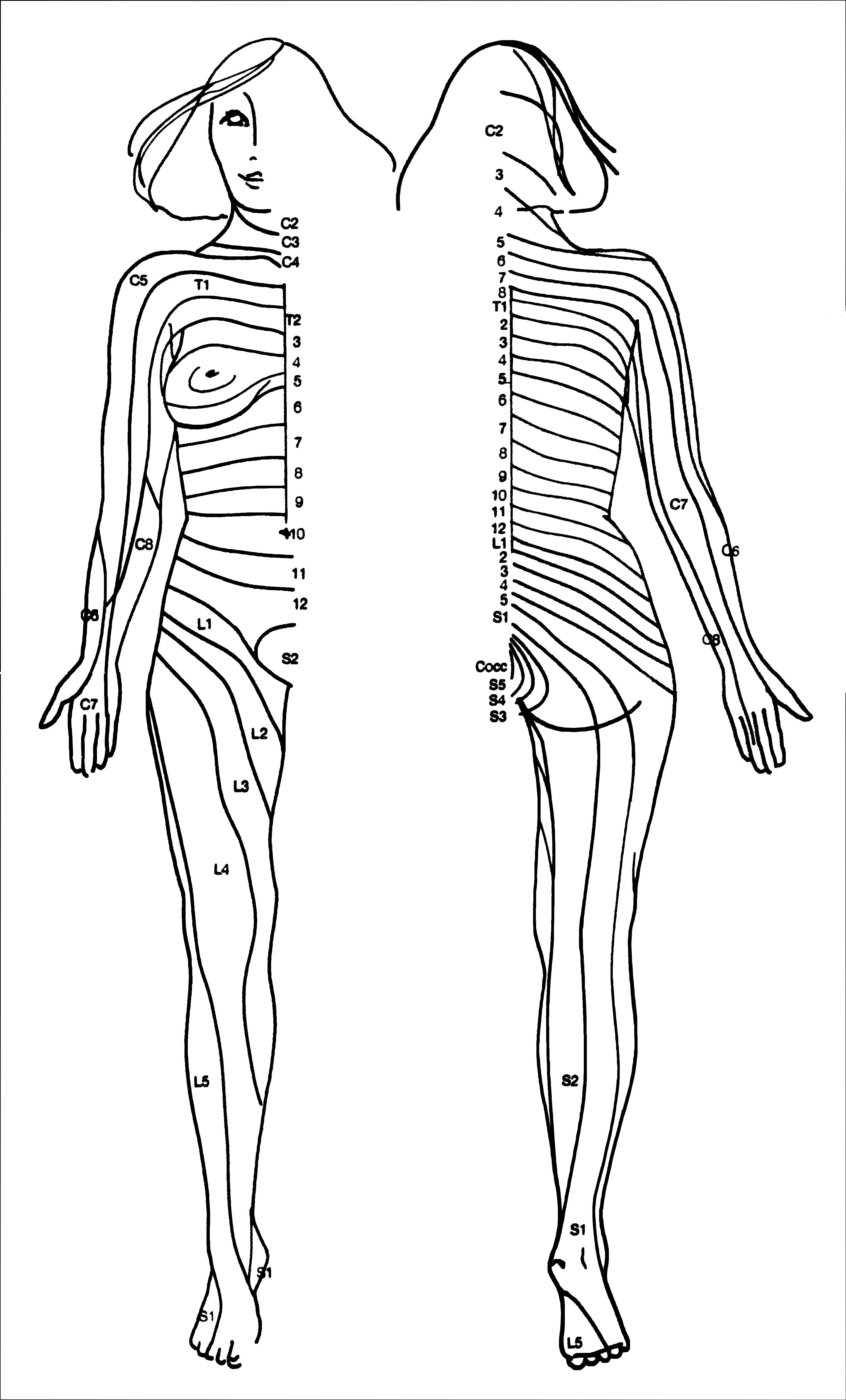 увствительная
иннервация имеет сегментарный характер,
т.е. каждая область тела иннервируется
корешками определенного сегмента
спинного мозга (рисунок 1). Поскольку
спинной мозг короче позвоночника и его
сегменты короче позвонков, корешки
спинного мозга проходят в субарахноидальном
пространстве определенное расстояние,
прежде чем выйти из «своего» межпозвоночного
отверстия.
увствительная
иннервация имеет сегментарный характер,
т.е. каждая область тела иннервируется
корешками определенного сегмента
спинного мозга (рисунок 1). Поскольку
спинной мозг короче позвоночника и его
сегменты короче позвонков, корешки
спинного мозга проходят в субарахноидальном
пространстве определенное расстояние,
прежде чем выйти из «своего» межпозвоночного
отверстия.
Межпозвоночный промежуток для пункции эпидурального пространства4 выбирается исходя из сегментарной иннервации области предполагаемой операции (таблица 1). Увеличение дозы анестетика способствует расширению границ блокады.
Таблица 1
Выбор уровня пункции эпидурального
пространства в зависимости от области операции
|
Область хирургического вмешательства |
Уровень катетеризации |
|
|
|
|
Нижние конечности |
LII – LIII |
|
Нижний этаж брюшной полости, органы малого таза |
ThXI – LI |
|
Верхний этаж брюшной полости |
ThVII – ThIX |
|
Грудная клетка |
ThIV – ThV |
Основы клинической фармакологии
местных анестетиков
Проведение импульса по нервным волокнам связано с деполяризацией аксональной мембраны при входе ионов Na+ через Na каналы. Местные анестетики связываются со специфическими рецепторами Na каналов (расположенными внутри клетки) и предотвращают их активацию, таким образом, деполяризации мембраны не происходит.
Молекула местного анестетика состоит из бензольного кольца, третичного амина и соединяющей их цепочки, в зависимости от строения которой все местные анестетики разделяются на 2 группы:
Эфирные (в настоящее время применяется практически только Прокаин, (Новокаин)) характеризуются нестабильностью (короткая продолжительность действия) и высокой частотой аллергических реакций, вызванных метаболитом – парааминобензойной кислотой
Амидные (Лидокаин, Бупивакаин (Маркаин), Ропивакаин (Наропин)), лишены указанных недостатков.
Основные клинические характеристики местных анестетиков
Мощность
Латентный период
Длительность действия
Токсичность
Клинические характеристики местного анестетика напрямую зависят от его физико-химических и фармакокинетических свойств, таких, как рК, жирорастворимость, связывание с белками, скорость системной абсорбции, пути элиминации.
Основные характеристики наиболее распространенных местных анестетиков представлены в таблице 2.
Таблица 2
Характеристики современных местных анестетиков
|
Препарат, тип, год внедрения |
Мощность (жирораст-воримость) |
Константа диссоциации (рК) |
% связ. с белками |
Токсич-ность |
|
|
|
|
|
|
|
Прокаин (Но-вокаин), Э, 1905 |
1 (0,6) |
8,9 |
+ (5,8) |
+ |
|
Лидокаин, А, 1947 |
4 (2,9) |
7,7 |
++ (64,3) |
++ |
|
Бупивакаин (Мар-каин), А, 1963 |
8 (27,5) |
8,1 |
++++ (95,6) |
++++ |
|
Ропивакаин (На-ропин), А, 1996 |
7 (14,0) |
8,1 |
++++ (94,0) |
++ |
Как видно из таблицы, совершенствование местных анестетиков шло в направлении повышения их мощности, длительности действия и, в последнее время, снижения токсичности. Наиболее современный анестетик – ропивакаин – при схожем с бупивакаином аналгетическом потенциале и продолжительности действия отличается значительно меньшей системной токсичностью, более высоким клиренсом (не кумулирует в организме), менее выраженным моторным блоком и отчетливой дифференцировкой сенсорного и моторного блока в зависимости от концентрации раствора (см. ниже).
Токсичность местных анестетиков
Токсичность местного анестетика проявляется в двух эффектах:
Местная токсичность (прямой нейротоксический эффект) – повреждение нейронов при непосредственном контакте с анестетиком. Зависит от концентрации анестетика в области нервного волокна и наиболее характерна для лидокаина.
Системная токсичность – возникает при повышении плазменной концентрации местного анестетика. Системная абсорбция анестетика зависит от:
Степени васкуляризации места введения (внутриплевральная анестезия > межреберная > эпидуральная > анестезия плечевого сплетения),
Физико-химических свойств анестетика (рК, жирорастворимость, связывание с белками),
Влияния анестетика на сосудистый тонус: у лидокаина – выражен вазодилатирующий эффект (следовательно, он быстрее абсорбируется в кровь), у ропивакаина – собственный вазоконстрикторный эффект (поэтому отсутствует смысл его комбинации с вазопрессорами)
Проявления системной токсичности определяются блокадой Na каналов сердца (угнетение автоматизма, сократимости, проводимости, синтеза АТФ) и центральной нервной системы (парестезии, головокружение, зрительные нарушения, затем кома, судороги, остановка дыхания). При использовании лидокаина обычно сначала появляются признаки нейротоксического действия (наиболее ранними из которых являются парестезии вокруг рта, появление «мушек» перед глазами). Особенностью бупивакаина является то, что тяжелые проявления кардиотоксичности часто возникают неожиданно, предшествуя неврологическим нарушениям. Выраженность токсических проявлений зависит не только от абсолютной концентрации местного анестетика в плазме, но и от скорости ее нарастания (максимальна при ошибочном внутрисосудистом введении). Токсичность усиливается при таких нарушениях, как гипоксемия, респираторный ацидоз, гиперкалиемия, а также при беременности. Из применяемых анестетиков наиболее токсичен бупивакаин, токсичность ропивакаина при сопоставимых клинических характеристиках значительно (на 30 – 40%) ниже.
Профилактика токсического действия местных анестетиков
Использование методик, снижающих вероятность внутривенного введения
Аспирационные пробы на всех этапах манипуляции
Дробное введение анестетика с оценкой симптомов системной токсичности
При введении препаратов в васкуляризированные области – выбор препарата с меньшей токсичностью
Соблюдение максимальных рекомендуемых доз (таблица 3).
Таблица3
Максимальные рекомендуемые дозы местных анестетиков
|
Препарат |
МРД, мг | |
|
Разовая |
Суточная | |
|
|
|
|
|
Лидокаин |
300 |
800 |
|
Лидокаин + Адреналин |
500 | |
|
Бупивакаин |
175 |
400 |
|
Бупивакаин + Адреналин |
225 | |
|
Ропивакаин |
225 |
800 |
Взаимодействие анестетика с нервным волокном
Для описания взаимодействия местного анестетика с нервным волокном существует понятие минимальной концентрации (по аналогии с МАК для ингаляционных анестетиков) анестетика, блокирующей проведение импульсов по конкретному волокну. Она зависит от свойств анестетика и волокна и от условий их взаимодействия. При прочих равных условиях наиболее легко блокируются более тонкие и миелинизированные волокна (таблица 4).
Таблица 4
Классификация нервных волокон
|
Класс |
Функция |
Миелинизация |
Тол-щина |
Сm |
|
|
|
|
|
|
|
Аα |
Двигательные |
+ |
++++ |
++++ |
|
Аβ |
Кожная чувствительность (тактильная, болевая, чувство давления) |
+ |
+++ |
+++ |
|
Аγ |
Проприоцептивные |
+ |
+++ |
++ |
|
Аδ |
Кожная чувствительность (болевая, температурная) |
+ |
++ |
+ |
|
В |
Симпатические |
+ |
++ |
+ |
|
С |
Кожная чувствительность (болевая и чувство давления) |
- |
+ |
+++ |
Компоненты регионарной анестезии
Сенсорный блок (анестезия),
Симпатический блок, проявляется в зависимости от уровня:
вазодилатацией при блокаде симпатических волокон сегментов ThV – LI, то есть при практически любой регионарной анестезии. Вазодилатация сопровождается снижением АД, выраженность которого зависит в первую очередь от распространенности блока и исходного волемического статуса,
брадикардией при блокаде сегментов ThI – ThV,
снижением тонуса сфинктеров, усилением перистальтики желудка и кишечника, повышением спланхнического кровотока при блокаде сегментов ThV – LI,
снижением тонуса мышц мочевого пузыря при блокаде сегментов SII – SIV,
Моторный (двигательный) блок
Как следует из данных, приведенных в таблице 4, легче всего (наименьшей концентрацией анестетика в области нервного волокна) блокируются симпатические волокна, для блокады чувствительной импульсации необходима более высокая концентрация, наибольшая концентрация анестетика требуется для блокады двигательной импульсации.
Таким образом, изменяя дозу и концентрацию анестетика, можно получить определенную селективность блокады, например, при использовании низкоконцентрированных растворов моторный блок обычно не выражен. В тех случаях, когда доза и концентрация анестетика достаточно велика, блокада дифференцирована по протяженности: моторный блок наименее распространен, сенсорный блок – в большей степени, и наиболее широк симпатический. Разница между границами блоков составляет обычно 2 – 3 сегмента. Такая же закономерность отмечается и во времени возникновения блока: сначала развивается симпатический, затем сенсорный и в последнюю очередь – моторный блок.
Поскольку при эпидуральной анестезии создаваемая в области нервных корешков концентрация анестетика значительно меньше, чем при спинальной, она характеризуется значительно менее выраженным моторным блоком и не всегда адекватным (особенно в сегментах LV и SI – дистальные отделы нижних конечностей) сенсорным.
ПОКАЗАНИЯ И Противопоказания
к спинальной и эпидуральной анестезии
Показания к регионарным методам анестезии определяется их высокой клинической эффективностью. Учитывая доказанные преимущества эпидуральной и спинальной анестезии для обеспечения адекватности как интраоперационной анестезии, так и послеоперационной аналгезии, а также в отношении результатов хирургического лечения в целом, можно говорить о целесообразности их применения при любых оперативных вмешательствах. Регионарные методы прочно завоевали свое место в травматологии и ортопедии, акушерстве, сосудистой и торакальной хирургии. При высокотравматичных операциях регионарная анестезия используется в основном в составе многокомпонентной анестезии, при менее травматичных вмешательствах - изолированно.
Основные противопоказания к спинальной и эпидуральной анестезии практически идентичны, причем за последнее время круг абсолютных противопоказаний существенно сузился.
Абсолютные противопоказания:
Несогласие больного,
Выраженная гиповолемия, клиника шока,
Отсутствие оборудования, препаратов, квалифицированного персонала,
Инфекция кожи в радиусе 20 см от места пункции, не позволяющая провести адекватную антисептическую обработку,
Клинические проявления коагулопатии, выраженная тромбоцитопения (< 50 × 109/л), недавний тромболизис,
Индивидуальная непереносимость местного анестетика5
Относительные противопоказания
Применение антикоагулянтов / антиагрегантов
Использование антикоагулянтов и антиагрегантов в периоперационном периоде для тромбопрофилактики распространяется все шире. Это повышает риск образования эпидуральной гематомы при регионарной анестезии, но не является абсолютным противопоказанием при учете фармакокинетических свойств используемых препаратов (таблица 5).
Таблица 5
Фармакокинетические свойства антитромботических агентов
|
Препарат |
Пик действия |
Время нормализации гемостаза |
|
|
|
|
|
Гепарин |
1 час |
4 – 6 часов |
|
НМГ |
2 – 5 часов |
12 часов |
|
Варфарин |
4 – 6 дней |
4 – 6 дней |
|
Аспирин |
Часы |
5 – 8 дней |
|
Тиклопидин |
1 сутки |
10 – 14 дней |
Наиболее распространенным является применение низкомолекулярных гепаринов. Параметры гемостаза возвращаются к уровню, безопасному для выполнения регионарной анестезии, через 12 часов после ведения профилактической дозы. Рекомендуется выполнять регионарную анестезию и удалять эпидуральный катетер не ранее, чем через 12 часов после введения низкомолекулярного гепарина, такой же интервал должен быть выдержан между манипуляцией и следующим введением препарата. При использовании лечебных доз низкомолекулярных гепаринов эти временные интервалы увеличиваются до 24 часов.
Сепсис / бактериемия
В последнее время данное противопоказание «переместилось» из разряда абсолютных в относительные. Считается достаточно безопасным выполнение регионарной анестезии на фоне сепсиса, в т.ч. сопровождающегося бактериемией, на фоне проведения антибактериальной терапии. Разумеется, у больных с сепсисом должны быть исключены гиповолемия и тромбоцитопения. Риск гемодинамических нарушений, безусловно, существует; практика показывает, что он менее значителен, когда анестезия / аналгезия начинается после дренирования очага инфекции, находящегося в зоне блокады.
Сопутствующие или перенесенные заболевания нервной системы (периферическая нейропатия, демиелинизирующие заболевания, инсульты и т.д.) с неврологическим дефицитом в зоне блокады,
Нарушение / изменение сознания больного,
Выраженные анатомические деформации, перенесенные травмы и операции на позвоночнике,
Гиповолемия, анемия,
Несогласие хирурга оперировать в условиях регионарной анестезии,
Некоторые заболевания сердца (аортальный стеноз, идиопатический гипертрофический субаортальный стеноз, врожденные пороки со сбросом справа-налево).
Подготовка
к проведению регионарной анестезии
Определение показаний и противопоказаний
Информирование и получение согласия больного
Надежный венозный доступ. Регионарная анестезия всегда сопровождается вазодилатацией, вызывающей более или менее выраженную артериальную гипотензию. Венозный доступ должен обеспечивать струйную инфузию растворов. Как правило, перед началом анестезии (это относится только к спинальной анестезии) рекомендуется провести т.н. преинфузию в объеме 800 мл кристаллоидов. Исходная гиповолемия должна быть устранена до начала анестезии.
Любая регионарная анестезия / аналгезия проводится в условиях операционной, т.е. со строгим соблюдением правил асептики и наличием оборудования для мониторинга и всего необходимого для лечения осложнений (оборудование для искусственной вентиляции легких, набор для интубации трахеи, дефибриллятор, инфузионные среды, вазопрессоры, препараты для сердечно-легочной реанимации)
Одноразовый инструментарий
Анестетики соответствующего назначения
Премедикация. Стандартно включает в себя холинолитики в обычных дозировках. Использование бензодиазепинов, наркотических аналгетиков – только при выраженной эмоциональной лабильности пациента, поскольку эти препараты могут маскировать картину повреждения нерва или спинного мозга, токсического действия местного анестетика. Не рекомендуется профилактическое использование вазопрессорных препаратов.
Выбор межпозвоночного промежутка для пункции (исходя из области операции и четкости анатомических ориентиров)
Обработка операционного поля: двукратно 0,5% спиртовым раствором хлоргексидина, экспозиция 2 минуты, обкладывание стерильным бельем. Не рекомендуется использование йодсодержащих препаратов, поскольку даже в минимальном количестве они могут вызвать явления асептического менингита.
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ
АРТЕРИАЛЬНОЙ ГИПОТЕНЗИИ
Одной из наиболее актуальных проблем, связанных с регионарной анестезией, является проблема обеспечения гемодинамической стабильности. Как уже говорилось, практически любая регионарная анестезия сопровождается снижением артериального давления. Вероятно, именно перераспределение сосудистого тонуса является основным фактором, определяющим значительное снижение кровопотери при операциях, выполняемых в условиях регионарной анестезии, а также снижение нагрузки на миокард и его потребности в кислороде. С другой стороны, выраженная артериальная гипотензия закономерно приводит к противоположным результатам: ишемии миокарда, неврологическим осложнениям, ишемии оперируемых органов, почечной недостаточности и т.д.
В этом плане эпидуральная анестезия имеет значительное преимущество перед спинальной: гемодинамические нарушения бывают обычно менее выраженными и развиваются постепенно (создается резерв времени для их своевременной коррекции).
Основными факторами риска развития артериальной гипотензии являются:
Хроническое употребление алкоголя
Высокий индекс массы тела (ожирение)
Анамнез артериальной гипертензии
Исходная гиповолемия и гемоконцентрация
Высокий уровень блока (сенсорный блок выше ThV)
Экстренность операции
На настоящий момент в клинике не существует методов, которые позволяли бы достоверно прогнозировать развитие артериальной гипотензии.
Меры профилактики гипотензии также весьма дискутабельны. Использование таких мер, как преинфузия (в любых объемах, любыми инфузионными средами), профилактическое использование вазопрессоров подвергается в последнее время серьезной критике ввиду их опасности и, самое главное, сомнительной эффективности.
Из эффективных мер профилактики можно рекомендовать осмысленное выполнение самой анестезии: учет противопоказаний, определение минимально необходимой дозы анестетика, при эпидуральной анестезии – дробное введение основной дозы, при спинальной – разумная скорость введения анестетика и контроль распространения блока использованием гипербарических растворов.
Лечение артериальной гипотензии неспецифическое: инфузионная терапия коллоидными и кристаллоидными (возможно, гипертоническими) растворами, при их неэффективности - использование адреномиметиков, из которых наиболее распространены эфедрин (вводится болюсно по 2,5 – 10 мг) и мезатон (по 50 – 100 мкг).
Залог успеха лечения артериальной гипотензии состоит в его своевременности, т.е. адекватности мониторинга, надежности венозного доступа, доступности необходимых препаратов и инфузионных сред.
ЭПИДУРАЛЬНАЯ АНЕСТЕЗИЯ
Инструментарий
Шприц с иглой для местной анестезии
Игла для перфорации кожи 18G (±)
Игла Туохи 16G или 18G со стилетом
Шприц низкого сопротивления (поисковый) с физраствором
Шприц с анестетиком для введения тест-дозы
Эпидуральный катетер6
Направитель для катетера (±)
Бактериальный фильтр
Замок для соединения катетера и фильтра
Приспособление для фиксации катетера к коже
Положение пациента
Лежа на боку с приведенными к животу коленями, приведенным к груди подбородком, максимально согнутым позвоночником, или
Сидя с согнутым позвоночником и приведенным к груди подбородком (используется, как правило, при технических сложностях в положении на боку)
Доступ к эпидуральному пространству
Серединный – анестезия места вкола (3 – 4 мл 1% раствора лидокаина) – между остистыми отростками по средней линии. Перфорация кожи. Игла со стилетом ориентируется в соответствии с планируемым направлением продвижения катетера (срезом краниально или каудально) и продвигается параллельно остистому отростку строго по средней линии. При попадании иглы в межостистую связку (ощущается по фиксации иглы и сопротивлению ее продвижению) к ней присоединяется поисковый шприц, заполненный 0,9% раствором NaCl7. Дальнейшее продвижение иглы осуществляется одновременно с давлением на поршень шприца (при недостаточном опыте манипуляции – игла продвигается по 1 – 2 мм ступенчато, после каждого продвижения контроль – давление на поршень). Пока конец иглы находится в связках, при давлении на поршень ощущается сопротивление. Прохождение желтой связки ощущается как «провал» - резкое прекращение сопротивления продвижению иглы. Одновременно с этим прекращается и сопротивление давлению на поршень – физраствор свободно поступает из шприца в эпидуральное пространство.
Парамедианный (используется редко, обычно при технических сложностях, связанных с выраженными изменениями позвоночника, перенесенными операциями и т.п.). Точка вкола – на 2 – 4 см латеральное нижней точки вышерасположенного остистого отростка. Эпидуральную иглу со стилетом направляют к срединной линии и в слегка краниальном направлении, с расчетом, чтобы она пересекла воображаемую срединную линию на глубине 4 – 6 см от поверхности. После того, как игла пройдет через кожу, к ней присоединяют поисковый шприц. Игла продвигается через мышцы с умеренным сопротивлением, давление на поршень также сопровождается умеренным сопротивлением. Возрастание сопротивления продвижению иглы и давлению на поршень шприца говорит о том, что игла вошла в желтую связку. Ощущение «провала» иглы и потеря сопротивления давлению на поршень говорят о попадании иглы в эпидуральное пространство.
Идентификация эпидурального пространства
Ощущение «провала» иглы при прокалывании желтой связки
Прекращение сопротивления давлению на поршень шприца – свободное поступление физраствора из шприца в эпидуральное пространство.
Отсутствие вытекания жидкости из иглы при отсоединении шприца (может вытекать физраствор редкими каплями)
Существует также ряд дополнительных признаков для идентификации эпидурального пространства, основанных на наличии в нем отрицательного давления (не всегда)
Признак «висячей капли» - при подвешивании капли раствора к павильону иглы, она втягивается в иглу
Признак «спущенной шины» - при отсоединении шприца слышен шипящий звук
Тест-доза
После идентификации эпидурального пространства через иглу вводится тест-доза – 4 мл 2% раствора лидокаина. В течение 5 минут проводится наблюдение за больным, ежеминутное измерение артериального давления и частоты сердечных сокращений с целью исключения признаков развития спинальной анестезии
Катетеризация эпидурального пространства
При отсутствии признаков спинальной анестезии в течение 5 минут, выполняется катетеризация эпидурального пространства: через иглу (возможно с использованием направителя) вводится катетер. Срез иглы Туохи определяет направление движения катетера в эпидуральном пространстве, поэтому важно, чтобы он был расположен строго краниально или каудально (в зависимости от выбранного направления). Катетеризация в краниальном направлении обычно удается легче, учитывая угол между иглой и продольной осью тела. Когда катетер доходит до метки, соответствующей длине иглы, появляется легкое сопротивление, говорящее о попадании катетера в эпидуральную клетчатку. Катетер вводится на глубину 4 – 5 см. После этого катетер фиксируется, игла удаляется. К катетеру подсоединяется замок, проводится аспирационная проба (не должен аспирироваться ликвор или кровь), присоединяется бактериальный фильтр, и повторно вводится тест-доза – 4 мл 2% раствора лидокаина. При отсутствии поступления жидкостей из катетера и признаков спинального блока в течение 5 минут, катетер фиксируется к коже с помощью специальных устройств или лейкопластырем. Бактериальный фильтр (или катетер) маркируется для уменьшения вероятности ошибочного введения в него ненадлежащих препаратов.
Сложности при пункции эпидурального пространства
Не удается идентифицировать эпидуральное пространство после 4 – 5 попыток.
Отказаться от эпидуральной анестезии
После отсоединения шприца от иглы частыми каплями вытекает теплая прозрачная жидкость – непреднамеренная пункция субарахноидального пространства.
Рассмотреть возможность одномоментной спинальной анестезии (на поясничном уровне), ИЛИ
Медленно подтянуть иглу на себя до прекращения истечения ликвора, повторно идентифицировать эпидуральное пространство, ИЛИ
Удалить иглу, пунктировать эпидуральное пространство в соседнем промежутке.
После непреднамеренной пункции твердой мозговой оболочки не рекомендуется использование наркотических аналгетиков для эпидуральной анестезии.
После отсоединения шприца из иглы вытекает редкими каплями жидкость с геморрагической окраской – подозрение на ранение сосуда эпидурального пространства. Ввести через иглу 4 – 5 мл физраствора. Если вытекающая жидкость бесцветна, или интенсивность окраски уменьшилась (кровь от повреждения мягких тканей) – катетеризировать. Сохраняется интенсивное геморрагическое окрашивание (ранение сосуда) –
Пунктировать в соседнем промежутке, ИЛИ
Отказаться от эпидуральной анестезии, если имеются нарушения со стороны системы гемостаза, проводится или будет проводиться тромбопрофилактика антикоагулянтами.
Сложности при катетеризации эпидурального пространства
Катетер не удается провести на необходимую глубину
Удалить катетер вместе с иглой, повторно пунктировать эпидуральное пространство
Из катетера вытекает или получается при аспирационной пробе прозрачная жидкость – катетеризация субарахноидального пространства
Рассмотреть возможность одномоментной спинальной анестезии (на поясничном уровне), ИЛИ
Удалить катетер, пунктировать в соседнем промежутке
Из катетера вытекает или получается при аспирационной пробе геморрагическая жидкость – подозрение на внутрисосудистое расположение катетера. Ввести в катетер 4 – 5 мл физраствора. Аспирировать повторно. Если вытекающая жидкость бесцветна, или интенсивность окраски уменьшилась (кровь от повреждения мягких тканей) – продолжить анестезию. Если сохраняется интенсивное геморрагическое окрашивание (катетер в сосуде):
Удалить катетер, пунктировать в соседнем промежутке, ИЛИ
Отказаться от эпидуральной анестезии, если имеются нарушения со стороны системы гемостаза, проводится или будет проводиться тромбопрофилактика антикоагулянтами.
Препараты, применяемые для эпидуральной анестезии.
Растворы местных анестетиков.
Лидокаин 2%
Бупивакаин 0,25%, 0,5%
Ропивакаин 0,2%, 0,75%, 1%
Растворы наркотических аналгетиков
Морфин 1%
Фентанил 0,005%
Использование любых других препаратов недопустимо.
Эффекты эпидуральной анестезии зависят не только от абсолютной дозы препарата, но и от его концентрации. Так, при введении дозы анестетика в большом объеме (низкоконцентрированном растворе) блок будет распространенным, с умеренно выраженным или не выраженным моторным компонентом. При введении той же дозы, но в концентрированном растворе блок будет ограниченным по распространенности, но более «плотным», с выраженным моторным компонентом. Исходя из этого, для проведения анестезии во время операции используются обычно достаточно концентрированные растворы (бупивакаин 0,5%, ропивакаин 0,75% и 1%, лидокаин 2%), а для проведения послеоперационной аналгезии – растворы меньшей концентрации.
Для определения дозировки препаратов для эпидуральной анестезии существуют формулы и номограммы, однако они далеко не всегда позволяют вычислить необходимую дозу. Дозировка местных анестетиков составляет в большинстве случаев от 1 до 2 мл/сегмент спинного мозга (количество сегментов определяется исходя из вида операции). Доза зависит от:
Возраста пациента – с возрастом доза местного анестетика, необходимая для достижения определенного уровня анестезии снижается
Роста – чем выше рост, тем больше необходимая доза
Веса – доза снижается при выраженном ожирении
Также необходимая доза снижается при беременности
В большинстве случаев необходимая доза анестетика составляет при эпидуральной анестезии на поясничном уровне 15 – 25 мл, на грудном – 10 – 15 мл.
Наилучшим способом, позволяющим выбрать оптимальную дозу у конкретного больного, является дробное – по 5 мл с интервалом не менее 2 минут – введение местного анестетика в эпидуральное пространство под контролем уровня блокады и признаков системной токсичности. Такая тактика позволяет свести к минимуму гемодинамические изменения.
Время введения повторных дозировок местного анестетика зависит от его фармакокинетических свойств. Длительность действия анестетика описывается с помощью времени двухсегментарной регрессии, т.е. времени, через которое граница сенсорного блока сокращается на 2 сегмента. Для лидокаина это время составляет 90 – 150 минут, для бупивакаина и ропивакаина – 200 – 260 минут
Повторные дозировки местного анестетика составляют обычно 1/2 – 1/3 от основной, введение их необходимо через 50 – 60 минут при использовании лидокаина и через 100 – 120 минут при использовании бупивакаина и ропивакаина.
Также для эпидуральной анестезии используются наркотические аналгетики – морфин и фентанил (таблица 6).
Таблица 6
Наркотические аналгетики,
используемые для эпидуральной анестезии
|
Препарат |
Доза, мг |
Начало действия, минуты |
Продолжительность действия, часы |
|
|
|
|
|
|
Морфин |
2 – 5 |
30 – 60 |
6 – 24 |
|
Фентанил |
0,05 – 0,1 |
5 – 10 |
4 – 6 |
Точкой приложения вводимых эпидурально наркотических аналгетиков являются опиатные рецепторы задних рогов спинного мозга. Морфин – препарат гидрофильный, в связи с этим блокада при его использовании характеризуется медленным началом, высокой продолжительностью действия и широким распространением от места введения (после введения на поясничном уровне возможно получение аналгезии после торакальных операций). Исходя из этого, рекомендуется применять морфин только при поясничной эпидуральной анестезии. Фентанил гораздо лучше растворяется в жирах, в связи с этим короче латентный период и продолжительность действия, блок бывает менее распространенным и соответствует уровню введения. Скорость эпидурального введения фентанила во время операции составляет в среднем 50 мкг в час.
Эпидуральная аналгезия
в послеоперационном периоде
Для послеоперационной эпидуральной аналгезии используется, как правило, катетер, установленный перед операцией, однако методики применения анестетиков существенно отличаются от интраоперационной эпидуральной анестезии.
Перед началом проведения послеоперационной аналгезии следует повторно убедиться в проходимости катетера и отсутствии его внутрисосудистой или субарахноидальной миграции с помощью аспирационной пробы и введения тест-дозы.
Эффективность послеоперационной эпидуральной аналгезии определяется следующими факторами
Адекватностью собственно обезболивания,
Защитой сегментарных структур от болевой импульсации (что предупреждает развитие хронических болевых синдромов),
Ограничением эндокринного, метаболического и воспалительного компонентов хирургического стресс-ответа,
Симпатическим блоком,
Созданием минимальной постоянной плазменной концентрации местного анестетика, снижающего агрегацию форменных элементов и проницаемость эндотелия.
Отметим, что в основном позитивное влияние эпидуральной аналгезии на течение послеоперационного периода и частоту различных осложнений наблюдается именно при использовании местных анестетиков. Применение наркотических аналгетиков, как системное, так и эпидуральное, обеспечивая сопоставимое качество аналгезии, не дает столь широкого круга эффектов.
Вместе с тем, нужно отметить, что послеоперационная эпидуральная аналгезия не должна противопоставляться назначению системных аналгетиков, но может с успехом сочетаться с ним.
Адекватность послеоперационной аналгезии в клинической практике принято оценивать с помощью визуально-аналоговых шкал. Больному (с достаточным уровнем сознания) предлагается, ориентируясь на шкалу, оценить выраженность болевых ощущений в интервале от полного отсутствия боли до максимальной боли, которую пациент может себе вообразить. Как правило, используется 10-балльная шкала; удовлетворительной аналгезия считается при оценках в 3 балла и ниже.
Нежелательным при проведении послеоперационной эпидуральной аналгезии является возникновение моторного блока. Для его объективной оценки предложена шкала Bromage (таблица 7).
Таблица 7
Шкала Bromage для оценки моторного блока
|
Пациент, лежа на спине, по команде способен поднять прямую ногу |
0 баллов |
|
Пациент способен поднять только ногу, согнутую в колене |
1 балл |
|
Сохранены движения только в стопе и голеностопном суставе |
2 балла |
|
Полное отсутствие движений в ногах |
3 балла |
Удовлетворительным считается наличие моторного блока не более 1 балла.
Оптимальной продолжительностью послеоперационной эпидуральной аналгезии считается 48 – 72 часа; в случае возникновения хирургических осложнений – период до разрешения ситуации.
Методики эпидурального введения анестетиков для послеоперационной аналгезии.
Болюсное введение. По часам, реже по требованию больного, в эпидуральное пространство вводится определенная доза анестетика. При данной методике концентрация анестетика в эпидуральном пространстве непостоянна, следовательно, непостоянны и свойства аналгезии: выраженность и распространенность симпатического, сенсорного и моторного блока.
Длительная эпидуральная инфузия. С помощью дозатора с определенной скоростью постоянно проводится эпидуральная инфузия анестетика. Это позволяет создать постоянную концентрацию анестетика в эпидуральном пространстве (и в плазме), что обеспечивает постоянство свойств аналгезии, стабильность гемодинамики и снижает суммарную дозу анестетика (а следовательно, и риск проявлений системной токсичности). Скорость инфузии регулируется в зависимости от выраженности болевого синдрома и моторного блока, показателей гемодинамики.
Аналгезия, контролируемая пациентом. Устанавливается определенная скорость эпидуральной инфузии анестетика (как правило, меньшая, чем при постоянной инфузии), в дополнение к которой пациент при усилении болевого синдрома может нажатием специальной кнопки вводить болюсы анестетика. Объем болюса и минимальный интервал между их введением ограничиваются, что не позволяет пациенту передозировать анестетик. Методика наиболее перспективна, но требует использования дорогостоящих дозаторов, поэтому распространена ограниченно.
Препараты, используемые для послеоперационной аналгезии.
Используются низкоконцентрированные растворы местных анестетиков:
Лидокаин 1%
Бупивакаин 0,125% – 0,25%
Ропивакаин 0,2%
Скорость инфузии составляет обычно 6 – 10 мл/час, она регулируется в зависимости от показателей гемодинамики, адекватности аналгезии и выраженности моторного блока.
Наиболее предпочтительным считается использование ропивакаина, поскольку он (в отличие от бупивакаина) менее токсичен, не кумулирует в организме, в меньшей степени вызывает моторный блок и тахифилаксию.
С целью снижения суммарной дозы местного анестетика и повышения качества аналгезии без выраженного моторного блока также используются наркотические аналгетики:
Фентанил (скорость эпидуральной инфузии 6 – 12 мкг/час)
Использование морфина для послеоперационной аналгезии не рекомендуется, т.к. достаточно часто возникают осложнения в виде кожного зуда, задержки мочеиспускания и т.д. Кроме того, использование морфина может маскировать клинику хирургических осложнений в послеоперационном периоде.
Мониторинг во время послеоперационной эпидуральной аналгезии
Показатели гемодинамики (как минимум, 1 раз в 30 минут в течение первых двух часов, далее – не реже 1 раза в 2 часа при стабильном течении аналгезии).
Выраженность болевого синдрома по визуально-аналоговой шкале (адекватной аналгезия считается при оценке не более 3 баллов по 10-балльной шкале) – оценивается 2 – 3 раза в течение первого часа, далее 1 раз в 3 часа.
Распространенность сенсорного блока (соответствие области операции).
Выраженность моторного блока по Bromage (оптимально не более 1 балла) – оценивается 2 – 3 раза в течение первого часа, далее 1 раз в 3 часа.
Оценка признаков токсического действия местного анестетика.
Учитывая необходимость мониторинга при послеоперационной эпидуральной аналгезии, доступности персонала и оборудования для оказания экстренной помощи при развитии осложнений, тщательного соблюдения правил асептики, КАТЕГОРИЧЕСКИ НЕ РЕКОМЕНДУЕТСЯ проведение послеоперационной эпидуральной анестезии в «профильных» – хирургических, травматологических, гинекологических и т.п. – отделениях. Авторам известны многочисленные случаи введения неквалифицированным персоналом в эпидуральный катетер самых различных препаратов, в т.ч. попытки проведения инфузионной терапии и промывания катетера раствором гепарина (!). Условия для безопасной эпидуральной аналгезии могут быть созданы только в отделении реанимации и интенсивной терапии.
Проблемы при проведении эпидуральной аналгезии
Нестабильность гемодинамики
Уменьшить скорость эпидуральной инфузии
Увеличить темп внутривенной инфузии кристаллоидов и коллоидов
Для сохранения адекватности аналгезии возможно болюсное эпидуральное введение 50 – 100 мкг фентанила
После стабилизации гемодинамики восстановить оптимальную скорость эпидуральной инфузии местного анестетика
Сохранение болевых ощущений более 3 баллов по 10-балльной визуально-аналоговой шкале
Исключить технические проблемы (миграция катетера, дисконнекция катетера и инфузионной линии, неисправность инфузионного насоса)
Увеличить под контролем гемодинамики скорость эпидуральной инфузии (максимально до 14 мл/час), ИЛИ
Ввести болюсно в эпидуральное пространство 50 – 100 мкг фентанила, ИЛИ
Ввести болюсно 4 – 5 мл концентрированного раствора местного анестетика (бупивакаин 0,5%, ропивакаин 0,75%)
При неэффективности указанных мер перейти на системное введение аналгетиков.
Возникновение болевых ощущений на фоне ранее эффективной эпидуральной аналгезии
Исключить технические проблемы (см. выше)
Исключить хирургические осложнения (их клиника не маскируется послеоперационной эпидуральной аналгезией, за исключением случаев применения морфина).
СПИНАЛЬНАЯ АНЕСТЕЗИЯ
Инструментарий
Шприц с иглой для местной анестезии
Направитель для иглы (±)
Шприц с раствором для спинальной анестезии
Игла для спинальной анестезии со стилетом
Иглы для спинальной анестезии отличаются диаметром и формой среза.
Диаметр игл принято измерять в Гоуджах (Gauge, G), цвет стилета соответствует определенному диаметру (таблица 8).
Таблица 8
Размеры и маркировка игл для спинальной анестезии
|
Размер, G |
Диаметр, мм |
Цвет |
|
|
|
|
|
20 |
0,9 |
Желтый |
|
21 |
0,8 |
Темно-зеленый |
|
22 |
0,7 |
Черный |
|
23 |
0,6 |
Темно-синий |
|
24 |
0,55 |
Сиреневый |
|
25 |
0,5 |
Оранжевый |
|
26 |
0,45 |
Коричневый |
|
27 |
0,4 |
Серый |
|
28 |
0,36 |
Бирюзовый |
|
29 |
0,33 |
Красный |
|
30 |
0,3 |
Желтый |
Технически проще выполнить пункцию более толстой иглой, она жестче, более отчетливы тактильные ощущения в ходе пункции, быстрее начинает поступать ликвор. С другой стороны, чем меньше диаметр иглы, тем меньше частота постпункционных головных болей – одного из наиболее частых осложнений спинальной анестезии. Частота их существенно возрастает при использовании игл толще 25G. Оптимальным на сегодняшний день считается диаметр 25 – 27G.
Для выполнения спинальной анестезии могут использоваться направители – диаметром 20G для спинальных игл менее 25G и диаметром 22G для спинальных игл менее 27G. Их использование технически облегчает пункцию и предотвращает контакт спинальной иглы с кожей и антисептиком.
Кроме диаметра, иглы для спинальной анестезии отличаются формой окончания.
Классические иглы (Квинке, Питкина, Грини) имеют отверстие на конце и косой срез; отличаются в основном углом среза. При их использовании необходимо ориентировать срез иглы таким образом, чтобы он располагался параллельно продольной оси тела. Волокна твердой мозговой оболочки имеют продольное направление, поэтому при такой ориентации иглы она будет не разрезать, а раздвигать волокна, и постпункционнй дефект в твердой мозговой оболочке будет существенно меньше. Это, в свою очередь, обеспечивает снижение частоты постпункционных головных болей (по некоторым данным, более чем в 50 раз).
Иглы типа Уайтэкра, Спротта, Pencil Point имеют слепой конический конец и отверстие на боковой поверхности (отличаются между собой формой отверстия и расстоянием от него до кончика иглы). Благодаря этому, они не перерезают, а раздвигают волокна твердой мозговой оболочки, что уменьшает размеры дефекта. Кроме того, конец иглы (в отличие от классических игл) сохраняет свою форму после контакта с костными структурами.
В последнее время появилась новая модификация спинальной иглы – Atraucan со срезом в двух плоскостях.
Несмотря на значительное количество исследований, данные о влиянии формы иглы на размеры дефекта твердой мозговой оболочки и частоту постпункционной головной боли остаются противоречивыми.
Положение пациента
Лежа на боку с приведенными к животу коленями, приведенным к груди подбородком, максимально согнутым позвоночником, или
Сидя с согнутым позвоночником и приведенным к груди подбородком (используется, как правило, при технических сложностях в положении на боку)
Доступ к субарахноидальному пространству
Серединный – анестезия места вкола (3 – 4 мл 1% раствора лидокаина) – между остистыми отростками по средней линии. Для игл тоньше 25G могут использоваться направители - иглы большего диаметра для прохождения кожи и надостистой связки. Игла8 со стилетом продвигается параллельно остистому отростку строго по средней линии. После прохождения желтой связки ощущается «провал» – снижение сопротивления продвижению иглы. Игла продвигается далее еще на 3 – 4 мм и ощущается второй «провал», соответствующий пункции твердой мозговой оболочки («дуральный щелчок»). Игла находится в субарахноидальном пространстве. При удалении мандрена из иглы начинает поступаль ликвор.
Парамедианный (используется редко, обычно при технических сложностях, связанных с выраженными изменениями позвоночника, перенесенными операциями и т.п.). Точка вкола – на 2 – 4 см латеральное нижней точки вышерасположенного остистого отростка. Иглу со стилетом направляют к срединной линии и в слегка краниальном направлении, с расчетом, чтобы она пересекла воображаемую срединную линию на глубине 4 – 6 см от поверхности. Игла продвигается через мышцы с незначительным сопротивлением. Возрастание сопротивления продвижению иглы говорит о том, что игла вошла в желтую связку. Ощущение «провала» иглы говорит о попадании ее в эпидуральное пространство, игла продвигается далее, и ощущение второго «провала» говорит о попадании иглы в субарахноидальное пространство. При удалении мандрена из иглы начинает поступать ликвор.
Идентификация субарахноидального пространства.
Тактильные ощущения при пункции
Поступление ликвора из иглы после удаления мандрена
Поступление ликвора при повороте иглы вокруг собственной оси из каждого квадранта
При использовании современных игл малого диаметра и с оригинальными формами среза тактильные ощущения при выполнении пункции могут быть смазанными. В любом случае, они менее отчетливы, чем при выполнении эпидуральной анестезии.
Поступление ликвора из игл малого диаметра также может быть сильно замедленным; в некоторых случаях приходится прибегать к его активной аспирации.
Введение анестетика
Форсированное введение анестетика в субарахноидальное пространство приводит к тому, что он будет активнее смешиваться с ликвором и распространяться в большем объеме. Следовательно, блок будет более распространенным, но менее продолжительным и, возможно, с недостаточно выраженным моторным компонентом. Распространенность симпатического блока приведет к более значительным гемодинамическим нарушениям.
Барботаж (активное перемешивание анестетика с ликвором) приводит к непрогнозируемо широкому распространению анестетика в ликворе.
Удаление иглы из субарахноидального пространства
Перед удалением иглы рекомендуется вставлять в нее мандрен. По некоторым данным, это снижает частоту постпункционных головных болей в 3 раза (правда, исследование проводилось на сравнительно толстых иглах – 21G). После удаления иглы место пункции зарывается стерильной повязкой.
Препараты, применяемые для спинальной анестезии.
Спинальная анестезия предъявляет высокие требования к используемым препаратам. Наличие в них посторонних примесей или бактериальное загрязнение может привести к тяжелым последствиям. Могут применяться только специально предназначенные для спинальной анестезии растворы местных анестетиков.
Лидокаин 2%
За рубежом выпускаются специальные растворы лидокаина, предназначенные именно для спинальной анестезии. В нашей стране некоторые производители разрешают субарахноидальное применение своего препарата, некоторые – нет. Надо сказать, что значительное количество описанных осложнений, связанных с местным токсическим действием лидокаина, делает его применение при спинальной анестезии нежелательным.
Бупивакаин 0,5%
На сегодняшний день в России зарегистрированы только 2 спинальных раствора бупивакаина:
Маркаин Спинал и Маркаин Спинал Хеви (0,5% раствор в ампулах по 4 мл).
Использование любых других препаратов недопустимо. Раствор ропивакаина для спинальной анестезии в России пока не зарегистрирован (вероятно, будет зарегистрирован в первой половине 2006 года).
Растворы бупивакаина во флаконах по 20 мл не должны применяться для спинальной анестезии, т.к. не обладают необходимой химической чистотой (содержат консервант). Также в России не разрешено применение для спинальной анестезии наркотических аналгетиков, клофелина и т.п.
Распространение анестетика в ликворе (а следовательно, и уровень и распространенность блокады) зависит от его относительной плотности – баричности.
По отношению к плотности ликвора (1,003 – 1,008 при 37ºС) растворы анестетиков подразделяются на:
Гипобарические, их плотность ниже плотности ликвора, после введения они перемещаются вверх
Изобарические, плотность которых приблизительно равна плотности ликвора, распространяются равномерно
Гипербарические, их плотность выше плотности ликвора, после введения распространяются преимущественно вниз.
Распространение анестетика в ликворе зависит также от выраженности изгибов позвоночника и положения операционного стола.
Маркаин Спинал (0,5% водный раствор бупивакаина) – раствор изобарический, его плотность при комнатной температуре 1,0058, но при температуре тела плотность снижается и раствор приобретает слегка гипобарический характер (в этой связи нельзя признать разумным ставший почти общепринятым прием – поднимание головного конца операционного стола при чрезмерно широком распространении блока – он, скорее, усугубит ситуацию).
Маркаин Спинал Хеви (0,5% раствор бупивакаина в 8,25% растворе глюкозы) – гипербарический. Поднятие головного конца стола после инъекции приведет к ограничению распространения анестетика вверх. Существует методика «седловидного блока» – после пункции больной остается в сидячем положении на 3 – 5 минут и получается изолированный блок нижних поясничных и крестцовых сегментов. Поднятие ножного конца операционного стола после инъекции гипербарического раствора приведет к распространению анестетика и расширению блока в краниальном направлении. При горизонтальном положении операционного стола верхняя граница блока будет ограничена на уровне ThIV (наиболее выступающий уровень грудного кифоза).
Так же, как и при эпидуральной, доза анестетика для спинальной анестезии зависит от количества сегментов, которые должны быть заблокированы: чем больше требуемая распространенность блокады, тем выше необходимая доза местного анестетика. Кроме того, доза зависит от следующих факторов:
Возраста пациента – с возрастом доза местного анестетика, необходимая для достижения определенного уровня анестезии снижается,
Роста – чем выше рост, тем больше необходимая доза,
Веса пациента – необходимая доза снижается при выраженном ожирении (так же, как и при повышении внутрибрюшного давления, связанном с иными причинами: асцит, новообразования брюшной полости, парез кишечника)
Также необходимая доза снижается при беременности
Примерные дозы распространенных местных анестетиков при спинальной анестезии в зависимости от характера операции приведены в таблице 9.
Таблица 9
Дозы анестетиков для спинальной анестезии
|
Препарат |
Доза, мг |
Продолжи-тельность действия, мин | ||
|
Нижние конечности, промежность |
Малый таз |
Нижний этаж брюшной полости | ||
|
|
|
|
|
|
|
Лидокаин |
25 |
50 – 75 |
75 – 100 |
<60 |
|
Бупивакаин |
5 – 7,5 |
8 – 12 |
12,5 – 20 |
120 – 240 |
Продолжительность анестезии в небольшой степени зависит от дозы анестетика: чем выше доза, тем длительнее анестезия, однако проявляется это в основном при использовании небольших доз и низкоконцентрированных растворов.
Продленная спинальная анестезия
Существуют методики продленной спинальной анестезии с введением катетера в субарахноидальное пространство. Основными их преимуществами является достижение качественной анестезии во время операции (не ограниченной временем действия местного анестетика) и качественной послеоперационной аналгезии минимальными дозами анестетика, без риска проявлений системной токсичности, а также более высокая управляемость анестезии со снижением дозы одномоментно вводимого анестетика (а следовательно, снижение риска гемодинамических нарушений). К недостаткам метода следует отнести высокий риск неврологических осложнений (связанных, возможно, с непосредственным контактом катетера с корешками спинномозговых нервов или с местной токсичностью анестетиков) и развития моторного блока. Из-за высокого риска осложнений, в США методика на настоящее врем запрещена.
Варианты методики:
Пункция твердой мозговой оболочки иглой и введение катетера в субарахноидальное пространство через ее просвет,
Идентификация иглой эпидурального пространства, катетеризация субарахноидального пространства по методике "катетер на игле" (т.е. твердая мозговая оболочка пунктируется стилетом, находящимся в катетере).
На настоящий момент использование продленной спинальной анестезии лимитируется не только невыясненной безопасностью, но и высокой стоимостью инструментария.
Сравнительная характеристика
спинальной и эпидуральной анестезии
В случаях, когда операция (например, на нижнем этаже брюшной полости, органах малого таза, промежности) может быть выполнена как под спинальной, так и под эпидуральной (на поясничном уровне) анестезией, перед анестезиологом встает вопрос – какой метод предпочесть.
Спинальная анестезия имеет целый ряд преимуществ перед эпидуральной. Это, в частности, техническая простота, быстрое наступление блока и лучшее его качество (особенно при операциях на нижних конечностях), более выраженный моторный блок (миорелаксация), практически полное отсутствие риска токсического действия местного анестетика, наконец, дешевизна.
Преимуществ поясничной эпидуральной анестезии можно выделить лишь два, но оба они очень весомы: возможность продолжения аналгезии в послеоперационном периоде и меньший риск гемодинамических нарушений при корректном проведении анестезии. Последнее особенно важно у пациентов с ограниченными резервами системы кровообращения – при сопутствующей сердечно-сосудистой патологии, в условиях гиповолемии и т.д.
Таблица 10
Сравнительная характеристика спинальной и эпидуральной анестезии
|
Характеристика |
СА |
ЭА |
|
|
|
|
|
Техническая сложность |
+ |
++ |
|
Стоимость |
+ |
++ |
|
Быстрота развития блока |
+++ |
– |
|
Качество блока |
+++ |
++ |
|
Верхний уровень блока |
Максимум до ТhIV |
Не ограничен |
|
Послеоперационная аналгезия |
– * |
+ |
|
Риск неудач |
+ |
++ |
|
Гемодинамические нарушения |
+++ |
++ |
|
Риск токсического действия анестетика |
– |
++ |
|
Релаксация |
+++ |
+ |
* - за исключением весьма редкой методики продленной спинальной анестезии
Исходя из этого, можно рекомендовать поясничную эпидуральную анестезию лишь тогда, когда планируется проведение эпидуральной аналгезии в послеоперационном периоде (т.е. при сравнительно крупных операциях), в большинстве других случаев целесообразнее применить спинальную анестезию.
СПИНАЛЬНО – ЭПИДУРАЛЬНАЯ АНЕСТЕЗИЯ
Наличие недостатков спинальной и эпидуральной анестезии привело к рождению относительно нового метода – комбинированной спинально-эпидуральной анестезии. Смысл метода состоит в том, что часть анестетика вводится субарахноидально и часть – эпидурально. Метод позволяет сочетать преимущества и нивелировать недостатки спинальной и эпидуральной анестезии.
Фракция, введенная субарахноидально обеспечивает быстрое начало и высокое качество анестезии, моторный блок. Учитывая то, что пролонгироваться анестезия будет эпидуральным компонентом, доза, вводимая субарахноидально, обычно меньше, чем при «чистой» спинальной анестезии, что снижает риск гемодинамических нарушений.
Катетеризация эпидурального пространства позволяет поднять верхнюю границу блока до любого уровня и пролонгировать аналгезию на послеоперационный период. Дозировки, требуемые для эпидурального введения ниже, чем при «чистой» эпидуральной анестезии, что снижает риск токсических эффектов местного анестетика.
К недостаткам метода можно отнести техническую сложнось и сравнительно высокую стоимость инструментария.
Методики спинально-эпидуральной анестезии.
Односегментарный метод
Применяется только на поясничном уровне (так же, как и при спинальной анестезии – уровень пункции не выше LIII).
По общим правилам проводится пункция и идентификация эпидурального пространства, введение тест-дозы. Далее через просвет эпидуральной иглы проводится спинальная, ей пунктируется твердая мозговая оболочка, идентифицируется положение иглы в субарахноидальном пространстве и вводится спинальная доза местного анестетика. Одним из преимуществ метода является то, что, поскольку спинальная игла почти весь путь проходит в просвете эпидуральной, она может быть очень тонкой – 27 – 29G. Далее спинальная игла удаляется, и производится катетеризация эпидурального пространства обычным порядком. Введение анестетиков через эпидуральный катетер начинается обычно сразу по стабилизации гемодинамики после спинальной анестезии, до появления признаков регрессии спинального блока, что обеспечивает постоянство свойств анестезии.
Двухсегментарный метод
Исходя из области операции, выбирается уровень пункции эпидурального пространства и обычным порядком производится его катетеризация. Далее на поясничном уровне выполняется спинальная анестезия. Тактика использования эпидурального катетера аналогична предыдущему варианту.
Регионарные методы анестезии находят все более широкое применение в клинической практике. Причин этому достаточное количество: высокая эффективность в лечении боли, доказанное снижение количества осложнений периоперационного периода, удовлетворенность пациентов и анестезиологов. Кажущаяся простота методов иногда оборачивается тяжелыми осложнениями. Ответственное отношение к проведению регионарной анестезии должно стать основной широкого применения и дальнейшего развития регионарных методик анестезии.
ЛИТЕРАТУРА
Дж. Эдвард Морган-мл., Мэгид С. Михаил. Клиническая анестезиология: книга 1 -я /Пер. с англ./. М.-СПб.: БИНОМ-Невский Диалект; 1998, 431 с.
Овечкин А. М., Гнездилов А. В., Кукушкин М. Л. и др. Профилактика послеоперационной боли: патогенетические основы и клиническое применение. Анестезиология и реаниматология 2000; 5: 71-76.
Овечкин А.М., Карпов И.А., Люосев С.В., Бастрикин С.Ю. Протокол послеоперационного обезболивания при помощи длительной эпидуральной инфузии 0,2% ропивакаина. Вестник интенсивной терапии 2004; 5: 70-73.
Овечкин А.М., Ситкин С.И. (ред.) Регионарная анестезия и лечение боли: тематический сборник. Тверь; 2004, 280 с.
Ферранте Ф.М., ВейдБонкор Т.Р. Послеоперационная боль. М: Медицина; 1998, 640 с.
Auroy Y., Narchi P., Messiah A. et al. Serious complications related to regional anesthesia. Anesthesiology, 1997; 87: 479–86
Breivik Н. Postoperative pain management. Bailliere's Clinical Anaesthesiology 1995; 9: 403-585
Horlocker T.T., Wedel D.J. Neurologic complications of spinal and epidural anaesthesia. Regional Anesthesia and Pain Medicine 2000; 25: 83-98
Horlocker T.T., Wedel D.J., Benzon H., et al. Regional anesthesia in the anticoagulated patient: defining the risks (The second ASRA consensus conference on neuraxial anesthesia and anticoagulation). Regional Anesthesia and Pain Medicine 2003; 28: 172–97
Kehlet H., Holte K. Effect of postoperative analgesia on surgical outcome. British Journal of Anaesthesia 2001; 87(1): 62–72.
Rodgers A., Walker N., Schug S. et al. Reduction of postoperative mortality and morbidity with epidural or spinal anaesthesia: results from overview of randomised trials. BMJ 2000; 321: 1493.
Tryba M. - European Practice Guidelines: Thromboembolism prophylaxis and regional anesthesia. Regional Anesthesia and Pain Medicine 1998; 23 (6) Suppl 2: 178-182.
Turnbull D.K., Shepherd D.B. Post-dural puncture headache: pathogenesis, prevention and treatment. British Journal of Anaesthesia 2003; 91(5): 718-729
Wheatley R.G., Schug S.A., Watson D. Safety and efficacy of postoperative epidural analgesia. British Journal of Anaesthesia 2001; 87(1): 47 - 61
Государственное образовательное учреждение
высшего профессионального образования
