
- •«Ярославская государственная медицинская академия
- •Содержание учебно-методического комплекса
- •Министерство здравоохранения Российской Федерации
- •Оглавление
- •Введение
- •Пояснительная записка.
- •Непрерывное последипломное профессиональное образование по специальности «анестезиология-реаниматология»
- •Консультирование
- •Повышение_квалификации и_подготовка кадров
- •Врач анестезиолог-реаниматолог Первая квалификационная категория
- •Социальная гигиена и организация здравоохранения
- •По специальности
- •Консультирование
- •Повышение квалификации и подготовка кадров
- •Врач анестезиолог-реаниматолог Вторая квалификационная категория
- •Социальная гигиена и организация здравоохранения
- •По специальности
- •Перечень практических навыков по специальности анестезиология-реаниматология
- •Методические рекомендации по преподаванию специальности анестезиология-реаниматология
- •2. Сроки освоения программ послевузовской профессиональной подготовки.
- •Пластическая хирургия
- •Практические навыки
- •Эволюционный формуляр
- •Учебная программа
- •Фармакология
- •Анатомия
- •Биохимия
- •Математика
- •Классификация, рестриктивные нейрологические
- •Сердечно-сосудистая система
- •Премедикация
- •Микроклимат операционной
- •Обеспечение проходимости дыхательных путей
- •Приобретенные пороки сердца и гипертрофическая кардиомиопатия
- •Оценка функции почек
- •Реанимация и интенсивная терапия
- •Принципы лечения кровотечения в послеоперационном периоде.
- •Государственного стандарта послевузовской
- •Профессиональной подготовки специалистов с
- •Высшим медицинским образованием
- •2. Предшествующим уровнем образования для послевузовской
- •3. Общие требования к стандартам послевузовской профессиональной подготовки специалистов с высшим медицинским образованием.
- •4. Требования к обязательному минимуму содержания стандартов послевузовской профессиональной подготовки специалистов с высшим медицинским образованием.***
- •9. Требования к уровню профессиональной подготовленности
- •10.Требования к государственной итоговой аттестации.
- •1. Общие положения.
- •2. Структура, состав и содержание умк.
- •3. Порядок рассмотрения и утверждения умк.
- •Положение
- •Текущий и рубежный контроль учебных достижений
- •Промежуточная аттестация
- •Положение о клинической ординатуре в ярославской государственной медицинской академии Ярославль – 2008
- •I. Общая часть
- •II. Организация обучения в ординатуре
- •III. Права и обязанности врачей ординаторов
- •IV. Целевая клиническая ординатура
- •Учебный план послевузовской профессиональной подготовки специалистов в клинической ординатуре по специальности "Анестезиология и реаниматология"
- •Учебно-тематический план послевузовской профессиональной подготовки в клинической ординатуре по специальности "Анестезиология и реаниматология
- •Учебный план послевузовской профессиональной трехлетней подготовки специалистов в клинической ординатуре (первичная специализация) по специальности "Анестезиология и реаниматология"
- •Ярославская государственная медицинская академия
- •Учебно-методическая карта дисциплины
- •Модульная карта дисциплины
- •Модуль № 1 «Анестезиология и реаниматология в абдоминальной хирургии»
- •Модуль № 2 «Анестезиология и реаниматология в сосудистой и пластической хирургии»
- •Модуль № 3 «Анестезиология и реаниматология в акушерстве и гинекологии»
- •Модуль № 4 «Анестезиология и реаниматология в торакальной и кардиохирургии»
- •Модуль № 5 «Анестезиология и реаниматология в травматологии и ортопедии»
- •Модуль № 6 «Анестезиология и реаниматология в педиатрии и неонатологии»
- •Модуль № 7 «Анестезиология и реаниматология в хирургии головы и шеи»
- •Модуль № 8 «Анестезиология и реаниматология в эндоскопической хирургии и урологии»
- •Модуль № 9 «Интенсивная терапия критических состояний (общая реаниматология)»
- •Модуль № 10 «Анестезиология и реаниматология в условиях центральной районной больницы (практика)»
- •А. Предаттестационные баллы
- •Б. Аттестационные баллы
- •В. Дополнительные баллы
- •Положение об итоговой аттестации клинических ординаторов.
- •Кафедра анестезиологии и реаниматологии с курсом фпдо
- •Фамилия Имя Отчество _____________________________________
- •Задано вопросов ________ Всего утверждений ________Дано ответов _______
- •% Правильных _____________ % эффективности __________ % результ. _________
- •Экзамен по практическим навыкам
- •Устное собеседование
- •Список литературы для клинических ординаторов и врачей
- •Периодические издания
- •Учебные пособия
- •Федерального агентства по здравоохранению
- •Введение
- •Анатомо-физиологические особенности организма ребенка с точки зрения анестезиолога
- •Сосудистый доступ
- •Особенности инфузионной терапии
- •Новорожденные:
- •Обеспечение проходимости дыхательных путей и интраоперационная ивл
- •Внутренний диаметр (мм)
- •Клиническая фармакология
- •Проведение анестезии
- •Ларингоспазм
- •Постинтубационный круп
- •Профилактика гипотермии
- •Анестезия при отдельных заболеваниях
- •Послеоперационное обезболивание
- •Список литературы
- •Федерального агентства по здравоохранению
- •Ярославль, 2006
- •Оглавление
- •Введение
- •Виды нарушений при оказании медицинской помощи.
- •2. Основы законодательства Российской Федерации в здравоохранении.
- •Основы законодательства Российской Федерации при оказании анестезиологической и реаниматологической помощи населению
- •Гражданская ответственность за профессиональные правонарушения
- •Возмещение морального вреда
- •Практика привлечения к ответственности
- •Правонарушения
- •6. Приложения Приложение 1 Заявление об информированном согласии на операцию в условиях общей анестезии
- •Я, пациент (законный представитель),_____________
- •Обоснование медицинского вмешательства без согласия нациента
- •Подписи членов консилиума или дежурного (лечащего) врача __________________________________________________________
- •Приложение 3 Заявление об информированном отказе от операции и анестезии
- •Я, пациент (законный представитель),_________________
- •Отказывается от __________________________________________
- •Зам. Главного врача _________________________________
- •7. Список законодательных и нормативно-правовых актов, использованных в учебном пособии
- •8. Список литературы
- •Федерального агентства по здравоохранению
- •«Ярославская государственная
- •Оглавление
- •Введение
- •Диагностика
- •Алгоритм реанимационных мероприятий
- •В: искусственная вентиляция легких
- •Особые ситуации
- •2. Гипотермия
- •Электромеханическая диссоциация
- •Осложнения слр
- •Показания для прекращения реанимации
- •Приложение:
- •Сердечно-легочная реанимация специализированной бригадой
- •(Стандарт действий)
- •Военно-медицинская академия Санкт-Петербург
- •«Ярославская государственная
- •Оглавление
- •Введение
- •Принципы классификации отравлений
- •Общая характеристика токсического действия ядов на организм
- •Клинические синдромы острых отравлений
- •2. Токсическое поражение сердечно-сосудистой системы.
- •3. Токсическое поражение дыхательной системы.
- •Общие принципы диагностики острых отравлений
- •Формулировка диагноза острых отравлений
- •Детоксикация организма при острых отравлениях
- •1. Сорбционные:
- •2. Диализные и фильтрационные:
- •3. Аферетические:
- •4. Физио и химиогемотерапия при сочетанном применении.
- •1. Магнитная гемотерапия.
- •3. Лазерная гемотерапия
- •Список литературы
- •Федерального агентства по здравоохранению
- •Оглавление
- •Введение Актуальность проблемы
- •Определения основных понятий
- •Предоперационная оценка, подготовка и анестезия у больного с травмой Оценка состояния пациента
- •Защита дыхательных путей
- •Мониторинг пациентов с травмами
- •Инфузионная терапия
- •Премедикация, индукция и поддержание анестезии
- •Алгоритм работы анестезиолога-реаниматолога при поступлении больного с травмой
- •Анестезия при операциях на стопе и кисти
- •Анестезия при травматических повреждениях костей таза
- •Анестезия при травмах органов живота
- •Анестезия при травме позвоночника и спинного мозга
- •Анестезия при ожоговой травме
- •Анестезия при тотальном эндопротезировании тазобедренного сустава
- •Анестезия при операциях по поводу переломов проксимального конца бедренной кости
- •Анестезия при тотальном эндопротезировании коленного сустава
- •Анестезия при артроскопических операциях
- •Федерального агентства по здравоохранению
- •Оглавление
- •1. Введение
- •1.1. Актуальность проблемы
- •1.2. Определения основных понятий
- •1.3. Последствия нутритивной (белково-энергетической) недостаточности
- •1.4. Цели, принципы и результаты нутритивной поддержки
- •Основные принципы проведения нутритивной поддержки
- •1.6. Показания к нутритивной поддержке
- •2. Оценка нутритивного статуса
- •2.1. Определения степени и выраженности белково-энергетической недостаточности
- •2.2. Определение энергопотребности
- •Дыхательный коэффициент (rq)
- •2.3. Определение потребности в основных нутриентах
- •2.4. Определение потребности в питательных веществах Потребность в белках
- •Потребность в углеводах
- •Потребность в жирах
- •Потребности в основных микронутриентах
- •3. Парентеральное питание
- •3.1. Показания к проведению парентерального питания
- •3.2. Противопоказания к проведению парентерального питания
- •3.3. Классификация компонентов парентерального питания
- •I Донаторы пластического материала
- •II Донаторы энергии:
- •Рекомендуемые дозировки углеводов
- •Три поколения жировых эмульсий
- •Рекомендуемые дозировки липидов
- •Растворы кристаллических аминокислот
- •Общие рекомендации по дозировке аминокислот
- •3.6. Правила проведения парентерального питания
- •Двух и трехкомпонентные мешки (методика «Все в одном»)
- •3.8. Осложнения парентерального питания
- •4. Энтеральное питание
- •4.1. Эффекты сбалансированного энтерального питания
- •4.2. Абсолютные противопоказания
- •4.3. Точки приложения энтеральной поддержки
- •(Назодуоденального) зонда и уход за ним.
- •Пути осуществления доступа для энтерального питания
- •4.4. Характеристика сред для энтерального питания
- •Стандарт качества современной энтеральной смеси:
- •Классификация современных энтеральных смесей
- •Варианты энтерального питания:
- •4.6. Пероральное энтеральное питание
- •Правила приема гиперкалорических энтеральных диет:
- •Показания к применению пероральных диет в хирургии
- •Основные эффекты гиперкалорической пероральной нутритивной терапии
- •4.7. Зондовое энтеральное питание
- •4.8. Осложнения энтерального питания и их профилактика
- •1.Механические
- •2. Желудочно- кишечные (неаспирационные)
- •4.9. Синдром кишечной недостаточности при критических состояниях и принципы его коррекции
- •5. Система стандартных лечебных диет
- •Система стандартных диет
- •Характеристика и состав стандартных диет
- •6. Специализированные продукты питания
- •7. Оценка эффективности нутритивной поддержки
- •9. Алгоритм нутритивной поддержки
- •1 Этап - стартовая терапия:
- •Нутритивной поддержки
- •Шаг 5. Нутритивная поддержка не проводится в следующих случаях:
- •10. Фармакоэкономическое
- •11. Список литературы
- •Квалификационный экзамен Раздел «Фундаментальные основы специальности»
- •Квалификационный экзамен Раздел «Фундаментальные основы специальности»
- •Квалификационный экзамен Раздел «Фундаментальные основы специальности»
- •Квалификационный экзамен Раздел «Фундаментальные основы специальности»
- •Квалификационный экзамен Раздел «Фундаментальные основы специальности»
- •Квалификационный экзамен Раздел «Фундаментальные основы специальности»
- •Квалификационный экзамен Раздел «Фундаментальные основы специальности»
- •Квалификационный экзамен Раздел «Клиническая анестезиология»
- •Квалификационный экзамен Раздел «Клиническая анестезиология»
- •Квалификационный экзамен Раздел «Клиническая анестезиология»
- •Квалификационный экзамен Раздел «Клиническая анестезиология»
- •Квалификационный экзамен Раздел «Клиническая анестезиология»
- •Квалификационный экзамен Раздел «Клиническая анестезиология»
- •Квалификационный экзамен Раздел «Клиническая анестезиология»
- •Квалификационный экзамен Раздел «Клиническая реаниматология»
- •Квалификационный экзамен Раздел «Клиническая реаниматология»
- •Квалификационный экзамен Раздел «Клиническая реаниматология»
- •Квалификационный экзамен Раздел «Клиническая реаниматология»
- •"Клинические случаи в анестеЗиологии"
- •Рид а.П., Каплан Дж.А.
- •Перевод с английского –м. Медицина, 1995 г.
- •Ситуационные задачи.
- •Тестовые задания порубежного контроля
- •1. Социальная гигиена является наукой, изучающей
- •Раздел 12
- •Раздел 13
- •Раздел 14
- •Раздел 16
- •Раздел 20
- •Раздел 24
- •Раздел 12 АнестезиЯ, реанимациЯ и интенсивнаЯ терапиЯ в нейрохирургии и патологии нервной системы
- •Раздел 13 АнестезиЯ и интенсивнаЯ терапиЯ при заболеваниЯх эндокринной системы
- •Раздел 14
- •АнестезиЯ и интенсивнаЯ терапиЯ
- •При операциЯх у больных
- •С сопутствующими заболеваниЯми
- •Раздел 16 АнестезиЯ, интенсивнаЯ терапиЯ и реанимациЯ в акушерстве и гинекологии
- •Раздел 20 РеанимациЯ и интенсивнаЯ терапиЯ у детей
- •Раздел 24 Основы радиационной медицины
- •Образцы тестовых вопросов прИведены
- •Вопросы к контрольно – семинарским занятиям «Анестезия в плановой абдоминальной хирургии»
- •«Анестезия в экстренной абдоминальной хирургии»
- •«Наркозно – дыхательная аппаратура»
- •Особенности анестезии при сопутствующем сахарном диабете
- •«Анестезия при эндоскопических операциях. Амбулаторная анестезия. Анестезия в стоматологии и оториноларингологии»
- •«Ит в послеоперационном периоде»
- •«Искусственная вентиляция легких в реаниматологии»
- •«Острые отравления и методы детоксикации»
- •«Осложнения катетеризации центральных вен.»
- •«Плановая анестезиология»
- •«Экстренная анестезиология»
- •«Методы реаниматологии».
- •«Интенсивная терапия»
Список литературы
Анестезия в педиатрии: Руководство (под ред. Грегори Дж.А.; пер. с англ. Карачунского М.А., Мельникова Е.В., Митрохина А.А. и др.) - 1192 с., М: Медицина, 2003;
В.И. Гордеев, Ю.С. Александрович. Педиатрическая анестезиология – реаниматология, частные разделы. Санкт-Петербургское медицинское издательство, 2004;
Дж. Эдвард Моган-мл., Мэгид С. Михаил. Клиническая анестезиология, книга третья. Перевод с английского под редакцией академика РАМН А.А. Бунятяна, канд. мед. Наук А.М. Цейтлина. Издательство Бином, Москва, 2003;
Интенсивная терапия в педиатрии. Практическое руководство. Под редакцией В.А. Михельсона. Москва, издательский дом «Гэотар-мед», 2003
С.В. Ражев, С.М. Степаненко, В.А. Сидоров. Лекарственные препараты в детской анестезиологии и интенсивной терапии (для детских анестезиологов-реаниматологов). Под редакцией члена-корреспондента РАМН профессора В.А. Михельсона. Медицинский информационный центр «ИнтерМедЛайн», 1997.
Государственное образовательное учреждение
высшего профессионального образования
«ЯРОСЛАВСКАЯ ГОСУДАРСТВЕННАЯ
МЕДИЦИНСКАЯ АКАДЕМИЯ
Федерального агентства по здравоохранению
и социальному развитию»
Кафедра анестезиологии и реаниматологии
с курсом ФПК и ППСЗ
П.А.Любошевский, А.В.Забусов
СОВРЕМЕННЫЕ ПОДХОДЫ
К РЕСПИРАТОРНОЙ ПОДДЕРЖКЕ
ПРИ ОСТРОМ РЕСПИРАТОРНОМ
ДИСТРЕСС–СИНДРОМЕ
(Учебное пособие
для клинических ординаторов и врачей)
Ярославль, 2006
УДК: 616.24 – 008.4 – 08
ББК: 53.5 + 54.12
Современные подходы к респираторной поддержке при остром респираторном дистресс-синдроме - Учебное пособие для клинических ординаторов и врачей, Ярославль, 2006, 39 с., ил.
Авторы:
П.А.Любошевский – ассистент кафедры анестезиологии и реаниматологии Ярославской государственной медицинской академии, кандидат медицинских наук.
А.В.Забусов – заведующий кафедрой анестезиологии и реаниматологии Ярославской государственной медицинской академии, доцент, кандидат медицинских наук, главный специалист Департамента здравоохранения и фармации Администрации Ярославской области.
Рецензент:
С.В.Свиридов заведующий кафедрой анестезиологии и реаниматологии Российского государственного медицинского университета, профессор, доктор медицинских наук
В учебном пособии подробно изложены основные патофизиологические и клинические аспекты острого респираторного дистресс-синдрома, а также современные подходы к респираторной поддержке на различных этапах его лечения. Рассмотрены основные современные методы и режимы управляемой и вспомогательной ИВЛ.
Настоящее учебное пособие составлено на кафедре анестезиологии и реаниматологии с курсом ФПКиППСЗ Ярославской государственной медицинской академии и предназначено для клинических ординаторов и врачей – анестезиологов-реаниматологов.
Рекомендовано к изданию: методическим советом Академии по последипломному образованию.
Протокол № 2 от 15 февраля 2006 г.
Разрешено к печати: центральным координационно-методическим советом и редакционно-издательским советом Академии.
Ярославль, 2006
СОДЕРЖАНИЕ
|
Введение ………………………………………………………….. |
4 |
|
Оценка тяжести и стадии ОРДС ………………………………… |
9 |
|
Задачи респираторной поддержки при ОРДС …………………. |
11 |
|
Классификация методов респираторной поддержки ………….. |
12 |
|
Стратегия управляемой вентиляции легких при ОРДС ……….. |
14 |
|
Основные параметры вентиляции легких ……………………… |
16 |
|
Режимы вспомогательной вентиляции легких …………………. |
28 |
|
Отлучение больного от респиратора ……………………………. |
33 |
|
Литература ………………………………………………………... |
38 |
ВВЕДЕНИЕ
Острый респираторный дистресс-синдром был впервые описан Ashbaugh et al. в 1967 году как клинический синдром, состоящий из одышки, тахипноэ, рефрактерного к кислородотерапии цианоза, снижения комплайнса легких и диффузной инфильтрации на рентгенограмме грудной клетки.
В 1994 году состоялась американо-европейская согласительная конференция, давшая следующее определение:
Острое повреждение легких (ОПЛ, ALI, Acute Lung Injury) / Острый респираторный дистресс-синдром (ОРДС, ARDS, Acute Respiratory Distress Syndrome) – воспалительный синдром, связанный с повышением проницаемости альвеолярно-капиллярной мембраны и ассоциированный с комплексом клинических, рентгенологических и физиологических нарушений, которые не могут быть объяснены наличием левопредсердной или легочной капиллярной гипертензией.
Критериями диагноза ОРДС / ОПЛ являются:
Острое начало;
Отношение парциального напряжения кислорода в артериальной крови (РаО2) к фракции кислорода во вдыхаемой смеси (FiO2) < 200 мм Hg, для ОРДС и < 300 мм Hg для ОПЛ, не взирая на уровень положительного давления в конце вдоха (ПДКВ);
Двусторонняя инфильтрация легких на фронтальной рентгенограмме грудной клетки;
Давление заклинивания в легочной артерии (ДЗЛА) < 18 mm Hg
Таким образом, разница между ОРДС и ОПЛ состоит в степени выраженности гипоксемии; фактически это формы (стадии) одного патологического процесса – острого паренхиматозного поражения легких. Термин ОПЛ может быть применен к широкому спектру патологических процессов в паренхиме лёгких. Термин ОРДС должен быть отнесен к самой тяжелой группе этого спектра, то есть ОРДС является крайним проявлением ОПЛ.
Распространенность ОРДС составляет в среднем 1,5 – 10 случаев на 100 000 населения в год, летальность – от 20 до 71% (столь широкий разброс цифр связан с тем, что единые критерии определения ОРДС только начинают входить в клиническую практику). Современные тенденции в эпидемиологии состоят в увеличении частоты развития ОРДС (вследствие повышения эффективности лечения критических состояний) и некотором снижении летальности.
ОРДС может развиваться вследствие действия как прямых, так и непрямых повреждающих факторов, в последнее время выделяют «pulmonary ARDS» и «extrapulmonary ARDS», т.е. «легочный» и «внелегочный» - в зависимости от причин, его вызвавших. Существуют определенные различия в патогенезе и тактике респираторной терапии в зависимости от причин ОРДС.
«Прямые» факторы риска:
Документированная аспирация желудочного содержимого
Контузия легких: локализованный инфильтрат, появившийся на рентгенограмме в течение 6 ч после тупой травмы груди.
Пневмония: наличие инфильтрата на рентгенограмме, плюс любые 3 из следующих четырех факторов:
наличие гнойной мокроты;
патогенные культуры в посевах мокроты или крови;
температура тела > 38,5°С или < 36°С;
лейкоциты > 12 000 в мм3, или < 3 500 в мм3, или > 20% незрелых форм.
Ингаляционные повреждения, приводящие к развитию гипоксемии в течение 3 – 6 суток.
Утопление
Искусственная вентиляция легких
«Непрямые» факторы риска:
Шок: артериальная гипотензия длительностью более 2 ч. (систолическое АД < 100 мм Hg, или среднее АД < 85 мм Hg, или необходимость применения инотропных препаратов для поддержания среднего АД > 85 мм Hg). При шоке вероятность развития ОПЛ зависит от тяжести и продолжительности метаболического ацидоза и объема перелитых кристаллоидов.
Тяжелый сепсис (сепсис с органной дисфункцией)
Массивные гемотрансфузии: замещение более 40 – 50% ОЦК в течение 24 ч (инфузия > 5 стандартных доз (450 мл) цельной крови, или более 4 – 5 стандартных пакетов эритроцитарной массы (200 мл эритроцитов и лейкоцитов + 100 мл плазмы))
Множественные переломы (двух и более трубчатых костей)
Тяжелая преэклампсия, эклампсия
Ожог более 28% поверхности тела (II – III степени).
Острый панкреатит при уровне амилазы трехкратно превышающем верхнюю границу нормы.
Передозировка некоторых лекарственных препаратов (опиаты, барбитураты, некоторые сердечно-сосудистые средства)
Искусственное кровообращение
Во всех случаях развитие ОРДС связано с неспецифическим синдромом системной воспалительной реакции (ССВР, SIRS), и практически всегда он является компонентом полиорганной недостаточности. Различия в патогенезе «легочного» (развивающегося в результате действия прямых повреждающих факторов) и внелегочного (действие непрямых факторов) состоят в основном в последовательности событий. В первом случае первично возникает повреждение легких, запускающее ССВР, во втором – существование ССВР вызывает паренхиматозное повреждение легких. «Медиаторная буря», характерная для ССВР, сопровождается повреждением эндотелия легочных капилляров, эпителия, сурфактанта, нарушением мембранной проницаемости, регуляции сосудистого и бронхиального тонуса, бронхиальной секреции и мукоцилиарного клиренса и т.д.
Основными патофизиологическими характеристиками ОРДС являются:
Повышение содержания внесосудистой воды в легких некардиогенный отек) со снижением их растяжимости. В клинике растяжимость собственно легких оценить трудно, оценивается растяжимость системы «легкие – грудная клетка», которая складывается из 2 составляющих. Количественно растяжимость (податливость) легких и грудной клетки определяется по величине комплайнса (прирост объема легких на единицу инспираторного давления). Обычно определяется т.н. статический комплайнс (Cstat), равный отношению дыхательного объема к разности давления в конце вдоха (давление плато, Ppl) и давления на выдохе (РEEP), нормальные значения для взрослых составляют 70 – 100 мл/см Н2О. Снижение комплайнса является основной причиной повышения работы и «кислородной цены» дыхания и утомления дыхательной мускулатуры при паренхиматозной дыхательной недостаточности. При «легочном» ОРДС преимущественно снижается комплайнс легких, при «внелегочном» - грудной клетки.
Поражение сурфактанта
Коллабирование альвеол, напрямую связанное в повреждением сурфактанта, приводит к снижению объема функционирующей легочной паренхимы. Принудительное расправление спавшихся альвеол практически невозможно при обычных режимах ИВЛ. Поэтому при ОРДС вентилируется лишь часть альвеол («младенческое легкое»), в относительно интактных участках (как правило, вышележащих).
Нарушение перфузии легких (нарушения сосудистого тонуса, агрегация форменных элементов крови, внутрисосудистое свертывание).
Нарушение регионарных вентиляционно-перфузионных соотношений. «Медиаторная буря», возникающая при SIRS, вызывает нарушение регуляции тонуса легочных сосудов. В норме существует рефлекс Von Euler’а – гипоксическая вазоконстрикция, т.е. спазм ветвей легочных артериальных сосудов, кровоснабжающих невентилируемые участки. Угнетение данного рефлекса приводит к шунтированию крови, которое является основной причиной гипоксемии при ОРДС. Также увеличивается объем мертвого пространства, т.е. количество альвеол, которые вентилируются, но не перфузируются.
Обструктивные нарушения (бронхиолоспазм, повышение продукции и нарушение реологических свойств мокроты)
Диффузионный блок (отек альвеолокапиллярной мембраны, образование гиалиновых мембран)
Принципиальной особенностью является то, что поражение легких имеет негомогенный характер, т.е. при ОРДС в легких соседствуют интактные и поврежденные участки. Понимание этого имело важнейшее значение для формирования современной концепции респираторной поддержки при ОРДС.
|
|
Рисунок 1. Компьютерная томограмма грудной клетки при ОРДС – картина "влажной губки". Пораженные участки в дорзальных (нижележащих) сегментах соседствуют с относительно интактными вышележащими участками |
Степень поражения имеет гравитационную зависимость – в большей степени подвержены инфильтрации и коллабированию нижележащие участки легких. В норме альвеолы поддерживаются в раскрытом состоянии (кроме сурфактанта, снижающего поверхностное натяжение) транспульмональным давлением, которое снижается в направлении сверху вниз. В условиях повышения собственной массы легких (вследствие инфильтрации) транспульмональное давление снижается более резко, преимущественно в нижних отделах, что и способствует ателектазированию нижних («зависимых») участков.
Оценка тяжести и стадии ОРДС
Для объективной оценки тяжести повреждения легких (в том числе, в динамике на фоне лечения) предложено несколько индексов:
Индекс оксигенации, ИО = PaO2/FiO2
Индекс Tharrat, ИТ = (FiO2 ×Ppeak) / (PaO2 × 10)
Для объективизации тяжести повреждения легких предложены также более сложные шкалы, из которых наибольшее распространение получила шкала J.Murray (Lung Injury Score).
Таблица 1
Шкала J.Murray
|
Рентгено-графия: |
Альвеолярной инфильтрации нет |
0 баллов |
|
Альвеолярная инфильтрация 1 квадрант |
1 балл | |
|
Альвеолярная инфильтрация 2 квадранта |
2 балла | |
|
Альвеолярная инфильтрация 3 квадранта |
2 балла | |
|
Альвеолярная инфильтрация 4 квадранта |
2 балла | |
|
Гипоксемия: |
PaO2/FiO2 >300 мм Hg |
0 баллов |
|
PaOj/FiO2 299-255 мм Hg |
1 балл | |
|
PaO2/FiO2 254-175 мм Hg |
2 балла | |
|
PaO2/FiO2 174-100 мм Hg |
3 балла | |
|
PaO2/FiO2 < 100 мм Hg |
4 балла | |
|
Торакопульмональная податливость: |
> 80 мл/см Н2О |
0 баллов |
|
79 – 60 мл/см Н2О |
1 балл | |
|
59 – 40 мл/см Н2О |
2 балла | |
|
39 – 20 мл/см Н2О |
3 балла | |
|
< 20 мл/см Н2О |
4 балла | |
|
ПДКВ при ИВЛ: |
0 – 5 см Н2О |
0 баллов |
|
6 – 8 см Н2О |
1 балл | |
|
9 – 11 см Н2О |
2 балла | |
|
12 – 14 см Н2О |
3 балла | |
|
> 14 см Н2О |
3 балла |
Общая сумма баллов делится на число исследованных признаков. Оценка:
0 – поражения лёгких нет;
0 – 2,5 – умеренное поражение;
> 2,5 – тяжёлый синдром ОПЛ.
Таблица 2
Клинико-инструментальные стадии ОРДС
|
Характеристика |
Стадия ОРДС | |||
|
I |
II |
III |
IV | |
|
|
|
|
|
|
|
ЦНС |
Эйфория |
Возбуждение |
Оглушение |
Сопор, кома |
|
Органы дыхания |
Тахипноэ (не всегда). Жёсткое дыхание
|
Выраженная одышка. Зоны ослабленного дыхания |
Тахипноэ со снижением ДО, участие вспомогательной мускулатуры, цианоз |
Разнообразные нарушения ритма дыхания. Множество влажных хрипов |
|
Гемодинамика |
Тахикардия (не всегда) |
Стойкая тахикардия |
Выраженная тахикардия, часто гипертензия |
Аритмии, гипотензия, требующая инотропной поддержки |
|
Газы крови |
Гипоксемия, устраняемая ингаляцией кислорода, ± гипокапния |
Гипоксемия, резистентная к ингаляции кислорода и выраженная гипокапния |
Выраженная гипоксемия, нарастает гиперкапния |
Гипоксемия и гиперкапния корректируются только "агрессивными" режимами ИВЛ |
|
Рентгенограмма легких |
Усиление лёгочного рисунка, двусторонние мелкоочаговые тени |
Сливные тени, симптом "воздушной бронхографии" |
Множественные сливающиеся тени, ± выпот в плевральных полостях |
Затемнение больших участков, признаки отека легких |
|
Летальность |
Близка к 0 |
До 50% |
До 75% |
До 100% |
ЗАДАЧИ РЕСПИРАТОРНОЙ ПОДДЕРЖКИ ПРИ ОРДС
Респираторная поддержка является ключевым моментом в лечении ОРДС. Ее основные задачи:
Поддержание газообмена в легких
Снижение работы дыхания и его «кислородной цены», т.е. доли транспорта кислорода, идущей на работу дыхательной мускулатуры
Терапевтическое воздействие (как минимум, отсутствие повреждающего влияния) на легочную паренхиму, т.е., в первую очередь, препятствование ателектазированию и гиперинфляции альвеол и их дополнительной травме (в соответствии с концепцией «open lung rest» – «открытое легкое отдыхает»).
Если необходимость поддержания газообмена почти всегда очевидна, то две другие, не менее важные, задачи часто ускользают от внимания клиницистов, вызывая неоправданное промедление с началом применения методов респираторной поддержки.
Респираторная поддержка также должна обладать минимальным влиянием на функцию других органов и систем. В этом плане на первое место выступают возможные нарушения гемодинамики. Важно отметить, что неблагоприятные эффекты ИВЛ на гемодинамику (достаточно хорошо изученные на нормальных легких в конце прошлого века) реализуются через повышение внутриплеврального давления. В условиях ОРДС эти эффекты уменьшаются вследствие снижения растяжимости (комплайнса) легких, т.е. положительное давление в дыхательных путях в меньшей степени влияет на внутриплевральное. Особенно справедливо это для «легочного» ОРДС, когда снижается преимущественно растяжимость легких и даже выраженное повышение давления в дыхательных путях скорее приведет к баротравме, чем к нарушениям гемодинамики. При «внелегочном» ОРДС со снижением комплайнса грудной клетки, нарушения гемодинамики более возможны. В целом при ОРДС показатели гемодинамики на фоне адекватной респираторной поддержки имеют тенденцию к нормализации (за счет устранения гипоксемии). То же относится и к влиянию респираторной поддержки на функции и структуру легких.
Классификация методов
респираторной поддержки
Ситуация с классификацией методов и режимов респираторной поддержки достаточно сложна, в немалой степени из-за того, что производители респираторов часто обозначают одинаковые по сути режимы "своими" фирменными названиями. Нюансы перевода названий режимов на русский язык умножают существующий беспорядок. Единой классификации не существует, и этот вопрос остается предметом многих дискуссий. Для практического применения предлагается следующая классификация.
По доступу к дыхательным путям:
Инвазивная (через интубационную трубку или трахеостомическую канюлю)
Неинвазивная (через маску: назальную, ротоносовую, лицевую), используются, как правило, вспомогательные режимы с управлением по давлению.
По роли аппарата в определении дыхательного паттерна
Управляемая (контролируемая, принудительная) – респиратор полностью определяет характеристики режима вентиляции и выполняет всю работу дыхания без какого-либо участия пациента (например у больных в атонической коме или в состоянии миоплегии) – CMV, Control Mechanical Ventilation. Самостоятельное дыхание при CMV нежелательно, может приводить к баротравме и другим нежелательным последствиям.
Варианты CMV – вентиляция с управлением по объему / управляемым объемом (VC, Volume Control), с управлением по давлению (PC, Pressure Control) и их "гибриды" – PLV, Pressure Limited Ventilation (вентиляция с ограничением давления), PRVC = AutoFlow = VV+ = APV = VPC (вентиляция с заданным дыхательным объемом и автоматически изменяемыми уровнями давления и потока).
Вспомогательная вентиляция – пациент в той или иной степени "участвует" в регуляции параметров собственного дыхания и выполняет определенную часть работы дыхания (иногда минимальную, необходимую лишь для запуска аппаратного дыхательного цикла)
A/C – Assist/Control Ventilation, вспомогательно-принудительная вентиляция
SIMV / IMV – (Synchronized) Intermittent Mandatory Ventilation, (синхронизированная) перемежающаяся принудительная вентиляция
BIPAP = Bi-Vent = Bi-Level – Biphasic Positive Airway Pressure, двухфазное положительное давление в дыхательных путях
MMV = AutoMode – Mandatory Minute Ventilation, принудительная минутная вентиляция
VS, Volume Support, поддержка объемом
PS = ASB, Pressure Support = Assisted Spontaneous Breathing, поддержка давлением
Современные модификации PS – VAPS, PAV, PPS, ASV, ...
CPAP, Continuous Positive Airway Pressure, Постоянное положительное давление в дыхательных путях.
Синхронизация самостоятельного вдоха (или попытки вдоха) пациента и работы респиратора в любом из вспомогательных режимов осуществляется с помощью триггера. От четкости работы последнего в значительной степени зависит адекватность респираторной поддержки и комфорт пациента. Встречаются триггеры по давлению, реагирующие на снижение давления в дыхательном контуре, вызванное попыткой вдоха пациента. Такие системы требуют больше времени для отклика аппарата и некомфортны для больного (создают затруднение при вдохе). Более совершенны триггеры по потоку, реагирующие на поток в контуре, создаваемый или изменяющийся при вдохе пациента.
Чувствительность триггера устанавливается индивидуально, недостаточная чувствительность делает поддержку самостоятельного вдоха запоздалой (вызывая дискомфорт пациента и повышение работы дыхания), избыточная чувствительность триггера может привести к аутоциклированию, когда система будет реагировать аппаратными вдохами на различные помехи (например, связанные с раскачиванием шлангов контура пациента).
Во вспомогательных режимах с задаваемой частотой аппаратных дыхательных циклов (A/C, SIMV, BIPAP) существует также понятие «триггерного окна» – период времени, в течение которого респиратор «ждет» дыхательную попытку пациента. Идентификация в этот период попытки вдоха пациента приводит к запуску аппаратного вдоха. Если пациент попытается сделать вдох раньше (до начала триггерного окна), аппаратный вдох запущен не будет; если в пределах триггерного окна попытка вдоха не будет идентифицирована (например, при ее отсутствии или вследствие низкой чувствительности триггера), респиратор сам инициирует принудительный вдох по окончании времени ожидания. Таким образом, в отсутствие самостоятельного дыхания пациента параметры вентиляции в этих режимах мало чем будут отличаться от принудительной ИВЛ.
Стратегия управляемой
вентиляции легких у больных с ордс
До конца прошлого века существовала традиционная концепция в респираторной терапии ОРДС. Целью ставилось достижение нормальных показателей газообмена, для чего использовались высокие дыхательные и минутные объемы, фракционные концентрации кислорода. Данная концепция строилась на представлении об ОРДС как о гомогенном повреждении легких. Исследования последнего десятилетия, показавшие негомогенность поражения легочной паренхимы при ОРДС, сделали эту концепцию несостоятельной. По современным данным, легкие при ОРДС разделяются условно на 3 зоны: практически интактные участки (имеющие склонность к перерастяжению при высоком инспираторном давлении), нестабильные альвеолы, открывающиеся на вдохе и спадающиеся на выдохе (при нулевом или недостаточном давлении на выдохе), и стабильно ателектазированные участки. Использование высоких дыхательных объемов приводит к перерастяжению и баро/волюмотравме интактных участков, "хлопанью" нестабильных альвеол, и даже теоретически не может расправить ("рекрутировать") ателектазированные участки легких. В результате такой режим респираторной поддержки сам по себе является повреждающим фактором. В литературе существует термин "вентилятор-ассоциированное / индуцированное повреждение легких" (Ventilator-associated / induced lung injury)1.
Факторы риска VALI/VILI:
FiO2 > 0,6 в течение 6 – 8 часов
Пиковое давление вдоха более 35 см Н2О
Высокий ДО (> 10 мл/кг)
Потребность в высоком минутном объеме
Неравномерность вентиляции
Задержка бронхиального секрета
Молодой возраст
Хронический алкоголизм
По современным данным, баротравма легких (т.е. травма повышенным давлением) наблюдается у 13 – 20% всех больных на ИВЛ, при ОРДС ее частота достигает 30%, причем в 2 – 14% случаев она является непосредственной причиной летального исхода. Существуют также понятия волюмотравмы (травмы высоким объемом, перерастяжением альвеол), биотравмы (выбросом из легких биологически активных веществ) и ателектотравмы (травмы вследствие ателектазирования), все они во многом связаны с некорректным проведением респираторной поддержки.
Все вышесказанное привело к рождению концепции "протективной ИВЛ", в основе которой лежит представление о негомогенности поражения легочной паренхимы и необходимости защиты интактных и нестабильных участков легких от повреждающего действия самой респираторной поддержки.
Основные ее принципы:
Минимальная FiO2
Снижение пикового давления и ДО
Использование ПДКВ
Допустимая гипоксемия и гиперкапния
«Агрессивные» режимы – только при резистентной критической гипоксемии
Постуральная терапия
Синхронизация седацией и миоплегией
ОСНОВНЫЕ ПАРАМЕТРЫ ВЕНТИЛЯЦИИ ЛЕГКИХ
Дыхательный объем (Vt, Tidal Volume)
В 2001 году опубликованы результаты многоцентрового исследования, которое имело целью сравнить эффективность при ОРДС/ОПЛ низких (6 мл/кг) и высоких (12 мл/кг) дыхательных объемов. Исследование было прекращено досрочно в связи с тем, что летальность при использовании высоких ДО оказалась выше почти на 1/3. Хотя до конца этот вопрос не закрыт, ясно одно: дыхательный объем при ОРДС должен быть максимально ограничен.
Рекомендуемая величина ДО составляет обычно 6 – 8 мл/кг массы тела.
ДЫХАТЕЛЬНЫЙ ОБЪЕМ РАССЧИТЫВАЕТСЯ ИСХОДЯ ИЗ ДОЛЖНОЙ МАССЫ ТЕЛА.
ДМТ = 50 + 0,91 × (рост – 152,4) для мужчин
ДМТ = 45,5 + 0,91 × (рост – 152,4) для женщин
При выборе ДО обращают внимание также на величины давления на вдохе: пиковое давление не должно превышать 35 см H2O, давление плато – 30 см Н2О.
Управление: по давлению или по объему?
Вентиляция с управлением по объему (VCV, volume control ventilation).
Респиратор создает поток определенного профиля и продолжительности, т.е. доставляет в легкие за определенное время заданный дыхательный объем (дыхательный объем равен площади под кривой потока на графике).
Устанавливается дыхательный объем и частота дыханий, их произведение равно минутной вентиляции. Частота дыханий (f) определяет продолжительность дыхательного цикла (60 сек/f). Продолжительность фазы вдоха устанавливается или напрямую (в секундах), или из соотношения вдоха и выдоха I/E (подробнее см. ниже), например, при f = 15 продолжительность дыхательного цикла = 60/15 = 4 сек. и при соотношении вдоха и выдоха 1/1 продолжительность вдоха равна 2 секундам.
Фаза вдоха разделяется на собственно вдох и инспираторную паузу, в течение которой закрыты клапаны вдоха и выдоха, поток в контуре равен нулю и происходит распределение воздуха в легких. Продолжительность инспираторной паузы может устанавливаться на разных респираторах напрямую (в процентах от длительности дыхательного цикла или секундах) или путем изменения скорости потока. Если скорость потока невелика (рисунок 2а), то дыхательной объем подается в легкие в течение всего времени вдоха и времени на инспираторную паузу «не остается». При высокой скорости потока (рисунок 2б) дыхательный объем «успевает» доставляться за время меньшее, чем продолжительность вдоха, оставшийся период – это и есть инспираторная пауза.
Считается, что инспираторная пауза способствует более равномерному распределению газов в поврежденных легких.
|
Рисунок 2а Кривые давления и объема при низкой величине инспираторного потока |
Рисунок 2б Кривые давления и потока при высоком инспираторном потоке (стрелка – инспираторная пауза) |




Инспираторная пауза указана стрелками на рисунках 2а и 2б. На графике «давление-время» инспираторной паузе соответствует т.н. давление плато (Ppl), на графике «поток-время» – нулевое значение потока между вдохом и выдохом.
Раздувание легких сопровождается повышением давления в дыхательных путях, которое зависит от величины дыхательного объема, аэродинамического сопротивления и растяжимости (комплайнса) легких и грудной клетки: чем меньше растяжимость, тем выше инспираторное давление. Давление достигает максимума (пиковое давление) в момент окончания инспираторного потока. Меньшая скорость инспираторного потока вызывает меньшее повышение пикового давления (как видно на рисунках 2а и 2б), что снижает вероятность баротравмы.
На рисунках 3а и 3б представлены кривые давления и потока при идентичных параметрах вентиляции у здорового субъекта и у пациента с ОРДС. Обращает на себя внимание разница в величине давления на вдохе.
Комплайнс легких и грудной клетки определяется как отношение дыхательного объема к разности между Рpl и PEEP.
|
Рисунок 3а Графики давления и потока при VCV у здорового субъекта |
Рисунок 3б Графики давления и потока при VCV у пациента с ОРДС |
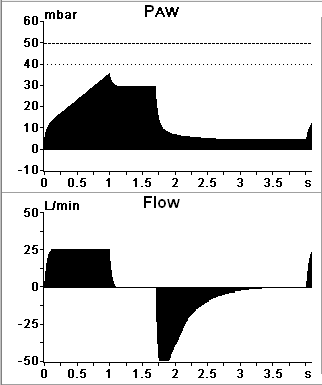

Достоинством VCV является то, что величина дыхательного объема (а следовательно, и минутной вентиляции) остается постоянной. Основной недостаток – в случае снижения комплайнса инспираторное давления может существенно повышаться, приводя к баротравме.
Вентиляция с управлением по давлению (РСV, pressure control ventilation).
Аппарат на определенный период времени повышает до заданного уровня давление в дыхательных путях. Это сопровождается раздуванием легких. Величина дыхательного объема зависит от комплайнса легких и грудной клетки: чем он ниже, тем меньше дыхательный объем. На рисунках 4а и 4б представлены кривые давления и потока при PCV у здорового субъекта и при ОРДС. Обращает на себя внимание различие в величине дыхательного объема (площади под кривой потока).
|
Рисунок 4а Графики давления и потока при РCV у здорового субъекта |
Рисунок 4б Графики давления и потока при РCV у пациента с ОРДС |
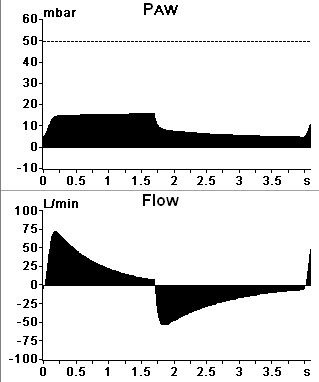

Достоинством PCV является постоянная величина инспираторного давления (снижение риска баротравмы). Кроме того, считается, что нисходящий профиль потока, который создается при PCV, способствует более равномерному распределению газа в легких. Основной недостаток – непостоянные значения дыхательного объема (ДО зависит от комплайнса), следовательно, возможность волюмотравмы при повышении комплайнса или (что чаще) гиповентиляции при его снижении.
Что важнее – поддержание постоянных параметров вентиляции или ограничение давления? На настоящий момент нет доказательных данных о преимуществах того или иного режима. Однако большинство исследователей считают более безопасной при ОРДС вентиляцию с управлением по давлению.
Наличие недостатков у обоих основных режимов привело к рождению их модификаций.
Вентиляция с ограничением давления (PLV, Pressure Limited Ventilation)
Дополнительно к параметрам вентиляции с управлением по объему задается предел давления (отмечен стрелкой). Респиратор в определенных пределах автоматически модифицирует форму потока таким образом, чтобы дыхательный объем был доставлен без превышения заданного давления (рисунок 5).
|
Рисунок 5 Вентиляция с ограничением давления | ||
|
а |
б |
в |
|
|
|
|
Если предел давления установлен достаточно большим (выше пикового инспираторного давления, рисунок 5а), графики давления и потока при неизменном значении комплайнса не будут отличаться от вентиляции с управлением по объему. При невысоком пределе инспираторного давления (на уровне давления плато, рисунок 5б) цикл напоминает вентиляцию с управлением по объему. Если предел давления слишком низкий (ниже давления плато, рисунок 5в), снижается дыхательный объем, срабатывает тревожная сигнализация (т.е. ограничение давления имеет приоритет над дыхательным объемом).
PRVC = AutoFlow = VV+ = APV = VPC (вентиляция с заданным дыхательным объемом и минимальным инспираторным давлением), рисунок 6.
З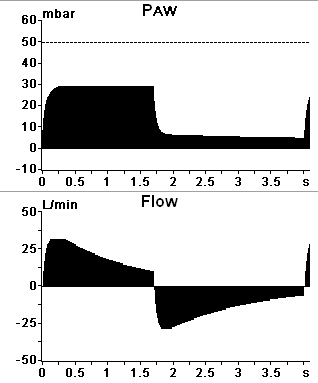 адается
значение дыхательного объема. Исходя
из реально существующих биомеханических
свойств легких (комплайнса, аэродинамического
сопротивления), респиратор модифицирует
поток таким образом, чтобы инспираторное
давление было минимальным (т.е. возможность
регулировки потока, инспираторной
паузы, инспираторного давления вообще
отсутствуют).
адается
значение дыхательного объема. Исходя
из реально существующих биомеханических
свойств легких (комплайнса, аэродинамического
сопротивления), респиратор модифицирует
поток таким образом, чтобы инспираторное
давление было минимальным (т.е. возможность
регулировки потока, инспираторной
паузы, инспираторного давления вообще
отсутствуют).
Как и в случае VCV, значения дыхательного и минутного объемов остаются постоянными, однако одной из задач респиратора является снижение инспираторного давления.
Минутный объем
Минутный объем дыхания устанавливается после оптимизации дыхательного объема путем изменения частоты дыханий. Цель – обеспечение нормокапнии (нормального парциального давления СО2).
Обсуждается использование при ОРДС допустимой (пермиссивной) гиперкапнии, т.е. гиповентиляции. Смысл этого состоит опять-таки в предоставлении функционального покоя легким, их механическом щажении. Во многих исследованиях доказано отсутствие каких-либо негативных влияний самой по себе гиперкапнии, вплоть до уровня РаСО2 в 80 и даже 100 мм Hg. Лимитирующим фактором здесь является уровень рН артериальной крови, который в любом случае не должен быть ниже 7,2. Наиболее очевидными противопоказаниями к использованию пермиссивной гиперкапнии являются ИБС и внутричерепная гипертензия.
Фракционная концентрация кислорода в смеси
Уже говорилось о том, что высокие фракционные концентрации кислорода являются повреждающим легочную паренхиму фактором. На настоящее время относительно безопасной при длительной ИВЛ считается FiO2 не более 40%. Одной из задач респираторной поддержки при ОРДС является обеспечение минимально достаточного (подчеркнем, не нормального) транспорта кислорода. В идеале оценка достаточности транспорта кислорода производится с учетом сердечного выброса и текущего потребления кислорода. В условиях ограниченности возможностей мониторинга можно говорить о достаточности транспорта кислорода при следующих параметрах:
PaO2 > 65 mm Hg, SaO2 > 92 – 94 %, при обязательном определении тех же показателей в смешанной венозной крови:
PvO2 > 35 mm Hg, SvO2 > 55%
Положительное давление в конце выдоха
Основной терапевтической мишенью применения ПДКВ при ОРДС являются нестабильные, "хлопающие" альвеолы. Отек и повреждение сурфактанта приводит к тому, что эти альвеолы, открытые на вдохе, на выдохе с нулевым давлением спадаются, что приводит к "выдавливанию" из них сурфактанта с его дальнейшим повреждением. В итоге это приводит к стойкому их ателектазированию (дальнейшему снижению объема функционирующей паренхимы). Применение адекватного ПДКВ препятствует ателектазированию нестабильных альвеол во время выдоха2.
Существует несколько способов подбора ПДКВ.
На основании изменений комплайнса. В определенных пределах увеличение ПДКВ приводит к повышению комплайнса. ПДКВ пошагово увеличивают до тех пор, пока это сопровождается ростом комплайнса (т.е. увеличением ДО при PCV, или снижением градиента Ppl – PEEP при VCV). Метод прост технически, но полученные с его помощью значения оптимального ПДКВ, как правило, завышены.
На основании изменений оксигенации. В терапевтическом диапазоне ПДКВ его увеличение ведет к практически линейному увеличению оксигенации крови. ПДКВ увеличивают до тех пор, пока это сопровождается ростом SaO2 и PaO2. Метод также отличается простотой и тенденцией к завышению подобранного ПДКВ
На основании данных графического мониторинга. Даже в современных руководствах можно встретить описание метода подбора ПДКВ на основании анализа инспираторной части кривой "объем-давление". В действительности Lower Inflexion Point отражает лишь изменения комплайнса, в лучшем случае, давление, при котором нестабильные альвеолы открываются, тогда как ПДКВ призвано предотвратить их закрытие. В результате опять-таки значения ПДКВ получаются завышенными. Для подбора ПДКВ может быть использована экспираторная часть кривой "объем-давление", но и это остается спорным
На основании анализа транспорта кислорода. ОПТИМАЛЬНОЕ ПДКВ – ТО, ПРИ КОТОРОМ МАКСИМАЛЕН ТРАНСПОРТ КИСЛОРОДА. ПДКВ ступенчато увеличивают, что сопровождается повышением РаО2 и SpO2. При увеличении ПДКВ выше определенного уровня наблюдается снижение сердечного выброса и в итоге – доставки кислорода. Оптимальное значение ПДКВ устанавливается на 2 см Н2О ниже этого уровня. В отсутствие мониторинга гемодинамики косвенными признаками снижения сердечного выброса являются рутинные показатели гемодинамики (АД, ЧСС, ЦВД), а также градиент между показателями оксигенации артериальной и смешанной венозной крови (снижение PvO2 и SvO2 после очередного повышения ПДКВ свидетельствует о снижении сердечного выброса).
В большинстве клинических ситуаций оптимальное значение ПДКВ укладывается в диапазон от 5 до 15 см Н2О.
Отношение вдох / выдох
В норме продолжительность вдоха и выдоха соотносятся как 1 : 1,3. При респираторной поддержке у больных с ОРДС иногда применяется так называемое инверсированное соотношение вдоха и выдоха (IRV, Inverse Ratio Ventilation), 1 : 1 и выше, т.е. удлиняется фаза вдоха и укорачивается фаза выдоха. Обратное (инверсированное) соотношение вдоха и выдоха достигается при VCV удлинением времени вдоха, снижением скорости потока или удлинением инспираторной паузы (как представлено на рисунке 7), при PCV - непосредственным удлинением продолжительности вдоха.
|
Рисунок 7 Изменение соотношения вдоха и выдоха | ||
|
а – 1/1,5 |
б – 1/1 |
в – 1,5/1 |





Удлинение времени инспирации повышает равномерность распределения газа в легких и позволяет снизить скорость потока и, следовательно, инспираторное давление. Укорочение времени экспирации создает эффект "воздушной ловушки", т.е. воздух к началу следующего вдоха не успевает полностью покинуть легкие, в результате создается так называемое внутреннее ПДКВ, или аутоПДКВ. Этот эффект усиливается при наличии обструктивных нарушений и, следовательно, более выражен в пораженных участках легких. На современных респираторах возможно измерить внутренне ПДКВ и определить объем «задержавшегося» в легких газа. Качественно определить наличие аутоПДКВ можно по кривой «поток-время»: к моменту начала очередного вдоха экспираторный поток не достигает нулевого значения (стрелки на рисунках 7б и 7в).
Потенциальные преимущества:
АутоПДКВ воздействует в большей степени на пораженные участки
Повышение среднего давления без роста инспираторного позволяет повысить оксигенацию
Проблемы при использовании IRV:
Затруднен контроль – измерение аутоПДКВ возможно не на всех респираторах, кроме того, реальное аутоПДКВ в пораженных участках может оказаться значительно выше измеренного (на уровне контура аппарата), приводя к баротравме.
Возможно быстрое и значительное нарастание аутоПДКВ, например, при повышении частоты дыханий (сокращается абсолютная продолжительность фазы выдоха) или при обструкции мокротой.
Применение инверсированного соотношения вдох / выдох некомфортно для больного, режим, как правило, требует дополнительной седации и часто – миоплегии.
Исходя из этого, применение вентиляции с обратным соотношением вдох / выдох следует рекомендовать лишь в тех случаях, когда оптимизация дыхательного и минутного объемов, FiO2, внешнего ПДКВ не позволяет добиться удовлетворительных показателей газообмена.
Степень инверсии не должна превышать 1,5 : 1
Величина аутоПДКВ не должна превышать 50% от общего
Резюме: Принципы протективной ИВЛ при ОРДС:
Дыхательный объем 6 – 8 мл / кг должной массы тела
Инспираторное давление не выше 30 – 35 см Н2О
Минутная вентиляция – до нормокапнии, пермиссивная гиперкапния (?)
FiO2 – минимальная для удовлетворительного транспорта кислорода
ПДКВ – соответствующее максимальному транспорту кислорода
Если оптимизация всех предыдущих параметров не позволяет добиться удовлетворительных показателей газообмена, использование IRV (соотношение не более 1,5 : 1).
Дополнительные приемы при респираторной поддержке у больных с ОРДС
Прон-позиция
Известно, что поражение легочной паренхимы при ОРДС негомогенно. Некардиогенный отек легких, характерный для ОРДС, более выражен в нижних отделах, где выше гидростатическое давление крови в капиллярах. Альвеолы поддерживаются в раскрытом состоянии за счет транспульмонального давления, величина которого также уменьшается в направлении сверху вниз (особенно значительно при увеличении собственной массы легких). В результате наиболее пораженные участки локализуются в задне-базальных отделах легких. Прон-позиция, т.е. положение на животе позволяет:
Уменьшить регионарные различия биомеханических свойств легких и вентиляционно-перфузионных отношений
Повысить транспульмональное давление в пораженных участках легких, что создает предпосылки для расправления ателектазов
Улучшить дренирование мокроты
Поворот больного в положение на животе в большинстве случаев, особенно при "внелегочном" ОРДС, сопровождается улучшением газообмена, уменьшением шунтирования крови. Эти эффекты достаточно кратковременны (особенно при выраженной гипергидратации), и уже через 4 – 6 часов показатели возвращаются к исходным значениям. Поэтому наиболее распространенные методики предусматривает попеременную смену положений на спине и на животе. Получены данные о стойком улучшении показателей газообмена и сокращении сроков респираторной поддержки, но пока нет данных о снижении летальности.
Маневр открытия альвеол (рекруирмент)
Величина давления, необходимого для расправления ателектазированных участков легких может достигать 60 и более см Н2О. Такие давления при длительном применении, несомненно, приведут к развитию баротравмы легких и нарушениям гемодинамики. Вместе с тем, давление, необходимое для поддержания альвеол в раскрытом состоянии значительно меньше и находится в терапевтическом диапазоне ПДКВ. Исходя из этого, предлагаются методики кратковременного (в течение нескольких минут) применения высоких инспираторных давлений (в условиях низкой частоты дыхания, полной миоплегии, расширенного мониторинга) для расправления ателектазов, "открытия легких" (преимущественно в ранних сроках 48 часов ОРДС). Прекращение нарастания комплайнса и оксигенации при очередном увеличении инспираторного давления говорит о том, что уже расправлены все способные к этому альвеолы ("точка открытия"). После нахождения давления открытия ступенчато снижается ПДКВ; снижение комплайнса и оксигенации свидетельствует о начале коллабирования альвеол (фиксируется "точка закрытия"). Затем легкие повторно раскрываются (инспираторное давление поднимается до "точки открытия"), ПДКВ устанавливается на 2 см Н2О выше "точки закрытия" и продолжается проведение протективной ИВЛ. Методика ограниченно применяется в ведущих клиниках, и из-за относительно малой изученности и определенного риска пока не нашла широкого клинического применения.
Режимы вспомогательной ИВЛ
Как уже говорилось, вспомогательная ИВЛ характеризуется сочетанием самостоятельного дыхания пациента и аппаратной поддержки. Синхронизация дыхательных попыток пациента и работы респиратора осуществляется с помощью триггера.
Рассмотренные режимы принудительной ИВЛ у больных с тяжелой паренхиматозной дыхательной недостаточностью часто некомфортны для пациента и требуют глубокой седации и часто – миоплегии. Длительное использование миорелаксантов чревато развитием периферической нейропатии, детренированием дыхательной мускулатуры, что замедляет процесс перехода на спонтанное дыхание даже при разрешении паренхиматозной дыхательной недостаточности. Поэтому в чистом виде принудительная ИВЛ применяется только в период наибольшей тяжести ОРДС, когда необходима точнейшая регулировка параметров респираторной поддержки, и любое вмешательство пациента приводит к их дестабилизации (например, к нарастанию внутреннего ПДКВ или пикового инспираторного давления). По мере разрешения клиники паренхиматозной дыхательной недостаточности пациенту предоставляется все большая свобода в регулировании параметров вентиляции, одновременно повышаются требования к респираторной поддержке: дополнительно она должна обеспечивать комфорт пациента и способствовать дозированному повышению нагрузки на дыхательную мускулатуру (тренировке).
Режим вспомогательно-принудительной вентиляции (А/С, Assist/Control).
Отличается от режимов принудительной вентиляции только включением триггера. Каждая попытка самостоятельного вдоха пациента в пределах триггерного окна инициирует аппаратный вдох с заданными характеристиками (управляемый по объему или давлению). В отсутствие (попыток) самостоятельного дыхания респиратор работает аналогично соответствующему режиму (VC, PC, PLV или PRVC) принудительной ИВЛ. Повышение частоты самостоятельного дыхания приводит к значительной гипервентиляции и сокращению времени выдоха с риском нарастания степени инверсии отношения вдох/выдох и внутреннего ПДКВ.
Синхронизированная перемежающаяся принудительная вентиляция (SIMV, Synchronized Intermittent Mandatory Ventilation), рисунок 8.
П опытка
самостоятельного вдоха пациента в
пределах триггерного окна инициирует
аппаратный вдох с заданными параметрами
(с управлением по давлению (как показано
на рисунке) или объему,PLV
или PRVC).
В отсутствие самостоятельного дыхания
аппарат по истечении времени ожидания
(приблизительно = 60сек/f)
запускает принудительный вдох, т.е.
параметры вентиляции практически не
будут отличаться от принудительной
вентиляции. В отличие от предыдущего
режима, на вдохи пациента, превышающие
установленную частоту, респиратор или
не реагирует («чистый» SIMV),
или реагирует поддержкой давлением или
объемом (SIMV
+ PS/VS).
Иными словами, респиратор дает возможность
пациенту дышать самостоятельно в
промежутках между аппаратными вдохами
(рисунок 8). Таким образом, задается
необходимая минимальная вентиляция,
пациент при возрастании респираторной
потребности может увеличивать минутную
вентиляцию за счет повышения частоты
дыханий.
опытка
самостоятельного вдоха пациента в
пределах триггерного окна инициирует
аппаратный вдох с заданными параметрами
(с управлением по давлению (как показано
на рисунке) или объему,PLV
или PRVC).
В отсутствие самостоятельного дыхания
аппарат по истечении времени ожидания
(приблизительно = 60сек/f)
запускает принудительный вдох, т.е.
параметры вентиляции практически не
будут отличаться от принудительной
вентиляции. В отличие от предыдущего
режима, на вдохи пациента, превышающие
установленную частоту, респиратор или
не реагирует («чистый» SIMV),
или реагирует поддержкой давлением или
объемом (SIMV
+ PS/VS).
Иными словами, респиратор дает возможность
пациенту дышать самостоятельно в
промежутках между аппаратными вдохами
(рисунок 8). Таким образом, задается
необходимая минимальная вентиляция,
пациент при возрастании респираторной
потребности может увеличивать минутную
вентиляцию за счет повышения частоты
дыханий.
Режим перемежающейся принудительной вентиляции (IMV, Intermittent Mandatory Ventilation) отличается от SIMV в худшую сторону – отсутствием синхронизации аппаратных вдохов с попытками самостоятельного дыхания.
Д вухфазное
положительное давление в дыхательных
путях (BIPAP,
BiVent,
BiLewel
- Biphasic
Positive
Airway
Pressure),
рисунок 9.
вухфазное
положительное давление в дыхательных
путях (BIPAP,
BiVent,
BiLewel
- Biphasic
Positive
Airway
Pressure),
рисунок 9.
Один из наиболее «пластичных» режимов респираторной поддержки из существующих на сегодняшний день. Эволюция данного режима начинается с CPAP-терапии (постоянное положительное давление в дыхательных путях), которая обеспечивает повышение показателей оксигенации (которые зависят в основном от среднего давления в дыхательных путях), но не практически не влияет на объем вентиляции. Для борьбы с гиповетиляцией было предложено использовать кратковременные «сбросы» давления (APRV, Airway Pressure Release Ventilation). После удлинения периодов сброса давления и появился BIPAP, который для простоты можно представить как вариант самостоятельного дыхания с постоянным положительным давлением при циклическом изменении значений давления. Основными управляемыми параметрами являются: значение высокого (Pinsp) и низкого (ПДКВ) давлений, продолжительность фаз и частота их смены. В отсутствие самостоятельного дыхания режим выглядит аналогично PCV. Однако специальный алгоритм работы клапанов вдоха и выдоха (активный клапан выдоха) позволяет больному дышать самостоятельно как в фазу высокого, так и в фазу низкого давления, при этом заданные значения давлений поддерживаются постоянными. Переход с низкого давления на высокое (соответствующий аппаратному вдоху) синхронизируется в пределах триггерного окна с попыткой самостоятельного вдоха, обратный переход – с попыткой выдоха больного. Дополнительно самостоятельное дыхание пациента может поддерживаться давлением (на современных респираторах в обе фазы). Режим позволяет в наилучшей степени достичь компромисса между комфортом пациента (а следовательно, снижается потребность в седации и миоплегии) и контролем параметров вентиляции и оксигенации.
Вентиляция с принудительным минутным объемом (MMV, Mandatory Minute Ventilation). В отличие от SIMV, в режиме MMV принудительные вдохи запускаются респиратором только в случае, если минутная вентиляция снижается ниже установленного предела. Если спонтанная минутная вентиляция выше предела, респиратор не выполняет принудительных вдохов, при ее снижении производятся периодические нерегулярные аппаратные вдохи (при этом сумма спонтанной и аппаратной вентиляции остается постоянной), при апноэ респиратор автоматически переходит на принудительную вентиляцию (с автоматическим же прекращением ее при восстановлении спонтанного дыхания). Спонтанные вдохи пациента могут поддерживаться давлением или объемом.
Следующие режимы не обеспечивают минимума принудительной вентиляции, поэтому предъявляют повышенные требования к мониторингу и используются в основном у относительно стабильных больных в период отлучения от респиратора.
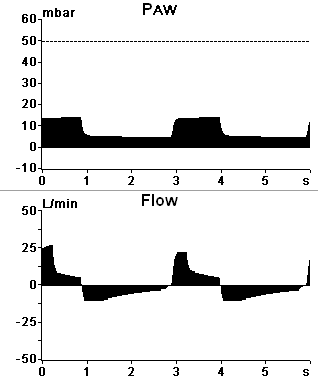
Вентиляция с поддержкой давлением (PS, Pressure Support, ASB), рисунок 10.


В данном режиме на каждый вдох больного респиратор отвечает повышением давления в контуре до заданного уровня.
Поддержка давлением прекращается при снижении инспираторного потока до определенного процента от максимального значения (как правило, до 25%; в некоторых респираторах этот уровень может изменяться, что повышает комфортность режима) или по истечении определенного времени. Частота дыханий полностью определяется пациентом; при возникновении апноэ, как правило, предусмотрена возможность перехода на аварийную принудительную вентиляцию3. Режим отличается наибольшей комфортностью для пациента, однако дает минимальный контроль за состоянием вентиляции. Важной является регулировка скорости нарастания давления; считается, что медленный подъем давления в ответ на попытку вдоха (на рисунке 10 справа) способствует тренировке дыхательной мускулатуры, быстрый (на рисунке слева) – облегчает ее работу. В действительности, обе «крайности» приводят к дискомфорту пациента, и скорость нарастания давления должна регулироваться в соответствии с текущим респираторным запросом пациента.
Вентиляция с поддержкой объемом (VS, Volume Support). Отличие от предыдущего режима состоит в том, что респиратор, анализируя дыхательный объем в текущем цикле, вносит поправку к значению давления поддержки в следующем, с тем, чтобы в нем был достигнут установленный (целевой) дыхательный объем.
Существуют более сложные в техническом плане модификации PS и VS (VAPS, PPS, PAV, ASV и т.д.). Основной их задачей и потенциальным преимуществом является обеспечение большего комфорта пациента в процессе респираторной поддержки, однако клиническую целесообразность их использования еще предстоит доказать.
 Самостоятельное
дыхание с постоянным положительным
давлением в дыхательных путях (CPAP,
Continuous
Positive
Airway
Pressure),
рисунок 11.
Самостоятельное
дыхание с постоянным положительным
давлением в дыхательных путях (CPAP,
Continuous
Positive
Airway
Pressure),
рисунок 11.
Строго говоря, СРАР не является режимом респираторной поддержки, однако, безусловно, заслуживает краткого комментария. Принципиальна разница CPAP и РЕЕР. Если PEEP (ПДКВ) можно создать, заставив пациента выдыхать через сопротивление (в простейшем варианте – через трубку, опущенную в емкость с водой), то СРАР – это достаточно сложная система, препятствующая созданию отрицательного давления в момент спонтанного вдоха, которое может привести к коллабированию нестабильных альвеол. Особенно выраженным отрицательное давление будет в случае, если пациент спонтанно дышит через интубационную трубку, трахеостомическую канюлю. Разумеется, СРАР не обеспечивает собственно респираторной поддержки и используется в основном на финальных этапах отлучения от респиратора.
ОТЛУЧЕНИЕ БОЛЬНОГО ОТ РЕСПИРАТОРА
Длительная искусственная вентиляция легких приводит к т.н. респираторной зависимости, основными причинами которой являются:
Нарушения центральной регуляции дыхания
Недостаточность дыхательной мускулатуры (может быть связана с недостаточностью питания, атрофией или усталостью дыхательной мускулатуры, электролитными и эндокринными расстройствами)
Сохранение явлений паренхиматозной дыхательной недостаточности (или усугубление при преждевременном снижении респираторной поддержки)
Психические факторы (наиболее простой их признак - исчезновение проблем при медикаментозной седации)
В результате этого, сложности при отлучении пациента от респиратора (проще говоря, при переводе на самостоятельное дыхание) встречаются в 20 – 50 % случаев.
Факторами риска сложного отлучения являются:
Предшествующая острая или хроническая дыхательная недостаточность.
Ожирение
Гестозы
Злокачественные новообразования
Возраст пациента
Системные заболевания
Иммунодефицит
Основные шаги отлучения от респиратора:
Определение причины респираторной зависимости
Оценка способностей больного
Выбор режима для отлучения
Поддержка нестабильных пациентов, тренировка стабильных
Принятие решения об экстубации
Оценка способностей больного.
Для принятия решения о начале процесса отлучения существуют клинические и специальные критерии.
Клинические критерии:
Стабильность гемодинамики
Положительная рентгенологическая динамика
Налаженная нутритивная поддержка
Отсутствие работы вспомогательной мускулатуры и парадоксальных движений грудной клетки (говорящих о повышении «кислородной цены» дыхания)
Достаточный уровень сознания (критерий не является обязательным у больных с патологией ЦНС)
Специальные критерии:
На фоне управляемой вентиляции:
РаО2 > 70, SpO2 > 95 при ПДКВ < 5 см Н2О и FiO2 < 0,4
РаО2 / FiO2 > 250
рН > 7,35
Статический комплайнс > 30 мл/см Н2О
Аэродинамическое сопротивление < 12 см Н2О/л/с
При переводе в СРАР (5 см Н2О)
Дыхательный объем > 5 мл / кг
Рост РаСО2 не более, чем на 8 мм Hg
Частота дыханий не более 30
«Классический» тест Rapid Shadow Breathing (быстрого поверхностного дыхания). Отношение частоты к дыхательному объему не более 100
ЖЕЛ > 15 мл / кг
Пиковый поток вдоха > 60 л / мин.
Максимальная произвольная минутная вентиляция > 20 л / мин,
NIP – отрицательное инспираторное давление (у пациента в сознании) – максимальное давление, которое пациент может развить при вдохе из замкнутой системы – не менее 25 см Н2О,
Р0,1 – отрицательное давление, создаваемое пациентом в первые 100 мс спонтанного вдоха (измеряется автоматически) – не более 4 см Н2О.
При наличии всех клинических и большинства функциональных критериев можно рассчитывать на успешное отлучение. Все мероприятия должны проводиться в условиях тщательного мониторинга показателей вентиляции и гемодинамики. Даже официальные зарубежные руководства не рекомендуют проводить очередные шаги по отлучению от респиратора в вечернее и ночное время.
Существуют несколько вариантов перевода на самостоятельное дыхание:
Пробное отключение от респиратора. Постепенно, под контролем показателей вентиляции и гемодинамики, удлиняются периоды самостоятельного дыхания
Инжекционная высокочастотная ИВЛ помогает улучшить газообмен на фоне неадекватного спонтанного дыхания
С появлением современных респираторов эти 2 метода уступили место использованию различных режимов вспомогательной ИВЛ (см. выше).
Основные требования к режиму вспомогательной ИВЛ:
Сочетание самостоятельного дыхания и работы аппарата
Поддержание адекватной оксигенации и вентиляции
Снижение работы дыхательной мускулатуры с дозированным повышением нагрузки (тренировкой)
Комфортность для пациента
Сохранение позитивного влияния на легкие
С целью повышения комфорта пациента, снижения потребности в седации, в последнее время отлучение от респиратора часто проводят с помощью неинвазивной ИВЛ.
В зависимости от причины респираторной зависимости применяются в основном 3 режима респираторной поддержки.
При нарушении центральной регуляции дыхания используются режимы, обеспечивающие необходимый минимум управляемой вентиляции – SIMV, BIPAP
При слабости (детренированности) дыхательной мускулатуры, сохранении признаков паренхиматозной дыхательной недостаточности – PS, BIPAP.
Рекомендуемая последовательность снижения параметров респираторной поддержки:
Снижение FiO2
Снижение частоты дыхания
Снижение инспираторного давления
Снижение ПДКВ (в последнюю очередь!)
Тактика изменения параметров PS в ходе отлучения состоит в поэтапном снижении инспираторного давления от уровня плато при управляемой ИВЛ до 0. Постоянно в зависимости от респираторной потребности больного регулируется время нарастания давления и (если доступно) степень снижения инспираторного потока, при которой прекращается вдох.
При использовании SIMV в основном производится снижение частоты принудительных вдохов от исходной частоты управляемой ИВЛ до 0; возможно, в сочетании с PS.
Использование BIPAP позволяет в зависимости от причины респираторной зависимости, потребностей пациента постепенно снижать инспираторное давление, частоту вентиляции, или оба параметра.
После перевода на самостоятельное дыхание обычно рекомендуется проведение СРАР-терапии в постоянном или интермиттирующем режиме.
Мониторинг в процессе отлучения (после каждого изменения режима):
Оксигенация – SpO2 больше 90%
Вентиляция – EtCO2 или РаСО2 изменяется меньше, чем на 5 mm Hg от исходного
Частота дыханий в пределах 8 – 30 в мин.
Спонтанный дыхательный объем в среднем > 5 ml/kg.
Изменения ЧСС и АД меньше, чем на 20%
В случае, если хотя бы один из критериев нарушен, рекомендуется вернуть исходные настройки респиратора.
Принятие решения об экстубации.
В течение 2 часов наблюдения за больным в CPAP недолжно быть ни одного признака:
Частота дыханий > 35/мин
SpO2 < 90% и/или PaO2 < 60 mm Hg
Спонтанный дыхательный объем < 4 мл/кг
Пульс > 120% от обычного более 5 минут
Участие в дыхании вспомогательной мускулатуры
Парадоксальные движения передней брюшной стенки при дыхании (торако-абдоминальный асинхронизм)
Обильное потоотделение
Жалобы на одышку
При отсутствии данных признаков может быть принято решение об экстубации
Разумеется, лечение острого респираторного дистресс- синдрома не ограничивается исключительно респираторной поддержкой. Оно включает в себя комплексную интенсивную терапию полиорганной недостаточности с применением современной энтеральной терапии, гемодинамической поддержки, методов заместительной почечной терапии, коррекции нарушений гемостаза и т.д. Однако рациональное применение методов респираторной поддержки является ключевым моментом, определяющим успех интенсивной терапии.
ЛИТЕРАТУРА
Власенко А.В., Закс И.О., Мороз В.В. Нереспираторные методы терапии синдрома острого паренхиматозного повреждения легких. Часть 1. Вестник интенсивной терапии 2001; 2: 31-38, Часть 2. Вестник интенсивной терапии 2001;3: 3-11
Власенко А.В., Остапченко Д.А., Закс И.О., и соавт. Применение прон-позиции у больных с острым паренхиматозным поражением легких в условиях респираторной поддержки. Вестник интенсивной терапии 2003; 3: 1 - 7
Зильбер А.П. Этюды критической медицины. Респираторная медицина. Петрозаводск; 1996, 487 с.
Кассиль В.Л., Лескин Г.С., Выжигина М.А. // Респираторная поддержка: Руководство по искусственной и вспомогательной вентиляции лёгких в анестезиологии и интенсивной терапии. М: Медицина; 1997, 320 с.
Лебединский К.М., Мазурок В.А., Нефедов А.В. Основы респираторной поддержки. СПб: МАПО; 2005, 220с.
A Collective Task Force Facilitated by the American College of Chest Physicians; the American Association for Respiratory Care; and the American College of Critical Care Medicine Evidence-Based Guidelines for Weaning and Discontinuing Ventilatory Support. Chest 2001; 120; 6: 375-95
Bernard GR, Artigas A, Brigham KL, et al. The American-European Consensus Conference on ARDS: definitions, mechanisms, relevant outcomes, and clinical trial coordination. Am J Respir Crit Care Med 1994; 149: 818-824
Feihl F, Eckert P, Brimioulle S, et al. Permissive hypercapnia impairs pulmonary gas exchange in the acute respiratory distress syndrome. Am J Respir Crit Care Med 2000; 162: 209-215
Gattinoni L, Pelosi P, Suter PM, Pedoto A, Vercesi P, Lissoni A. Acute respiratory distress syndrome caused by pulmonary and extrapulmonary disease: different syndromes? Am J Respir Crit Care Med 1998; 158: 3-11
Lachmann B. Open up the lung and keep the lung open. Intensive Care Med 1992; 18: 319-21.
Martinon-Torres, F., Rodriguez-Nunez, A., Martinon-Sanchez, J. M., Tobin, M. J. (2001). Advances in Mechanical Ventilation. N Engl J Med 2001; 345: 1133-1134
Pelosi P, Tubiolo D, Mascheroni D, et al. Effects of the prone position on respiratory mechanics and gas exchange during acute lung injury. Am J Respir Crit Care Med 1998;157:387-393
Rubenfeld GD. Epidemiology of acute lung injury. Crit Care Med 2003; 31: 276-284
The Acute Respiratory Distress Syndrome Network. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. N Engl J Med 2000; 342: 1301-1308
Tobin MJ, Perez W, Guenther SM, et al. The pattern of breathing during successful and unsuccessful trials of weaning from mechanical ventilation. Am Rev Respir Dis 1986; 134: 1111-1118
Tobin, M. J. Of Principles and Protocols and Weaning. Am J Respir Crit Care Med 2004; 169: 661-662
Государственное образовательное учреждение
высшего профессионального образования
«ЯРОСЛАВСКАЯ ГОСУДАРСТВЕННАЯ
МЕДИЦИНСКАЯ АКАДЕМИЯ
Федерального агентства
по здравоохранению и социальному развитию»
Кафедра анестезиологии и реаниматологии
с курсом ФПК и ППСЗ
П.С.Жбанников, В.В.Смирнов
ПРАВОВЫЕ ВОПРОСЫ
ОКАЗАНИЯ АНЕСТЕЗИОЛОГИЧЕСКОЙ И РЕАНИМАТОЛОГИЧЕСКОЙ ПОМОЩИ
(Учебное пособие
для клинических ординаторов и врачей)




