
- •Часть I. Механизмы хранения и реализации генетической информации 17
- •Предисловие автора
- •Часть I. Механизмы хранения и реализации генетической информации введение
- •Средний размер гаплоидного генома у некоторых групп организмов
- •Гены и хромосомы
- •Геном прокариот
- •Геном вирусов
- •Нуклеоид бактериальной клетки
- •Геном архебактерий
- •Минимальный размер генома одноклеточных организмов
- •Геном эукариот
- •Последовательности нуклеотидов эукариотического генома
- •Хроматин
- •Свойства гистонов животных
- •Роль днк-топоизомераз в обеспечении структуры и функционирования хроматина
- •Реализация генетической информации при экспрессии генов
- •Транскрипция
- •Днк-зависимые рнк-полимеразы
- •Характеристики белковых компонентов холофермента рнк-полимеразы II дрожжей
- •Единицы транскрипции (транскриптоны)
- •Этапы транскрипции
- •Субъединичный состав и характеристика основных факторов транскрипции (gtf) рнк-полимеразы II человека
- •Основные факторы элонгации рнк-полимеразы II
- •Хроматин во время транскрипции
- •Субъединичный состав и свойства белковых комплексов Swi/Snf и nurf
- •Котранскрипционные и посттранскрипционные модификации рнк
- •Процессинг рнк у бактерий
- •Редактирование пре-мРнк
- •Различные способы редактирования мРнк
- •Редактирование рнк у животных и их вирусов
- •Другие модификации эукариотических мРнк
- •Сравнение полиаденилирования мРнк у эукариот и прокариот
- •5’-Концевой сайт Точка 3’-Концевой сайт
- •5’–Экзон 1guaugu__...__uacuaac__...__(Py)nAgэкзон 2–3’
- •Механизм прямой и обратной реакций аутосплайсинга интронов группы I
- •Кэп-связывающий комплекс в роли фактора, сопрягающего основные реакции метаболизма транскриптов рнк-полимеразы II
- •Функциональная компартментализация ядра
- •Интерфазные хромосомы в ядре
- •Ядрышко
- •Пространственная организация синтеза мРнк
- •Ядерные тельца и домены
- •Компартментализованное ядро
- •Биосинтез белка рибосомами бактерий
- •Рибосомы
- •Этапы биосинтеза белка
- •Антибиотики, действующие на уровне трансляции
- •Трансляция у эукариот
- •Особенности первичной структуры эукариотических мРнк
- •Инициация биосинтеза белка эукариотическими рибосомами
- •Элонгация полипептидных цепей
- •Терминация трансляции
- •Трансляция в митохондриях
- •Трансляция в хлоропластах.
- •Основные пути регуляции экспрессии генов
- •Регуляция экспрессии генов на уровне транскрипции у прокариот
- •Регуляция на уровне инициации транскрипции
- •Регуляция синтеза рнк на уровне элонгации и терминации
- •Регуляция экспрессии генов на уровне транскрипции у эукариот
- •Передача сигнала и вторичные мессенджеры
- •Рецепторы мембран, осуществляющие трансмембранный перенос сигнала
- •Механизмы позитивной регуляции транскрипции
- •Классификация факторов транскрипции
- •Функциональные домены факторов транскрипции
- •Механизмы негативной регуляции транскрипции
- •Структура хроматина как специфический регулятор экспрессии генов
- •Импринтинг
- •Метилирование днк в регуляции транскрипции
- •Факторы транскрипции позвоночных, на активность которых оказывает влияние метилирование остатков цитозина в узнаваемых ими регуляторных последовательностях нуклеотидов
- •Посттранскрипционная регуляция экспрессии генов
- •Направленный транспорт, внутриклеточная локализация и депонирование мРнк
- •Сплайсинг рнк в регуляции экспрессии генов
- •Избирательная деградация мРнк
- •Регуляция экспрессии генов на уровне трансляции
- •Регуляция инициации трансляции
- •Регуляция элонгации синтеза полипептидных цепей
- •Регуляция терминации трансляции
- •Синтез белков, содержащих остатки селеноцистеина
- •Посттрансляционная регуляция экспрессии генов
- •Последствия фолдинга вновь синтезированных полипептидных цепей
- •Специфические протеиназы в посттрансляционном процессинге белков
- •Убиквитин-зависимая система протеолиза в регулируемой деградации белков
- •Сплайсинг белков
- •Другие посттрансляционные модификации белков
- •Воспроизведение генетической информации
- •Репликация днк
- •Белки, участвующие в репликации днк
- •Белки, входящие в состав репликативных комплексов прокариотических и эукариотических организмов
- •Репликативная вилка e. Coli и бактериофага t4
- •Особенности функционирования репликативной вилки эукариот
- •Эукариотические днк-полимеразы и их функциональные гомологи у прокариот
- •Регуляция репликации днк
- •Инициация репликации днк у e. Coli и ее регуляция
- •Регуляция репликации плазмиды ColE1
- •Особенности репликации линейных геномов
- •Линейные хромосомы бактерий
- •Репликаторы эукариот
- •Репликация теломерных участков эукариотических хромосом
- •Пространственная организация синтеза днк у эукариот
- •Защита генетической информации
- •Мутации
- •Основные источники мутаций и методы определения мутагенной активности
- •Основные классы алкилирующих агентов
- •Метаболиты нормальной микрофлоры человека, обладающие мутагенной и канцерогенной активностями
- •Sos-мутагенез у бактерий
- •Мутаторный фенотип
- •Экспансия днк
- •Адаптивные мутации
- •Механизмы защиты генома от мутаций
- •Репарация днк
- •Основные механизмы репарации поврежденной днк
- •Эксцизионная репарация в клетках животных
- •Днк-гликозилазы и эндонуклеазы клеток микроорганизмов и человека, участвующие в ber
- •Белки животных, участвующие в ner
- •Гомологичная рекомбинация в репарации днк
- •Репарация ошибочно спаренных нуклеотидов
- •Полимераза поли(adp-рибозы) в репарации днк у эукариот
- •Альтруистичная днк
- •Парадокс возможности существования многоклеточных организмов
- •Повышение информационной стабильности генома избыточными последовательностями
- •Селективная защита генов от мутаций
- •Высокоупорядоченное расположение летальных генов на хромосомах
- •Возможный смысл парадокса с
- •Современная концепция гена
- •Часть II основные направления развития прикладной молекулярной генетики Введение
- •Часть II. Искусственные генетические системы
- •Принципы генной инженерии
- •Основные ферменты, используемые в генной инженерии
- •Рестриктазы и днк-метилазы
- •Эффективность расщепления коротких последовательностей днк некоторыми распространенными рестриктазами
- •Днк- и рнк-лигазы
- •Ферменты матричного синтеза днк и рнк
- •Частота ошибок при синтезе днк, осуществляемом термостабильными днк-полимеразами in vitro при проведении пцр в оптимальных условиях
- •Другие ферменты
- •Векторы
- •Плазмидные векторы
- •Векторы на основе фага
- •Космиды и фазмиды
- •Сверхъемкие векторы yac, bac и pac
- •Интегрирующие и челночные (бинарные) векторы
- •Конструирование экспрессирующих векторов и их функционирование
- •Векторы для переноса днк в клетки животных и растений
- •Клонотеки генов
- •Получение клонотек генов
- •Введение рекомбинантных днк в клетки
- •Методы скрининга клонотек генов
- •Эукариотические системы экспрессии рекомбинантных генов, основанные на культурах клеток
- •Клетки яичников китайских хомячков (линия cho)
- •Клетки мышиной миеломы (линия Sp2/0)
- •Клетки селезенки мышей (линия mel)
- •Клетки африканской зеленой мартышки (линия cos)
- •Клетки насекомых, зараженные бакуловирусами
- •Сравнение эффективности рассмотренных систем экспрессии
- •Бесклеточные белоксинтезирующие системы
- •Прокариотические системы
- •Эукариотические системы
- •Проточные системы
- •Другие современные методы исследования генов
- •Рестрикционное картирование генов
- •"Прогулки и прыжки по хромосомам"
- •S1-картирование рнк и днк
- •Футпринтинг
- •Стратегия выделения нового гена
- •Направленный мутагенез и белковая инженерия
- •Методы направленного получения мутаций
- •Получение делеций и вставок
- •Химический мутагенез
- •Сайт-специфический мутагенез с использованием олигонуклеотидов
- •Полимеразная цепная реакция в направленном мутагенезе
- •Белковая инженерия
- •Библиотеки пептидов и эпитопов
- •Белки-репортеры в гибридных белках
- •Гибридные токсины
- •Подходы к созданию новых ферментов
- •Субтилигаза в лигировании пептидов
- •Концепция ксенобиоза
- •Антисмысловые рнк, рибозимы и дезоксирибозимы
- •Антисмысловые рнк и олигонуклеотиды
- •Механизм действия антисмысловых рнк
- •Использование антисмысловых рнк
- •Влияние экспрессии антисмысловых рнк на фенотип трансгенных мышей
- •Природные антисмысловые рнк
- •Антисмысловые рнк и патология: возможный механизм возникновения доминантных мутаций
- •Рибозимы и дезоксирибозимы
- •Типы рибозимов
- •Свойства рибозимов
- •Рибозимы как лекарственные средства
- •Репарация мутантных рнк с помощью рибозимов, осуществляющих транс-сплайсинг
- •Дезоксирибозимы
- •Аптамеры
- •Молекулы рнк у истоков жизни
- •Молекулы рнк в качестве рнк-репликаз
- •Возможность синтеза полипептидных цепей молекулами рнк
- •Трансгенные животные и растения
- •Способы получения трансгенных многоклеточных организмов
- •Экспрессия трансгенов
- •Использование трансгенов у животных
- •Исследование механизмов экспрессии генов
- •Токсигены в исследовании дифференцировки соматических клеток в онтогенезе
- •Изменение физиологического статуса лабораторных и сельскохозяйственных животных
- •Моделирование наследственных и приобретенных заболеваний человека
- •Трансгенные растения
- •Генотерапия наследственных и приобретенных заболеваний
- •Способы доставки новых генов в геном человека
- •Управление экспрессией трансгенов в клетках-мишенях
- •Современные достижения генотерапии онкологических заболеваний
- •Ближайшие перспективы использования генотерапии
- •Успехи генотерапии в модельных экспериментах
- •Проблемы, возникающие в связи с практическим применением генотерапии
- •Днк-диагностика и днк-типирование
- •Днк-диагностика наследственных и приобретенных заболеваний
- •Получение клинического генетического материала
- •Диагностика заболеваний
- •Днк-типирование
- •Днк-типирование микроорганизмов
- •Идентификация личности на основе минисателлитной днк: определение отцовства
- •Микроматрицы и микрочипы днк
- •Методы создания микроматриц днк
- •Ограничения в использовании микроматриц днк
- •Использование микроматриц днк в фундаментальных и прикладных исследованиях
- •Картирование и определение первичной структуры генома человека
- •Основные подходы к картированию генома человека
- •Генетические карты сцепления
- •Современные методы построения генетических карт сцепления
- •Пцр в исследованиях генома человека
- •Физические карты низкого разрешения
- •Физические карты высокого разрешения
- •Определение полной первичной структуры днк генома человека
- •Базы данных получаемой информации
- •Заключение
- •Рекомендуемая литература
Физические карты низкого разрешения
В отличие от рассмотренных выше генетических карт сцепления физические карты генома отражают реальное расстояние между маркерами, выражаемое в парах оснований. Физические карты различаются по степени их разрешения, т.е. по тем деталям структуры генома, которые на них представлены (рис. II.39). Исчерпывающая физическая карта генома человека максимального разрешения будет содержать полную нуклеотидную последовательность всех его хромосом. На другом полюсе физических карт с минимальным разрешением находятся хромосомные (цитогенетические) карты генома.

Рис. II.39. Четыре типа генетических карт геномной ДНК и их взаимоотношения
1 – генетическая карта сцепления, 2 – физическая рестрикционная карта, пробелы обозначают места расщепления ДНК рестриктазами, 3 – физическая карта контигов, показаны перекрывающиеся клоны ДНК, полученные с помощью YAC-векторов, 4 – исчерпывающая физическая карта в виде последовательности нуклеотидов ДНК. На всех картах представлен один и тот же участок хромосомы
Хромосомные карты. Хромосомные карты генома человека получают локализацией генетических маркеров на индивидуальных хромосомах с использованием цитогенетических методов, включая авторадиографию и FISH. В последних двух случаях радиоактивная или флуоресцентная метки, ассоциированные с исследуемыми генетическими локусами интактных хромосом, выявляются с помощью световой микроскопии. Еще совсем недавно хромосомные карты позволяли локализовать исследуемый фрагмент ДНК на участке хромосомы протяженностью 10 м.п.о. Современные методы гибридизации in situ с использованием метафазных хромосом, главным образом, метод FISH, локализуют полинуклеотидные маркеры в пределах 2–5 м.п.о. Более того, при гибридизации in situ с интерфазными хромосомами, в которых генетический материал находится в менее компактной форме, разрешающая способность хромосомных карт приближается к 100 т.п.о.
Точность хромосомных карт повышается и с использованием современных генетических методов. Например, способность ПЦР амплифицировать сегменты ДНК единичного сперматозоида позволяет исследовать большое число мейозов, как бы законсервированных в отдельных образцах спермы. В результате появляется возможность проверки взаимного расположения генетических маркеров, локализованных на хромосомных картах более грубыми методами.
Карты кДНК. Карты кДНК отражают положение экспрессирующихся участков ДНК (экзонов) относительно известных цитогенетических маркеров (бэндов) на метафазных хромосомах. Поскольку такие карты дают представление о локализации транскрибирующихся участков генома, в том числе и генов с неизвестными функциями, они могут быть использованы для поиска новых генов. Этот подход особенно полезен при поиске генов, повреждения которых вызывают заболевания человека, в том случае если приблизительная локализация таких участков хромосом уже предварительно проведена на генетических картах сцепления в результате семейного генетического анализа.
Физические карты высокого разрешения
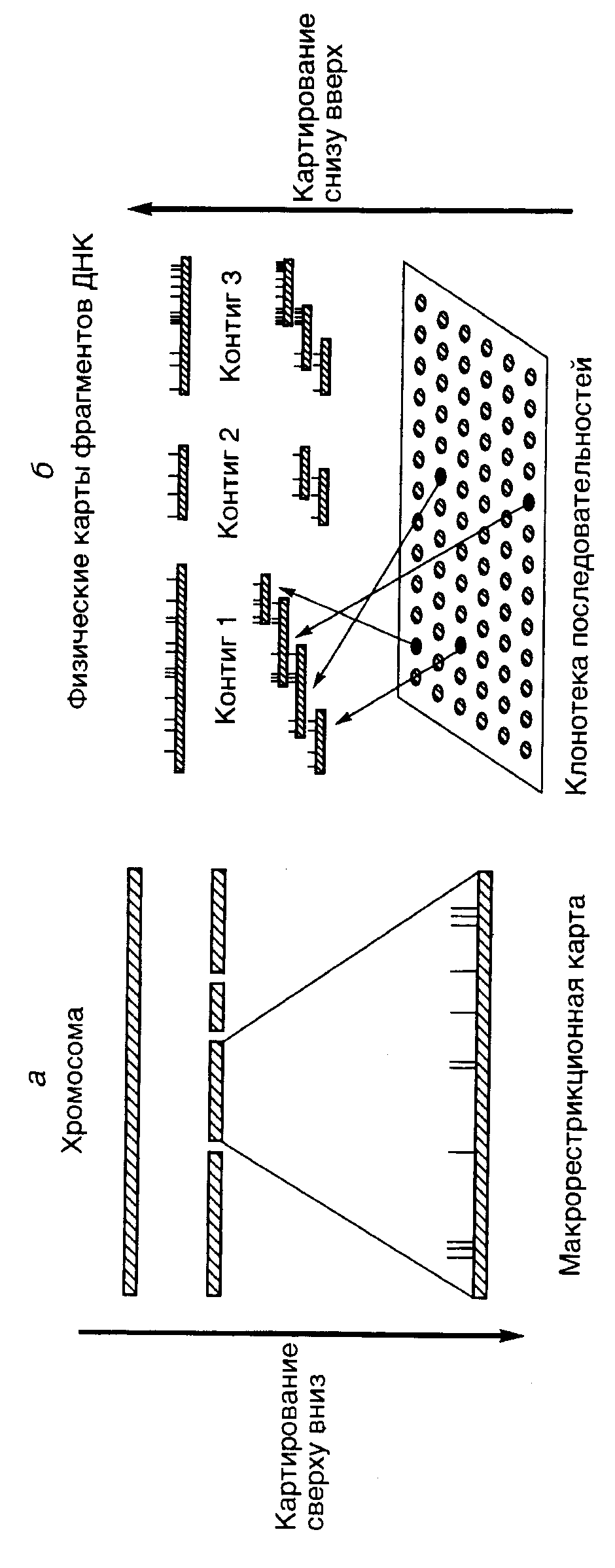
Рис. II.40. Две стратегии построения физических карт ДНК
а – стратегия "сверху вниз": ДНК целой хромосомы расщепляется крупнощепящими рестриктазами, для каждого из индивидуальных фрагментов ДНК строится рестрикционная карта; б – стратегия "снизу вверх", индивидуальные YAC-клоны после идентификации объединяются в контиги
В попытках построения карт генома человека высокого разрешения экспериментально реализуются два альтернативных подхода, получивших названия картирования сверху вниз (top-down mapping) и картирования снизу вверх (bottom-up mapping). При картировании сверху вниз (рис. II.40,а) исходным в анализе является препарат ДНК индивидуальной хромосомы человека. ДНК разрезается крупнощепящими рестриктазами (например NotI) на длинные фрагменты, которые после разделения электрофорезом в импульсном электрическом поле подвергаются дальнейшему рестрикционному анализу с другими рестриктазами. В результате получают макрорестрикционную карту, на которой достаточно полно представлены все последовательности исследуемой хромосомы или ее части, однако ее разрешение невысоко. На такой карте очень трудно локализовать индивидуальные гены. К тому же каждая индивидуальная карта редко охватывает протяженные сегменты ДНК (как правило, не более 1–10 м.п.о.).
При картировании генома человека снизу вверх (см. рис. II.40,б) на основе препарата суммарной ДНК генома или индивидуальной хромосомы получают серию случайных клонов протяженных последовательностей ДНК (10–1000 т.п.о), часть из которых перекрывается друг с другом. В качестве вектора для клонирования в этом случае часто используют искусственные минихромосомы бактерий (BAC) или дрожжей (YAC), подробно описанные в разделе 7.2.4. Серия частично перекрывающихся и дополняющих друг друга клонов образует непрерывную состыкованную (contiguous) последовательность нуклеотидов ДНК, получившую название контига (contig). Правильность полученных контигов подтверждают гибридизацией in situ (FISH) с одновременной их привязкой к определенным участкам исследуемых хромосом. Карты, основанные на контигах, представляют полную информацию о структуре отдельных сегментов хромосом и позволяют локализовать отдельные гены. Однако такие карты трудно применять для реконструкции целых хромосом или протяженных их участков из-за отсутствия соответствующих клонов в имеющихся клонотеках генов.
Основная проблема, которую приходится решать при использовании обоих подходов к построению физических карт высокого разрешения, – объединение разрозненных фрагментов ДНК в непрерывные последовательности нуклеотидов. Чаще всего для этого применяют специальные клонированные фрагменты ДНК, получившие название связующих (linking) клонов. Фрагменты ДНК из связующих клонов содержат в своих внутренних частях последовательности нуклеотидов крупнощепящих рестриктаз и, следовательно, представляют собой места стыковки фрагментов ДНК, используемых на первых этапах физического картирования. Гибридизацией по Саузерну, при проведении которой в качестве зондов используют фрагменты ДНК связующих клонов, определяют фрагменты ДНК физических карт, содержащие последовательности нуклеотидов окрестностей сайтов рестрикции крупнощепящих рестриктаз. Если два таких фрагмента найдены, то соответствующий связующий клон перекрывает оба этих фрагмента и является их частью. Связующие клоны, в свою очередь, отбирают из клонотек генов с помощью зондов, которые представляют собой последовательности нуклеотидов сайтов рестрикции крупнощепящих рестриктаз.
