
- •Часть I. Механизмы хранения и реализации генетической информации 17
- •Предисловие автора
- •Часть I. Механизмы хранения и реализации генетической информации введение
- •Средний размер гаплоидного генома у некоторых групп организмов
- •Гены и хромосомы
- •Геном прокариот
- •Геном вирусов
- •Нуклеоид бактериальной клетки
- •Геном архебактерий
- •Минимальный размер генома одноклеточных организмов
- •Геном эукариот
- •Последовательности нуклеотидов эукариотического генома
- •Хроматин
- •Свойства гистонов животных
- •Роль днк-топоизомераз в обеспечении структуры и функционирования хроматина
- •Реализация генетической информации при экспрессии генов
- •Транскрипция
- •Днк-зависимые рнк-полимеразы
- •Характеристики белковых компонентов холофермента рнк-полимеразы II дрожжей
- •Единицы транскрипции (транскриптоны)
- •Этапы транскрипции
- •Субъединичный состав и характеристика основных факторов транскрипции (gtf) рнк-полимеразы II человека
- •Основные факторы элонгации рнк-полимеразы II
- •Хроматин во время транскрипции
- •Субъединичный состав и свойства белковых комплексов Swi/Snf и nurf
- •Котранскрипционные и посттранскрипционные модификации рнк
- •Процессинг рнк у бактерий
- •Редактирование пре-мРнк
- •Различные способы редактирования мРнк
- •Редактирование рнк у животных и их вирусов
- •Другие модификации эукариотических мРнк
- •Сравнение полиаденилирования мРнк у эукариот и прокариот
- •5’-Концевой сайт Точка 3’-Концевой сайт
- •5’–Экзон 1guaugu__...__uacuaac__...__(Py)nAgэкзон 2–3’
- •Механизм прямой и обратной реакций аутосплайсинга интронов группы I
- •Кэп-связывающий комплекс в роли фактора, сопрягающего основные реакции метаболизма транскриптов рнк-полимеразы II
- •Функциональная компартментализация ядра
- •Интерфазные хромосомы в ядре
- •Ядрышко
- •Пространственная организация синтеза мРнк
- •Ядерные тельца и домены
- •Компартментализованное ядро
- •Биосинтез белка рибосомами бактерий
- •Рибосомы
- •Этапы биосинтеза белка
- •Антибиотики, действующие на уровне трансляции
- •Трансляция у эукариот
- •Особенности первичной структуры эукариотических мРнк
- •Инициация биосинтеза белка эукариотическими рибосомами
- •Элонгация полипептидных цепей
- •Терминация трансляции
- •Трансляция в митохондриях
- •Трансляция в хлоропластах.
- •Основные пути регуляции экспрессии генов
- •Регуляция экспрессии генов на уровне транскрипции у прокариот
- •Регуляция на уровне инициации транскрипции
- •Регуляция синтеза рнк на уровне элонгации и терминации
- •Регуляция экспрессии генов на уровне транскрипции у эукариот
- •Передача сигнала и вторичные мессенджеры
- •Рецепторы мембран, осуществляющие трансмембранный перенос сигнала
- •Механизмы позитивной регуляции транскрипции
- •Классификация факторов транскрипции
- •Функциональные домены факторов транскрипции
- •Механизмы негативной регуляции транскрипции
- •Структура хроматина как специфический регулятор экспрессии генов
- •Импринтинг
- •Метилирование днк в регуляции транскрипции
- •Факторы транскрипции позвоночных, на активность которых оказывает влияние метилирование остатков цитозина в узнаваемых ими регуляторных последовательностях нуклеотидов
- •Посттранскрипционная регуляция экспрессии генов
- •Направленный транспорт, внутриклеточная локализация и депонирование мРнк
- •Сплайсинг рнк в регуляции экспрессии генов
- •Избирательная деградация мРнк
- •Регуляция экспрессии генов на уровне трансляции
- •Регуляция инициации трансляции
- •Регуляция элонгации синтеза полипептидных цепей
- •Регуляция терминации трансляции
- •Синтез белков, содержащих остатки селеноцистеина
- •Посттрансляционная регуляция экспрессии генов
- •Последствия фолдинга вновь синтезированных полипептидных цепей
- •Специфические протеиназы в посттрансляционном процессинге белков
- •Убиквитин-зависимая система протеолиза в регулируемой деградации белков
- •Сплайсинг белков
- •Другие посттрансляционные модификации белков
- •Воспроизведение генетической информации
- •Репликация днк
- •Белки, участвующие в репликации днк
- •Белки, входящие в состав репликативных комплексов прокариотических и эукариотических организмов
- •Репликативная вилка e. Coli и бактериофага t4
- •Особенности функционирования репликативной вилки эукариот
- •Эукариотические днк-полимеразы и их функциональные гомологи у прокариот
- •Регуляция репликации днк
- •Инициация репликации днк у e. Coli и ее регуляция
- •Регуляция репликации плазмиды ColE1
- •Особенности репликации линейных геномов
- •Линейные хромосомы бактерий
- •Репликаторы эукариот
- •Репликация теломерных участков эукариотических хромосом
- •Пространственная организация синтеза днк у эукариот
- •Защита генетической информации
- •Мутации
- •Основные источники мутаций и методы определения мутагенной активности
- •Основные классы алкилирующих агентов
- •Метаболиты нормальной микрофлоры человека, обладающие мутагенной и канцерогенной активностями
- •Sos-мутагенез у бактерий
- •Мутаторный фенотип
- •Экспансия днк
- •Адаптивные мутации
- •Механизмы защиты генома от мутаций
- •Репарация днк
- •Основные механизмы репарации поврежденной днк
- •Эксцизионная репарация в клетках животных
- •Днк-гликозилазы и эндонуклеазы клеток микроорганизмов и человека, участвующие в ber
- •Белки животных, участвующие в ner
- •Гомологичная рекомбинация в репарации днк
- •Репарация ошибочно спаренных нуклеотидов
- •Полимераза поли(adp-рибозы) в репарации днк у эукариот
- •Альтруистичная днк
- •Парадокс возможности существования многоклеточных организмов
- •Повышение информационной стабильности генома избыточными последовательностями
- •Селективная защита генов от мутаций
- •Высокоупорядоченное расположение летальных генов на хромосомах
- •Возможный смысл парадокса с
- •Современная концепция гена
- •Часть II основные направления развития прикладной молекулярной генетики Введение
- •Часть II. Искусственные генетические системы
- •Принципы генной инженерии
- •Основные ферменты, используемые в генной инженерии
- •Рестриктазы и днк-метилазы
- •Эффективность расщепления коротких последовательностей днк некоторыми распространенными рестриктазами
- •Днк- и рнк-лигазы
- •Ферменты матричного синтеза днк и рнк
- •Частота ошибок при синтезе днк, осуществляемом термостабильными днк-полимеразами in vitro при проведении пцр в оптимальных условиях
- •Другие ферменты
- •Векторы
- •Плазмидные векторы
- •Векторы на основе фага
- •Космиды и фазмиды
- •Сверхъемкие векторы yac, bac и pac
- •Интегрирующие и челночные (бинарные) векторы
- •Конструирование экспрессирующих векторов и их функционирование
- •Векторы для переноса днк в клетки животных и растений
- •Клонотеки генов
- •Получение клонотек генов
- •Введение рекомбинантных днк в клетки
- •Методы скрининга клонотек генов
- •Эукариотические системы экспрессии рекомбинантных генов, основанные на культурах клеток
- •Клетки яичников китайских хомячков (линия cho)
- •Клетки мышиной миеломы (линия Sp2/0)
- •Клетки селезенки мышей (линия mel)
- •Клетки африканской зеленой мартышки (линия cos)
- •Клетки насекомых, зараженные бакуловирусами
- •Сравнение эффективности рассмотренных систем экспрессии
- •Бесклеточные белоксинтезирующие системы
- •Прокариотические системы
- •Эукариотические системы
- •Проточные системы
- •Другие современные методы исследования генов
- •Рестрикционное картирование генов
- •"Прогулки и прыжки по хромосомам"
- •S1-картирование рнк и днк
- •Футпринтинг
- •Стратегия выделения нового гена
- •Направленный мутагенез и белковая инженерия
- •Методы направленного получения мутаций
- •Получение делеций и вставок
- •Химический мутагенез
- •Сайт-специфический мутагенез с использованием олигонуклеотидов
- •Полимеразная цепная реакция в направленном мутагенезе
- •Белковая инженерия
- •Библиотеки пептидов и эпитопов
- •Белки-репортеры в гибридных белках
- •Гибридные токсины
- •Подходы к созданию новых ферментов
- •Субтилигаза в лигировании пептидов
- •Концепция ксенобиоза
- •Антисмысловые рнк, рибозимы и дезоксирибозимы
- •Антисмысловые рнк и олигонуклеотиды
- •Механизм действия антисмысловых рнк
- •Использование антисмысловых рнк
- •Влияние экспрессии антисмысловых рнк на фенотип трансгенных мышей
- •Природные антисмысловые рнк
- •Антисмысловые рнк и патология: возможный механизм возникновения доминантных мутаций
- •Рибозимы и дезоксирибозимы
- •Типы рибозимов
- •Свойства рибозимов
- •Рибозимы как лекарственные средства
- •Репарация мутантных рнк с помощью рибозимов, осуществляющих транс-сплайсинг
- •Дезоксирибозимы
- •Аптамеры
- •Молекулы рнк у истоков жизни
- •Молекулы рнк в качестве рнк-репликаз
- •Возможность синтеза полипептидных цепей молекулами рнк
- •Трансгенные животные и растения
- •Способы получения трансгенных многоклеточных организмов
- •Экспрессия трансгенов
- •Использование трансгенов у животных
- •Исследование механизмов экспрессии генов
- •Токсигены в исследовании дифференцировки соматических клеток в онтогенезе
- •Изменение физиологического статуса лабораторных и сельскохозяйственных животных
- •Моделирование наследственных и приобретенных заболеваний человека
- •Трансгенные растения
- •Генотерапия наследственных и приобретенных заболеваний
- •Способы доставки новых генов в геном человека
- •Управление экспрессией трансгенов в клетках-мишенях
- •Современные достижения генотерапии онкологических заболеваний
- •Ближайшие перспективы использования генотерапии
- •Успехи генотерапии в модельных экспериментах
- •Проблемы, возникающие в связи с практическим применением генотерапии
- •Днк-диагностика и днк-типирование
- •Днк-диагностика наследственных и приобретенных заболеваний
- •Получение клинического генетического материала
- •Диагностика заболеваний
- •Днк-типирование
- •Днк-типирование микроорганизмов
- •Идентификация личности на основе минисателлитной днк: определение отцовства
- •Микроматрицы и микрочипы днк
- •Методы создания микроматриц днк
- •Ограничения в использовании микроматриц днк
- •Использование микроматриц днк в фундаментальных и прикладных исследованиях
- •Картирование и определение первичной структуры генома человека
- •Основные подходы к картированию генома человека
- •Генетические карты сцепления
- •Современные методы построения генетических карт сцепления
- •Пцр в исследованиях генома человека
- •Физические карты низкого разрешения
- •Физические карты высокого разрешения
- •Определение полной первичной структуры днк генома человека
- •Базы данных получаемой информации
- •Заключение
- •Рекомендуемая литература
Белки-репортеры в гибридных белках
В рассмотренных выше библиотеках пептидов последние ковалентно связаны с белком-носителем. В таком виде они являются одними из представителей гибридных белков, получаемых методами генной инженерии.
В другом случае гибридные белки применяют для получения высокого уровня экспрессии коротких пептидов в бактериальных клетках благодаря стабилизации этих пептидов в составе гибридных белков. Часто гибридные белки используют для идентификации и очистки трудноопределяемых рекомбинантных белков. Например, присоединив к С-концу исследуемого белка в качестве белка-репортера -галактозидазу, можно производить очистку рекомбинантного белка по активности -галактозидазы, определяя ее антигенные детерминанты иммунохимическими методами. Соединяя фрагменты ДНК, содержащие открытые рамки считывания (ОРС), с генами белков-репортеров, можно очистить такие гибридные белки по активности белка-репортера и использовать их для иммунизации лабораторных животных. Полученные антитела далее применяют для очистки нативного белка, в состав которого входит рекомбинантный полипептид, кодируемый ОРС, и тем самым идентифицируют клонированный фрагмент гена.
С помощью гибридных белков решают и обратную задачу клонирования неизвестного гена, к белковому продукту которого имеются антитела. В таком случае конструируют клонотеку последовательностей нуклеотидов, представляющих ОРС неизвестных генов, в векторах, которые позволяют соединять клонируемую ОРС в одной рамке считывания с геном-репортером. Образующиеся в результате экспрессии этих рекомбинантных генов гибридные белки идентифицируются с помощью антител иммуноферментными методами. Гибридные гены, объединяющие секретируемые белки и белки-репортеры, дают возможность по-новому исследовать механизмы секреции, а также локализацию и перемещение в тканях секретируемых белков.
Гибридные токсины
Серия работ И. Пастана с сотрудниками по конструированию гибридных токсинов направленного действия прекрасно иллюстрирует возможности белковой инженерии в части комбинирования различных функциональных доменов белков для достижения конкретных биологических эффектов.
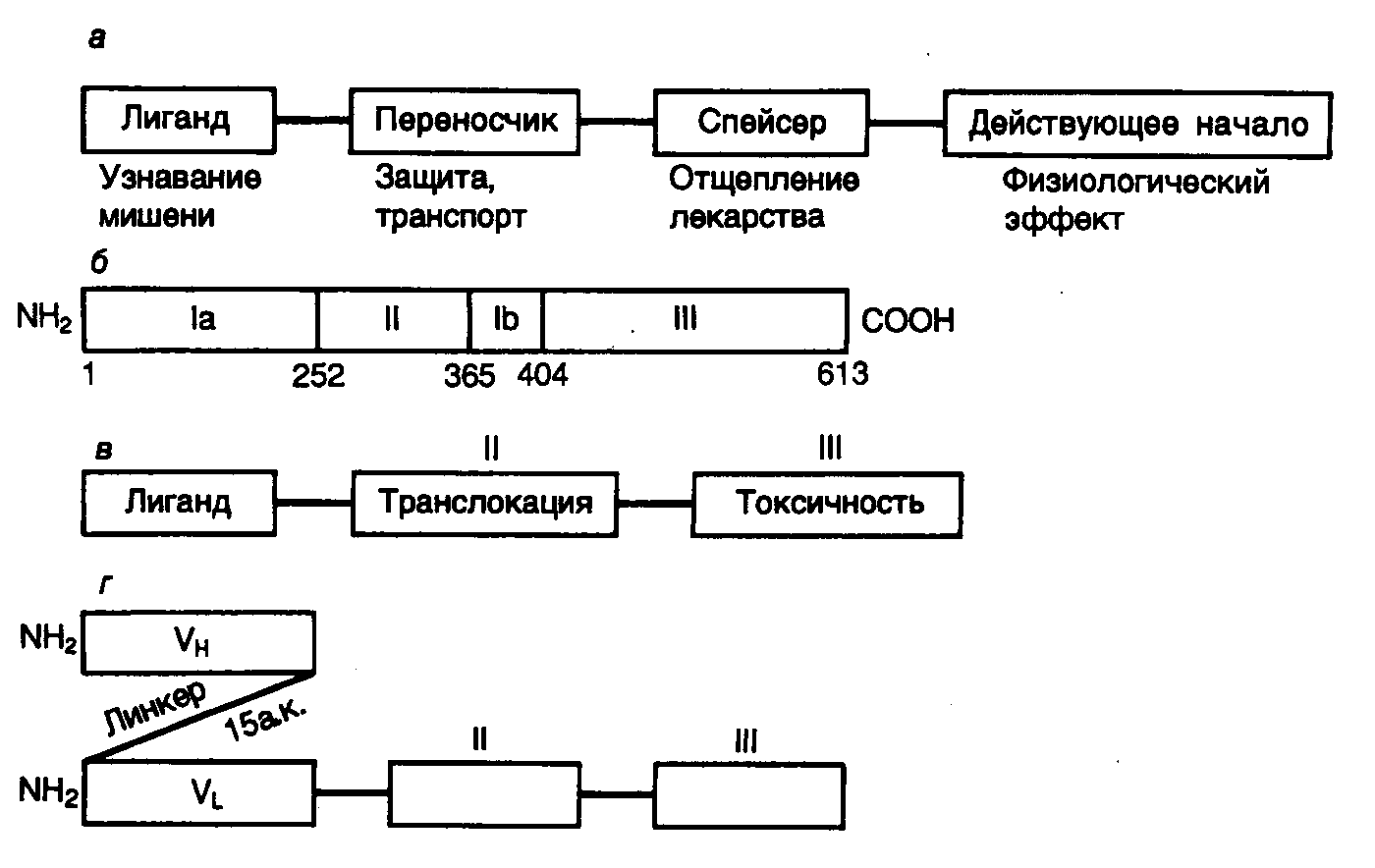
Рис. II.22. Лекарственные препараты направленного действия на основе гибридных токсинов
а– обобщенная схема структуры лекарственного препарата направленного действия;б– строение псевдомонадного токсина (цифрами обозначено положение аминокислотных остатков);в– строение гибридного токсина;г– гибридный токсин на основе моноклональных антител
Идеальное лекарственное средство строго специфического избирательного действия должно обладать, по крайней мере, следующими структурно-функциональными особенностями (рис. II.22,а). Такой лекарственный препарат должен заключать в себе действующее начало для достижения физиологического эффекта и лиганд, распознающий рецептор на поверхности клеток-мишеней. Кроме того, в нем должны быть структурные элементы, распознаваемые системой транспорта организма, для доставки лекарства к клеткам-мишеням, а также спейсерный участок, необходимый для отделения действующего начала от остальных функциональных частей препарата после его доставки по адресу. Именно такая идеальная схема реализуется в природном экзотоксине Pseudomonas aeruginosa. Экзотоксин А P. aeruginosa представляет собой белок, состоящий из одной полипептидной цепи длиной в 613 аминокислот, которая организована в три функциональных домена (см. рис. II.22,б). N-Концевой домен Ia (аминокислотные остатки 1–252) необходим для взаимодействия с поверхностью клеток-мишеней (прототип лиганда идеального лекарства направленного действия). Функции домена Ib (аминокислотные остатки 365–404) в настоящее время неизвестны. Домен II (аминокислотные остатки 253–364) обеспечивает эффективный перенос токсина в цитозоль клеток (система транспорта лекарства), а домен III (аминокислотные остатки 405–613) осуществляет ADP-рибозилирование фактора элонгации трансляции EF2, что приводит к подавлению трансляции и гибели клеток-мишеней. Таким образом, для оказания цитотоксического действия экзотоксину A необходимо с помощью домена Iа распознать рецепторы на поверхности клеток, проникнуть в клетку с помощью эндоцитоза, опосредованного рецепторами, и быть транслоцированным через внутреннюю мембрану в цитозоль, где локализуется фактор EF2. Основная идея в создании токсинов направленного действия заключалась в том, чтобы заменить домен Iа на какой-либо иной пептидный лиганд, взаимодействующий с другой группой рецепторов на поверхности клеток, и тем самым изменить специфичность действия токсина в отношении самих клеток (см. рис. II.22,в).
Было установлено, что удаление домена Iа генно-инженерными методами резко (в сотни и тысячи раз) снижает токсичность такого укороченного белка как в отношении клеток различных линий, так и in vivo. Присоединение к С-концевой части укороченного полипептида молекулы интерлейкина 2 человека осуществляли путем объединения структурных частей соответствующих генов в экспрессирующем векторе. Очищенный гибридный токсин оказался чрезвычайно токсичным в отношении клеток, несущих на своей поверхности рецепторы интерлейкина 2, и не действовал на клетки, у которых эти рецепторы отсутствовали и которые погибали под действием природного токсина. Интернализация (транслокация внутрь клеток) гибридного токсина была опосредована субъединицами р55 и р70 рецептора интерлейкина 2. Таким образом, в результате действия гибридного токсина на популяцию клеток, часть из которых экспрессирует на своей поверхности рецепторы интерлейкина 2, происходит избирательная гибель именно этих клеток.
В организме большинство покоящихся T-клеток и T-клеток памяти не экспрессируют на своей поверхности высокоаффинных рецепторов интерлейкина 2, тогда как T-клетки, стимулированные аллоантигенами, содержат такие рецепторы. Поэтому внутрибрюшинное введение гибридного токсина крысам с экспериментальным артритом – заболеванием, обусловленным патологической активацией T-клеток, снижало симптомы заболевания. Гибридный токсин существенно уменьшал у мышей и реакции отторжения трансплантата.
Вслед за этими пионерскими работами последовала целая серия исследований, направленных на создание аналогичных систем адресной доставки различных цитотоксических полипептидов. В процессе дальнейшего усовершенствования системы адресной доставки псевдомонадного токсина с использованием интерлейкина 2 в качестве лиганда отказались от полного удаления адресного домена токсина и ограничились его инактивацией путем введения в ген токсина четырех сайт-специфических мутаций. Молекулы такого гибридного токсина оказались в 10–100 раз более эффективными цитотоксическими агентами против клеток человека и обезьян, экспрессирующих на своей поверхности рецепторы для интерлейкина 2, а также обладали значительно большим временем полужизни в крови мышей in vivo по сравнению с ранее полученной конструкцией.
На основе псевдомонадного токсина были созданы гибридные токсины, содержащие в качестве лигандов полипептидные цепи интерлейкина 4, интерлейкина 6, трансформирующего фактора роста типа и инсулиноподобного фактора роста I. Для всех этих гибридных белков была показана высокоспецифическая цитотоксичность в отношении опухолевых клеток (включая клетки миеломы человека), обладающих соответствующими рецепторами. Использование в гибридном токсине в качестве лиганда части полипептидной цепи CD4 – гликопротеина поверхности T-клеток, который является рецептором вируса ВИЧ и взаимодействует с его гликопротеином gp120, позволило избирательно поражать T-клетки, зараженные вирусом ВИЧ и экспрессирующие на своей поверхности вирусный белок gp120.
Тот же принцип подавления инфекции, вызванной вирусами ВИЧ, растворимыми рецепторами CD4 был использован при конструировании гибридных белков, объединяющих части полипептидных цепей CD4 с константными частями тяжелых или легких цепей иммуноглобулинов человека. При этом в процессе объединения генов были удалены последовательности нуклеотидов, кодирующие трансмембранный и цитоплазматический домены CD4, а также вариабельную часть полипептидных цепей иммуноглобулинов. Образующиеся гибридные молекулы, названные иммуноадгезинами, за счет константной части молекулы иммуноглобулина приобретали повышенную стабильность в организме и, кроме того, сохраняли специфические свойства, опосредуемые константными частями иммуноглобулинов: связывание Fс-рецептора и белка A, способность к фиксации комплемента и перенос через плацентарный барьер. Совокупность всех этих свойств давала возможность иммуноадгезинам эффективно прерывать инфекцию T-клеток вирусом ВИЧ-I, блокируя как сам вирус, так и зараженные им клетки, экспрессирующие на своей поверхности вирусный антиген gp120.
Дальнейшее усовершенствование генно-инженерных конструкций на основе псевдомонадного экзотоксина А произошло после того, как в качестве адресной части гибридного токсина стали использовать вариабельные домены моноклональных антител к компоненту p55 рецептора интерлейкина 2 человека. В этом рекомбинантном белке с помощью 15-звенного пептидного линкера аминокислот соединяли вариабельный домен тяжелой цепи этого иммуноглобулина с вариабельным доменом его легкой цепи, а С-конец легкой цепи – с N-концом укороченного псевдомонадного токсина (см. рис. II.22,г). Такие молекулы гибридного токсина также оказались высокоспецифичными цитотоксическими агентами по отношению к лейкозным клеткам человека, экспрессирующим на своей поверхности рецепторы интерлейкина 2.
Разработанный подход продемонстрировал возможность использования специфических антител в качестве адресных частей гибридных токсинов. Это дает в руки исследователей универсальный способ адресной доставки токсинов, который в будущем позволит оказывать цитотоксическое действие на любые группы клеток, экспрессирующих на своей поверхности специфические антигены, т.е. значительно расширить количество мишеней для химиотерапевтических воздействий с использованием рекомбинантных белков.
Помимо псевдомонадного экзотоксина A в качестве действующего начала в гибридных токсинах успешно применяли дифтерийный токсин, фактор некроза опухолей и A-цепь рицина. Поскольку A-белок избирательно взаимодействует с константными (Fс) частями иммуноглобулинов класса G многих млекопитающих, такой гибридный токсин в паре с иммуноглобулином, полученным против какого-либо антигена на поверхности клеток, избирательно связывается с этими клетками и убивает их. Такие иммунотоксины являются еще одним потенциальным противоопухолевым агентом и могут быть использованы против клеток, экспрессирующих на своей поверхности специфические антигены.
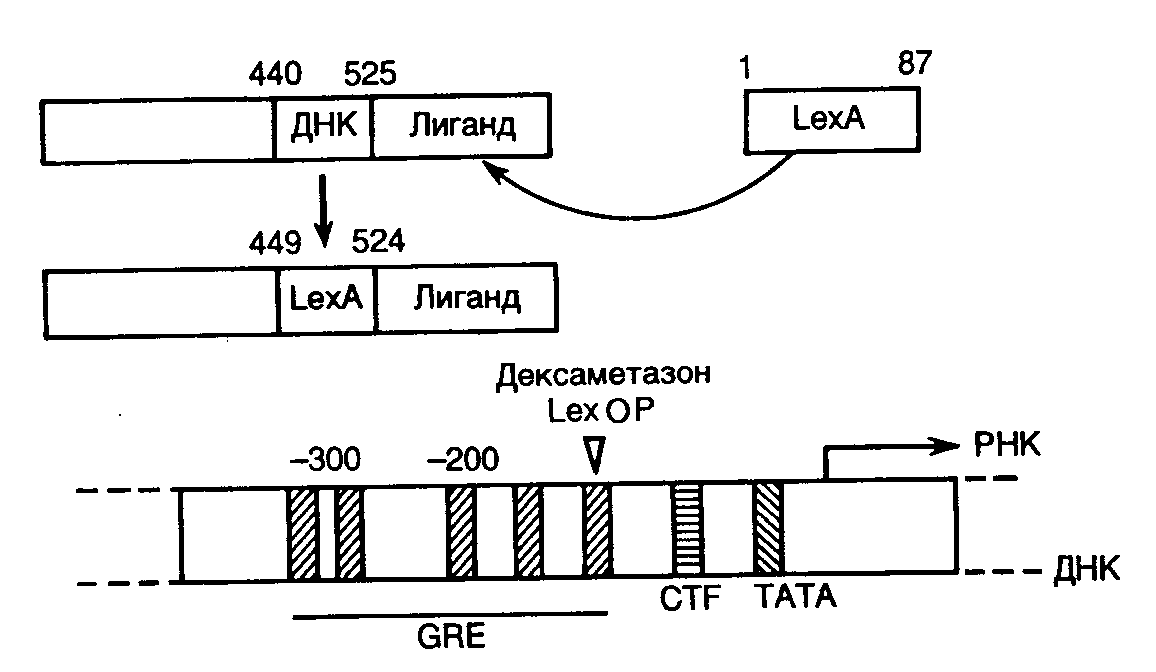
Рис. II.23. Использование гибридного белка для регуляции экспрессии гена
Методы генной инженерии открывают безграничные возможности конструирования новых белков путем объединения в разных комбинациях различных функциональных доменов полипептидных цепей. Получение гибридных токсинов направленного действия иллюстрирует возможности такого подхода в белковой инженерии. В качестве последней иллюстрации возможностей этой группы методов рассмотрим гибридный белок как новый регулятор активности генов. При конструировании такого белка методами генной инженерии был заменен ДНК-связывающий домен в рецепторе глюкокортикоидных гормонов на соответствующий домен LexA-репрессора E. coli (рис. II.23).
Введение операторной последовательности гена lexA в область промотора глобинового гена (или других генов) приводило к активации промотора под действием гибридного белка в присутствии дексаметазона – синтетического гормона, взаимодействующего с рецептором глюкокортикоидов. Таким образом, в новом генетическом окружении последовательность нуклеотидов оператора гена lexA E. coli функционировала в качестве энхансера транскрипции в присутствии гибридного белка-активатора, узнающего эту последовательность. Результаты работы демонстрируют возможность создания новых белков – регуляторов активности генов путем комбинирования известных функциональных доменов.
Развитие белковой инженерии во многом сдерживается недостатком знания о структурно-функциональных взаимоотношениях в белках, что обусловлено сложностью объекта исследования. Многочисленные работы, направленные на изучение таких связей, как правило, носят эмпирический характер и завершаются локализацией аминокислот, существенных для функционирования активных центров ферментов. Поэтому основная задача белковой инженерии – по известной последовательности аминокислотных остатков получить белок с заданными свойствами – в настоящее время еще далека от своего разрешения. Тем не менее, уже сейчас иногда удается целенаправленно изменять некоторые свойства существующих ферментов путем замен небольшого числа аминокислотных остатков их полипептидных цепей с помощью направленного мутагенеза.
