
- •УЧастина і загальна мікробіологія
- •Організація, устаткування, режим роботи бактеріологічних, імунологічних і вірусологічних лабораторій
- •Методи лабораторних досліджень
- •1. Феноловий генціанвіолет
- •Культивування мікроорганізмів
- •Екологія мікроорганізмів
- •Мікробіологічне дослідження води
- •Визначення індексу бгкп на етапах очищення
- •Дослідження мікрофлори повітря
- •Мікробіологічне дослідження грунту
- •Мікробіологічні дослідження харчових продуктів
- •Дослідження мікрофлори людини
- •Експериментальна інфекція. Використання тварин в лабораторних дослідженнях
- •Способи зараження експериментальних тварин
- •Мікробіологічне дослідження трупа
- •Визначення чутливості бактерій до антибіотиків
- •Основні набори дисків, які рекомендуються для визначення чутливості залежно від виду виділеної культури та патологічного матеріалу
- •Частина іі імунологія
- •Імунологічні методи діагностики інфекційних захворювань
- •Імунопрофілактика та імунотерапія інфекційних захворювань
- •Мікробіологічна діагностика окремих інфекційних захворювань Стафілококові інфекції
- •Захворювання, спричиненні умовно-патогенними ентеробактеріями
- •Ранова анаеробна газова інфекція
- •Бактероїдози
- •Дифтерія
- •Коклюш і паракоклюш
- •Псевдомонадні інфекції
- •Інфекції, викликані гемофільними бактеріями
- •Легіонельози
- •Лістеріоз
- •Туберкульоз
- •Лепра (проказа)
- •Мікобактеріози
- •Актиномікоз
- •Нокардіоз
- •1 2 Рис. 80. N.Asteroides: колонії (1), ланцюжки і конідії в мазку (2).
- •Сифіліс та інші трепонематози
- •Ендемічні побутові трепонематози
- •Лептоспіроз
- •Епідемічний поворотний тиф
- •Ендемічний поворотний тиф
- •Бореліоз Лайма
- •Рикетсіози
- •Епідемічний висипний тиф
- •Ендемічний висипний тиф
- •Північноазіатський рикетсіоз
- •Гарячка цуцугамуші
- •Пароксизмальний рикетсіоз
- •Трахома
- •Респіраторний хламідіоз
- •Сечостатевий хламідіоз
- •Будова і класифікація вірусів
- •Методи лабораторної діагностики вірусних інфекцій
- •Методи ідентифікації вірусів
- •Виділення та титрування бактеріофагів
- •Парагрип
- •Епідемічний паротит
- •Респіраторно-синцитіальні інфекції
- •Ентеровірусні інфекції
- •Ротавірусні гастроентерити
- •1 Ерпесвірусні інфекції
- •Простий герпес
- •Вітряна віспа - оперізуючий герпес
- •Цитомегалія
- •Аденовірусні інфекції
- •Коронавірусні інфекції
- •Гарячки Марбург і Ебола
- •Арбовірусні інфекції
- •Весняно-літній кліщовий енцефаліт
- •Японський енцефаліт
- •Гарячка Західного Нілу
- •Жовта гарячка
- •Геморагічні гарячки
- •Кримська-Конго геморагічна гарячка
- •Геморагічна гарячка з нирковим синдромом
- •Краснуха
- •Лімфоцитарний хоріоменінгіт
- •Гепатит в
- •Кандидоз
- •.Частина VI протозойні інфекції
- •Методи лабораторної діагностики
- •Малярія
Виділення та титрування бактеріофагів
Вперше спонтанний лізис бактерій описав М.Ф. Гамалія в 1898 р. Детальніше явище розчинення дизентерійних бактерій якимось невідомим агентом дослідив канадський мікробіолог Ф. д'Ерелль у 1917 р. Він назвав цей агент бактеріофагом. На основі вивчення феномена бактеріофагії були вирішені дуже важливі проблеми молекулярної біолоігї та генетики. Бактеріофаги виявились основною моделлю для дослідження тонкої структури гена, універсального генетичного коду, впливу радіації на спадкові структури організмів.
Більшість бактеріофагів мають форму сперматозоїда. Вони складаються з гексагональної головки, в якій міститься ДНК, хвостового відростка (стержня, оточеного білковим чохлом), базальної пластинки з фібрилами - рецепторами. Розмір голівки 60-100 нм. Її двошарова оболонка утворена капсомерами, які оточують одну щільно скручену молекулу ДНК. Порожнистий відросток довжиною 100-200 нм служить для прикріплення до поверхні бактерійної клітини та її інфікування. Адсорбується фаг на клітині за допомогою базальної пластинки та фібрил-рецепторів. Існує шість морфологічних типів фагів: нитчасті, без відростка, з аналогом відростка, коротким відростком, з чохлом відростка, що не скорочується й з чохлом відростка, що скорочується (рис. 86).
Рис.
86.
Схема
будови бактеріофага:
а
-
головка;
б -
ДНК; в
-
стержень;
г
- чохол;
д -
базальна
пластинка; е -
шипи;
є -
хвостові
фібрили; ж -
комірець.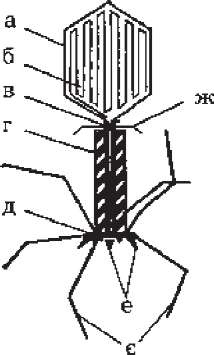
ліпідів у оболонці. Переважна більшість фагів містить ДНК і лише окремі - РНК. За своїм складом фагові нуклеїнові кислоти не відрізняються від аналогічних структур інших мікроорганізмів і вірусів. Всередині голівки є невелика кількість "внутрішнього білка". В дистальній частині відростка, під чохлом, міститься фермент лізоцим, який відіграє велику роль у проникненні фагової нуклеїнової кислоти в бактеріальну клітину.
У мікроорганізмів, виявляється, також існують "інфекційні хвороби", і викликають їх бактеріофаги. При цьому лізис бактерій під впливом фагів характеризується строгою специфічністю. Для кожного виду як патогенних, так і сапрофітних мікроорганізмів існує свій індивідуальний бактеріофаг, який вибірково діє лише на "свій" мікроб. Ця вибіркова спеціалізація дії може бути спрямована тільки на певну різновидність (або навіть певний штам), що має велике значення для ідентифікації збудників інфекційних хвороб, їх окремих фаговарів. Це допомагає епідеміологам і клініцистам встановити джерело інфекції та намітити раціональні шляхи для її профілактики. Такі високоспеціалізовані бактеріофаги називають монофагами. Але в природі існують і поліфаги, які здатні лізувати кілька близьких між собою видів бактерій.
Бактеріофаги стійкі до дії багатьох факторів зовнішнього середовища. Зокрема, вони витримують високий тиск, зберігають активність при дії іонізуючого та рентгенівського випромінювання, а також при значеннях рН - 2,5 -8,5. Однак вони швидко втрачають свої властивості при кип'ятінні, дії дезінфікуючих розчинів та ультрафіолетових променів.
Феномен бактеріофагії можна спостерігати як на рідких, так і на щільних живильних середовищах. Якщо в пробірку з МПБ, де росте кишкова паличка, додати декілька крапель відповідного бактеріофага, то через певний час відбувається просвітління мутної суспензії бактерій за рахунок дії фагів. Для вивчення лізису клітин на щільних живильних середовищах їх попередньо засівають мікроорганізмами, а потім наносять бактеріофаги. Через добу на фоні суцільного газону бактерій утворюються зони, де ріст відсутній. Такі зони мають, як правило, круглу форму і виникають внаслідок літичної дії бактеріофагів. Їх називають негативними колоніями або бляшками бактеріофагів (рис. 87).
Залежно від наслідків взаємодії фагів з бактеріальною клітиною, вони поділяються на вірулентні та помірні.
Вірулентні бактеріофаги проникають всередину клітини, спричиняючи її лізис. Взаємодія їх з клітиною складається з ряду етапів, притаманних практично всім вірусам.
Рис.
87.
Стерильні плями ("бляшки") на
бактеріальному газоні після зараження
бактеріофагом.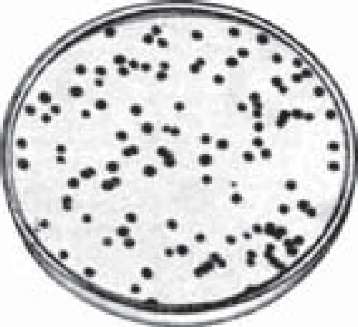
Такий фаг, який вмонтовано в хромосому клітини, називається профагом. Мікроорганізми з профагом називаються лізогенними бактеріями, і при дії деяких факторів (іонізуючого й ультрафіолетового випромінювання, мутагенів) вони здатні до продукції помірного фага втрачаючи свою лізогенність. Лізогенізація має велике біологічне значення й широко поширена у мікробному світі, тому що під впливом бактеріофагів можуть суттєво змінюватись біологічні властивості бактерій. Таке явище називають фаговою конверсією. Доказана можливість перетворення нетоксигенних дифтерійних паличок у токсигенні під впливом лізоген- ізації їх помірним бактеріофагом, який несе в своєму геномі 1юх+-гени. Саме вони забезпечують синтез дифтерійними паличками сильного екзотоксину. Доведена роль бактеріофагів у забезпеченні продукції токсинів збудників ботулізму, стафілококів та інших бактерій. У деяких випадках під впливом помірних бактеріофагів можуть змінюватись антигенні властивості бактерій кишкової групи, вібріонів, ферментативна активність мікробів, їх резистентність до антибіотиків.
Помірні бактеріофаги відіграють роль типових плазмід. Їх використовують як моделі для вивчення актуальних проблем генетики мікроорганізмів, в генно- інженерних дослідженнях і біотехнологічних процесах.
Бактеріофаги широко розповсюджені в природі. Вони зустрічаються в будь- яких середовищах довкілля: грунті, воді, стічних водах - всюди, де є відповідні їм види мікроорганізмів. Фаги знайдено в кишечнику та виділеннях людей, тварин, птахів, плазунів, риб. Відповідно звідси в навколишнє середовище потрапляють бактеріофаги численних збудників інфекційних захворювань: черевного тифу та паратифів, сальмонельозів, ешерихіозів, дизентерії, холери та ін.
Одержують бактеріофаги або з лізогенних культур мікроорганізмів, або з навколишнього середовища, заражаючи матеріалом відповідні бактерії. Для цього досліджуваний матеріал центрифугують, для осадження твердих частинок, а надосадову рідину в об'ємі 1 мл вносять у 30 мл м'ясо-пептонного бульйону, який попередньо засіяний 1 мл 6-18-годинної культури бактерій. Через 18-24 год інкубації при температурі 37 °С посів фільтрують через бактеріальний фільтр, розводять у 10-1, 10-2, 10-3, 10-4 разів, додають 0,05-0,1 мл культури мікроорганізмів та інкубують протягом доби при оптимальній температурі. Як контроль використовують культуру бактерій без бактеріофагу. Якщо в матеріалі присутній бактеріофаг, середовище залишається прозорим внаслідок лізису бактерій фагами, в той час як у контрольній пробірці відбувається ріст бактерій (середовище стає мутним).
Для визначення наявності інфекційних бактеріофагів використовують метод Граціа - метод агарових шарів. Він полягає в тому, що попередньо матеріал, який містить бактеріофаг, розводять м'ясо-пептонним бульйоном: 10-1, 10-2, 10-3, 10-4. Після цього по 1 мл кожного розведення вносять в 2,5 мл розтопленого 0,7 % м'ясо-пептонного агару, додають 0,1 мл індикаторних мікроорганізмів, ретельно перемішують і виливають у чашки Петрі на поверхню підсушеного щільного 1,5 % м'ясо-пептонного агару. Чашки залишають на 30 хв при кімнатній температурі для застигання агару і поміщають у термостат при температурі 37 °С на добу.
Уразі наявності бактеріофагів спостерігають появу окремих стерильних плям - "негативних" колоній ("бляшок") - зон лізису мікроорганізмів.
Титруючи фаги за методом Граціа, після добової інкубації підраховують число "негативних" колоній бактеріофагів. Кількість цих плям відповідає кількості фагів у засіяній суспензії. Виходячи з цього, можна підрахувати число фагових корпускул в 1 мл вихідної суспензії (титр бактеріофагів): число колоній множать на розведення бактеріофагів. Наприклад, при розведенні 10-4 з'явилось 50 колоній, отже, титр фагів дорівнює: 50х10-4 або 5х10-5 в 1 мл.
Титрування
бактеріофагів за методом Аппельмана
|
Таблиця 69 Компоненти |
Пробірки |
Конт |
роль |
|||||||||||
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
культури |
фага |
|||
М 'ясо -пептонний бульйон |
4,5 |
4,5 |
4,5 |
4,5 |
4,5 |
4,5 |
4,5 |
4,5 |
4,5 |
4,5 |
4,5 |
4,5 |
||
Досліджуваний фаг |
0,5 |
^ |
^ |
^ |
^ |
^ |
^ |
^ |
^ |
т |
- |
0,5 |
||
Розведення |
10-1 |
10-2 |
10-3 |
10-4 |
10-5 |
10-6 |
10-7 |
10-8 |
10-9 |
10-Іи |
- |
- |
||
Суспензія мікроорганізмів |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
- |
||
Облік результатів |
|
|
|
|
|
|
|
|
|
|
|
|
||
Після цього в них додають по 0,05 мл індикаторних мікроорганізмів. Паралельно готують контрольні пробірки: одну - з культурою бактерій без фага, а другу - з бактеріофагом без мікробів. Посіви інкубують при 37 °С протягом 18-24 год і спостерігають за лізисом мікроорганізмів. Титром бактеріофага вважають найбільше його розведення, яке викликає повний лізис бактерій.
Оскільки фаги мають специфічну літичну дію на мікроорганізми, їх можна використовувати для фагоіндикації - визначення виду відповідних бактерій в інфекційному матеріалі та об'єктах зовнішнього середовища.
Для цього у дві пробірки з м'ясо-пептонним бульйоном засівають досліджувану культуру бактерій. Потім в одну з них додають декілька крапель індикаторного фага. Пробірки інкубують при оптимальній температурі протягом 18-24 год. Порівнюють мутність бульйону в контрольній та дослідній пробірці і роблять висновок про чутливість мікроорганізмів до літичної дії бактеріофагів.
З цією ж метою на щільне живильне середовище газоном засівають досліджувану культуру бактерій. Після підсушування чашок на них бактеріологічною петлею або пастерівською піпеткою наносять краплю відповідного розведення бактеріофага, яке вказано на ампулі. Посіви інкубують у термостаті при 37 °С протягом 18-24 год і фіксують наявність прозорих круглих плям, які свідчать про
літичну дію бактеріофага. Позитивний результат вказує на належність бактерій до певного виду.
Фаготипування бактерій проводять з метою аналізу епідеміологічної ситуації для визначення джерела інфекції. Найчастіше його виконують при діагностиці стафілококових, кишкових та інших інфекцій. Цей метод грунтується на використанні специфічної чутливості бактерій до своїх бактеріофагів, яка свідчить про спільне (тотожнє) походження бактерій, що мають однаковий фаготип.
В основі тесту лежить визначення фаговаріантів (фаговарів) збудників. Для цього чашку з м'ясо-пептонним агаром за числом бактеріофагів поділяють на квадрати. Вирощують 4 годинну бульйонну культуру досліджуваного штаму і 1 мл її засівають на поверхню середовища. Розподіляють рівномірно культуру по поверхні середовища і надлишок її зливають. Чашку підсушують у термостаті при 37 °С протягом 30-40 хв і на поверхню засіяного газону в кожний квадрат капають піпеткою певні бактеріофаги відповідних розведень. Посіви ставлять у термостат або залишають при кімнатній температурі протягом 18-20 год, після чого оцінюють результати за допомогою лупи. Залежно від чутливості культури до бактеріофагів виділяють різні ступені лізису бактерій, який оцінюють за чотири-плюсовою системою: від лізису, який зливається, до його відсутності.
Враховуючи, що чутливість бактерій до фага є постійною ознакою, порівнюють фаготипи досліджуваних культур з фаготипом мікробів, який було виділено від вірогідного джерела інфекції. При їх збігові роблять висновок про виявлене джерело інфекції.
Розділ 13
ЛАБОРАТОРНА ДІАГНОСТИКА ВІРУСНИХ ІНФЕКЦІЙ
Грип
Грип - гостре респіраторне захворювання людини, яке має тенденцію до епідемічного поширення. Характеризується катаральним запаленням верхніх дихальних шляхів, гарячкою, вираженою загальною інтоксикацією. Часто грип супроводжується виникненням тяжких ускладнень - вторинних бактеріальних пневмоній, загостренням хронічних захворювань легень.
Збудники грипу належать до родини ОгіЬошухоуііМае. Вона включає три роди вірусів - А, В, С.
Вірус грипу має сферичну форму, його розміри 80-120 нм (рис. 88; див. вкл., рис. 29). Деколи утворюються ниткоподібні віріони. Геном утворений однонитко- вою мінус-ниткою РНК, яка складається з восьми фрагментів, і оточений білковим капсидом. РНК асоційована з 4 внутрішніми білками: нуклеопротеїдом (КР) і
високомолекулярними білками Р1, Р2, Р3, які беруть участь у транскрипції геному та реплікації вірусу. Нуклеокапсид має спіральний тип симетрії. Над кап- сидною оболонкою знаходиться шар матриксного білка (М протеїн). На зовнішній, суперкапсидній оболонці у вигляді шипиків розміщені гемаглютинін (Н) і нейрамінідаза (К). Обидва глікопротеїни (К і Н) мають виражені антигенні властивості. У вірусів грипу знайдено 13 різних антигенних типів гемаглютиніну (Н1-13) та 10 варіантів нейрамінідази (N1-10).
За внутрішнім нуклеопротеїдним антигеном розрізняють три типи вірусів грипу - А, В, С, які можна визначити в РЗК. У вірусів типу А, які вражають людину, є три різновидності гемаглютиніну (Н1, Н2, Н3) і дві - нейрамінідази (N1, N2). Залежно від їх комбінацій, виділяють варіанти вірусів грипу А - Н1Ш, Н2№, №N2. Їх визначають у реакції гальмування гемаглютинації з відповідними сироватками.
Віруси грипу легко культивуються в курячих ембріонах і різноманітних культурах клітин. Максимальне нагромадження вірусів відбувається через 2-3 дні. У зовнішньому середовищі вірус швидко втрачає інфекційність через висушування. При низькій температурі в холодильнику зберігається протягом тижня, при -70 °С - значно довше. Нагрівання призводить до його інактивації через кілька хвилин. Під впливом ефіру, фенолу, формаліну швидко руйнується.
Вірусологічний метод діагностики. Матеріалом для дослідження є змиви з носоглотки, виділення з носа, які беруть сухими або вологими стерильними ватними тампонами в перші дні захворювання, харкотиння. Віруси можна також знайти в крові, спинномозковій рідині. При летальних випадках забирають шматочки уражених тканин верхніх і нижніх дихальних шляхів, головного мозку тощо.
Носоглоткові змиви беруть натщесерце. Хворий повинен тричі прополоскати горло стерильним ізотонічним розчином хлориду натрію (10-15 мл), який збирають у стерильну банку з широким горлом. Після цього шматочком стерильної вати протирають задню стінку глотки, носові ходи, потім її занурюють у банку із змивом.
Можна взяти матеріал стерильним, зволоженим в розчині хлориду натрію тампоном, яким ретельно протирають задню стінку глотки. Після забору матеріалу тампон занурюють у пробірку з ізотонічним розчином, до якого добавлено 5 % інактивованої сироватки тварин. У лабораторії тампони полощуть у рідині, віджимають біля стінки пробірки і видаляють. Змив витримують у холодильнику для відстоювання, потім відбирають середню частину рідини в стерильні пробірки. До матеріалу додають антибіотики пеніцилін (200-1000 ОД/мл), стрептоміцин (200500 мкг/мл), ністатин (100-1000 ОД/мл) для знищення супутньої мікрофлори, витримують 30 хв при кімнатній температурі і використовують для виділення вірусів, попередньо перевіривши його на стерильність.
Рис.
88.
Вірус грипу.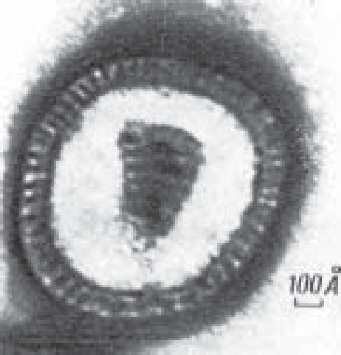
порожнини. Заражають, як правило, 3-5 ембріонів. Ембріони інкубують при оптимальній температурі 33-34 °С протягом 72 год. З метою збільшення кількості віріонів у досліджуваному матеріалі його попередньо концентрують. Для цього використовують методи адсорбції вірусів на курячих еритроцитах, обробку 0,2 % розчином трипсину з метою підсилення інфекційних властивостей вірусів або осаджують їх за спеціальними методиками.
Після інкубації курячі ембріони охолоджують при температурі 4 °С протягом 2-4 год, потім відсмоктують стерильними піпетками або шприцем алантоїсну чи амніотичну рідину. У ній за допомогою РГА визначають наявність інфекційного вірусу. Для цього змішують рівні об' єми (0,2 мл) вірусмісткого матеріалу і 1 % зависі еритроцитів курей. Про позитивну реакцію (наявність вірусу в матеріалі) свідчить осідання еритроцитів у вигляді парасольки.
За умови наявності в матеріалі вірусу, який має гемаглютинуючі властивості, його титрують за допомогою розгорнутої РГА, визначаючи титр гемаглютинуючої активності (табл. 70).
За допомогою цієї реакції визначають титр гемаглютинуючого вірусу - найбільше розведення матеріалу, яке ще дає реакцію гемаглютинації. Цю кількість вірусу приймають за одну гемаглютинуючу одиницю (ГАО).
Ідентифікують віруси грипу за допомогою РГГА (табл. 71). Для цього спочатку готують робоче розведення вірусного матеріалу, яке містить 4 ГАО вірусу в певному об'ємі.
Облік реакції проводять після утворення осаду еритроцитів в контрольних лунках. Про позитивну реакцію свідчить затримка гемаглютинації в досліджуваних лунках.
Схема
титрування вірусів за допомогою РГА
|
Таблиця 70 Компоненти, мл |
Досліджувані пробірки |
|||||||
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Ізотонічний розчин хлориду натрію |
— |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
Вірусмісткий матеріал, попередньо розведений в 10 разів |
0,2 |
0,2 |
^ |
^ |
^ |
^ |
і |
|
Розведення |
1:10 |
1:20 |
1:40 |
1:80 |
1:160 |
1:320 |
1:640 |
- |
1 % завись еритроцитів курки |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
Інкубація при температурі 18-20 °С протягом 30 хвилин |
||||||||
Результат III II |
||||||||
|
Таблиця 71 Схема типування вірусів грипу в РГГА Компоненти, мл |
Досліджувані лунки |
|||||||||
1 |
2 |
3 |
4 |
5 |
6 |
7 |
Контроль сироватки |
Контроль еритроцитів |
||
Ізотонічний розчин хлориду натрію |
- |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
|
Діагностичні сироватки (1:10) |
|
|
|
|
|
|
|
|
|
|
НШ! (1-ий ряд) |
0,2 |
0,2 |
|
|
|
|
|
0,2 |
- |
|
Н2Ш (2-ий ряд) |
0,2 |
0,2 |
|
|
|
|
|
0,2 |
- |
|
Н3Ш (3-ій ряд) |
0,2 |
0,2 |
|
|
|
|
|
0,2 |
- |
|
Досліджувані віруси (4 ГАО в 0,2 мл) |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
- |
- |
|
Розведення |
1:10 |
1:20 |
1:40 |
1:80 |
1:160 |
1:320 |
1:640 |
- |
- |
|
Інкубація п |
ри 18-20 °С протягом 30 хв |
|||||||||
1 % суспензія еритроцитів курки |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0.4 |
|
Інкубація при 18-20 °С протягом 1 год |
||||||||||
Результат |
||||||||||
Сироватки: НШ1 |
|
|
|
|
|
|
|
|
|
|
Н2Ш |
|
|
|
|
|
|
|
|
|
|
Н3Ш |
|
|
|
|
|
|
|
|
|
|
Для ідентифікації виділених вірусів використовують РГГА (за умови, якщо титр гемаглютинінів становить у культуральній рідині не менше 1:8). Крім цієї реакції, можна використати РГГадс, однак вона є менш чутливою і вимагає титру імунної сироватки не менше, ніж 1:160 а також РЗК, РН, РЕМА тощо.
Серологічне дослідження використовують для підтвердження діагнозу грипу. Воно грунтується на визначенні чотирикратного зростання титру антитіл у сироватці хворого.
Першу сироватку отримують на початку хвороби в гострому періоді (2-5-й день хвороби), другу - після 10- 14-го дня захворювання. Оскільки сироватки досліджують одночасно, першу з них зберігають у холодильнику при температурі -20 °С.
Найчастіше використовують РГГА, РЗК, РНГА. Ці реакції ставлять із спеціальними наборами стандартних вірусних діагностикумів (еталонні штами вірусів грипу різних серологічних типів). Оскільки сироватки хворих можуть містити неспецифічні інгібітори гемаглютинації, їх спочатку прогрівають при температурі 56 °С, а також обробляють спеціальним ферментом (наприклад, нейрамініда- зою) або розчинами перйодату калію, риванолу, хлориду марганця, суспензією білої глини тощо за спеціальними схемами.
Реакцію гальмування гемаглютинації можна ставити в пробірках (макрометод) або в спеціальних планшетах для імунологічних досліджень (мікрометод). Схема постановки РГГА наведена в таблиці 72.
|
Таблиця 72 Компоненти, мл |
Досліджувані лунки |
|||||||||
1 |
2 |
3 |
4 |
5 |
6 |
7 |
Контроль сироватки 1:5 |
Контроль діагностику му |
Контроль еритроцитів |
|
Ізотонічний розчин хлориду натрію |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
Сироватки хворого (1:5): |
|
|
|
|
|
|
|
|
|
|
І (1-ий ряд) |
0,2 |
|
|
|
|
|
|
0,2 |
- |
- |
ІІ (2-ий ряд) |
0,2 |
|
|
|
|
|
|
0,2 |
- |
- |
Вірусний діагностикум (4 ГАО в 0,2 мл) |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
- |
0,2 |
- |
Розведення сироваток |
1:10 |
1:20 |
1:40 |
1:80 |
1:160 |
1:320 |
1:640 |
- |
- |
- |
Інкубація при 18-20 °С протягом 30 хв |
||||||||||
1 % суспензія еритроцитів курей |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0.4 |
Інкубація при 18-20 °С протягом 1 год |
||||||||||
Результат |
||||||||||
Сироватки: І |
|
|
|
|
|
|
|
|
|
|
ІІ |
|
|
|
|
|
|
|
|
|
|
Реакція вважається позитивною при утворенні компактного, щільного осаду еритроцитів з рівними краями.
Експрес-діагностика. Метод базується на виявленні в досліджуваному матеріалі специфічних вірусних антигенів за допомогою імунофлуоресценції в прямій або непрямій РІФ. Слиз отримують із носових ходів або задньої стінки глотки, центрифугують і з осаду клітин циліндричного епітелію слизової оболонки готують мазки на предметних скельцях. Їх обробляють імунофлуоресцентними сироватками, кон 'югованими з флуорохромами, наприклад, ФІТЦ (флуоресцеїнізоті- оцианат). При дослідженні препаратів за допомогою люмінесцентного мікроскопа спостерігають характерне зелено-жовтувате світіння вірусів грипу, які локалізуються на початку хвороби в ядрах епітеліальних клітин.
Схема
РГГА для серологічної діагностики
грипу
■ ■ • • • • і ••• Параміксовірусні інфекції
До родини Paramyxoviridae (para - біля, myxa - слиз) належать віруси пара- грипу, епідемічного паротиту, кору та респіраторно-синцитіальний вірус.
