
- •УЧастина і загальна мікробіологія
- •Організація, устаткування, режим роботи бактеріологічних, імунологічних і вірусологічних лабораторій
- •Методи лабораторних досліджень
- •1. Феноловий генціанвіолет
- •Культивування мікроорганізмів
- •Екологія мікроорганізмів
- •Мікробіологічне дослідження води
- •Визначення індексу бгкп на етапах очищення
- •Дослідження мікрофлори повітря
- •Мікробіологічне дослідження грунту
- •Мікробіологічні дослідження харчових продуктів
- •Дослідження мікрофлори людини
- •Експериментальна інфекція. Використання тварин в лабораторних дослідженнях
- •Способи зараження експериментальних тварин
- •Мікробіологічне дослідження трупа
- •Визначення чутливості бактерій до антибіотиків
- •Основні набори дисків, які рекомендуються для визначення чутливості залежно від виду виділеної культури та патологічного матеріалу
- •Частина іі імунологія
- •Імунологічні методи діагностики інфекційних захворювань
- •Імунопрофілактика та імунотерапія інфекційних захворювань
- •Мікробіологічна діагностика окремих інфекційних захворювань Стафілококові інфекції
- •Захворювання, спричиненні умовно-патогенними ентеробактеріями
- •Ранова анаеробна газова інфекція
- •Бактероїдози
- •Дифтерія
- •Коклюш і паракоклюш
- •Псевдомонадні інфекції
- •Інфекції, викликані гемофільними бактеріями
- •Легіонельози
- •Лістеріоз
- •Туберкульоз
- •Лепра (проказа)
- •Мікобактеріози
- •Актиномікоз
- •Нокардіоз
- •1 2 Рис. 80. N.Asteroides: колонії (1), ланцюжки і конідії в мазку (2).
- •Сифіліс та інші трепонематози
- •Ендемічні побутові трепонематози
- •Лептоспіроз
- •Епідемічний поворотний тиф
- •Ендемічний поворотний тиф
- •Бореліоз Лайма
- •Рикетсіози
- •Епідемічний висипний тиф
- •Ендемічний висипний тиф
- •Північноазіатський рикетсіоз
- •Гарячка цуцугамуші
- •Пароксизмальний рикетсіоз
- •Трахома
- •Респіраторний хламідіоз
- •Сечостатевий хламідіоз
- •Будова і класифікація вірусів
- •Методи лабораторної діагностики вірусних інфекцій
- •Методи ідентифікації вірусів
- •Виділення та титрування бактеріофагів
- •Парагрип
- •Епідемічний паротит
- •Респіраторно-синцитіальні інфекції
- •Ентеровірусні інфекції
- •Ротавірусні гастроентерити
- •1 Ерпесвірусні інфекції
- •Простий герпес
- •Вітряна віспа - оперізуючий герпес
- •Цитомегалія
- •Аденовірусні інфекції
- •Коронавірусні інфекції
- •Гарячки Марбург і Ебола
- •Арбовірусні інфекції
- •Весняно-літній кліщовий енцефаліт
- •Японський енцефаліт
- •Гарячка Західного Нілу
- •Жовта гарячка
- •Геморагічні гарячки
- •Кримська-Конго геморагічна гарячка
- •Геморагічна гарячка з нирковим синдромом
- •Краснуха
- •Лімфоцитарний хоріоменінгіт
- •Гепатит в
- •Кандидоз
- •.Частина VI протозойні інфекції
- •Методи лабораторної діагностики
- •Малярія
Визначення чутливості бактерій до антибіотиків
Антибіотики - це речовини мікробного, рослинного або тваринного походження, їх напівсинтетичні та синтетичні аналоги і похідні, що вибірково пригнічують життєдіяльність мікроорганізмів, вірусів, найпростіших, грибів, а також затримують ріст пухлин.
Антибіотикам притаманна висока біологічна активність. Вони спричиняють біологічний ефект у дуже малих кількостях (наприклад, пеніцилін викликає виражену бактерицидну дію на бактерії у концентрації 0,000001 г/мл). Антибіотики мають високу вибіркову специфічність, оскільки проявляють свою дію тільки відповідно до певних груп організмів, не завдаючи шкоди іншим. Так, бензилпеніцилін затримує ріст грампозитивних бактерій (стафілококів, стрептококів) і практично не впливає на грамнегативні мікроби, гриби.
Біологічну активність антибіотиків оцінюють в умовних одиницях, які містяться в 1 мл розчину (ОД/мл) або в 1 мг препарату (ОД/мг). У таких антибіотиків, як еритроміцин, новобіоцин, ністатин, трихоцетин та ін. одна одиниця активності еквівалентна 1 мкг препарату. За одиницю антибіотичної активності пеніциліну приймають мінімальну кількість препарату, здатну затримувати ріст штаму Staphylococcus aureus 209 у 50 мл поживного бульйону. Активність стрептоміцину вимірюється мінімальною кількістю антибіотика, який інгібує ріст Escherichia coli в 1 мл поживного бульйону. Фактично для більшості антибіотиків 1 ОД відповідає 1 мкг хімічно чистого препарату. Однак є антибіотики, для яких існують винятки. Так, наприклад, для пеніциліну 1 ОД відповідає 0,6 мкг, поліміксину В - 0,1 мкг, ністатину - 0,333 мкг хімічно чистих антибіотиків.
Оцінка чутливості мікробів до антибіотиків та вивчення їх фармакокінетики в організмі хворого є основними лабораторними показниками, які при їх співстав- ленні дозволяють прогнозувати ефективність антибактеріальної терапії. Крім того, результати визначення антибіотикочутливості використовують як маркер, що дозволяє виявляти та контролювати зміни антибіотикограми збудників у динаміці, використовувати детермінанти резистентності, які найчастіше зустрічаються, або їх сполучення як додаткові маркери при діагностиці внутрішньолікарняних інфекцій, для виявлення джерел інфікування та шляхів розповсюдження полірезистент- них штамів. Такі дані, одержані та узагальнені у різних регіонах країни протягом фіксованих проміжків часу, використовуються при формуванні політики антибактеріальної терапії та визначенні номенклатури антибіотиків, які випускаються в країні.
Найрозповсюдженішими методами визначення антибіотикочутливості збуд - ників інфекцій є диско-дифузійний (метод дисків) та серійних розведень.
Живильні середовища для визначення чутливості бактерій до антибіотиків повинні відповідати таким вимогам:
бути стандартними та забезпечувати оптимальні умови росту мікроорганізмів;
не містити інгібіторів бактеріального росту і великої кількості стимуляторів;
не мати речовин, що пригнічують активність препаратів.
На результати дослідження може суттєво впливати значення рН середовища. Найдоцільніше вибирати нейтральне або дещо лужне середовище (рН 7,0-7,4), оскільки ці значення придатні для більшості антибіотиків. При визначенні чутливості бактерій використовують бульйон і 1,5-2 % агар на переварі Хоттінгера, звичайний м'ясо-пептонний бульйон і 1,5-2 % агар на ньому, середовище АГВ (агар Гівенталя-Вєдьміної), агар Mueller-Hinton 2. Вони придатні при визначенні антибіотикочутливості стафілококів, ентеробактерій, псевдомонад. Однак стрептококи та гемофільні бактерії вимагають добавки ростових факторів; дріжджі та анаеробні бактерії - спеціальних середовищ і певних умов культивування. На результати визначення чутливості мікроорганізмів до антибіотиків-аміноглікозидів, поліміксинів, тетрациклінів впливає вміст у живильних середовищах катіонів кальцію, магнію, що особливо важливо при дослідженні P. aeruginosa. Оптимальний вміст - 50 мг/л Са2+і 25 мг/л Mg2+. Більшість середовищ, що випускаються країнами СНД, за цим показником, як правило, не стандартизуються. Це призводить до суттєвих коливань вмісту двовалентних катіонів у різних серіях середовищ, навіть якщо вони випускаються одним підприємством, і спотворює результати.
Диско-дифузійний метод визначення антибіотикочутливості є найпростішим якісним методом і широко використовується для епідеміологічного контролю резистентності. Достовірність результатів забезпечується шляхом стандартизації проведення тесту на всіх етапах дослідження: вибір і виготовлення живильних середовищ із врахуванням всіх властивостей можливих збудників, взяття проб і умови їх доставки, виготовлення і розливання посівного матеріалу на поверхню агару, вибір дисків (використання набору дисків у відповідності до виду виділеного збудника та локалізації інфекції).
Чутливість мікроорганізмів до антибіотиків слід визначати тільки у чистій культурі. Однак у ряді випадків для швидкого одержання орієнтовних даних про антибіотикограму бактерій використовують безпосередньо патологічний матеріал. Щільні субстрати (харкотиння, гній, кал та ін.) розтирають, рідини (сеча, ексудати та ін.) центрифугують, а для посіву використовують осад. Досліджуваний матеріал наносять на поверхню живильного середовища петлею або ватним тампоном. Після одержання чистої культури дослідження повторюють.
Для виготовлення інокулюму 5-10 однорідних колоній суспендують у 2 мл рідкого середовища або фізіологічного розчину. Бактеріальну суспензію (103-105 КУО/мл залежно від виду мікробів) в об'ємі 1 мл рівномірно розподіляють по поверхні середовища при похитуванні чашки, надлишок рідини видаляють піпеткою. Чашки підсушують при кімнатній температурі протягом 20-30 хв, а потім на них на однаковій віддалі кладуть диски з антибіотиками.
Рівномірність газону, яка визначається величиною посівної дози, - найголовніший фактор одержання достовірних результатів і підлягає кількісній оцінці та якісній стандартизації. Ступінь нестандартності результатів дослідження, який пов'язаний із зміною величини дози інокулюму, варіює залежно від виду збудників, властивостей антибіотика та інших факторів. При невеликій дозі інокулю- му при визначенні чутливості до бета-лактамних препаратів пеніциліназо-утво- рюючих бактерій можна одержати великі розміри зон затримки росту, які створюють уявлення про високу чутливість штамів. І, навпаки, розмір зон різко знижується при збільшенні щільності інокулюму. Вирішальне значення має його величина при визначенні чутливості до бета-лактамних антибіотиків метицилінорезистент- них варіантів стафілококів внаслідок гетерогенності їх саме за показником чутливості. Для виявлення стійкості до метициліну необхідно дотримуватись певних температурних режимів (30-35 °С). Оскільки ці стафілококи повільніше ростуть при 37 °С, слід їх культивувати на середовищах з додаванням 5 % хлориду натрію. Результати враховують через 24 та 48 год (рис. 40). Для контролю стандартності проведення досліджень у кожному досліді використовують тест-культури з відо
мою чутливістю до антибіотиків. ВООЗ рекомендує три штами типових культур: Escherichia coli, Staphylococcus aureus, Pseudomonas aeruginosa. При визначенні антибіотикочутливості виділених штамів слід співставляти отримані дані з розмірами зон пригнічення росту навколо дисків з антибіотиками для контрольних культур (табл. 12). Їх порівнюють з допустимими контрольними значеннями.
Рис.
40.
Визначення антибіотикочутливості
за допомогою методу стандартних дисків.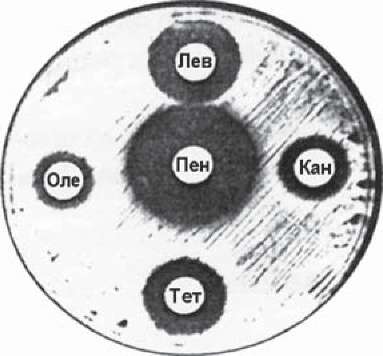
Таблиця
12
Граничні
межі діаметрів зон затримки росту
еталонних штамів |
Діаметри зон затримки росту, мм |
|||||
на середовищах № 1 і № 2 |
на середовищі АГВ |
|||||
Антибіотики |
S. aureus |
E. coli |
P. aeruginosa |
S. aureus |
E. coli |
P. aeruginosa |
|
ATCC |
ATCC |
ATCC |
ATCC |
ATCC |
ATCC |
|
25923 |
25922 |
27853 |
25923 |
25922 |
27853 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
Бензилпеніцилін |
- |
- |
- |
29-38 |
- |
- |
Ампіцилін |
24-35 |
13-20 |
- |
30-36 |
14-20 |
- |
Карбеніцилін (25 мкг) |
- |
- |
- |
32-38 |
19-25 |
- |
Карбеніцилін (100 мкг) |
- |
21-26 |
20-24 |
35-42 |
23-29 |
18-24 |
Метицилін |
- |
- |
- |
22-30 |
- |
- |
Оксацилін |
27-32 |
- |
- |
24-30 |
- |
- |
Цефалотин |
24-37 |
15-22 |
- |
30-40 |
15-20 |
- |
Стрептоміцин |
17-25 |
14-22 |
- |
20-25 |
14-19 |
- |
Неоміцин |
19-27 |
18-24 |
- |
20-27 |
13-17 |
- |
Канаміцин |
20-27 |
18-26 |
- |
20-27 |
15-19 |
- |
Гентаміцин |
20-28 |
20-27 |
16-24 |
22-32 |
21-30 |
16-26 |
Тетрациклін |
20-29 |
19-26 |
- |
22-31 |
17-26 |
- |
Еритроміцин |
23-31 |
- |
- |
22-31 |
8-15 |
- |
Олеандоміцин |
20-29 |
- |
- |
22-29 |
- |
- |
Лінкоміцин |
24-32 |
- |
- |
24-32 |
- |
- |
Левоміцетин |
21-27 |
26-28 |
- |
19-25 |
19-27 |
- |
Рифампіцин |
- |
- |
- |
26-34 |
7-11 |
- |
Поліміксин |
- |
12-17 |
- |
- |
16-20 |
15-20 |
Ристоміцин |
14-18 |
- |
- |
12-16 |
- |
- |
татів. Орієнтовні дані щодо вибору наборів дисків із врахуванням виду виділеного збудника і локалізації інфекції наведено у таблиці 13.
Таблиця 13
