
- •УЧастина і загальна мікробіологія
- •Організація, устаткування, режим роботи бактеріологічних, імунологічних і вірусологічних лабораторій
- •Методи лабораторних досліджень
- •1. Феноловий генціанвіолет
- •Культивування мікроорганізмів
- •Екологія мікроорганізмів
- •Мікробіологічне дослідження води
- •Визначення індексу бгкп на етапах очищення
- •Дослідження мікрофлори повітря
- •Мікробіологічне дослідження грунту
- •Мікробіологічні дослідження харчових продуктів
- •Дослідження мікрофлори людини
- •Експериментальна інфекція. Використання тварин в лабораторних дослідженнях
- •Способи зараження експериментальних тварин
- •Мікробіологічне дослідження трупа
- •Визначення чутливості бактерій до антибіотиків
- •Основні набори дисків, які рекомендуються для визначення чутливості залежно від виду виділеної культури та патологічного матеріалу
- •Частина іі імунологія
- •Імунологічні методи діагностики інфекційних захворювань
- •Імунопрофілактика та імунотерапія інфекційних захворювань
- •Мікробіологічна діагностика окремих інфекційних захворювань Стафілококові інфекції
- •Захворювання, спричиненні умовно-патогенними ентеробактеріями
- •Ранова анаеробна газова інфекція
- •Бактероїдози
- •Дифтерія
- •Коклюш і паракоклюш
- •Псевдомонадні інфекції
- •Інфекції, викликані гемофільними бактеріями
- •Легіонельози
- •Лістеріоз
- •Туберкульоз
- •Лепра (проказа)
- •Мікобактеріози
- •Актиномікоз
- •Нокардіоз
- •1 2 Рис. 80. N.Asteroides: колонії (1), ланцюжки і конідії в мазку (2).
- •Сифіліс та інші трепонематози
- •Ендемічні побутові трепонематози
- •Лептоспіроз
- •Епідемічний поворотний тиф
- •Ендемічний поворотний тиф
- •Бореліоз Лайма
- •Рикетсіози
- •Епідемічний висипний тиф
- •Ендемічний висипний тиф
- •Північноазіатський рикетсіоз
- •Гарячка цуцугамуші
- •Пароксизмальний рикетсіоз
- •Трахома
- •Респіраторний хламідіоз
- •Сечостатевий хламідіоз
- •Будова і класифікація вірусів
- •Методи лабораторної діагностики вірусних інфекцій
- •Методи ідентифікації вірусів
- •Виділення та титрування бактеріофагів
- •Парагрип
- •Епідемічний паротит
- •Респіраторно-синцитіальні інфекції
- •Ентеровірусні інфекції
- •Ротавірусні гастроентерити
- •1 Ерпесвірусні інфекції
- •Простий герпес
- •Вітряна віспа - оперізуючий герпес
- •Цитомегалія
- •Аденовірусні інфекції
- •Коронавірусні інфекції
- •Гарячки Марбург і Ебола
- •Арбовірусні інфекції
- •Весняно-літній кліщовий енцефаліт
- •Японський енцефаліт
- •Гарячка Західного Нілу
- •Жовта гарячка
- •Геморагічні гарячки
- •Кримська-Конго геморагічна гарячка
- •Геморагічна гарячка з нирковим синдромом
- •Краснуха
- •Лімфоцитарний хоріоменінгіт
- •Гепатит в
- •Кандидоз
- •.Частина VI протозойні інфекції
- •Методи лабораторної діагностики
- •Малярія
Нокардіоз
Нетиповий актиномікоз або нокардіоз - хронічне захворювання внутрішніх органів, в основному, легень, рідко шкіри і слизових оболонок; можливий розвиток міцетоми стопи. Найчастішими збудниками є НосагЛа asteroides і NоеаМіа brasiliensis із родини ШосаМіасеае. Мікробіологічна діагностика проводиться так само, як і при актиномікозах. Матеріал для дослідження - харкотиння, гній із абсцесів і нориць, біоптати тканин.
Бактеріоскопія. Препарати-мазки забарвлюють за методом Грама і Ціля-Ніль- сена. При мікроскопії виявляють бацилярні і кокоподібні структури або скупчення паличок, що галузяться, забарвлюються за Грамом у фіолетовий колір (рис. 80).
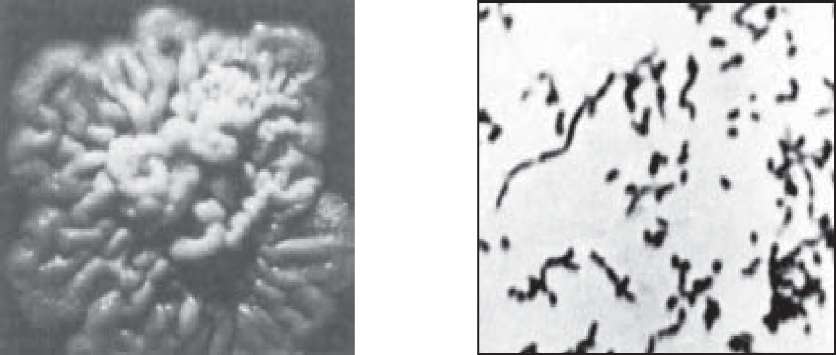
1 2 Рис. 80. N.Asteroides: колонії (1), ланцюжки і конідії в мазку (2).
При гістологічному дослідженні уражених тканин друз не знаходять. Для експрес-діагностики можна використати реакцію імунофлуоресценції.
Бактеріологічне дослідження. Нокардії вирощують в аеробних умовах. Клінічний матеріал сіють на середовище Сабуро, кров'яний і звичайний МПА. На 2-3 добу виростають дрібні воскоподібні колонії. Чисті культури ідентифікують за морфологічними особливостями, характером росту і біохімічними ознаками.
Можна поставити біологічну пробу на мишах і гвінейських свинках здебільшого при інтрацеребральному і внутрішньовенному способах зараження.
При необхідності провести серологічні дослідження ставлять реакції аглютинації, преципітації в гелі, зв'язування комплементу. Для діагностики міцетоми стопи використовують і реакцію імуноелектрофорезу.
Сифіліс та інші трепонематози
Сифіліс - хронічна інфекційна венерична хвороба людини, що має циклічний прогресуючий перебіг, уражає шкіру, слизові оболонки, внутрішні органи і нервову систему. Збудником захворювання є Treponema pallidum.
Розрізняють три основні періоди розвитку сифілісу, методи лабораторної діагностики яких мають свої особливості. У ранній період хвороби матеріалом для лабораторної діагностики служить виділення з твердого шанкеру, пунктат із лімфатичних вузлів, зскрібки з розеол, сифілід тощо. При вторинному і третинному періодах досліджують сироватку крові і ліквор.
У зв'язку з тим, що виділення чистих культур трепонем у звичайних бактеріологічних лабораторіях неможливе, під час первинного періоду хвороби (рідко пізніше) проводять бактеріоскопічний метод діагностики. Починаючи з вторинного періоду, використовують, в основному, серологічні методи.
Бактеріоскопічне дослідження. Перед взяттям патологічного матеріалу спочатку сифілітичну виразку протирають ватним тампоном, для видалення сального нальоту і контамінуючої мікрофлори. Потім дно твердого шанкеру подразнюють скальпелем чи металевою лопаточкою або енергійно стискають виразку з боків пальцями в гумовій рукавичці до виділення ранового ексудату. При невеликій
кількості прозорої рідини її можна внести у краплю 0,85 % розчину хлориду натрію. При неможливості взяти матеріал із дна шанкеру (фімоз, рубцювання виразки тощо) проводять пункцію регіонарних лімфатичних вузлів.
Краплю рідини з виразки або пунктату наносять на тонке предметне скло (1,1-1,2 мм), накривають покривним скельцем і досліджують у темному полі зору (краще!), або за допомогою фазово-контрастного чи аноптрального мікроскопа.
Бліда трепонема у темному полі зору має вигляд злегка блискучої тонкої ніжної спіралі з крутими рівномірними округлими первинними завитками (рис. 81). Рухи її плавні, часом вона згинається під кутом. Та особливо характерні для неї маятникоподібні коливання.
Збудник сифілісу необхідно відрізняти від Treponema refringens (що колонізує зовнішні статеві органи), яка товстіша, грубіша, з нерівномірними крупнішими завитками і має активні безладні рухи, але не згинається. Трепонеми фузосп- ірохетозного симбіозу відрізняються тонким рисунком, пологими завитками і безладним рухом.
При діагностиці ротового сифілісу бліду тре-
понему слід диференціювати і від зубних трепо-
нем, особливо Т. dentium, а також від Т. buccalis.
Першу з них взагалі важко відрізнити від сифілі- Рис■ 81 T PaUidum
.. _ . „ у темному полі зору.
тичноі. Вона, правда, коротша, має 4-8 гострих за-
витків, маятникоподібний рух відсутній. T. buccalis товстіша, має грубі первинні завитки і безладний рух.
При будь-яких сумнівах потрібно враховувати, що всі сапрофітні трепонеми, на відміну від блідої, добре фарбуються аніліновими барвниками. Вони не проникають у лімфатичні вузли, тому дослідження пунктатів має більшу діагностичну цінність. Виявлення у пунктаті лімфатичних вузлів типових трепонем беззаперечно підтверджує діагноз сифілісу.
Отже, темнопольне дослідження надавленої краплі є найкращим методом виявлення збудника сифілісу. Його переваги полягають у тому, що матеріал досліджують швидко, а морфологія трепонем у живому стані найбільш характерна. Тушові мазки за методом Буррі тепер не використовують.
7
Можна використовувати і метод сріблення за Морозовим. Трепонеми повністю зберігають свої морфологічні особливості і виглядають під мікроскопом коричневими або майже чорними. Але посріблені препарати довго не зберігаються. Останнім часом методи фарбування трепонем застосовують рідко.
Якщо розпочато лікування сифілісу хіміопрепаратами, виявити збудник у патологічних матеріалах навіть за допомогою темного поля зору практично не вдається. При отриманні негативного аналізу його необхідно повторити.
Серологічна діагностика сифілісу. При проведенні серологічних реакцій тепер використовують такі уніфіковані в Україні методи досліджень: реакції зв'язування комплементу (РЗК), імунофлуоресценції (РІФ), іммобілізації трепонем (РІТ), мікрореакцію преципітації (МПР) та імуноферментний аналіз (ІФА).
Впродовж багатьох років основною й найбільш поширеною реакцією вважалась реакція зв'язування комплементу або реакція Вассермана (РВ, RW). Для її постановки використовують сироватку крові хворого на сифіліс і спинномозкову рідину при ураженні нервової системи.
Методика постановки реакції Вассермана не відрізняється від техніки проведення РЗК. Різниця лише в тім, що для РВ використовують не лише специфічний трепонемний, а й неспецифічний кардіоліпіновий антиген.
Взяття 5-10 мл крові з ліктьової вени проводять натщесерце або не раніше 6 год після прийому їжі. Не можна брати кров у хворих з підвищеною температурою, після вживання алкоголю і жирної їжі, у вагітних жінок за 10 днів до пологів і породіль. Добуту з крові сироватку прогрівають при температурі 56 °С протягом 30 хв для інактивації власного комплементу. РВ обов'язково ставлять із двома антигенами: специфічним і неспецифічним.
Специфічний ультраозвучений трепонемний антиген готують із культур блідих трепонем (штам Рейтера), вирощених у пробірках і підданих дії ультразвуку. Його випускають у вигляді ліофільно висушеного порошку. Неспецифічний кардіоліпі- новий антиген готують шляхом спиртового екстрагування ліпідів із бичачого серця і очищення від баластових сумішей, розфасовують в ампули по 2 мл. Для введення антигену в РВ його титрують згідно з даною інструкцією. Безпосередньо перед постановкою РВ проводять титрування комплементу і гемолітичної сироватки за такою ж схемою, як і в РЗК. Реакцію Вассермана ставлять як якісним, так і кількісним методом. Якісну реакцію проводять у трьох пробірках із двома антигенами за звичайною схемою (табл. 61).
Результати реакції оцінюють за 4 плюсовою системою: позитивна реакція - коли є повна або значна затримка гемолізу (4+, 3+); слабопозитивна реакція - часткова затримка гемолізу (2+); сумнівна реакція - незначна затримка гемолізу (1+). В разі виникнення повного гемолізу РВ вважають негативною (див. вкл., рис.23).
Кожну сироватку, що дала позитивну якісну реакцію, необхідно дослідити і кількісним методом з послідовним її розведенням від 1:10 до 1:640 (табл. 62).
Титром досліджуваної сироватки (титр реагінів) вважають те максимальне її розведення, при якому настає повна (4+) або значна (3+) затримка гемолізу. Кількісний метод постановки РВ має важливе значення для оцінки ефективності
|
Таблиця 61 Схема постановки якісної реакції Вассермана Компоненти, мл |
Номер пробірки |
||
1 |
2 |
3 (контр.) |
|
Інактивована сироватка хворого 1:5 |
0,25 |
0,25 |
0,25 |
Антиген трепонемний в робочій дозі |
0,25 |
- |
- |
Антиген кардіоліпіновий в робочій дозі |
- |
0,25 |
- |
Ізотонічний розчин хлориду натрію |
- |
- |
0,25 |
Комплемент у робочому титрі |
0,25 |
0,25 |
0,25 |
Струсити, поставити на 45 хв у термостат при 37 °С |
|||
Гемолітична система |
0,5 |
0,5 |
0,5 |
Струсити, поставити на 45-60 хв у термостат при 37 °С |
|||
|
Таблиця 62 Компоненти, мл |
Номер п |
робірки |
||||||||
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|||
Ізотонічний розчин хлориду натрію |
0,25 |
0,25 |
0,25 |
0,25 |
0,25 |
0,25 |
0,25 |
0,25 |
||
Сироватка хворого, 1:5, інактивована |
0,25^ |
^ |
^ |
^ |
^ |
^ |
^ |
- |
||
Розведення сироватки |
1:10 |
1:20 |
1:40 |
1:80 |
1:160 |
1:320 |
1:640 |
- |
||
Кардіоліпіновий антиген у робочій дозі |
0,25 |
0,25 |
0,25 |
0,25 |
0,25 |
0,25 |
0,25 |
0,25 |
||
Комплемент у робочому титрі |
0,25 |
0,25 |
0,25 |
0,25 |
0,25 |
0,25 |
0,25 |
0,25 |
||
Експозиція в термостаті 45 хв при 37 °С |
||||||||||
Гемолітична система |
0,50 |
0,50 0,50 |
0,50 0,50 0,50 0,50 |
0,50 |
||||||
Експозиція в термостаті 60 хв при 37 °С |
||||||||||
Можливий результат |
4+ |
4+ 4+ |
3+ - - - |
- |
||||||
У даному випадку титр сироватки 1:80 |
||||||||||
лікування сифілісу. Швидке зниження титру реагінів вказує на успішну терапію. Якщо ж титр сироватки довго не знижується, це свідчить про відсутність ефективності застосованих препаратів і необхідність змінити тактику лікування.
При підозрі на серонегативний первинний сифіліс або прихований, третинний чи вроджений, рекомендують ставити реакцію Вассермана на холоді за тією ж схемою. В разі підозріння на нейросифіліс РВ проводять із спинномозковою рідиною, яку не інактивують, оскільки вона не містить власного комплементу. В реакцію вводять нерозведений ліквор і в розведеннях 1:2 і 1:5.
Реакція Вассермана стає позитивною через 2-3 тижні після появи твердого шанкру. При вторинному сифілісі вона випадає позитивною в 100 % випадків, у третинному - в 75 %.
Схема
кількісного методу реакції Вассермана
Мікрореакцію преципітації ставлять із кардіоліпіновим антигеном. Принцип реакції полягає в тому, що при додаванні до плазми або сироватки крові хворого на сифіліс емульсії кардіоліпінового антигену утворюється преципітат (комплекс антиген-антитіло), який осідає у вигляді пластівців білого кольору. Користуються такою методикою: у лунку пластини вносять піпеткою три краплі плазми (або інактивованої сироватки), потім додають одну краплю емульсії стандартного кардіоліпінового антигену. Компоненти реакції змішують струшуванням пластини протягом 5 хв, після чого додають три краплі 0,9 % розчину хлориду натрію і залишають при кімнатній температурі ще на 5 хв. Обов'язково ставлять контроль із слабопозитивною сироваткою крові. Результати оцінюють неозброєним оком над штучним джерелом освітлення. При появі в лунці великих пластівців реакцію вважають позитивною (4+, 3+), середніх і дрібних - як слабопозитивну (2+, 1+). При негативному результаті преципітат не утворюється.
Мікрореакцію преципітації можна проводити і кількісним методом для встановлення титру преципітуючих антитіл і оцінки на цій основі ефективності лікування. Більш високі титри МРП отримують з плазмою, ніж із сироваткою. За кордоном аналогом МРП із сироваткою хворого є VDRL (Veneral disease research laboratory), а з плазмою - RPR (Rapid plasma reagin).
Реакція імунофлуоресценції (РІФ). До групи специфічних реакцій, які широко вживаються для серологічної діагностики сифілісу, відноситься непряма реакція імунофлуоресценції. Як антиген, в ній використовують завись патогенних блідих трепонем штаму Нікольса із паренхіми яєчок кролика на 7-ий день після зараження. Реакцію ставлять у двох модифікаціях: РІФ-АБС і РІФ-200. У першому варіанті використовують сорбент антитіл (сонікат) - ультраозвучений трепо- немний антиген для РЗК. Його випускає Каунаське підприємство з виробництва бактерійних препаратів (Литва). При варіанті РІФ-200 сироватку хворого розводять у 200 разів з метою зняти вплив групових протитрепонемних антитіл.
Постановку РІФ-АБС проводять на тонких, добре знежирених предметних скельцях. На зворотному боці скелець склорізом позначено 10 кружечків, діаметром 0,7 см. У межах кружка на скло наносять антиген - завись блідих трепонем - у такій кількості, щоб у полі зору їх було 50-60. Мазки висушують на повітрі, фіксують над полум'ям і 10 хв в ацетоні. В окрему пробірку вносять 0,2 мл сорбенту (сонікату) і 0,5 мл сироватки крові хворого, добре перемішують. Суміш наносять на мазок (антиген) так, щоб рівномірно його покрити, витримують 30 хв у вологій камері при 37 °С (І фаза реакції). Після цього мазок промивають фосфатним буфером, висушують і наносять на нього антиглобулінову флуоресцуючу сироватку на 30 хв, ставлять у вологу камеру при 37 °С (ІІ фаза). Препарат знову промивають фосфатним буфером, висушують і досліджують під люмінесцентним мікроскопом.
При позитивній реакції бліді трепонеми випромінюють золотаво-зелене сяйво, при негативній - не світяться.
Техніка постановки РІФ-200 така сама, як і РІФ-АБС, тільки сироватку крові хворого попередньо розводять у 200 разів фосфатним буфером. При проведенні
реакції імунофлуоресценції з спинномозковою рідиною хворого на сифіліс нервової системи використовують РІФ-ц і РІФ-10, тобто ліквор вводять у реакцію не- інактивованим і нерозведеним, або розведеним 1:10.
Реакція іммобілізації блідих трепонем (РІТ) грунтується на феномені втрати їх рухливості у присутності іммобілізуючих протитрепонемних антитіл сироватки хворого і комплементу в умовах анаеробіозу. Як антиген в реакції використовують завись блідих трепонем із тестикулярної тканини кролика, зараженого лабораторним штамом Нікольса. Завись розводять стерильним 0,85 % розчином хлориду натрію так, щоб у полі зору було 10-15 спірохет.
Для проведення реакції в стерильній пробірці змішують 0,05 мл сироватки крові хворого, 0,35 мл антигену і 0,15 мл комплементу. Дослід супроводжують контролями сироватки, антигену і комплементу (табл. 63). Пробірки вміщують в анаеростат, створюють анаробні умови і витримують у термостаті 18-20 год при температурі 35 °С. Потім із кожної пробірки готують препарат надавленої краплі, підраховують не менше 25 трепонем і відмічають, скільки з них рухливих і скільки нерухливих. Відсоток специфічної іммобілізації блідих трепонем підраховують за такою формулою:
х=А-В. юс,
В
де Х - відсоток іммобілізації, А - число рухливих трепонем в контрольній пробірці, В - число рухливих трепонем у дослідній пробірці. Реакція вважається позитивною, коли відсоток іммобілізації становить 50 і більше, слабопозитивною - від 30 до 50, сумнівною - від 20 до 30 і негативною - від 0 до 20.
Постановка
реакції іммобілізації трепонем
(мікроанаеростатна методика)
|
Таблиця 63 Компоненти, мл |
Номер пробірки |
|||||||
дослід |
контроль компонентів |
|||||||
1 (дослідна) |
2 (контрольна) |
1 |
2 |
3 |
4 |
5 |
||
Досліджувана сироватка |
0,05 |
0,05 |
- |
- |
- |
- |
- |
|
Комплемент активний |
0,15 |
- |
0,15 |
0,15 |
0,15 |
- |
- |
|
Комплемент інактивований |
- |
0,15 |
- |
- |
- |
0,15 |
- |
|
Антиген |
0,35 |
0,35 |
0,35 |
0,35 |
0,35 |
0,35 |
0,35 |
|
Позитивна сироватка |
- |
- |
0,05 |
0,05 |
- |
- |
- |
|
Негативна сироватка |
- |
- |
- |
- |
0,05 |
0,05 |
- |
|
У практичних лабораторіях використовують більш простий меланжерний метод РІТ за М.М. Овчинниковим. Анаеробні умови досліду створюються вміщенням реагуючої суміші (сироватки, антиген, комплемент) у меланжер, обидва кінці якого закривають гумовим кільцем. Меланжерна методика дозволяє обходитись без складного обладнання та апаратури для створення анаеробіозу, але дає такі результати, які не поступаються класичній мікроанаеростатній методиці.
Реакції іммобілізації трепонем та імунофлуоресценції вважають найбільш специфічними в серологічній діагностиці сифілісу. І все ж таки, РІТ, незважаючи на її специфічність, не рекомендують для використання в широкій практиці через трудомісткість постановки.
Імуноферментний аналіз (ІФА) проводять як із кадріоліпіновим антигеном (неспецифічна, відбіркова реакція), так і з трепонемним (специфічна реакція), яка підтверджує діагноз сифілісу.
Принцип непрямого методу ІФА полягає в тому, що до антигена, адсорбованого на твердій фазі в лунках планшети, вносять досліджувану сироватку. Якщо вона містить антитіла проти трепонем, утворюється комплекс антиген-антитіло (І фаза). Після відмивання незв'язаних неспецифічних антитіл у лунки вносять ан- тиглобулінову сироватку, кон 'юговану з ферментом (частіше всього з пероксида- зою хріну). Кон'югат міцно приєднується до комплексу антиген-антитіло (ІІ фаза).
Після відмивання незв'язаного кон 'югату в лунки додають забарвлюючий субстрат ОФД - ортофенілендіамін (ІІІ фаза). Пероксидазну реакцію зупиняють, додаючи сірчану кислоту. Для контролю ставлять такі ж проби з позитивною та завідомо негативною сироватками.
Облік результатів аналізу проводять за допомогою фотометра, який визначає оптичну густину в двохвильовому режимі (492 нм і 620 нм). Для постановки реакції ензиммічених антитіл, окрім фотометра, потрібні одно- та восьмиканальні автоматичні піпетки з поліпропіленовим наконечником і відповідні набори діагностичних тест-систем.
Метод ІФА знаходить широке використання в серологічній діагностиці сифілісу. Він однаково ефективний для виявлення хвороби в інкубаційному періоді (через 1-2 тижні після інфікування), при клінічних проявах хвороби і прихованих її формах. Дуже часто ІФА використовують при скринінгових обстеженнях населення, особливо на станціях переливання крові.
У лабораторній практиці інколи застосовують також реакцію імунного прилипання (РІП) та реакцію непрямої гемаглютинації (РНГА). Перша з них грунтується на тому, що патогенні тестикулярні трепонеми штаму Нікольса при змішуванні з сироваткою хворого в присутності комплементу і еритроцитів людини прилипають до поверхні червоних кров'яних тілець. РНГА досить широко використовується для діагностики сифілісу завдяки своїй методичній простоті. Вона стає позитивною вже через три тижні після зараження. Позитивний результат реакції залишається впродовж років після видужання. Аналогом цієї реакції за кордоном є ТРНА (Treponema pallidum haemoagglutination).
