
- •УЧастина і загальна мікробіологія
- •Організація, устаткування, режим роботи бактеріологічних, імунологічних і вірусологічних лабораторій
- •Методи лабораторних досліджень
- •1. Феноловий генціанвіолет
- •Культивування мікроорганізмів
- •Екологія мікроорганізмів
- •Мікробіологічне дослідження води
- •Визначення індексу бгкп на етапах очищення
- •Дослідження мікрофлори повітря
- •Мікробіологічне дослідження грунту
- •Мікробіологічні дослідження харчових продуктів
- •Дослідження мікрофлори людини
- •Експериментальна інфекція. Використання тварин в лабораторних дослідженнях
- •Способи зараження експериментальних тварин
- •Мікробіологічне дослідження трупа
- •Визначення чутливості бактерій до антибіотиків
- •Основні набори дисків, які рекомендуються для визначення чутливості залежно від виду виділеної культури та патологічного матеріалу
- •Частина іі імунологія
- •Імунологічні методи діагностики інфекційних захворювань
- •Імунопрофілактика та імунотерапія інфекційних захворювань
- •Мікробіологічна діагностика окремих інфекційних захворювань Стафілококові інфекції
- •Захворювання, спричиненні умовно-патогенними ентеробактеріями
- •Ранова анаеробна газова інфекція
- •Бактероїдози
- •Дифтерія
- •Коклюш і паракоклюш
- •Псевдомонадні інфекції
- •Інфекції, викликані гемофільними бактеріями
- •Легіонельози
- •Лістеріоз
- •Туберкульоз
- •Лепра (проказа)
- •Мікобактеріози
- •Актиномікоз
- •Нокардіоз
- •1 2 Рис. 80. N.Asteroides: колонії (1), ланцюжки і конідії в мазку (2).
- •Сифіліс та інші трепонематози
- •Ендемічні побутові трепонематози
- •Лептоспіроз
- •Епідемічний поворотний тиф
- •Ендемічний поворотний тиф
- •Бореліоз Лайма
- •Рикетсіози
- •Епідемічний висипний тиф
- •Ендемічний висипний тиф
- •Північноазіатський рикетсіоз
- •Гарячка цуцугамуші
- •Пароксизмальний рикетсіоз
- •Трахома
- •Респіраторний хламідіоз
- •Сечостатевий хламідіоз
- •Будова і класифікація вірусів
- •Методи лабораторної діагностики вірусних інфекцій
- •Методи ідентифікації вірусів
- •Виділення та титрування бактеріофагів
- •Парагрип
- •Епідемічний паротит
- •Респіраторно-синцитіальні інфекції
- •Ентеровірусні інфекції
- •Ротавірусні гастроентерити
- •1 Ерпесвірусні інфекції
- •Простий герпес
- •Вітряна віспа - оперізуючий герпес
- •Цитомегалія
- •Аденовірусні інфекції
- •Коронавірусні інфекції
- •Гарячки Марбург і Ебола
- •Арбовірусні інфекції
- •Весняно-літній кліщовий енцефаліт
- •Японський енцефаліт
- •Гарячка Західного Нілу
- •Жовта гарячка
- •Геморагічні гарячки
- •Кримська-Конго геморагічна гарячка
- •Геморагічна гарячка з нирковим синдромом
- •Краснуха
- •Лімфоцитарний хоріоменінгіт
- •Гепатит в
- •Кандидоз
- •.Частина VI протозойні інфекції
- •Методи лабораторної діагностики
- •Малярія
Ранова анаеробна газова інфекція
Анаеробна газова інфекція (клостридіальний міозит, газова гангрена) - гостра, тяжка, поліетіологічна ранова інфекція, яку викликають бактерії роду Clostridium в асоціації між собою і умовно-патогенними мікроорганізмами. Основними збудниками захворювання є Clostridium perfrigens, C. novyi (oedematiens), C. septicum (див. вкл., рис. 17). Значно рідше зустрічаються C. histolyticum, C.sordellii, C. fallax. Із аеробних бактерій у рановому вмісті виявляють протей, стафілококи, кишкові палички та ін. C. perfrigens може викликати харчові токсикоінфекції.
В якості досліджуваного матеріалу беруть шматочки уражених тканин, рановий вміст, ексудат, випіт при набряках; при харчових токсикоінфеціях - блювотні маси, промивні води шлунка, випорожнення, кров, залишки підозрілої їжі. В разі необхідності досліджують перев'язувальний та шовний матеріал (шовк, кетгут), одяг, грунт, секційний матеріал (шматочки некротизованих тканин, печінки, селезінки). З метою попередження шкідливої дії кисню повітря на анаеробну мікрофлору тверді матеріали для дослідження краще брати у короткі пробірки, що герметично закриваються. Рідкі досліджувані матеріали можна набирати у шприц, на голку насадити гумовий корок і в такому вигляді транспортувати до лабораторії.
Мікробіологічна діагностика газової гангрени зводиться до виділення чистих культур збудників, їх ідентифікації на основі морфологічних, культуральних і біохімічних властивостей та визначення типів токсинів.
Бактеріоскопія є необхідним етапом для орієнтації в характері ранової мікрофлори. Для цього готують мазки-відбитки з уражених тканин, ексудату чи випоту, забарвлюють за Грамом або метиленовою синькою. Наявність у мазках великої кількості крупних грампозитивних паличок зі спорами чи капсулами (О. perfringens) або без них може служити ознакою можливого розвитку газової гангрени (рис. 75).
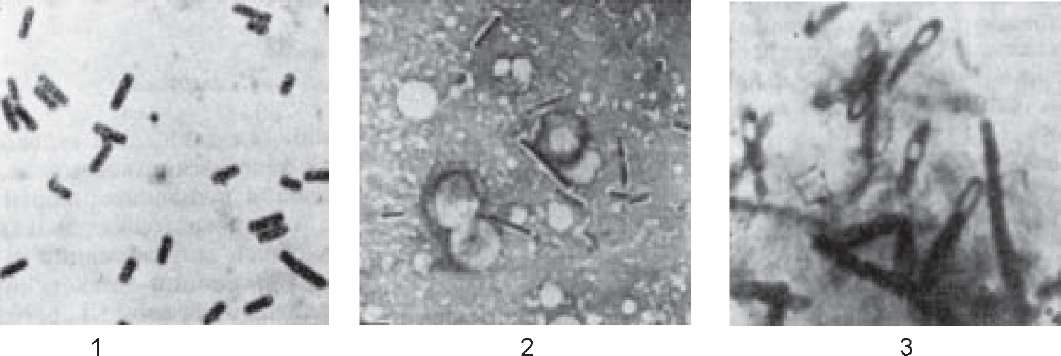
Рис. 75. C. Perfringens: 1 - вегетативні форми; 2 - капсули; 3 - спори.
З метою орієнтовної ідентифікації клостридій можна використати люмінесцентно-серологічний метод, коли мазки обробляють діагностичними флуоресцентними сироватками. За видом сироватки, яка викликає специфічне світіння навколо оболонок бактерій під люмінесцентним мікроскопом, визначають вид збудника.
Бактеріологічне дослідження. Рідкі досліджувані матеріали сіють у натив- ному вигляді. Шматочки уражених тканин та інші щільні матеріали спочатку гомогенізують у фарфорових ступках з піском, добавляючи рівний об'єм ізотонічного розчину хлориду натрію. Будь-який матеріал розділяють на 2 частини; одну з них прогрівають 20 хв при 80 °С, другу не піддають термічній обробці. Обидві проби паралельно висівають на спеціальні сердовища для культивування анаеробних мікроорганізмів.
Для первинного накопичення анаеробів широко використовують середовище Кітта-Тароцці. На ньому C. perfringens росте з інтенсивним помутнінням і бурхливим газоутворенням. Інші види утворюють помутніння і менше виділення газу або без нього (C. histolyticum). При посіві на стерильне знежирене лакмусове молоко C. perfringens вже через 4-5 год викликає його звудження з утворенням цегляного кольору губчастого згустка, який газ підіймає на поверхню пептонізованої рідини.
Класичним середовищем для отримання ізольованих колоній є кров'яний цукровий агар Цейслера (до МПА додають 1,5 % дефібринованої крові і 2 % глю - кози). Чашки з посівами вирощують в анаеростаті. На цьому агарі колонії основних збудників мають гладеньку дископодібну форму сіруватого кольору з рівними або бахромчастими краями і піднятим центром, оточені зоною гемолізу (рис. 76).
На середовищі Вілліса-Хоббса (МПА з лактозою, індикатором нейтральним червоним, яєчним жовтком і знежиреним молоком) колонії C. perfringens червоного кольору і зоною опалесценції; колонії C. novyi безбарвні (не розкладають лактози), але із зоною опалесценції; колонії С. septicum червоні; навколо колоній C. histolyticum є зона просвітлення.
Колонії C. histolyiticum, С. sordellii безбарвні, а ореол опалесценції мають лише колонії C. sordellii. На кров'яному агарі з бензидином колонії C. novyi чорніють після перебування на повітрі.
При посіві матеріалу уколом у стовпчик агару Вільсона-Блера вже через 3-4 години в ділянках росту C. perfringens середовище чорніє. Характерні особливості росту на молоці і середовищі Вільсона-Блера використовують для експрес- діагностики газової гангрени, викликаної C. perfringens.
Колонії, що виросли на диференціально-діагностичних середовищах, мікроскопують, пересівають на середовище Кітта-Тароцці, отримують чисту культуру й ідентифікують її за морфологічними, культуральними і біохімічними властивостями. Важливе значення має визначення типів екзотоксинів.
При відсутності анаеростатів та інших приладів для створення анаеробних умов ізольовані колонії, а отже й чисті культури, можна отримати шляхом посіву різних розведень досліджуваного матеріалу у трубки Віньяль-Вейона за методом Вейнберга. Матеріал розводять 1:10, 1:100, 1:1000 у розтопленому і охолодженому до 45 °С цукровому агарі, розлитому в пробірки по 10 мл. Із кожного розведення агар натягують у трубки, а капілярний кінець запаюють на вогні. Після інкубації при 37 °С трубки розпилюють надфілем, стовпчик агару з характерними колоніями анаеробів виштовхують у стерильну чашку Петрі. Потім колонії петлею пересівають у середовище Кітта-Тароцці, вирощують чисті культури й ідентифікують їх.
У ряді розвинутих країн оранізовані спеціальні лабораторії, в яких використовують сучасні апарати і тест-системи для культивування й ідентифікації анаеробів, а також бокси, де всі посіви, пересіви та інші маніпуляції проводять при повній відсутності кисню повітря.
Однак у рутинних бактеріологічних лабораторіях виділення і повну ідентифікацію чистих культур проводять рідко, оскільки весь процес займає багато часу, вимагає складних і дорогих живильних середовищ та спеціальних приладів. У зв'язку з цим для більш швидкої діагностики анаеробної газової інфекції і вибору відповідних лікувальних антитоксичних сироваток проводять визначення типів екзотоксинів за допомогою реакції нейтралізації in vivo.
Рис.
76.
Зони гемолізу навколо колоній
C.
perfringens.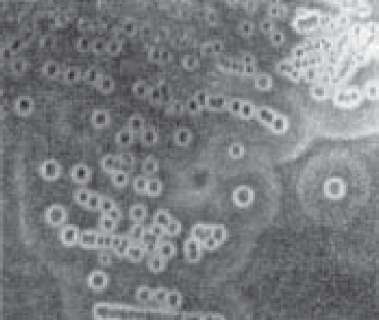
центрифугату, потім у 5 з них добавляють по 0,6 мл антитоксичних сироваток до основних видів збудників (табл. 55). У 6-у пробірку вносять 0,6 мл ізотонічного розчину хлориду натрію (контроль). Суміші витримують у термостаті протягом 40 хв і кожну з них в об'ємі 0,5 мл вводять внутрішньовенно двом мишам. Видову належність культури (токсину) визначають за мишами, що вижили, при загибелі тварин контрольної та інших дослідних груп.
У лабораторіях, де є можливості працювати з культурами тканин, реакцію нейтралізації ставлять на трипсинізованих клітинах 10-12 денних курячих ембріонів.
Токсигенність можна визначити ще на етапі росту ізольованих колоній. Для цього колонію емульгують на склі у краплі акридинового оранжевого, накривають покривним скельцем і досліджують під люмінесцентним мікроскопом. Наявність тільки зелених паличок свідчить про їх токсигенність. Червоні або зелені з червоними фрагментами бактерії виявляють при слабкій продукції токсинів або при повній їх відсутності.
Можна встановити вид і тип токсину в реакції преципітації на склі у агаровому гелі з фільтратом та відповідними антисироватками в реакції гальмування in vitro специфічними антитілами лецитиназної чи лейкотоксичної активності фільтратів або ранових ексудатів.
Ще швидше і точніше встановлюють види збудників газової гангрени за допомогою газової хроматографії, яка дозволяє визначати їх за якісним і кількісним вмістом насичених і ненасичених жирних кислот.
Діагностику харчових токсикоінфекцій, викликаних C. perfringens типів А і С, проводять за допомогою бактеріологічного дослідження з метою виділення збудника, визначення масивності контамінації ним харчових продуктів і типу токсинів.
Виділення чистих культур проводять так само, як і при анаеробній газовій інфекції (висів матеріалу на середовища Цейслера, Вілліса-Хобса або в трубки Віньяль-Вейона, отримання ізольованих колоній, чистих культур, ідентифікація).
Таблиця 55
Схема постановки реакцій нейтралізації на білих мишах
№ пробірок |
Центри- фугат культури, мл |
Антитоксичні сироватки |
0,85% розчин NaCl |
|||||
C.perf- ringens |
C.novyi |
C.septicum |
C.sordellii |
C.histo- lyticum |
||||
1 |
0,9 |
0,6 мл 50М0 |
|
|
|
|
|
|
2 |
0,9 |
|
0,6 мл 50М0 |
|
|
|
|
|
3 |
0,9 |
|
|
0,6 мл 100М0 |
|
|
|
|
4 |
0,9 |
|
|
|
0,6 мл 100М0 |
|
|
|
5 |
0,9 |
|
|
|
|
0,6 мл 100М0 |
|
|
6 |
0,9 |
|
|
|
|
|
0,6 мл |
|
При цьому обов'язково сіють10 мл крові хворого в 150-200 мл середовища Кітта- Тароцці з метою виділення C. perfringens. Із фільтратом культури важливо поставити реакцію нейтралізації на мишах для визначення типу екзотоксину.
Важливо провести і кількісний мікробіологічний аналіз. Для цього досліджуваний матеріал розводять у пептонній воді від 10-1 до 10-10 і по 1 мл кожного розведення засівають у розтоплене і охолоджене до 45 °С середовище Вільсона- Блера. Через 6-8 год інкубації при температурі 45-46 °С (або 20 год при 37 °С) відбирають ті проби, в яких виросло 10-30 колоній, і обчислюють кількість бактерій в 1 мл посівного матеріалу, враховуючи ступінь розведення і посівну дозу.
Для швидкого виявлення C. perfringens досліджуваний матеріал сіють у пробірку з лакмусовим молоком. Через 4-5 год відбувається характерне утворення губчастого згустка і просвітлення сироватки.
Діагноз харчової токсикоінфекції встановлюють тоді, коли виявляють значне обсіменіння (106 і більше в 1 г) тих продуктів, що спричинили захворювання, виділяють C. pergringens типів А і С і відповідні екзотоксини, або ж висівають з крові хворого C. perfringens будь -якого серотипу ( A, B, C, D, E, F).
Діагностика псевдомембранозного коліту. C. difficile є частим нозокоміаль- ним патогеном, який у 90-100 % випадків викликає це захворювання на фоні нераціональної терапії антибіотиками (ампіцилін, кліндаміцин, цефалоспорини). Вказані препарати викликають глибокий дисбаланс мікрофлори кишечника і колонізацію слизової C. difficile. Бактерії продукують 2 види токсинів - ентеротоксин (токсин А) і цитотоксин (токсин В).
Лабораторний діагноз псевдомембранозного коліту потребує взяття псевдомембран при колоноскопії і виділення збудника з біоптатів слизової оболонки сліпої кишки або випорожнень. C. difficile висівається майже від усіх хворих за допомогою тих же методів, що і при інших анаеробних інфекціях. "Золотим стандартом" є цитотоксичний тест: фільтрат фекалій або культури вносять у флакон з моношаром культури клітин, в результаті цього виникає цитопатична дія, що нейтралізується специфічною антисироваткою. На жаль, він досить громіздкий і забирає багато часу.
Швидка латекс-аглютинація застосовується часто, але вона не є високо-специфічною і часто дає хибно-позитивні і хибно-негативні результати. Більш точним і високоспецифічним є імуноферментний аналіз, який дає змогу надійно виявляти цитотоксин і ентеротоксин C. difficile.
