
- •УЧастина і загальна мікробіологія
- •Організація, устаткування, режим роботи бактеріологічних, імунологічних і вірусологічних лабораторій
- •Методи лабораторних досліджень
- •1. Феноловий генціанвіолет
- •Культивування мікроорганізмів
- •Екологія мікроорганізмів
- •Мікробіологічне дослідження води
- •Визначення індексу бгкп на етапах очищення
- •Дослідження мікрофлори повітря
- •Мікробіологічне дослідження грунту
- •Мікробіологічні дослідження харчових продуктів
- •Дослідження мікрофлори людини
- •Експериментальна інфекція. Використання тварин в лабораторних дослідженнях
- •Способи зараження експериментальних тварин
- •Мікробіологічне дослідження трупа
- •Визначення чутливості бактерій до антибіотиків
- •Основні набори дисків, які рекомендуються для визначення чутливості залежно від виду виділеної культури та патологічного матеріалу
- •Частина іі імунологія
- •Імунологічні методи діагностики інфекційних захворювань
- •Імунопрофілактика та імунотерапія інфекційних захворювань
- •Мікробіологічна діагностика окремих інфекційних захворювань Стафілококові інфекції
- •Захворювання, спричиненні умовно-патогенними ентеробактеріями
- •Ранова анаеробна газова інфекція
- •Бактероїдози
- •Дифтерія
- •Коклюш і паракоклюш
- •Псевдомонадні інфекції
- •Інфекції, викликані гемофільними бактеріями
- •Легіонельози
- •Лістеріоз
- •Туберкульоз
- •Лепра (проказа)
- •Мікобактеріози
- •Актиномікоз
- •Нокардіоз
- •1 2 Рис. 80. N.Asteroides: колонії (1), ланцюжки і конідії в мазку (2).
- •Сифіліс та інші трепонематози
- •Ендемічні побутові трепонематози
- •Лептоспіроз
- •Епідемічний поворотний тиф
- •Ендемічний поворотний тиф
- •Бореліоз Лайма
- •Рикетсіози
- •Епідемічний висипний тиф
- •Ендемічний висипний тиф
- •Північноазіатський рикетсіоз
- •Гарячка цуцугамуші
- •Пароксизмальний рикетсіоз
- •Трахома
- •Респіраторний хламідіоз
- •Сечостатевий хламідіоз
- •Будова і класифікація вірусів
- •Методи лабораторної діагностики вірусних інфекцій
- •Методи ідентифікації вірусів
- •Виділення та титрування бактеріофагів
- •Парагрип
- •Епідемічний паротит
- •Респіраторно-синцитіальні інфекції
- •Ентеровірусні інфекції
- •Ротавірусні гастроентерити
- •1 Ерпесвірусні інфекції
- •Простий герпес
- •Вітряна віспа - оперізуючий герпес
- •Цитомегалія
- •Аденовірусні інфекції
- •Коронавірусні інфекції
- •Гарячки Марбург і Ебола
- •Арбовірусні інфекції
- •Весняно-літній кліщовий енцефаліт
- •Японський енцефаліт
- •Гарячка Західного Нілу
- •Жовта гарячка
- •Геморагічні гарячки
- •Кримська-Конго геморагічна гарячка
- •Геморагічна гарячка з нирковим синдромом
- •Краснуха
- •Лімфоцитарний хоріоменінгіт
- •Гепатит в
- •Кандидоз
- •.Частина VI протозойні інфекції
- •Методи лабораторної діагностики
- •Малярія
1. Феноловий генціанвіолет
П Р А К Т И Ч Н А М І К Р О Б І О Л О Г І Я 1
Передмова 3
уЧастина І ЗАГАЛЬНА МІКРОБІОЛОГІЯ 4
Розділ 5 104
Розділ 6 21
ЕКСПЕРИМЕНТАЛЬНА ІНФЕКЦІЯ. ВИКОРИСТАННЯ ТВАРИН В ЛАБОРАТОРНИХ ДОСЛІДЖЕННЯХ 21
Розділ 7 ГЕНЕТИКА БАКТЕРІЙ 36
Розділ 8 39
ВИЗНАЧЕННЯ ЧУТЛИВОСТІ БАКТЕРІЙ ДО АНТИБІОТИКІВ 39
о. 60
л. 60
у V V 61
Ешерихіози 143
Захворювання, спричиненні умовно-патогенними ентеробактеріями 148
Черевний тиф і паратифи 152
Сальмонельози (харчові токсикоінфекції) 160
Дизентерія (шигельоз) 163
Клебсієльози 166
Холера 170
Кампілобактеріози і гелікобактеріози 180
Чума 183
Псевдотуберкульоз 190
Кишечний ієрсиніоз 191
Туляремія 192
Бруцельоз 197
Сап і меліоїдоз 203
Сибірка (злоякісний карбункул) 206
Мікробіологічна діагностика анаеробних інфекцій 211
Ботулізм 211
Правець 216
Ранова анаеробна газова інфекція 219
Бактероїдози 224
Дифтерія 229
Коклюш і паракоклюш 237
Псевдомонадні інфекції 239
Інфекції, викликані гемофільними бактеріями 242
Легіонельози 244
Лістеріоз 245
Туберкульоз 246
Лепра (проказа) 254
Мікобактеріози 255
Актиномікоз 256
Нокардіоз 258
Сифіліс та інші трепонематози 259
Ендемічні побутові трепонематози 269
Лептоспіроз 271
Бореліози 276
Епідемічний поворотний тиф 277
Ендемічний поворотний тиф 279
Бореліоз Лайма 280
Рикетсіози 281
Епідемічний висипний тиф 281
Ендемічний висипний тиф 283
Ку-гарячка 284
Північноазіатський рикетсіоз 285
Гарячка цуцугамуші 286
Пароксизмальний рикетсіоз 287
Хламідіози 288
Трахома 288
Орнітоз 290
Респіраторний хламідіоз 292
Сечостатевий хламідіоз 293
Мікоплазмози 295
Для серологічної діагностики можна використати постановку реакцій зв'язування комплементу, непрямої імунофлуоресценції, непрямої гемаглютинації, агрегат-аглютинації та метод імуноферментного аналізу. Однак реактиви для цих реакцій поки що мало доступні для практичних лабораторій і є лише у профільних науково-дослідних центрах.Частина IV ВІРУСОЛОГІЯ 299
БУДОВА І КЛАСИФІКАЦІЯ ВІРУСІВ 299
ЛАБОРАТОРНА ДІАГНОСТИКА ВІРУСНИХ ІНФЕКЦІЙ 330
Грип 330
■ ■ • • • • і ••• Параміксовірусні інфекції 337
Кір 340
1 ерпесвірусні інфекції 350
Сказ 359
Вірусні гепатити 371
Якщо з випорожнень виділяють патогенні ентеробактерії, гемолітичні еше- рихії та гемолітичні стафілококи, які у здорових людей відсутні, це має важливе діагностичне значення. Для визнання етіологічної ролі представників нормального мікробіоценозу важливо порівнювати їх титр з концентрацією відповідних мікроорганізмів у здорових дітей і дорослих. При ураженнях, викликаних іншими видами, необхідно проводити дослідження у відповідності з методикою виділення кожного збудника.Частина V МІКОЗИ 392
.Частина VI ПРОТОЗОЙНІ ІНФЕКЦІЇ 419
.Зміст 451
Барвник розчиняють у киплячій воді.
Метод П ю. Готують спеціальний барвник: до 2 мл етанолу добавляють 0,2 г толуїдинового синього, потім 100 мл 5 % розчину оцтової кислоти. Барвник стійкий, зберігається довго. На фіксований мазок наливають приготовлений барвник і підігрівають до появи парів протягом 1-2 хв, охолоджують, промивають водою, висушують і мікроскопують. Волютинові зерна мають темно-синє забарвлення. Метахромазія особливо чітко виступає при штучному освітленні.
Метод Мейера. Окрім метахромазії, забарвлений волютин має ще й значну кислотостійкість. Саме ця властивість і лежить в основі методу. З досліджуваного матеріалу роблять два тонких мазки (подібно до мазків крові), фіксують їх на полум'ї (або в рідині Карнуа) і забарвлюють метиленовим синім протягом 10 хв. Один мазок занурюють на 5 хв у 1 % водний розчин сірчаної кислоти, другий - на такий же час у 4 % розчин калію карбонату. Обидва мазки, не промиваючи водою, висушують фільтрувальним папером. Перший препарат помічають літерою К (кислота), другий - Л (луг). Мазок К додатково забарвлюють хризоїдином (або 0,25 % розчином світлого зеленого). Цитоплазма бактерій у мазку К забарвлюється у світло-коричневий (або зелений) колір, волютинові зерна - у вишнево-червоний. У мазку Л цитоплазма виглядає слабо забарвленою, а на місці метахроматичних зерен видні пустоти (знебарвлений волютин).
Метод Мейера дає найвірогіднішу можливість встановити волютинову природу включень.
Метод Раскіної. Барвник готують за таким прописом: фенолового фуксину Циля - 4 мл, льодяної оцтової кислоти - 5 мл, етанолу 96° - 95 мл, дистильованої води - до 200 мл. Його наливають на фіксований жаром препарат, підігрівають на полум'ї газового пальника до повного випаровування барвника, промивають водою, висушують і мікроскопують. Цитоплазма бактерій забарвлюється в світло- червоний колір, а зерна волютину - в чорно-синій.
Оболонка бактерій складається з цитоплазматичної мембрани, клітинної стінки й капсули.
Цитоплазматична мембрана - м'яка, пластична, тришарова поліфункціо- нальна структура. Вона здатна утворювати інвагінати, які називаються мезосома- ми, і відіграють важливу роль у життєдіяльності клітини.
Клітинна стінка - своєрідний захисний шар, який визначає і зберігає постійну форму бактерій, захищає цитоплазму від дії механічних та осмотичних сил і виконує ряд інших важливих функцій, є унікальним структурним компонентом, властивим тільки бактеріям (окрім мікоплазм). Морфологічно стінка складається з двох шарів: зовнішнього - пластичного і внутрішнього - ригідного, пружного.
Зовні мікробні клітини можуть бути вкриті речовиною слизового характеру, яку називають капсулою. У бактерій розрізняють мікрокапсулу, капсулу й слизовий шар. Мікрокапсула складається з мукополісахаридних фібрил, які невидимі під світловим мікроскопом, а виявляються лише при електронній мікроскопії.
Капсула - це міцно зв'язаний з клітинною стінкою особливий слизовий шар. Одні бактерії утворюють капсули тільки в організмі людей і тварин (збудники сибірки, чуми, крупозної пневмонії), в інших - вона завжди є в усіх середовищах (клебсієли). Інколи капсула оточує разом декілька клітин (сибіркова бацила, лей- коносток), тоді такі структури називають зооглеями. Окремі види мікробів виділяють слизові екзополімери у великій кількості, вони неміцно зв' язані з клітинною стінкою, утворюючи рихлий слизовий шар.
При повсякденних діагностичних лабораторних дослідженнях потреба виявляти клітинну стінку чи цитоплазматичну мембрану майже не виникає. Під світловим мікроскопом ці структури можна виявити за допомогою явищ плазмолізу або плазмоптизу. Якщо бактерії помістити в гіпертонічний розчин, виникає їх сильне зневоднення, цитоплазма клітин зморщується й відстає від клітинної стінки (плазмоліз). Під мікроскопом видно контури бактерій, тобто їх клітинні стінки. Якщо ж помістити мікроби в дистильовану воду (або гіпотонічний розчин), спостерігається протилежне явище - плазмоптиз. Вода направляється в клітину, яка згодом набрякає й лопається. При мікроскопії таких клітин спостерігають лише їх контури (чохли).
Розроблені також методи спеціального забарвлення клітинної стінки. Найбільш відомими з них є методи Пєшкова, Гутштейна, Кнайзі.
Метод Пєшкова. Мазок спочатку обробляють спеціальним фіксатором (60 мл 90 % етанолу, 30 мл хлороформу і 10 мл оцтової кислоти) протягом 15 хв, потім протравлюють у 10 % розчині таніну 5 хв, промивають водою і забарвлюють водним розчином основного фуксину протягом 30-60 с. Препарат висушують
на повітрі й мікроскопують. Оболонка виглядає як тонкий червоний обідок навколо бактерійної клітини.
Надійний спосіб забарвлення клітинної стінки, як варіант методу Гутш- тейна, описав Сінай. Препарат фіксують рідиною Карнуа, протравлюють 2-5 хв 10 % розчином таніну, промивають водою і розглядають в надавленій краплі 0,02 % водного розчину кристалічного фіолетового. Забарвлюються оболонки в фіолетовий колір вже через 5-10 с.
Метод Кнайзі. Зафіксований у полум' ї пальника мазок протравлюють у спеціальному розчині (насичений водний розчин калійних галунів - 70 мл, 20 % розчин таніну - 30 мл), промивають водою, наносять краплю фенолового фуксину, накривають покрівним скельцем і розглядають під мікроскопом. Клітинна стінка фарбується в червоний колір.
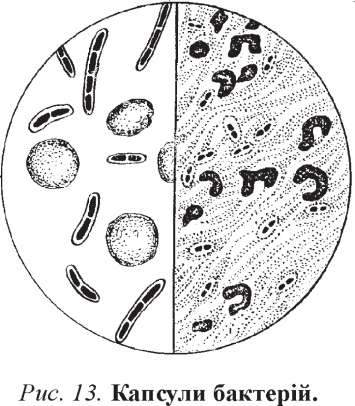
Забарвлення капсул. Капсули бактерій містять складні гетерополісахариди і поліпептиди, мають гелеподібну консистенцію. При звичайних методах фарбування вони погано сприймають барвники. Лише у препаратах-відбитках з уражених тканин і органів, мазках із гною, харкотиння вони виявляються при будь-якому методі фарбування у вигляді незабарвлених зон (ореолів) між забарвленими тілами бактерій і субстратом (рис. 13). Для фарбування самих капсул запропоновані різні методи.
Спосіб Ребігера. Нефіксований мазок забарвлюють насиченим розчином генціанового фіолетового у 40% формаліні протягом 15-20 с, швидко промивають водою і висушують. Капсули фарбуються у червоний, а бактерії - в темно-фіолетовий колір.
Метод Гінса. З досліджуваного матеріалу роблять негативний препарат за способом Буррі. Мазок фіксують сумішшю Никифорова, або метанолом, промивають водою і забарвлюють 3-5 хв за Гінсом феноловим фуксином Циля, розведеним 1:3. Промивають водою, висушують, мікроскопують під імерсійним об'єктивом. На темному димчасто-сірому фоні контрастно виділяються незабарвлені капсули, всередині яких знаходяться яскраво-червоні тіла бактерій (див. вкл., рис. 5).
Метод Гісса. Тонкий мазок фіксують у спирт-формолі або суміші Никифорова (але не жаром), фарбують розчином основного фуксину (1 ч насиченого спиртового розчину барвника + 19 ч дистильованої води) з підігріванням до появи парів, потім залишають на 30 с для охолодження. Препарат промивають великою кількістю розчину мідного купоросу, висушують, не промиваючи водою, і мікроскопують. Капсули забарвлюються в голубий колір, тіла мікробів - у темно-червоний.
Забарвлення спор. Деякі бактерії при несприятливих умовах здатні утворювати ендоспори. При дослідженні незабарвлених мазків із старих агарових культур спори виявляються у вигляді круглих, або овальних утворень, які сильно заломлюють світло, і виглядають пустотами. Вони погано забарвлюються аніліновими барвниками при звичайних методах фарбування.
Розміри спор можуть не перебільшувати діаметр мікробної клітини (Bacillus) або бути більшими за нього (Clostridium). Спори в клітині можуть розміщуватись центрально (збудник сибірки), субтермінально (палички ботулізму, газової гангрени) або термінально (палички правця).
Для виявлення спор розроблені спеціальні методи їх забарвлення. Всі вони основані на дії протрав, які розрихлюють міцні оболонки спор і полегшують проникнення барвників.
Метод Ожешки. На приготовлений густий не зафіксований мазок спороносної культури бактерій наливають 0,5 % розчин соляної кислоти й підігрівають 3-4 рази до появи парів (протрава). Препарат промивають водою, висушують фільтрувальним папером і фіксують у полум'ї пальника. Потім мазок забарвлюють за методом Циля-Нільсена, промивають водою, висушують і мікроскопують. Тіла бактерій фарбуються в голубий колір, спори - в червоний (див. вкл., рис. 6).
Метод Пешкова - простий і надійний спосіб забарвлення спор, який не вимагає хімічних протрав і диференціювання в кислоті чи спирті. Його проводять за таким алгоритмом:
Виготовляють мазок, висушують і фіксують у полум'ї газового ріжка, або в спиртовому формаліні.
На препарат наливають лужний метиленовий синій і доводять його до кипіння, періодично вносячи в полум'я на 15-30 с.
Барвник змивають водою і додатково фарбують 0,5 % водним розчином нейтрального червоного впродовж 30-40 с. Промивають дистильованою водою, висушують, розглядають за допомогою масляної імерсії. Спори виглядають синіми, або голубими, цитоплазма - рожевою.
Метод Мюллера. На зафіксований в полум'ї мазок наливають 5 % водний розчин хромової кислоти на 2-3 хв, промивають водою, висушують і забарвлюють за методом Циля-Нільсена, мікроскопують. Спори набувають червоного кольору, а цитоплазма бактерій - синього.
Метод Шеффера-Фултона. Густий мазок фіксують у полум'ї, наливають 5 % водний розчин малахітового зеленого, 3-4 рази нагрівають до появи парів, промивають струменем проточної води 30-40 с і додатково забарвлюють 0,5 % водним розчином сафраніну, промивають водою і мікроскопують. Тіла бактерій забарвлюються в червоний, а спори - в зелений колір.
Забарвлення джгутиків. У деяких видів плаваючих бактерій є спеціальні органи руху - джгутики, розміри яких досягають 0,02-0,04 мкм у ширину і 6-80 мкм у довжину. Вони містять особливий скоротливий білок флагелін. За кількістю і розташуванням джгутиків рухливі бактерії поділяють на 4 групи:
1. Монотрихи - один полярно розташований джгутик (холерний вібріон);
Лофотрихи - пучок джгутиків на одному кінці (псевдомонади);
Амфітрихи - поодинокі або пучки джгутиків на обох кінцях бактерій (спірили);
Перитрихи - багато джгутиків, розташованих навколо клітини (збудник черевного тифу, кишкова паличка).
Число, спосіб розміщення і розміри джгутиків є постійними ознаками для певного виду бактерій, що враховують при проведенні їх систематики.
Виявити джгутики можна за допомогою прямих та непрямих методів. При прямих методах джгутики забарвлюють барвниками або солями металів. Обов'язково вживають протрави, які сприяють осіданню на джгутиках препаратів срібла або заліза, що призводить до штучного збільшення їх діаметра. Вони стають видимими під світловим мікроскопом. До прямих методів виявлення джгутиків відносяться і дослідження їх під електронним мікроскопом на ультратонких зрізах.
При непрямих методах спостерігають за рухом бактерій у висячій або надавленій краплі за допомогою світлової, темнопольної, фазово-контрастної та анопт- ральної мікроскопії.
Забарвлення джгутиків - одна з найтонших, складних і вимогливих бактеріоско- пічних методик. Запропоновано багато складних методів їх фарбування: Леффлера, Грея, Морозова, Уварова, Бенін'єтті та ін. Найнадійнішим із них є метод Леффлера.
Метод Леффлера. Важливою умовою для успішного забарвлення є виготовлення мазків із молодої (12-18 год) агарової культури на ідеально чистих і знежирених скельцях. Бактеріологічною петлею беруть невелику кількість культури і вносять її в 5-6 мл водопровідної води, не емульгуючи, а залишаючи петлю до тих пір, поки бактерії самі розійдуться в рідині. Пастерівською піпеткою з тонко відтягнутим капіляром наносять на скельце 5-6 окремих крапель суспензії бактерій у воді, висушують на повітрі. Фіксують дуже обережно, один раз швидко провівши препарат через полум'я.
Для забарвлення необхідно приготувати такі розчини:
Протрава: 1 мл насиченого спиртового розчину основного фуксину, 10 мл 20 % водного розчину таніну, 5,5 мл насиченого на холоді водного розчину сірчанокислого закисного аміачного заліза. Розчин готують за 1-2 доби до вживання, перед використанням обов'язково фільтрують.
Концентрований феноловий фуксин Циля, наполовину розведений водою і профільтрований.
На фіксований препарат наносять надлишок протрави й залишають її протягом 10-15 хв, промивають дистильованою водою до повного видалення протрави. Фарбують профільтрованим фуксином Циля протягом 3-5 хв, промивають водою, висушують і мікроскопують. Тіла бактерій забарвлюються в темний червоно-коричневий колір, джгутики виглядають світлішими, такого ж відтінку.
Метод Бенін єтті. Суспензію бактерій і мазок роблять так само, як і за методом Леффлера. Протраву і забарвлення проводять одним фарбуючим розчином, який завжди готують ex tempore: розчин 1 - сірчанокислого цинку 1 г, таніну 10 г, дистильованої води 100 мл; розчин 2 - насичений спиртовий розчин генціана фіолетового.
Змішують 5 мл першого і 3 мл другого розчинів. Суміш наносять на препарат-мазок, тричі нагрівають до появи парів, охолоджують, добре промивають водою. Висушують і мікроскопують. Тіла бактерій фарбуються в темно-фіолетовий колір, джгутики мають більш ніжне забарвлення.
Мікроскопічне дослідження живих мікробів
Для прижиттєвого вивчення мікроорганізмів використовують методи надавленої й висячої краплі та спеціальні камери для тривалого спостереження за їх ростом, розмноженням, дією різних хіміотерапевтичних препаратів тощо. Перевагою цих методів є можливість досліджувати бактерії в неушкодженому вигляді, тоді як обробка мазків при їх висушуванні, фіксації та забарвленні часто супроводжується зміною мікробних клітин. Значно легше, простіше і швидше можна виявити рухливість, що свідчить про наявність джгутиків. Цим широко користуються в практичних лабораторіях при диференціально-діагностичному визначенні видів збудників.
Однак, ці методи мають і ряд недоліків. У живих бактерій, що активно рухаються, важко виявляти деталі структури. При такому дослідженні можна мати лише загальне уявлення про їх морфологію. Разом з тим, дослідження у живому стані крупніших мікроорганізмів (гриби, найпростіші) дає змогу вивчати тонку структуру їх клітин краще, ніж у забарвлених препаратах. Ця перевага стає особливо виразною при дослідженні живих незабарвлених мікробів за допомогою фазово- контрастної та аноптральної мікроскопії.
Необхідно завжди пам'ятати, що робота з живими збудниками більш небезпечна, вимагає виняткової обережності і навику. Після мікроскопії потрібно обов'язково занурювати препарати в дезінфікуючий розчин.
Надавлена крапля. На середину предметного скла бактеріологічною петлею або піпеткою наносять краплю молодої (12-18 год) теплої бульйонної культури або іншого досліджуваного матеріалу. При густому рості культури її розбавляють фізіологічним розчином, оскільки наявність великої кількості мікробних тіл у полі зору утруднює спостереження за окремими бактеріями та їх рухливістю. Нанесену краплю накривають покрівним скельцем, обережно накладаючи його пінцетом, щоб у надавленій краплі не з'являлись бульбашки повітря. Для цього по- крівне скельце краще не накладати зверху, а ставити його ребро біля краю краплі і повільно опускати, витісняючи повітря між предметним і покрівним скельцями. Вдало зроблена крапля заповнює весь простір між ними, але при цьому рідина не виступає за краї покрівного скельця. Якщо вона виступає, зайву її частину відсмоктують шматочком фільтрувального паперу, утримуючи його пінцетом, після чого папір занурюють у дезінфікуючий розчин. Недоліком надавленої краплі є її швидке висихання. При необхідності довго розглядати препарат, краї покрівного скла заздалегідь змащують вазеліном.
Висяча крапля - метод мікроскопічного дослідження живих мікроорганізмів, розроблений Р. Кохом в 1876 р. За його допомогою можна спостерігати розмно
ження бактерій, характер їх рухливості, проростання спор у вегетативні форми, явище хемотаксису, дію фізичних і хімічних факторів, імунних сироваток тощо. Його також широко використовують для вивчення морфології грибів, найпростіших і спірохет. Як і в методі надавленої краплі, досліджують молоді культури, вирощені в рідкому або на щільному середовищі.
Для виготовлення висячої краплі необхідні спеціальні предметні скельця, в центрі яких є напівсферичне заглиблення (лунка). Невелику краплю негустої суспензії бактерій петлею або піпеткою наносять на середину чистого, але не знежиреного покрівного скельця. Предметне скло з лункою, краї якої попередньо змащують вазеліном, обережно накладають на покрівне скельце, слідкуючи, щоб крапля культури знаходилась в центрі заглиблини, і швидко перевертають його. Крапля повинна звисати в лунці, але не торкатись її дна. Звідси походить назва препарату висяча крапля. Змащування країв лунки вазеліном створює своєрідну герметичну вологу камеру. Така крапля не висихає і придатна для спостереження протягом довгого часу (рис. 14).
Мікроскопічне дослідження живих об'єктів як в надавленій, так і висячій краплях проводиться за допомогою сильних сухих або імерсійних систем при опущеному конденсорі, звуженій діафрагмі та освітленні плоским дзеркалом. Спочатку при малому збільшенні (х8) знаходять край краплі, чітко видимий як лінія в дещо затемненому полі зору. По один бік цього краю є багато дрібнесеньких краплинок конденсату, які осіли на внутрішній поверхні покрівного скельця. По другий бік лінії видно рівномірний сіруватий фон. Це й є крапля. Знайдений край краплі переміщують у центр поля зору мікроскопа й переходять на сильніший сухий (х40), а при потребі й на імерсійний об'єктив (х90). Трохи відкривають діафрагму конденсора й починають спостерігати характер руху. Рухливі бактерії проходять з однаковою швидкістю значну віддаль, часом через усе поле зору, роблячи кругові та гвинтові рухи. Найбільш швидкі й прямолінійні рухи роблять мо- нотрихи й лофотрихи. Перитрихам і амфітрихам властива менш енергійна й безладна рухливість. Мікроскопіст-початківець може помилково прийняти молекулярний (броунівський) рух за справжній. При цьому нерухливі бактерії постійно коливаються між двома близькими точками, ніби "танцюють" на місці.
а
б
Рис.
14.
Висяча крапля:
а
- вид зверху; б - вид збоку.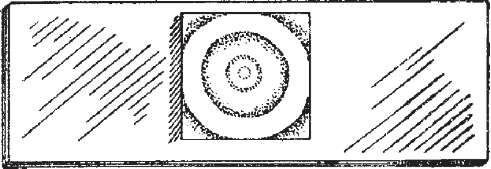
ми в краплі, що звисає донизу в цій вологій камері. За допомогою такої камери можна навіть проводити цейтраферну кінозйомку живих об'єктів.
Для збільшення контрастності досліджуваних об'єктів в надавленій чи висячій краплях можна застосувати прижиттєве (вітальне) забарвлення. Для цього використовують малотоксичні й майже нешкідливі барвники: метиленовий і толуїдиновий синій, конго і нейтральний червоний, акридиновий оранжевий, янус зелений та ін. Суспензію мікробів вносять у краплю 0,001 % водного розчину барвника, готують надавлену або висячу краплю і мікроскопують.
Можна проводити прижиттєве забарвлення бактерій і флуорохромами. Тоді дослідження проводять за допомогою люмінесцентної мікроскопії.
Ще кращі можливості для довготривалого вивчення живих мікроорганізмів створюються у спеціально сконструйованих камерах. Найбільш відомі з них запропонували Пєшков і Фонбрюн.
Ш-подібна камера Пєшкова. На предметне скло наливають шар розтопленого агару товщиною 0,2 мм. Після застигання стерильним скальпелем вирізають дві канавки і отримують Ш-подібний шар середовища. Посів мікробів проводять методом стікаючої краплі лише на середню смужку агару і негайно закривають стерильним покрівним скельцем. Середовище, що виступає за межі покрівного скла, обрізають і розтопленим парафіном герметично закривають краї препарату. Смужка агару, що межує з боків із повітрям канавок, гарантує нормальний розвиток аеробних і факультативно анаеробних мікробів.
Масляна камера Фонбрюна. На предметному склі товщиною 0,5 мм за допомогою густого спиртового розчину Шеллака приклеюють дві вузенькі скляні смужки такої ж товщини на відстані 10 мм одна від одної. Покрівне скельце з тонким шаром засіяного мікробами агару накладають на скляні бортики попередньо змазані сумішшю воску й каніфолю. Гумовою грушею продувають камеру, щоб випарувати конденсаційну вологу, і пастерівською піпеткою негайно заливають її вазеліновим маслом, обережно підпускаючи його під покрівне скельце. Масло заливають доти, поки весь шар агару знизу буде ним покритий. Краплю масла не слід доводити до країв камери, необхідно завжди залишати невеличкий зазор.
За допомогою камер Пєшкова й Фонбрюна можна вивчати найтонші зміни клітинних структур при розмноженні бактерій і проводити їх цейтраферну кінозйомку особливо при використанні фазово-контрастної й аноптральної мікроскопії.
Макроскопічне виявлення рухливості бактерій. Окрім забарвлення джгутиків, дослідження за допомогою надавленої та висячої крапель, рухливість мікроорганізмів можна досить просто встановити й неозброєним оком. Для цього досліджувану культуру сіють уколом у стовпчик напіврідкого живильного середовища. Посів інкубують у термостаті протягом 18-20 год. Якщо бактерії не мають джгутиків, їх ріст (інтенсивне помутніння) буде тільки впродовж лінії уколу. Рухливі бактерії дадуть дифузний ріст по всій товщині живильного середовища.
Розділ 4 ФІЗІОЛОГІЯ БАКТЕРІЙ
Фізіологія мікроорганізмів як окремий розділ мікробіології вивчає біохімічні й енергетичні процеси, що відбуваються в бактеріальній клітині й забезпечують відтворення її структурного матеріалу та енергетичні потреби. Адже бактерії є складними живими організмами, в яких відбуваються різноманітні біохімічні перетворення. Вони зумовлюють ріст, розмноження, продукцію ферментів, токсинів та інших біологічно активних речовин, відповідають за регуляцію функціональної активності клітин, їх високу пластичність і здатність адаптуватись до умов зовнішнього середовища.
