
- •Основні позначення фізичних величин та формули для їх визначення
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язання
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язання
- •Розв’язання
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Обчислення за рівняннями хімічних реакцій між розчином солі та металом
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язання
- •Розв’язок
- •Розв’язок
- •Виведення молекулярної формули речовини
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Лабораторні заняття Заняття 1
- •Тема 1. Розв’язування хімічних задач як важливий метод і засіб навчання. Методика розв’язування задач за хімічною формулою та на встановлення хімічного елемента чи формули речовини (4 год.).
- •Варіант 1
- •Варіант 2
- •Варіант 3
- •Варіант 4
- •Варіант 5
- •Варіант 6
- •Варіант 7
- •Варіант 8
- •Варіант 9
- •Варіант 10
- •Варіант 11
- •Варіант 12
- •Варіант 13
- •Тема 2. Методика розв’язування задач на знаходження молекулярної формули сполуки за масою, об’ємом та кількістю речовин – продуктів згоряння (4 год.).
- •Тема 3. Методика розв’язування задач на приготування розчинів (4 год.).
- •Варіант 1
- •Варіант 2
- •Варіант 3
- •Варіант 4
- •Варіант 5
- •Варіант 6
- •Варіант 7
- •Варіант 8
- •Варіант 9
- •Варіант 10
- •Варіант 11
- •Варіант 12
- •Варіант 13
- •Варіант 14
- •Варіант 15
- •Варіант 16
- •Тема 4. Обчислення швидкості хімічної реакції (4 год.).
- •Варіант 1
- •Варіант 2
- •Варіант 3
- •Варіант 4
- •Варіант 5
- •Варіант 6
- •Варіант 7
- •Варіант 8
- •Варіант 9
- •Варіант 10
- •Тема 5. Розв’язування задач, за умовою яких реагенти містять домішки. Обчислення практичного виходу продукту реакції (4 год.).
- •Варіант 1
- •Варіант 2
- •Варіант 3
- •Варіант 4
- •Варіант 5
- •Варіант 6
- •Варіант 7
- •Варіант 8
- •Варіант 9
- •Варіант 10
- •Варіант 11
- •Варіант 12
- •Варіант 13
- •Варіант 14
- •Варіант 15
- •Варіант 16
- •Варіант 17
- •Варіант 18
- •Варіант 19
- •Варіант 20
- •Варіант 21
- •Варіант 22
- •Варіант 23
- •Варіант 24
- •Варіант 25
- •Варіант 26
- •Варіант 27
- •Варіант 28
- •Варіант 29
- •Варіант 30
- •Варіант 31
- •Варіант 32
- •Варіант 33
- •Варіант 34
- •Варіант 35
- •Варіант 36
- •Варіант 37
- •Варіант 38
- •Варіант 39
- •Варіант 40
- •Тема 6. Розв’язування задач з використанням закону об’ємних відношень (4 год.).
- •Варіант 1
- •Варіант 2
- •Варіант 3
- •Варіант 4
- •Варіант 5
- •Варіант 6
- •Варіант 7
- •Варіант 8
- •Варіант 9
- •Варіант 10
- •Варіант 11
- •Варіант 12
- •Тема 7. Розв’язування задач на знаходження маси, об’єму, масової чи об’ємної частки компонентів суміші (4 год.).
- •Варіант 1/7
- •Варіант 2/7
- •Варіант 3/7
- •Варіант 4/7
- •Варіант 5/7
- •Варіант 6/7
- •Варіант 7/7
- •Варіант 8/7
- •Варіант 9/7
- •Варіант 10/7
- •Варіант 11/7
- •Варіант 12/7
- •Варіант 13/7
- •Варіант 14/7
- •Варіант 15/7
- •Варіант 16/7
- •Варіант 17/7
- •Варіант 18/7
- •Варіант 19/7
- •Варіант 20/7
- •Варіант 21/7
- •Варіант 22/7
- •Варіант 23/7
- •Варіант 24/7
- •Тема 8. Обчислення за хімічними рівняннями кількості, маси, об’єму речовини, якщо один із реагентів узятий у надлишку (4 год.).
- •Варіант 1/8
- •Варіант 2/8
- •Варіант 3/8
- •Варіант 4/8
- •Варіант 5/8
- •Варіант 6/8
- •Варіант 7/8
- •Варіант 8/8
- •Варіант 9/8
- •Варіант 10/8
- •Варіант 11/8
- •Варіант 12/8
- •Варіант 13/8
- •Варіант 14/8
- •Варіант 15/8
- •Варіант 16/8
- •Варіант 17/8
- •Варіант 18/8
- •Варіант 19/8
- •Варіант 20/8
- •Варіант 21/8
- •Варіант 22/8
- •Варіант 23/8
- •Варіант 24/8
- •Варіант 25/8
- •Варіант 26/8
- •Варіант 27/8
- •Варіант 28/8
- •Варіант 29/8
- •Варіант 30/8
- •Тема 9. Розв’язування задач за рівнянням реакції заміщення між металом і розчином солі (4 год.).
- •Варіант 1
- •Варіант 2
- •Варіант 3
- •Варіант 4
- •Варіант 5
- •Варіант 6
- •Варіант 7
- •Варіант 8
- •Варіант 9
- •Варіант 10
- •Варіант 11
- •Варіант 12
- •Варіант 13
- •Варіант 14
- •Варіант 15
- •Варіант 16
- •Варіант 17
- •Варіант 18
- •Варіант 19
- •Варіант 20
- •Контрольно-екзаменаційна робота в-1
- •Література
Розв’язок
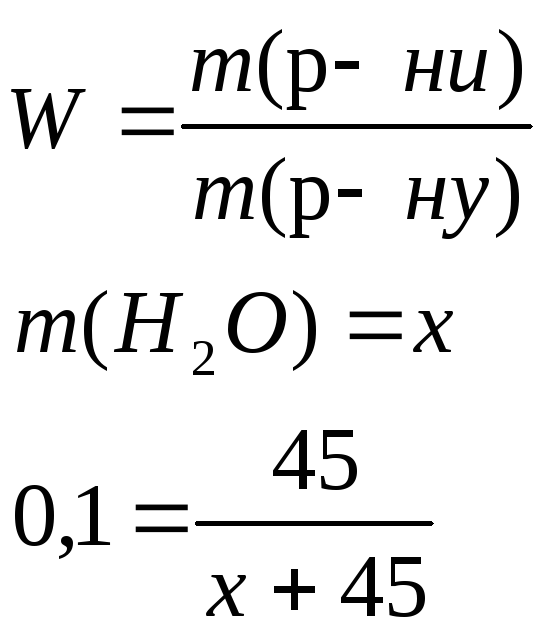
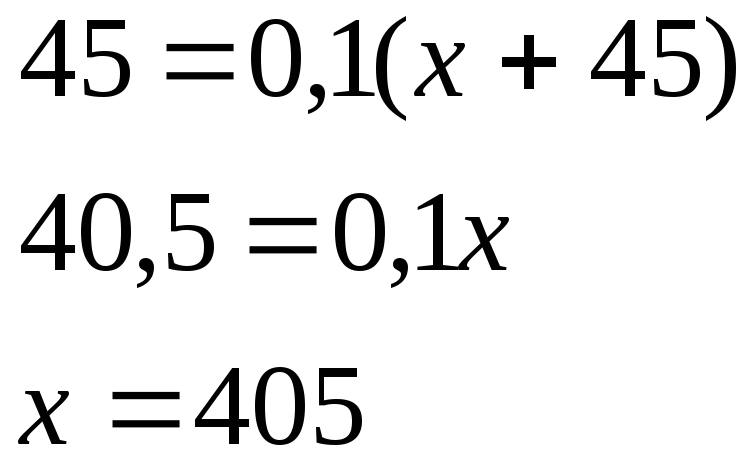
Задача 3. Визначте маси розчину сульфур(VI) оксиду в чистій сульфатній кислоті (масова частка сульфур(VI) оксиду дорівнює 10%) і розчину з масовою часткою сульфатної кислоти 60%, необхідні для приготування 480 г розчину з масовою часткою сульфатної кислоти 90%.
Розв’язок
m (H2SO4) = 0,9480 = 432
m(олеуму) = х
m(SO3) = 0,1x; m1(H2SO4) = 0,9x;
SO3 + H2O = H2SO4
(SO3)
= 2(H2SO4)
=
![]() ;
m2(H2SO4)
= 98
;
m2(H2SO4)
= 98![]() = 0,1225x
= 0,1225x
m2(p-ну) = 480 – х
m3(H2SO4) = 0,6(480-х) = 288 – 0,6х
0,9х + 0,1225х + 288 – 0,6х = 432
х = 340,83 (m(олеуму)
m2(p-ну) = 480 – 340,83 = 139,17
Задача 4. При розчиненні у воді масою 160 г кристалогідратуMeSO45H2O масою 40 г одержали розчин з масовою часткоюMeSO412,8%. Визначте невідому сіль.
Розв’язок
Ar(Me) = x
Mr(MeSO4) = x + 96
Mr(MeSO45H2O) = x + 186
Масова частка солі в кристалогідраті становить:
W(MeSO4)
=
![]() ,
тоді маса солі у кристалогідраті дорівнює
,
тоді маса солі у кристалогідраті дорівнює
m(MeSO4) = W(MeSO4)m(кристалогідрату)
m(MeSO4)
=
![]()
Для визначення масової частки солі в розчині скористаємося формулою:
W(MeSO4)
=
![]()
Підставимо у цю формулу всі відомі нам величини
0,128
=
![]() ;
;
x = 64 (Cu)
Задача 5. Скільки молекул метилового спирту (СН3ОН) і води міститься в 100 мл 12%-вого водного розчину метилового спирту, густина якого 0,98 г/см3?
Розв’язок
m(р-ну) =V; m(р-ну) = 1000,98 = 98 г;
m(CH3OH) = m(р-ну)W = 980,12 = 11,76 г
=
![]() (СН3ОН) =
(СН3ОН) =![]() моль
моль
N(СН3ОН) = NA = 0,36756,021023 = 2,212351023 молекул
m(H2O) = 98 – 11,76 = 86,24 г
(H2O)
=
![]() моль
моль
N(H2O) = 4,796,021023= 28,84251023молекул
Задача 6. При 100С у 100гводи розчиняється 347гнатрій гідроксиду.
а). Яка масова частка NaOH в отриманому розчині?
б). Яка мольна частка NaOH в отриманому розчині?
в). Скільки молекул води припадає на 1 атом (точніше, йон) натрію в отриманому розчині?
Розв’язок
W(NaOH)
=
![]() 0,7763
або 77,63%
0,7763
або 77,63%
(NaOH) =
![]() =
8,675моль = (Na)
=
8,675моль = (Na)
(Н2О) =![]() 5,556
моль
5,556
моль
(р-ну) = (NaOH) +(Н2О) =8,675 + 5,556 = 14,231 моль
=
![]() =
0,6096 або 60,96%
=
0,6096 або 60,96%
N(Na) : N(H2O) = (Na) : (Н2О) = 8,675 : 5,556 = 1 : 0,64
Задача 7.Визначити молярну концентрацію розчину, який утворюється при змішуванні 300 см32М і 700 см34Mрозчинів сульфатної кислоти.
Розв’язок
-
V1(р-ну)= 300 см3
C1(H2SO4) = 2 моль/л
V2(р-ну)= 700 см3
C1(H2SO4) = 4 моль/л
Молярна концентрація визначається за формулою:
С(H2SO4)=
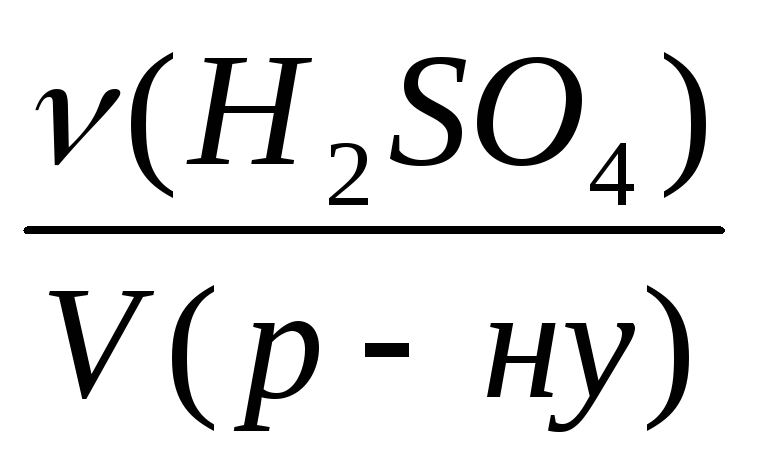
Визначимо кількість речовини сульфатної кислоти у першому розчині:
1(H2SO4) = C1(H2SO4)V1(р-ну)
1(H2SO4) =2 моль/л0,3 л = 0,6 моль
Визначимо кількість речовини сульфатної кислоти у другому розчині:
2(H2SO4) = 4 моль/л0,7 л = 2,8 моль
Кількість речовини сульфатної кислоти дорівнюватиме сумі кількостей речовини кислотив першому і другому розчині:
(H2SO4) = 1(H2SO4) + 2(H2SO4)
(H2SO4) = = 0,6 моль + 2,8 моль = 3,4 моль
V(р-ну) = 300см3+ 700 см3= 1000 см3= 1 л
С(H2SO4)=
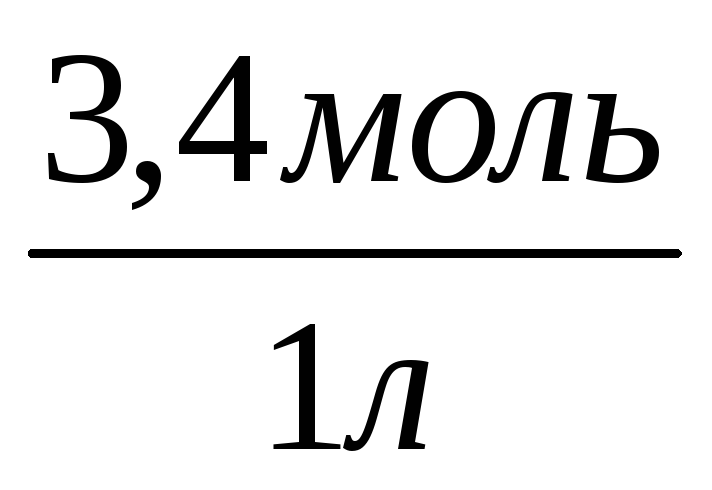 = 3,4 моль/л
= 3,4 моль/лС(H2SO4) = ?
Додаткові дані:
300 см3= 0,3 л
700 см3= 0,7 л
Задача 8.Визначте об’єм 7 М розчину сульфатної кислоти, який треба добавити до 120 мл 2 М розчину, щоб утворився 4 М розчин.
