
- •Основні позначення фізичних величин та формули для їх визначення
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язання
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язання
- •Розв’язання
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Обчислення за рівняннями хімічних реакцій між розчином солі та металом
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язання
- •Розв’язок
- •Розв’язок
- •Виведення молекулярної формули речовини
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Лабораторні заняття Заняття 1
- •Тема 1. Розв’язування хімічних задач як важливий метод і засіб навчання. Методика розв’язування задач за хімічною формулою та на встановлення хімічного елемента чи формули речовини (4 год.).
- •Варіант 1
- •Варіант 2
- •Варіант 3
- •Варіант 4
- •Варіант 5
- •Варіант 6
- •Варіант 7
- •Варіант 8
- •Варіант 9
- •Варіант 10
- •Варіант 11
- •Варіант 12
- •Варіант 13
- •Тема 2. Методика розв’язування задач на знаходження молекулярної формули сполуки за масою, об’ємом та кількістю речовин – продуктів згоряння (4 год.).
- •Тема 3. Методика розв’язування задач на приготування розчинів (4 год.).
- •Варіант 1
- •Варіант 2
- •Варіант 3
- •Варіант 4
- •Варіант 5
- •Варіант 6
- •Варіант 7
- •Варіант 8
- •Варіант 9
- •Варіант 10
- •Варіант 11
- •Варіант 12
- •Варіант 13
- •Варіант 14
- •Варіант 15
- •Варіант 16
- •Тема 4. Обчислення швидкості хімічної реакції (4 год.).
- •Варіант 1
- •Варіант 2
- •Варіант 3
- •Варіант 4
- •Варіант 5
- •Варіант 6
- •Варіант 7
- •Варіант 8
- •Варіант 9
- •Варіант 10
- •Тема 5. Розв’язування задач, за умовою яких реагенти містять домішки. Обчислення практичного виходу продукту реакції (4 год.).
- •Варіант 1
- •Варіант 2
- •Варіант 3
- •Варіант 4
- •Варіант 5
- •Варіант 6
- •Варіант 7
- •Варіант 8
- •Варіант 9
- •Варіант 10
- •Варіант 11
- •Варіант 12
- •Варіант 13
- •Варіант 14
- •Варіант 15
- •Варіант 16
- •Варіант 17
- •Варіант 18
- •Варіант 19
- •Варіант 20
- •Варіант 21
- •Варіант 22
- •Варіант 23
- •Варіант 24
- •Варіант 25
- •Варіант 26
- •Варіант 27
- •Варіант 28
- •Варіант 29
- •Варіант 30
- •Варіант 31
- •Варіант 32
- •Варіант 33
- •Варіант 34
- •Варіант 35
- •Варіант 36
- •Варіант 37
- •Варіант 38
- •Варіант 39
- •Варіант 40
- •Тема 6. Розв’язування задач з використанням закону об’ємних відношень (4 год.).
- •Варіант 1
- •Варіант 2
- •Варіант 3
- •Варіант 4
- •Варіант 5
- •Варіант 6
- •Варіант 7
- •Варіант 8
- •Варіант 9
- •Варіант 10
- •Варіант 11
- •Варіант 12
- •Тема 7. Розв’язування задач на знаходження маси, об’єму, масової чи об’ємної частки компонентів суміші (4 год.).
- •Варіант 1/7
- •Варіант 2/7
- •Варіант 3/7
- •Варіант 4/7
- •Варіант 5/7
- •Варіант 6/7
- •Варіант 7/7
- •Варіант 8/7
- •Варіант 9/7
- •Варіант 10/7
- •Варіант 11/7
- •Варіант 12/7
- •Варіант 13/7
- •Варіант 14/7
- •Варіант 15/7
- •Варіант 16/7
- •Варіант 17/7
- •Варіант 18/7
- •Варіант 19/7
- •Варіант 20/7
- •Варіант 21/7
- •Варіант 22/7
- •Варіант 23/7
- •Варіант 24/7
- •Тема 8. Обчислення за хімічними рівняннями кількості, маси, об’єму речовини, якщо один із реагентів узятий у надлишку (4 год.).
- •Варіант 1/8
- •Варіант 2/8
- •Варіант 3/8
- •Варіант 4/8
- •Варіант 5/8
- •Варіант 6/8
- •Варіант 7/8
- •Варіант 8/8
- •Варіант 9/8
- •Варіант 10/8
- •Варіант 11/8
- •Варіант 12/8
- •Варіант 13/8
- •Варіант 14/8
- •Варіант 15/8
- •Варіант 16/8
- •Варіант 17/8
- •Варіант 18/8
- •Варіант 19/8
- •Варіант 20/8
- •Варіант 21/8
- •Варіант 22/8
- •Варіант 23/8
- •Варіант 24/8
- •Варіант 25/8
- •Варіант 26/8
- •Варіант 27/8
- •Варіант 28/8
- •Варіант 29/8
- •Варіант 30/8
- •Тема 9. Розв’язування задач за рівнянням реакції заміщення між металом і розчином солі (4 год.).
- •Варіант 1
- •Варіант 2
- •Варіант 3
- •Варіант 4
- •Варіант 5
- •Варіант 6
- •Варіант 7
- •Варіант 8
- •Варіант 9
- •Варіант 10
- •Варіант 11
- •Варіант 12
- •Варіант 13
- •Варіант 14
- •Варіант 15
- •Варіант 16
- •Варіант 17
- •Варіант 18
- •Варіант 19
- •Варіант 20
- •Контрольно-екзаменаційна робота в-1
- •Література
Варіант 20
Записати рівняння реакцій таких перетворень:
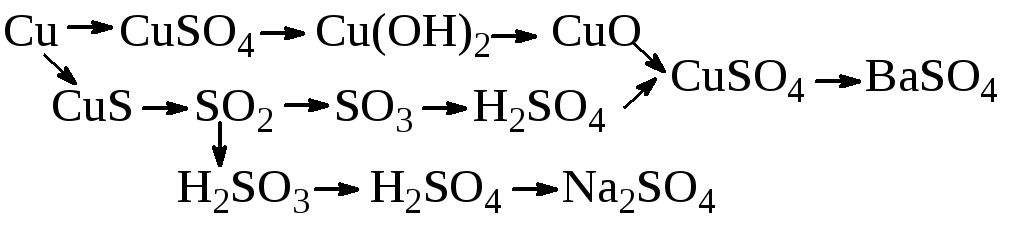
Зразок ферум(ІІ) сульфіду обробили надлишком хлоридної кислоти. Газ, що утворився, прореагував з 26,25 мл розчину калій гідроксиду, в якому масова частка калій гідроксиду дорівнює 25% (=1,28 г/см3). При цьому утворилася кисла сіль. Яка маса зразка ферум(ІІ) сульфіду?
Змішали 80,0 мл розчину калій гідрогенсульфіту (С=1,60 моль/л) і 80,0 мл розчину калій сульфіту. До отриманого розчину додали 2,00 мл розчину калій гідроксиду. З’ясувалося, що молярна концентрація калій гідрогенсульфіту в новому розчині дорівнює 0,617 моль/л. Обчисліть молярну концентрацію доданого розчину калій гідроксиду.
У герметичній ампулі об’ємом 1 мл міститься 0,260 мг тритію. Тритій розпадається з випромінюванням -частинок. Який тиск створиться в ампулі через проміжок часу, що дорівнює періоду піврозпаду тритію?
Варіант 21
Яку масу сульфур(ІV) оксиду необхідно затратити на взаємодію з 156 мл розчину натрій гідроксиду з масовою часткою 12% (=1,137 г/мл), щоб утворилася середня сіль?
Визначити масу осаду, добутого в результаті взаємодії алюміній сульфату масою 200 г, у якому масова частка розчиненої речовини становить 17,6%, із розчином барій хлориду масою 120 г, масова частка солі в якому 30%.
При розкладі 24,5 г бертолетової солі без каталізатора виділилося 5,33 г кисню. Аналіз твердого залишку показав наявність у ньому двох речовин, одна з яких – калій хлорид – міститься в ньому в кількості 9,93 г. Виведіть математично формулу другого твердого продукту розкладу. Напишіть рівняння реакції.
Густина за повітрям газу А, молекули якого складаються з атомів Гідрогену та атомів елементу X, дорівнює 4,41. Визначте елемент Х та густину газу А за воднем.
Варіант 22
Визначити масу осаду, добутого в результаті взаємодії розчину ферум(ІІ) сульфату масою 135 г, у якому масова частка розчиненої речовини становить 8,5%, із розчином барій нітрату масою 185 г, масова частка солі в якому 23%.
При обробці сульфатною кислотою 0,8 г суміші цинку з цинк оксидом утворилося 224 мл (н.у.) водню. Визначити масову частку цинку в суміші.
Дві пластинки однакової маси виготовлені з одного металу, валентність якого в хімічних реакціях дорівнює двом. Пластинки занурили одну в розчини купрум(ІІ) сульфату, а другу – в розчин гідраргірум сульфату. Через деякий час пластинки промили, висушили і зважили (вважали, що виділений метал осідав на пластинках). Маса першої пластинки зменшилась на 3,6%, а маса другої збільшилась на 6,675%. Зменшення молярної концентрації обох розчинів було однаковим. З якого металу виготовлено пластинки?
Яке повітря важче - сухе чи вологе? Відповідь обґрунтуйте. Обчисліть масу повітря у кухонній кімнаті площею 10 м2і висотою 2,75 м (умови нормальні). Як зміниться ця маса якщо 10% (за об'ємом) цього повітря замінити на водяну пару, залишивши тиск незмінним.
Варіант 23
Який об’єм сульфур(ІV) оксиду (н.у.) необхідно затратити на взаємодію з 145 мл розчину натрій гідроксиду з масовою часткою лугу 28% (=1,263 г/мл), щоб утворилася кисла сіль?
Який об’єм сірководню (дигідрогенсульфіду) (н.у.) необхідно затратити на взаємодію з 450 мл розчину натрій гідроксиду з масовою часткою лугу 8% (=1,065 г/мл), щоб утворилася кисла сіль?
Сіль одновалентного металу масою 74,4 г нагріли в закритій посудині, при цьому одержали 26,8 мл безбарвної рідини з концентрацією речовини 11,2 моль/л. Визначити формулу солі, якщо відомо, що вона містить метал, водень, 25,8% сірки і 51,61% кисню.
Монохлорпохідне деякого вуглеводню містить 46,4% хлору, а його монобромпохідне – 66,1% брому. Яку структуру може мати це монобромпохідне? Напишіть структурні формули всіх його можливих ізомерів.
