
- •Основні позначення фізичних величин та формули для їх визначення
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язання
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язання
- •Розв’язання
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Обчислення за рівняннями хімічних реакцій між розчином солі та металом
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язання
- •Розв’язок
- •Розв’язок
- •Виведення молекулярної формули речовини
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Лабораторні заняття Заняття 1
- •Тема 1. Розв’язування хімічних задач як важливий метод і засіб навчання. Методика розв’язування задач за хімічною формулою та на встановлення хімічного елемента чи формули речовини (4 год.).
- •Варіант 1
- •Варіант 2
- •Варіант 3
- •Варіант 4
- •Варіант 5
- •Варіант 6
- •Варіант 7
- •Варіант 8
- •Варіант 9
- •Варіант 10
- •Варіант 11
- •Варіант 12
- •Варіант 13
- •Тема 2. Методика розв’язування задач на знаходження молекулярної формули сполуки за масою, об’ємом та кількістю речовин – продуктів згоряння (4 год.).
- •Тема 3. Методика розв’язування задач на приготування розчинів (4 год.).
- •Варіант 1
- •Варіант 2
- •Варіант 3
- •Варіант 4
- •Варіант 5
- •Варіант 6
- •Варіант 7
- •Варіант 8
- •Варіант 9
- •Варіант 10
- •Варіант 11
- •Варіант 12
- •Варіант 13
- •Варіант 14
- •Варіант 15
- •Варіант 16
- •Тема 4. Обчислення швидкості хімічної реакції (4 год.).
- •Варіант 1
- •Варіант 2
- •Варіант 3
- •Варіант 4
- •Варіант 5
- •Варіант 6
- •Варіант 7
- •Варіант 8
- •Варіант 9
- •Варіант 10
- •Тема 5. Розв’язування задач, за умовою яких реагенти містять домішки. Обчислення практичного виходу продукту реакції (4 год.).
- •Варіант 1
- •Варіант 2
- •Варіант 3
- •Варіант 4
- •Варіант 5
- •Варіант 6
- •Варіант 7
- •Варіант 8
- •Варіант 9
- •Варіант 10
- •Варіант 11
- •Варіант 12
- •Варіант 13
- •Варіант 14
- •Варіант 15
- •Варіант 16
- •Варіант 17
- •Варіант 18
- •Варіант 19
- •Варіант 20
- •Варіант 21
- •Варіант 22
- •Варіант 23
- •Варіант 24
- •Варіант 25
- •Варіант 26
- •Варіант 27
- •Варіант 28
- •Варіант 29
- •Варіант 30
- •Варіант 31
- •Варіант 32
- •Варіант 33
- •Варіант 34
- •Варіант 35
- •Варіант 36
- •Варіант 37
- •Варіант 38
- •Варіант 39
- •Варіант 40
- •Тема 6. Розв’язування задач з використанням закону об’ємних відношень (4 год.).
- •Варіант 1
- •Варіант 2
- •Варіант 3
- •Варіант 4
- •Варіант 5
- •Варіант 6
- •Варіант 7
- •Варіант 8
- •Варіант 9
- •Варіант 10
- •Варіант 11
- •Варіант 12
- •Тема 7. Розв’язування задач на знаходження маси, об’єму, масової чи об’ємної частки компонентів суміші (4 год.).
- •Варіант 1/7
- •Варіант 2/7
- •Варіант 3/7
- •Варіант 4/7
- •Варіант 5/7
- •Варіант 6/7
- •Варіант 7/7
- •Варіант 8/7
- •Варіант 9/7
- •Варіант 10/7
- •Варіант 11/7
- •Варіант 12/7
- •Варіант 13/7
- •Варіант 14/7
- •Варіант 15/7
- •Варіант 16/7
- •Варіант 17/7
- •Варіант 18/7
- •Варіант 19/7
- •Варіант 20/7
- •Варіант 21/7
- •Варіант 22/7
- •Варіант 23/7
- •Варіант 24/7
- •Тема 8. Обчислення за хімічними рівняннями кількості, маси, об’єму речовини, якщо один із реагентів узятий у надлишку (4 год.).
- •Варіант 1/8
- •Варіант 2/8
- •Варіант 3/8
- •Варіант 4/8
- •Варіант 5/8
- •Варіант 6/8
- •Варіант 7/8
- •Варіант 8/8
- •Варіант 9/8
- •Варіант 10/8
- •Варіант 11/8
- •Варіант 12/8
- •Варіант 13/8
- •Варіант 14/8
- •Варіант 15/8
- •Варіант 16/8
- •Варіант 17/8
- •Варіант 18/8
- •Варіант 19/8
- •Варіант 20/8
- •Варіант 21/8
- •Варіант 22/8
- •Варіант 23/8
- •Варіант 24/8
- •Варіант 25/8
- •Варіант 26/8
- •Варіант 27/8
- •Варіант 28/8
- •Варіант 29/8
- •Варіант 30/8
- •Тема 9. Розв’язування задач за рівнянням реакції заміщення між металом і розчином солі (4 год.).
- •Варіант 1
- •Варіант 2
- •Варіант 3
- •Варіант 4
- •Варіант 5
- •Варіант 6
- •Варіант 7
- •Варіант 8
- •Варіант 9
- •Варіант 10
- •Варіант 11
- •Варіант 12
- •Варіант 13
- •Варіант 14
- •Варіант 15
- •Варіант 16
- •Варіант 17
- •Варіант 18
- •Варіант 19
- •Варіант 20
- •Контрольно-екзаменаційна робота в-1
- •Література
Розв’язок
2Н2+ О2= 2Н2О
Визначимо сумарний об’єм кисню і водню, які прореагували.
V(H2) +V1(O2) = 42 мл – 6 мл = 36 мл
Водень і кисень реагують у співвідношенні 2 : 1 (за рівнянням реакції)
Тоді:
V(H2)
=
![]() = 24 мл
= 24 мл
Об’єм кисню, що прореагував, у 2 рази менший від об’єму водню і становить 12 мл. Загальний об’єм кисню у вихідній суміші рівний:
V(O2) = 12 мл + 6 мл = 18 мл.
(О2) =![]()
(О2) =![]() = 0,4286, або 43,86%
= 0,4286, або 43,86%
Задача 3. До 120 мл суміші водню і азоту (н.у.) додали 150 мл кисню і підпалили. Після закінчення реакції і приведення газів до початкових умов їх об’єм становив 225 мл. Визначте об’ємні частки газів у вихідній суміші.
Розв’язок
Азот за звичайних умов з киснем і воднем не реагує.
2H2+ O22H2O
Нехай об’єм кисню, що вступив у реакцію: V(O2) =x
Тоді V(Н2) = 2x
Якщо продукти реакції привели до початкових умов, то вода – рідина. Отже:
2х + х = (120 + 150) – 225 = 45
х = 15
Кисень у надлишку. Отже, весь водень прореагував.
V(Н2) = 215 = 30 мл
V(N2) = 120 – 30 = 90 мл
(Н2) =![]() = 0,25 або 25%
= 0,25 або 25%
(N2) =![]() = 0,75 або75%
= 0,75 або75%
Задача 4. До 400 мл суміші деякого вуглеводню з азотом додали 900 мл (надлишок) кисню і підпалили. Об’єм одержаної після згоряння суміші становив 1,4 л, а після конденсації парів води скоротився до 800 мл. Нове скорочення об’єму до 400 мл спостерігалося в результаті пропускання газів через розчин калій гідроксиду. Об’єми вимірювалися за однакових умов. Установіть формулу вуглеводню.
Розв’язок
СхHy+
![]() O2xCO2+
O2xCO2+
![]() H2O
H2O
V(H2O) = 1400 – 800 = 600 мл
Розчином калій гідроксиду поглинувся вуглекислий газ:
V(СО2) = 800 – 400 = 400 мл
Залишилося 400 мл азоту та кисню, який не прореагував.
х = 400;
![]() = 600;
= 600;
![]() = 700
= 700
Тоді об’єм кисню, який не прореагував:
V(O2) = 900 – 700 = 200 мл
Тоді у вихідній суміші вуглеводню було:
V(СхHy) = 400 – 200 = 200 мл
Об’єми газів відносяться як кількості їх речовини.
(СхHy):(СО2):(Н2О) = 200:400:600 = 2:4:6 = 1:2:3
(С):(Н) = 2:6
С2Н6– етан
Задача 5. Для повного спалювання 1 л невідомого газу знадобилось 2 л кисню. У результаті реакції виділилось 1 л азоту та 2 л вуглекислого газу. Знайдіть формулу спаленої речовини.
Розв’язок
А – невідомий газ. Об’єми газів відносяться як кількості їх речовини:
А + 2О2 = N2 + 2CO2
Отже, до складу газу А входили елементи Нітроген і Карбон. Враховуючи кількості атомів Нітрогену і Карбону після реакції та той факт, що в реакцію вступив 1 моль речовини А, виводимо формулу газу А – С2N2.
![]() – диціан.
– диціан.
Задача 6. Суміш нітроген(ІІ) і нітроген(IV) оксидів об’ємом 5,6 л (н.у.) змішали з 2 л кисню. Потім гази пропустили через розчин, що містив 30 г калій гідроксиду. Аналіз газу (0,5 л при н.у.), що пройшов через розчин, показав, що це кисень. Визначити склад вихідної газової суміші в об’ємних процентах і обчисліть масові частки речовин у розчині (кінцева маса розчину 1 кг).
Розв’язок
2NO + O2 = 2NO2
4NO2 + O2 + 4KOH = 4KNO3 + 2H2O (1)
4NO + 3O2 + 4KOH = 4KNO3 + 2H2O (2)
V(NO2) = x; V1(O2) = 0,25x
V(NO) = y; V2(O2) = 0,75y
V(O2) = 2 - 1,5 = 0,5 л
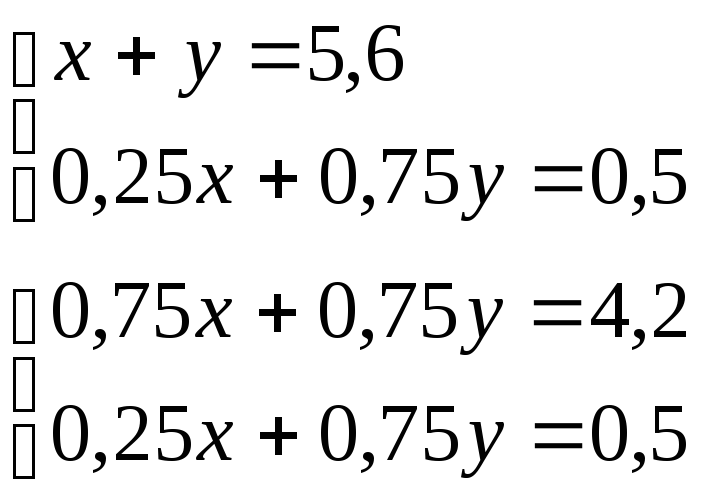
0,5x = 2,7; x = 5,4; y = 0,2
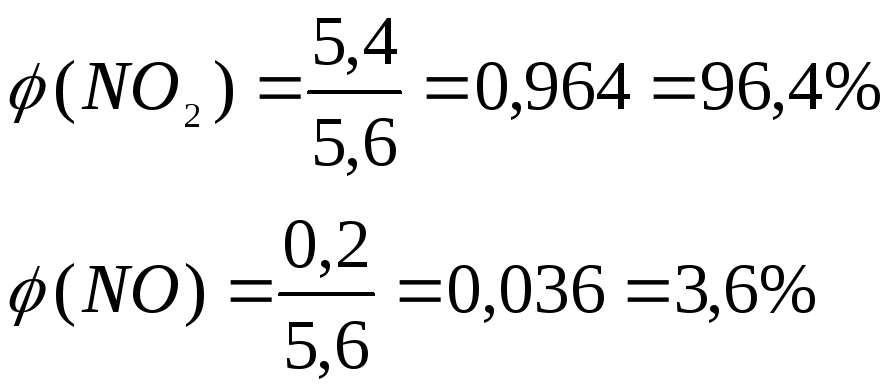
(KNO3)
= (NO)
+ (NO2)
=
![]()
m(KNO3) = 0,25·101 = 25,25 г
![]()
Задача 7. Обчисліть вміст метану в суміші з киснем, якщо відомо, що 36 мл газової суміші після спалювання метану зменшилась в об’ємі на 1,8 мл. Вважати, що пара води сконденсувалася повністю.
