
- •Глава 1. Предмет и задачи медицинской микробиологии и иммунологии
- •Мир микробов. Общие сведения
- •Микробиология — наука о микробах
- •Иммунология — наука об иммунитете
- •Связь микробиологии с иммунологией
- •История развития микробиологии и иммуно тогии
- •Isbn 5-225-04208-2 © Издательство «Медицина»,
- •Глава 1. Предмет и задачи медицинской микробиологии и иммунологии
- •Мир микробов. Общие сведения
- •Микробиология — наука о микробах
- •Связь микробиологии с иммунологией
- •История развития микробиологии и иммуно тогии
- •Глава 2. Классификация и морфология микробов
- •Систематика и номенклатура микробов
- •Классификация и морфология бактерий
- •Строение и классификация простейших
- •Основные методы изучения морфологии микробов
- •Глава 3. Физиология микробов
- •Физиология бактерий
- •Рост и размножение бактерий
- •Особенности физиологии грибов и простейших
- •Глава 4. Экология микробов
- •Распространение микробов в окружающей среде
- •Микрофлора почвы
- •4 1.2. Микрофлора воды
- •Микрофлора продуктов питания
- •Действие излучения
- •Действие химических веществ
- •Действие биологических факторов
- •Уничтожение микробов в окружающей среде
- •Стерилизация
- •Дезинфекция
- •Асептика и антисептика
- •Санитарная микробиология
- •Микробиологический контроль лекарственных средств
- •Глава 5. Генетика микробов
- •5‘ Конец
- •Фосфат fc-q
- •Особенности генетики вирусов
- •4. Применение генетических методов в диагностике инфекционных болезней
- •Метод молекулярной гибридизации
- •Глава 6. Биотехнология. Генная инженерия
- •Предмет и задачи биотехнологии
- •3. Объекты и процессы в биотехнологии
- •Генетическая инженерия в биотехнологии
- •Глава 7. Противомикробные препараты
- •Химиотерапевтические лекарства
- •Глава 8. Учение об инфекции
- •Понятие об инфекционной болезни
- •Участники инфекционного процесса
- •Стадии инфекционного процесса и его уровни
- •Патогенные и условно-патогенные микробы
- •Роль окружающей среды
- •Характерные особенности инфекционных болезней
- •8 7. Формы инфекционного процесса
- •Глава 9. Учение об иммунитете
- •Виды иммунитета
- •Созревание, размножение, дифферениировка
- •Патология иммунной системы
- •Реакции антиген — антитело и их практическое применение
- •Реакция преципитации
- •Реакция с использованием меченых антител или антигенов
- •Глава 10. Иммунопрофилактика и иммунотерапия болезней человека
- •Вакцины
- •Убитые вакцины
- •Лекарственные формы вакцин
- •Массовые способы вакцинации
- •10.2.7. Производство вакцин и их контроль
- •Бактериофаги
- •Эубиотики
- •Диагностические препараты
- •Классификация микробов по степени их биологической опасности. Номенклатура микробиологических лабораторий
- •112. Санитарно-техническое оснащение лаборатории
- •Правила работы в микробиологической лаборатории
- •Принципы микробиологической диагностики инфекционных болезней
- •11.S. Принципы иммунологической диагностики болезней человека
- •Глава 12. Возбудители кишечных инфекций
- •Возбудители бактериальных кишечных инфекций
- •Возбудители эшерихиозов
- •Возбудители дизентерии
- •Возбудители брюшного тифа и паратифов
- •Возбудители кишечного иерсиниоза и псевдотуберкулеза
- •1.7. Возбудители бруцеллеза
- •Возбудитель хеликобактериоза
- •Возбудители лептоспироза
- •Вирусы энтеральных гепатитов
- •Возбудитель лямблиоза
- •Глава 13 возбудители респираторных инфекционных болезней
- •Возбудители вирусных респираторных инфекций
- •Вирусы гриппа
- •2.2. Вирусы — возбудители других острых респираторных вирусных инфекций
- •Вирус эпидемического паротита
- •Вирус краснухи
- •Вирус оспы обезьян
- •Вирус ветряной оспы и опоясывающего герпеса
- •Глава 14. Возбудители кровяных инфекционных болезней
- •Возбудители бактериальных кровяных инфекций
- •Возбудитель туляремии
- •Возбудители риккетсиозов
- •Глава 15. Возбудители инфекционных болезней наружных покровов
- •Возбудители грибковых инф кций
- •Глава 16. Общие черты зоонозных инфекций
- •Глава 17. Онкогенные вирусы
- •Глава 18. Медленные вирусные инфекции
- •9Теории 210
Возбудители риккетсиозов
Бактерии отдела Gracilicutes, семейства Rickettsiaceae (названы по имени американского ученого Н.Риккетса) в настоящее время представлены 4 родами: Rickettsia, Coxiella и Ehrlichia. Они объединяют большую группу бактерий, паразитирующих на членистоногих (вшах, блохах, клещах). Большинство риккетсий непатогенны для млекопитающих, но часть их поражает человека и животных, вызывая тяжелые заболевания. Каждый род состоит из нескольких видов риккетсий, вызывающих то или иное специфическое заболевание. В основу классификации положены антигенная структура риккетсий, патогенез болезни и главным образом молекулярно-генетические параметры возбудителей. Заболевания, вызываемые риккетсиями, называются риккетси- озами. К ним относятся группа сыпного тифа, пятнистая лихорадка Скалистых Гор, марсельская лихорадка, северо-азиатский клещевой риккетсиоз, везикулезный риккетсиоз, лихорадка цу- цугамуши, Ку-лихорадка и др.
Риккетсиозы отмечаются во всех странах мира. Одни из них вызывают эпидемии (эпидемический сыпной тиф), другие природно-очаговые, в последнем случае источником возбудителей являются некоторые животные, а переносчиком (а иногда источником) — кровососущие членистоногие (вши, клещи блохи).
Все риккетсии являются облигатными внутриклеточными паразитами, т е. они живут и размножаются только в клетках (см. рис. 14.1).
Патологический процесс характеризуется развитием риккет- сий, главным образом в эндотелии сосудов, формированием сосудистых узелков (гранулем) и сопровождается интоксикацией. Все риккетсиозы — остро протекающие лихорадочные болезни с циклическим течением. Болезнь длится 2—3 нед и более. Риккетсии чувствительны к антибиотикам, поэтому эффективным лечением риккетсиозов является антибиотикотерапия.
Диагноз риккетсиозов основывается на клинической картине, данных эпидемиологического анамнеза и результатах серодиагностики.
Неспецифическая профилактика заключается в уничтожении членистоногих переносчиков (вшей, блох), защите лиц, находящихся в очагах клещевых риккетсиозов, от попадания клещей (защитнье сетки, одежда, репелленты). Для специфической профилактики некоторых риккетсиозов (сыпной тиф, Ку-лихо- радка и др.) разработаны вакцины, применяемые по эпидемическим показаниям.
Возбудитель эпидемического сыпного тифа
Эпидемический сыпной тиф (Typhus exanthematicus, син эпидемический тиф) — инфекционная болезнь, вызываемая Rickettsia prowazekii. Характеризуется лихорадкой, интоксикацией, специфической розе- олезно-петехиальной сыпью, поражением сосудистой и центральной нервной систем.
Таксономия. Возбудитель сыпного тифа назван по имени американского ученого Н.Риккетса и чешского ученого С.Прова- чека, погибших при изучении этого заболевания. Риккетсии Провачека относятся к отделу Gracilicutes, семейству Rickettsia- сеае, роду Rickettsia.
Морфологические и культуральные, антигенные свойства. Риккетсии Провачека — мелкие, неподвижные, грамотрицательные палочки размером 0,3—0,6 х 0,8—2,0 мкм, окрашиваются по Романовскому — Гимзе в красный цвет, их субмикроскопическое строение схоже со строением грамотрица- тельных бактерий. На наружной поверхности клеточной стенки располагаются микрокапсулы и капсулоподобный слизистый покров, содержащий групповой растворимый антиген. РиккетсииПровачека имеют фимбрии и пили, жгутиков не имеют. Культивируются в желточном мешке куриных эмбрионов, на перевиваемых культурах клеток, на чувствительных животных (мыши, морские свинки, кролики). Возбудитель — абсолютный внутриклеточный паразит, размножающийся в цитоплазме клеток. Имеет два основных антигена: поверхностный термостабильный, общий с антигеном возбудителя эндемического сыпного тифа, и термолабильный специфический.
Факто ры патогенности. Для риккетсий Провачека характерны образование лабильного токсина (растворимого антигена) и освобождение эндотоксина.
Резистентность. Риккетсии Провачека чувствительны к действию высокой температуры, многих химических веществ, к антибиотикам. Длительно сохраняются при низкой температуре, в сухих фекалиях зараженных вшей.
Из лабораторных животных к возбудителю наиболее восприимчивы хлопковые крысы и морские свинки; белые мыши высокочувствительны к интраназальному заражению.
Эпидемиология. Источником инфекции является больной человек, главным образом в течение всего лихорадочного периода (до 17 дней). Переносчик возбудителей — платяная вошь. Головная и лобковая вши могут переносить возбудителя, но их роль (по сравнению с платяной вошью) незначительна. Вши заражаются при кровососании на больном. Риккетсии размножаются в эпителии кишечника вши и выделяются в просвет кишечника. В слюнных железах, сосательном аппарате вшей риккетсии не содержатся, поэтому с укусом они не передаются. Укус вызывает у человека зуд. Человек, расчесывая место укуса, втирает в него фекалии вши, содержащие риккетсии, и таким образом заражается. Следовательно, возникновение и распространение сыпного тифа связано со вшивостью (педикулезом).
Сыпной тиф известен с древних времен, но как самостоятельное заболевание выделен в конце XIX в. Распространен повсеместно. Эпидемии сыпного тифа возникали чаще во время войн, голода и других социальных потрясений, сопровождавшихся снижением санитарно-гигиенического уровня и распространением педикулеза. Летальность в «доантибиотическую» эру достигала 80 %. В настоящее время регистрируются в основном спорадические (рецидивные) случаи сыпного тифа в виде болезни Брилля, протекающей относительно легко.
Патогенез. Риккетсии Провачека, попадая в кровь, проникают в клетки эндотелия кровеносных сосудов, размножаются в них, освобождая эндотоксин. Эндотелиальные клетки разрушаются, живые риккетсии вновь поступают в кровь. Поражаются преимущественно мелкие сосуды, капилляры, что ведет к нарушению микроциркуляции в головном мозге, миокарде, почках и других органах и возникновению менингоэнцефалита, миокардита, гломерулонефрита. В организме больных риккетсии могут длительно персистировать (переживать) и после выздоровления, что служит причиной появления рецидива сыпного тифа — болезни Брилля.
К л и н и к а. Инкубационный период составляет в среднем 10— 14 дней. Различают легкое, среднетяжелое и тяжелое течение болезни У больных отмечают высокую температуру тела, головную боль, бессонницу, характерную сыпь вследствие расшире ния капилляров кожи (розеолезная сыпь) и их повреждения с кровоизлиянием (петехиальная сыпь).
Рецидивный сыпной тиф проявляется через многие годы после болезни. Его клиническая картина сходна с таковой эпидемического сыпного тифа, но болезнь протекает быстрее (7—10 нед), прогноз благоприятный. Однако больной может быть источником инфекции.
Иммунитет. После сыпного тифа формируется стойкий и длительный иммунитет — антибактериальный и антитоксический. Однако случаи возникновения болезни Брилля свидетельствуют о возможности активизации в организме риккетсий в результате снижения иммунитета.
Микробиологическая диагностика. Основным методом диагностики является серологический: применяют РИГА, реакцию агглютинации, РСК, РИФ и ИФА для обнаружения риккетсиозного антигена или антител в сыворотке крови больных
Лечение. Наиболее эффективными антибиотиками являются современные тетрациклины (доксициклин и др.), рифампи- цины, левомицетин.
Профилактика, Неспецифическая профилактика заключается в ликвидации педикулеза и его профилактике. Специфическая профилактика имеет вспомогательное значение и применяется по эпидемиологическим показаниям. Для этого имеется сухая химическая сыпнотифозная вакцина, представляющая собой очищенную концентрированную субстанцию поверхностного антигена риккетсий Провачека. Показана также вакцинация медицинского персонала, работающего в условиях эпидемии или в научно-исследовательских лабораториях.
Возбудитель эндемического (блошиного) сыпного тифа
Эндемический (или крысиный) блошиный сыпной тиф — остролихорадочная зоонозная инфекция, встречающаяся у крыс. Возбудитель Rickettsia typhi близок по свойствам к риккетсиям Провачека. Переносчики возбудителей — блохи.
Заболевания людей в единичных случаях встречаются в местностях, в которых наблюдаются заболевания крыс.
Серодиагностика со специфическим антигеном позволяет дифференцировать блошиный сыпной тиф от эпидемического сыпного тифа.
Возбудитель Ку-лихорадки
Ку-лихорадка (от англ. query — неясный) — зоонозная инфекционная болезнь, вызываемая Coxiella burnetii, характеризуется полиморфной клинической картиной с преимущественным поражением легких.
Таксономия. Возбудитель C.bumetii (назван по имени Ф.Бернета) относится к отделу Gracilicutes, семейству Rickettsiaceae, роду Coxiella.
Морфологические и культуральные свойства. Это грамотрицательные, неподвижные, мелкие кокковидные или палочковидные бактерии. Культивируются в желточном мешке ку риного эмбриона или в культуре клеток. Устойчивы к высушиванию, действию формалина, фенола, нагревание до 90 °С выдерживают больше 1 ч. Из лабораторных животных наибольшей чувствительностью к возбудителю обладают морские свинки.
Эпидемиология. Ку-лихорадка распространена повсеместно. Паразитирование C.bumetii выявлено у многих видов млекопитающих, птиц, членистоногих. Источником возбудителя являются крупный и мелкий рогатый скот, лошади, верблюды. Заражение происходит воздушно-пылевым (при обработке шерсти, кожи зараженных животных), алиментарным (при употреблении молока и молочных продуктов) или трансмиссивным (через клещей) путями, а также при непосредственном контакте с больным животным. Заражение здорового человека от больного не наблюдается.
Патогенез и клиника. Возбудитель характеризуется очень высокой инвазивностью. Он может проникать не только через слизистые оболочки, но и через неповрежденную кожу. Возбудитель, попадая в кровь, распространяется по органам и тканям, вызывая поражение многих органов, чаще всего легких. Болезнь сопровождается лихорадкой, головной и мышечной болями, интерстициальной пневмонией.
Иммунитет. Иммунитет прочный и длительный, повторные заболевания редки.
Микробиологическая диагностика. Проводят серодиагностику (реакция агглютинации, РСК, ИФА) с риккетси- озным антигеном. Возбудитель можно выделить из крови, мокроты, мочи. С этой целью морским свинкам, мышам вводят материал от больного. Из селезенки зараженного животного возбудителей выделяют путем культивирования на курином эмбрионе. Можно использовать кожно-аллергическую пробу с антигеном
Лечение. Применяют антибиотики тетрациклиновой группы, рифампицин.
Профилактика. Неспецифическая профилактика — санитарно-ветеринарные мероприятия и соблюдение личной гигиены. Для создания искусственного иммунитета по эпидемиологическим показаниям применяют живую вакцину из штамма М-44, разработанную П.Ф.Здродовским и В.А.Гениг.
Возбудитель марсельской лихорадки (клещевой средиземноморской лихорадки)
Марсельская лихорадка — инфекционная болезнь, вызываемая Rickettsia conori. Характеризуется доброкачественным течением, наличием первичного очага на коже, распространенной сыпью, поражением регионарных лимфатических узлов
Таксономия. R.conori относится к отделу Gracilicutes, семейству Rickettsiaceae. По морфологическим, тинкториальным, культуральным и антигенным свойствам сходен с другими риккет- сиями. Малоустойчив в окружающей среде. Основным резервуаром и переносчиком служат клещи. Механизм передачи трансмиссивный. Человек, больной марсельской лихорадкой, не заразен. Естественная восприимчивость людей невысокая.
Болезнь эндемична в прибрежных районах Средиземного и Каспийского морей, протекает остро, с лихорадкой и интоксикацией. Инкубационный период составляет 3—10 дней, летальность не превышает 3 %.
Диагностика основана на выявлении R.conori в крови и кожных поражениях в серологических реакциях (РСК, РНГА) и постановкой биопробы на морских свинках.
Постинфекционный иммунитет пожизненный.
Лечение антибиотиками. Меры специфической профилактики не разработаны. Неспецифическая профилактика сводится к мерам защиты от нападения клещей.
С 1972 г. на территории России в Астраханской области зарегистрировано лихорадочное заболевание, которое впоследствии получило название астраханской лихорадки. Возбудителем болезни оказалась разновидность возбудителя марсельской лихорадки — R.conori. Основные биологические свойства возбудителя, а также эпидемиология, клиника, диагностика, профилактика и лечение при астраханской лихорадке принципиально такие же, как при марсельской лихорадке.Клещевой риккетсиоз (клещевой риккетсиоз североазиатский) — природно-очаговая болезнь, вызываемая Rickettsia sibirica. Характеризуется лихорадкой, первичным очагом, увеличением регионарных лимфатических узлов, сыпью.
Морфологические, культуральные и антигенные свойства. Возбудитель инфекции R.sibirica — грамотрицатель- ная бактерия, имеющая палочковидную форму. Культивируется на куриных эмбрионах и в культуре клеток. Бактерия малоустойчива в окружающей среде и к дезинфектантам.
R.sibirica — обитатели иксодовых клещей, которые являются переносчиками болезни. Клещевой риккетсиоз встречается только в Сибири и на Дальнем Востоке.
После попадания в кровь в результате присасывания зараженных клещей возбудитель размножается в эндотелии сосудов кожи, головного мозга и других органов, вызывая лихорадку, сыпь. Болезнь протекает, как правило, без летального исхода и оставляет прочный постинфекционный иммунитет.
Микробиологическая диагностика основана на определении специфических антител в сыворотке крови в РИГА, РСК, РИФ, ИФА Лечение антибиотиками. Неспецифическая профилактика сводится к мерам защиты от нападения клещей.
14.1 4.6. Возбудитель цуцугамуиш
Цуцугамуши (от японск. — клещевая болезнь; син. японская речная лихорадка) — инфекционная природно-очаговая болезнь, вызываемая Rickettsia tsutsugamushi. Характеризуется первичным воспалительным очагом на коже, поражением лимфатических узлов, сыпью, интоксикацией.
Морфологические, культуральные и антигенные свойства. R.tsutsugamushi — типичный представитель рода Rickettsia. Источником инфекции являются мышевидные грызуны, переносчиком — краснотелковые клещи. Болезнь встречается на Дальнем Востоке.
Патогенез и клиника. Возбудитель, попав в организм после укуса инфицированным клещом, размножается в эндотелии кровеносных сосудов, где образует узелки. Клиническая картина характеризуется лихорадкой, сыпью. Болезнь протекает тяжело, летальность высокая.
Иммунитет после перенесенного заболевания нестойкий, штаммоспецифический.
Диагностика основана на обнаружении (в РСК, РНГА, ИФА) специфических антител в сыворотке крови.
Лечение проводят антибиотиками.
Профилактика. Специфическая профилактика отсутствует. Неспецифическая профилактика сводится к мерам защиты от нападения клещей.
Возбудитель эрлихиозов
К эрлихиозам относится группа риккетсиозов, вызываемых Rickettsia ehrlichia, названных по имени П.Эрлиха. К ним относятся эрлихиозы собак, которыми болеет и человек; инфекционный моно- нуклеоз (болеет только человек) и эрлихиоз лошадей, овец и других животных. Эрлихиозы распространены повсеместно.
Морфологические, культуральные и антигенные свойства. Возбудитель — R.ehrlichia, по морфологическим, физиологическим и другим свойствам сходен с другими риккет- сиями, обычно размножается только в лейкоцитах.
Клиника. Клиническая болезнь проявляется лихорадкой, нарушением самочувствия, сыпью (в 30 %), изменением лейкоцитарной формулы. Прогноз благоприятный.
Микробиологическая диагностика. Диагноз ставят на основании обнаружения (в РСК, РПГА) специфических антител в сыворотке крови.
Лечение. Болезнь лечат антибиотиками.
Возбудители вирусных кровяных инфекций
Вирус иммунодефицита человека
СПИД — синдром приобретенного иммунодефицита (или AIDS от англ. acquired immunodeficiency syndrome) — антропонозная инфекционная болезнь, вызываемая вирусом иммунодефицита (ВИЧ, или HIV, от англ. human immunodeficiency virus), поражающего преимущественно иммунную систему. Заболевание характеризуется длительным течением, разнообразием клинических проявлений, заканчивается, как правило, летально, передается в естественных условиях от больного человека здоровому половым путем, а также парентерально при медицинских манипуляциях. Болезнь «склонна» к быстрому эпидемическому распространению.
Таксономия. Возбудитель ВИЧ-инфекции (СПИДа) относится к семейству Retro- viridae, подсемейству Lentivi- rinae\ имеет два типа (HIV-1 и HIV-2) и не менее 10 сероваров. Открыт в 1983 г. американским вирусологом Р Галло и французским ученым JI.Монтанье независимо друг от друга. Помимо ВИЧ, имеются аналогичные лимфо- тропные вирусы иммунодефицита обезьян, кошек и других животных. Человек к этим вирусам нечувствителен.
М
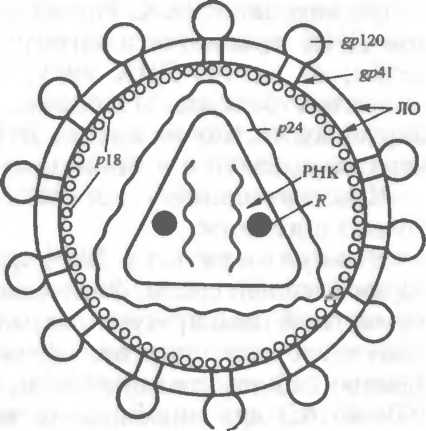
ЛО — липопротеиновая оболочка; R — ревертаза; />18, р24, gp41, gp 120 — поверхностные и сердцевинные антигены вируса.
орфология Вирус имеет сферическую форму, диаметр 100 нм (рис. 14.2), наружную двухслойную липидную оболочку, которая «пронизана» гликопротеидным комплексом gp\60 состоящим из двух субъединиц — gp4\ и gp\20.Сердцевина вируса образована главным образом белком gp24 и другими белками и имеет конусообразный вид. В сердцевине находятся РНК и несколько молекул ревертазы (обратной транс- криптазы). Геном вируса, представленный в виде двух идентичных однонитчатых молекул РНК, состоит из 3 структурных (gag, env, pot), 3 регуляторных (reg, tat, nej) и 5 генов, необходимых для осуществления процесса созревания и высвобождения вирусных частиц из клетки (vif, Vpu, Vpr, Vpi, Vpx).
Антигенная структура. Вирус имеет несколько антигенов. Главные из них — оболочечные gp41 и g/>120 и сердцевинный (коровый) g/>24. Поверхностный антиген gp41 обладает сродством к рецепторам CD4 Т лимфоцитов, макрофагов и других клеток и играет основную роль в патогенезе инфекции. Для антигенов ВИЧ характерна большая вариабельность, обусловленная гипервариабельностью его генома, расположенного в области env. Высокая изменчивость обеспечивает вирусу адаптацию к конкретным условиям его существования в процессе течения инфекции.
Культуральные свойства и резистентность. Вирус размножается только в культуре Т лимфоцитов на сложных питательных средах с добавлением иммуномодулятора интерлейкина-2.
Репликация вируса в лимфоцитах протекает в несколько стадий: 1) адсорбция вируса на рецепторах CD4 Г-лимфоцитов с помощью рецептора gp4\; 2) эндоцитоз вируса; 3) высвобож
дение вирусной РНК, синтез с помощью ревертазы двунитчатой ДНК провируса и интеграция провируса в геном (ДНК) кетки; 4) синтез РНК вируса, трансляция и формирование вирусных белков; 5) сборка, созревание и высвобождение вирусных частиц из клетки путем «почкования», в результате чего он одевается в липидную оболочку клетки.
Чувствительностью к ВИЧ, помимо человека, обладают только шимпанзе.
Резистентность. ВИЧ сравнительно малоустойчив к факторам внешней среды, физическим и химическим факторам. При комнатной температуре сохраняется до 4 сут; за 5—10 мин инактивируется спиртом, эфиром и другими дезинфектантами. Быстро гибнет при кипячении, но при умеренном прогревании (60—80 °С) для инактивации вируса требуется не менее 10 ч.
Эпидемиология. Начиная с 1980—1981 гг., когда были зарегистрированы первые больные в США, ВИЧ-инфекция быстро распространилась по всем континентам и странам мира, превратившись в настоящую пандемию. Наиболее поражено ВИЧ- инфекцией население Америки, Африки и в меньшей степени — Азии и Австралии. К настоящему времени на планете насчитывают более 20 млн ВИЧ-инфицированных, а более 2 млн человек уже умерли от СПИДа. Специалисты прогнозируют расширение эпидемии и в ближайшее десятилетие.
В России первый ВИЧ-инфицированный зарегистрирован в 1987 г., а число ВИЧ-инфицированных к 1998 г. достигло 10 000 человек, больных СПИДом более 300 человек.
Патогенез. Инфицирование вирусом происходит при половых контактах, использовании крови и препаратов от ВИЧ- инфицированных людей, при пользовании необезвреженными медицинскими инструментами и т. д. Также возможна передача вируса от инфицированной матери плоду при внутриутробном развитии и при кормлении грудным молоком.
Вирус, проникнув в кровь, разносится кровью и лимфой по всем органам и тканям, поражает Г-хелперы, ^-лимфоциты, макрофаги, нервные клетки, т.е. клетки, на чьей поверхности имеются рецепторы CD4, к которым прикрепляется вирус.
После цикла репродукции в клетке последняя погибает или снижает функциональную активность. Это приводит к нарушению защитной функции иммунной системы, угнетению реакций иммунитета на антигены; уменьшению числа 74-лимфоцитов и соотношения 74 и 78 (супрессоров), числа естественных киллеров, угнетению синтеза антител к ВИЧ, а также фагоцитоза, снижению продукции интерферона, интерлейкинов, комплемента
У ВИЧ-инфицированных вирус обнаруживается в крови, лимфе, слезах, слюне, молоке, влагалищном секрете, сперма-
тозоидах, в клетках-мишенях (в Т- и ^-лимфоцитах, макрофагах, нервных и других клетках), т.е. практически во всех органах и тканях.
В результате снижения функции иммунной системы возникают вторичные поражения условно-патогенной микрофлорой дыхательной системы, желудочно-кишечного тракта, центральной нервной системы, а также злокачественные новообразования.
Клиника. Инкубационный период значительно варьирует — от нескольких дней до нескольких месяцев. В течении болезни различают 3 периода: а) период первичного проявления (до 4— 10 нед), характеризующийся длительным субфебрилитетом, увеличением лимфатических узлов, диареей, полиморфной сыпью и другими симптомами; б) период вторичных проявлений (от нескольких месяцев до 8—10 лет), характеризующийся генерализацией процесса; в) период поражения в результате вторичных инфекций различных органов и систем — легких (пнев- моцистная пневмония), желудочно-кишечного тракта (энтериты), центральной нервной системы (абсцессы, менингит, энцефалиты), а также возникновение опухолей (саркома Капо- ши, лимфома мозга и др.).
Последний период заканчивается терминальной стадией — собственно СПИД, выражающейся кахексией, адинамией, де- менцией (слабоумием), которые приводят к смерти.
ВИЧ-инфекция характеризуется тотальным поражением Т-, В- и /1-звеньев иммунной системы.
Вирусологическая диагностика. Диагностика основана на определении антигенов и антител к вирусу на различных стадиях течения инфекции. Антигены gp41, gpl20 определяют на первых и последних стадиях болезни, а антитела к антигенам g/>41, gp24 и gp\20 — на протяжении всей болезни начиная со 2-й до 10-й недель после заражения. Наиболее распространенный способ определения антител — ИФА, в котором используют или лизаты ВИЧ, или химически синтезированные, или полученные генно-инженерным способом антигены. Серопозитивные сыворотки обязательно проверяют в подтверждающем тесте — методом иммуноблотгинга. Разработана ПЦР.
Лечение. Лечение противовирусное (азидотимидин и др.), иммунокорригирующее (интерлейкины, интерфероны, тимозин), антибактериальное, направлено против оппортунистических инфекций.
Профилактика. Специфическая профилактика отсутствует. Разработано несколько десятков экспериментальных вакцин, которые проходят клинические испытания. Основными способами профилактики являются выявление больных СПИДом или ВИЧ-инфицированных, обследование групп риска (наркоманов, проституток, гомосексуалистов, а также доноров), контроль препаратов крови, применение одноразовых шприцев и систем, соблюдение режима обработки инструментов и других материалов, правильное половое воспитание населения, пользование презервативами.
В России существует закон «О профилактике заболевания СПИДом», предусматривающий наказание за создание заведомой опасности заражения другого лица или за умышленное заражение ВИЧ-инфекцией.
Вирусы гепатитов
Парентеральные гепатиты — инфекционные болезни вирусной этиологии, характеризуются поражением печени, длительным течением, вирусоносительством, часто заканчиваются острой печеночной недостаточностью, циррозом печени и первичным раком печени. Антропонозы. Передаются через кровь и половым путем.
Заболевания вызывает группа вирусов, основными из которых являются вирусы гепатитов В, С, D и G.
Вирус гепатита В
Вирус гепатита В (ВГВ) относится к семейству Hepadnaviridae, роду Orthohaepadnavirus. Впервые был обнаружен под электронным микроскопом в 1970 г. Дейном, получив название «частица Деина»
Морфология. ВГВ — сложноорганизованный ДНК-содер- жащий вирус сферической формы, его диаметр 42—47 нм. Вирус состоит из сердцевины, построенной по кубическому типу симметрии и представляющей сердцевинный (НВс) антиген, а также липидсодержащей оболочки, несущей поверхностный HBs-антиген. Внутри сердцевины находятся ДНК, ДНК-полимераза и концевой белок — Ябе-антиген.
Геном представлен двунитчатой ДНК кольцевой формы с молекулярной массой 1,6 х 106. У ДНК плюс-цепь укорочена на '/3 длины. Полноценная минус-цепь ковалентно связана с ДНК- полимеразой, которая достраивает плюс-цепь до полноценной структуры. Геном записан на минус-цепи и состоит из 4 генов.
Культуральные свойства. ВГВ культивируется только в культуре клеток, полученной из ткани первичного рака печени в виде персистирующей инфекции, не вызывает цитопатичес- кого эффекта. В куриных эмбрионах не культивируется. К вирусу чувствительны приматы (шимпанзе, горилла, орангутанг), которых используют в качестве экспериментальной модели.
Резистентность. ВГВ высокоустойчив к факторам окружающей среды и дезинфицирующим веществам. Температуру —20 °С выдерживает более 10 лет. При нагревании до 100 °С в течение 2—5 мин сохраняет инфекционную активность. Термоустойчивость вируса повышается, если он находится в крови. Вирус устойчив к длительному воздействию кислой среды (pH 2,3), УФ, спирта, фенола Чувствителен к формалину, эфиру, хлорамину.
Антигенная структура. ВГВ обладает сложной антигенной структурой. В суперкапсиде вируса находится Я&-антиген, состоящий из S, preS, и ^/^-полипептидов в гликозилирован- ной форме, которые различаются по антигенной специфичности. Существует 4 антигенных серотипа вируса Наличие HBs-антигена в крови свидетельствует об инфицированности организма ВГВ. //ifc-антиген впервые был обнаружен в 1963 г. в крови австралийских аборигенов, поэтому получил название австралийского антигена. Сердцевинный ЯЯс-антиген не обнаруживается в свободном виде в крови, его можно выявить только в зараженных вирусом гепатоцитах. НВе-аитигси также является сердцевинным антигеном, производным #/?с-антигена. Появление ЯЯе-антигена в крови связано с репликацией вируса в гепатоцитах. В последнее время у ВГВ обнаружен НВх антиген (трансакгиватор).
Эпидемиология. Основным резервуаром и источником ин фекции является человек — больной и вирусоноситель, общее число которых в мире превышает 300 млн. Ежегодно в мире от вирусных гепатитов умирают около 2 млн человек. Россия относится к регионам с относительно высокой распространенностью гепатита В. Развитие инфекционного процесса наступает при попадании вируса в кровь. Заражение происходит при парентеральных манипуляциях (инъекциях, хирургических вмешательствах, трансплантации органов, искусственном оплодотворении, стоматологических и гинекологических манипуляциях, нанесении татуировок), переливаниях крови, а также половым путем, через микротравмы в быту и трансмиссивно (через клопов). ВГВ передается трансплацентарно от матери к плоду и при прохождении плода через родовые пути. Риск заражения ребенка от матери — носителя вируса составляет 60 %, а в случае «свежего» заболевания матери — 90 %. Вирус у инфицированных лиц находится во всех биологических жидкостях крови, слюне, моче, сперме, влагалищном секрете, синовиальной, цереброспинальной жидкости, грудном молоке. В крови ВГВ появляется за
3 мес до проявления симптомов поражения печени и сохраняется до 5 лет после клинического выздоровления.
Патогенез. Инфекционный процесс наступает после проникновения вируса в кровь. Вирус из крови посредством эн- доцитоза проникает в гепатоцит, видимо, при участии сывороточного альбумина, рецепторы к которому обнаружены как на preS2-aHTHreHe ВГВ, так и гепатоцитах. После проникновения вируса в гепатоцит плюс-нить ДНК ДНК-полимеразой достраивается до полноценной структуры, после чего возможно развитие двух типов вирусной инфекции: интегративной и продуктивной. Интегративная инфекция сопровождается интеграцией (включением) кольцевой ДНК вируса в хромосому печеночной клетки-гепатоцита с образованием в ней провируса. При этом синтезируется ///fc-антиген. Клинически это проявляется виру- соносительством, показателем которого является обнаружение в крови ЯЯу-антигена. Результатом вирусоносительства может быть развитие первичного рака печени, при этом в крови начинает определяться Я/frc-антиген.
При продуктивной инфекции в результате формирования новых вирусных частиц наблюдается клинически выраженный острый или хронический гепатит, маркером которого служит появление в крови анти- #/?с-антител. Репликация вируса происходит в цитоплазме гепатоцитов. При этом вирус не разрушает гепато- циты, а индуцирует иммунопатологические реакции, обусловленные тем, что HBcAg, накапливающийся на поверхности гепатоцита, придает гепатоциту свойства антигенной чужерод- ности. В результате этого в организме формируется популяция 7-киллеров, которые, взаимодействуя с HBcAg как с рецептором, расположенным на поверхности гепатоцита, вызывают лизис клеток.
Клиника. Инкубационный период продолжается от 2 до 6 мес. Клиническая картина характеризуется симптомами поражения печени, в большинстве случаев сопровождающихся развитием желтухи. Возможны и безжелтушные формы. В 1 % случаев возникают молниеносные формы, обычно со смертельным исходом. Острый гепатит в 5—10 % случаев переходит в хронический, с развитием цирроза и носительства ВГВ. Вероятность возникновения носительства ВГВ особенно велика (в 50—90 % случаев) у детей 1-го года жизни, заразившихся от матери.
Гуморальный иммунитет, представленный главным образом антителами к Я&-антигену, защищает гепатоциты от вируса. Клеточный иммунитет, в формировании которого основная роль принадлежит HBcAg, обеспечивает освобождение организма от инфицированных гепатоцитов. Переход острой формы болезни в хроническую связан с нарушением клеточного иммунитета, а также синтеза интерферона и интерлейкина-1.
Диагностика. Используют серологический метод и ПЦР. Методами ИФА и РНГА определяют в крови маркеры гепатита В: HBs-антиген, анти- Я/?с-антитела, /#Л/-анти-Я/?с-антитела, Я/?е-антиген. С помощью ПЦР выявляют вирусную ДНК в крови и биоптатах печени.
Лечение. В терапии используют интерферон и ингибиторы ДН К-полимеразы.
Профилактика. Важнейшим и наиболее эффективным методом профилактики гепатита В является исключение попадания вируса при парентеральных манипуляциях и переливаниях крови. Это достигается: а) применением одноразовых шприцев, систем для переливания крови, инструментов с последующим после их использования регламентированным сбором и уничто жением; б) надежной стерилизацией инструментов в централизованных стерилизационных пунктах; в) проверкой на наличие Я&-антигена крови доноров, а также доноров органов и тка ней, используемых для трансплантации и искусственного осеменения; г) учетом всех вирусоносителей в диспансерах и лечением больных гепатитом В в специализированных отделениях инфекционных больниц. Персонал контактирующий с кровью, обязан работать в перчатках. Группу высокого риска заражения гепатитом В составляют хирурги, гинекологи, акушеры, стоматологи, медицинские сестры, сотрудники отделений переливания крови и гемодиализа, работники лабораторий, лица, занятые в производстве иммунобиологических препаратов из донорской и плацентарной крови. Для предотвращения передачи гепатита В половым путем принимают меры, аналогичные таковым при ВИЧ-инфекции.
Специфическая профилактика осуществляется вакцинацией рекомбинантной генно-инженерной вакциной, содержащей HBs- антиген. В России разрешено применение отечественной рекомбинантной дрожжевой вакцины против гепатита В, а также аналогичной вакцины, выпущенной зарубежными фирмами.
Новорожденные, родившиеся у матерей — носителей ВГВ и больных гепатитом В, подлежат 4-кратной вакцинации. В этом случае первичное введение вакцины проводят в первые 24 ч жизни, далее — в соответствии с календарем прививок; 3-кратной вакцинации подлежат дети, в семьях которых есть носитель HBs- антигена или больной гепатитом В, а также воспитанники домов ребенка и интернатов, начиная с 4—5-месячного возраста. Среди взрослого населения 3- кратной вакцинации подвергаются лица, относящиеся к группе высокого риска заражения гепатитом В. Длительность поствакцинального иммунитета не менее 7 лет.
Вирус гепатита С
Вирус гепатита С (ВГС) относится к семейству Flaviviridae, роду Hepacivirus. Это РНК содержащий вирус; имеет сферическую форму, диаметр 55—65 нм, сложно организованный. Геном вируса представлен линейной однонитчатой РНК, обладает большой вариабельностью Известно более 10 генотипов вируса. Наиболее патогенным является генотип lb. Антигенами вируса являются сердцевинный С-протеин, гликопротеины оболочки (е-протеины 1 и 2) и неструктурные белки (NS).
Болезнь, вызываемая ВГС, широко распространена, заболеваемость нарастает с каждым годом. Природный резервуар вируса неизвестен. Экспериментальную инфекцию можно вызвать у шимпанзе. В чистом виде вирус гепатита С не выделен. Имеются успешные попытки адаптировать вирус к культуре тканей.
ВГС чувствителен к эфиру, детергентам, УФ-лучам.
Заражение ВГС аналогично заражению ВГВ. Однако для заражения ВГС требуется большая заражающая доза, чем при гепатите В. Наиболее часто ВГС передается при переливаниях крови.
Клиническое течение острого гепатита С более легкое, чем гепатита В, часто встречаются безжелтушные формы. Но несмотря на более легкое течение, в острой форме в 50 % случаев процесс переходит в хронический с развитием цирроза и первичного рака печени.
Диагностика. Диагностика серологическая: определяют антитела к вирусу гепатита С методом ИФА и ПЦР.
Лечение. Применяют интерферон и рибавирин.
Профилактика. Включает те же мероприятия, что и при гепатите В. Вакцина против гепатита В не защищает от гепатита С.
2.2.3. Вирус гепатита D
Вирус гепатита D (ВГО) впервые был обнаружен в 1977 г. Ризетто. Вирус не классифицирован. Он является сателлитом вируса гепатита В и представляет собой дефектный вирус, не имеющий собственной оболочки. Вирион ВГО имеет сферическую форму, диаметр 36 нм, однонитчатую РНК и сердцевинный дельта-антиген (#Я</-антиген), состоящий из двух белков с полипептидными цепями разной длины. В качестве внешней оболочки ВГО использует Я&-антиген внешней оболочки ВГВ (ем. рис. 4.2). Различают 3 генотипа вируса. В России преобладает 1-й генотип. Все генотипы относятся к одному серотипу.
Резервуаром вируса в природе являются больные и вирусо- носители. Заражение ВГО аналогично инфицированию ВГВ. Одновременное инфицирование вирусами гепатитов В и D (коинфекция) приводит к развитию умеренной формы болезни. Инфицирование ВГО больных хронической формой гепатита В утяжеляет течение инфекции, приводя к развитию острой печеночной недостаточности и цирроза печени. В свободном виде ВГБ в крови инфицированных им лиц не обнаруживается, его можно выявить в гепатоцитах.
Диагностика. Применяют серологический метод — определяют антитела к BrD методом ИФА.
Лечение, Используют интерферон.
Профилактика. Проводят те же мероприятия, что и для профилактики гепатита В. Вакцина против гепатита В защищает от гепатита D (общность ЯЛу-антигена).
Вирус гепатита G
Вирус гепатита G еще мало изучен. Он относится к семейству Flaviviridae, роду Hepacivirus. Предполагают, что этот вирус обладает дефектом в сердцевинном белке и для его репликации требуется помощь вируса гепатита С.
2.3. Арбовирусы
Арбовирусы (от англ. arthropod borne viruses — вирусы, рожденные или передаваемые членистоногими) — это экологическая группа вирусов, передающихся трансмиссивно восприимчивым позвоночным животным и человеку кровососущими членистоногими переносчиками, в организме которых они активно размножаются, не оказывая болезнетворного воздействия.
Изучение арбовирусов началось с установления вирусной этиологии желтой лихорадки в 1901 г. сотрудниками американской военной миссии на Кубе под руководством У. Рида. В России изучение арбовирусов началось с установления вирусной этиологии клещевого энцефалита в 1937 г. экспедицией под руководством Л.А. Зильбера. В настоящее время известно около 500 арбовирусов, 100 из них могут вызывать заболевания у человека, такие как желтая лихорадка, клещевой энцефалит, омская геморрагическая лихорадка, лихорадка Крым—Конго и др.
Арбовирусы включают представителей разных семейств. Наибольшую роль в патологии человека играют представители 3 семейств: Flaviviridaey Togaviridae и Bunyaviridae.
Морфология, химический состав и антигенная структура. Арбовирусы обладают рядом общих признаков. Вирионы чаще имеют сферическую форму, размер 40—100 нм. Строение сложное: они относятся к РНК-геномным вирусам и состоят из РНК и белка-капсида, окруженных суперкапсидом; на поверхности суперкапсида находятся шипы — гликопротеины. Арбовирусы имеют родоспецифические антигены, выявляемые в РСК, группоспецифические и типоспецифические антигены — гликопротеины, обладающие протективной активностью и выявляемые в РТГА и реакции нейтрализации. Гемаг- глютинирующие свойства арбовирусов наиболее выражены при использовании эритроцитов гусей.
Культивирование. Универсальной моделью для выделениях всех арбовирусов служат новорожденные белые мыши, у которых при заражении возникает энцефалит, заканчивающийся летально. Арбовирусы культивируют также в культурах клеток, где они, как правило, не вызывают цитопатического эффекта Для выделения некоторых арбовирусов применяют заражение куриных эмбрионов в желточный мешок. Арбовирусы размножаются при двух температурных режимах, 36—40 и 22— 25 °С, что позволяет им репродуцироваться в организме не только позвоночных, но и кровососущих членистоногих переносчиков.
Резистентность. Арбовирусы чувствительны к эфиру, де- зоксихолату натрия, дезинфектантам, УФ-облучению, формалину; инактивируются при 56—60 °С в течение 30 мин. Длительно сохраняются в замороженном и лиофилизированном состо янии.
Эпидемиология. Арбовирусы широко распространены. Большинство арбовирусных инфекций относится к природноочаговым зоонозам.
Благодаря трансфазовой (трансстадийной) и трансовариальной (от поколения к поколению) передаче вирусов основным резервуаром арбовирусов в природных очагах и их переносчиками являются кровососущие членистоногие (комары, клещи, москиты, мокрецы). Дополнительным резервуаром вирусов в природных очагах служат прокормители членистоногих (птицы, летучие мыши, грызуны, приматы и др.). Основной механизм и путь заражения трансмиссивный. При определенных условиях вирусы могут передаваться с помощью переносчиков от человека человеку. Иногда заражение может происходить воздушнокапельным, контактным и пищевым путями.
Арбовирусы могут вызывать как эпидемические вспышки, так и спорадические случаи заболевания. Для арбовирусных инфекций характерна сезонность, обусловленная активностью переносчиков.
Патогене з. Арбовирусы размножаются в тканях и органах членистоногих, в том числе в слюнных железах. При последующем укусе человека или животного вирусы с током крови заносятся во внутренние органы, где размножаются в эндотелии капилляров, откуда вновь поступают в кровь. Вторичная вире- мия сопровождается появлением лихорадки. Вазотропные вирусы поражают эндотелий капилляров внутренних органов, а нейротропные вирусы проникают в клетки центральной нервной системы, что ведет к их гибели.
Клиника. В большинстве случаев арбовирусные инфекции протекают скрыто, бессимптомно и выявляются лишь с помощью серологических методов. Клинические проявления арбовирусных инфекций укладываются в 3 основных синдрома: системные и геморрагические лихорадки, менингоэнцефалиты Летальность при некоторых формах заболеваний достигает 60— 75 %.
Иммунитет. После перенесенного заболевания формирует ся стойкий гуморальный, типоспецифический иммунитет.
Лабораторная диагностика. Лабораторная диагности ка основана на обнаружении вируса или его компонентов и выявлении прироста антител к возбудителю у больных. Материалом для исследования служат кровь, спинномозговая жид кость, при летальном исходе — материал из всех органов. Арбовирусы относятся к возбудителям особо опасных инфекций, поэтому работа с ними должна проводиться в специально оборудованных режимных лабораториях.
Арбовирусы выделяют путем интрацеребрального заражения новорожденных белых мышей, а также культур клеток и ку риных эмбрионов. Выделенный вирус идентифицируют с помощью РТГА, используя эритроциты гусей, РСК и реакции нейтрализации. Возможно применение РИФ, РПГА, ИФА. ИЭМ Эти же реакции применяют для обнаружения антител в парных сыворотках и спинномозговой жидкости. Для экспресс-диагно- стики используют РИФ, РПГА, ИФА, РИА, ПЦР.
Лечение. Для лечения применяют интерферон, рибавирин, биназу и другие противовирусные препараты. Используют также гомо- и гетерологичные иммуноглобулины.
Профилактика. Для экстренной профилактики используют гомо- и гетерологичные иммуноглобулины. Для создания активного иммунитета применяют главным образом убитые вакцины. Исключение составляет живая вакцина против желтой лихорадки.
Вирус клещевого энцефалита
Вирус клещевого энцефалита относится к семейству Flaviviridae, роду Flavivirus (от лат. flava — желтый). Это типичный арбовирус умеренного пояса. Ему свойственна значительная географическая и внутрипопуляционная изменчивость по ряду антигенных и биологических признаков. Вирус обладает нейротропностью. Он нестоек во внешней среде, но сохраняет жизнеспособность в диапазоне температур от —150 до 30 °С, высокоустойчив в кислой среде.
Эпидемиология и патогенез. Основным резервуаром и переносчиком вируса являются иксодовые клещи. Дополнительный резервуар — прокормители клещей: грызуны, птицы, дикие и домашние животные. Для клещевого энцефалита характерна весенне-летняя сезонность. Человек заражается при укусе инфицированными клещами, а также при употреблении сырого молока коз и овец. Распространяясь гематогенно, вирусы поражают двигательные структуры центральной нервной системы.
Клиника. Различают 3 клинические формы клещевого энцефалита: лихорадочную, менингеальную и очаговую, которая протекает наиболее тяжело и сопровождается развитием параличей шеи и верхних конечностей. У 1—3 % больных отмечается хронически-прогредиентное течение инфекции.
После перенесенной болезни формируется стойкий иммунитет.
Лабораторная диагностика. Вирус выделяют из крови и спинномозговой жидкости больных. Обнаруживают антитела в парных сыворотках с помощью серологических реакций. Экспресс-диагностика основана на выявлении вирусного антигена в крови с помощью РПГА, ИФА или участков генома в ПЦР.
Лечение и профилактика. Для лечения и экстренной профилактики применяют специфический донорский или гете- рологичный иммуноглобулин. Для вакцинации используют убитые культуральные вакцины. Из противовирусных препаратов применяют йодантипирин. Для исключения алиментарного пути заражения в природных очагах следует потреблять только кипяченое молоко (особенно козье).
Вирус омской геморрагической лихорадки
Вирус омской геморрагической лихорадки относится к семейству Flaviviridae, роду Flavivirus. По антигенным и биологическим свойствам он близок вирусу клещевого энцефалита, но не проявляет выраженных нейротропных свойств. Природные очаги болезни зарегистрированы на территории Западной Сибири. Основным резервуаром и переносчиком вируса являются клещи. В поддержании природных очагов участвуют грызуны околовод- ного комплекса (ондатра, водяная крыса и др.).
Заболевание у людей встречается редко. Заражение человека происходит при укусе инфицированными клещами или при прямом контакте с инфицированными животными, а также при употреблении зараженной вирусом воды.
Клиника и диагностика. Болезнь характеризуется прежде всего поражением капилляров, нервной системы и надпочечников. Прогноз благоприятный. Формируется напряженный иммунитет. Диагноз подтверждается результатами вирусологических и серологических методов.
Лечение и экстренная профилактика. Применяют специфический гетерологичный иммуноглобулин. Активную иммунизацию не проводят.
Вирус геморрагической лихорадки Крым—Конго
Вирус геморрагической лихорадки Крым—Конго относится к семейству Bunyaviridae, роду Nairovirus. Не обладает гемагглюти- нирующей активностью. Природные очаги заболевания в России находятся на территории Астраханской и Ростовской областей, Краснодарского и Ставропольского краев. Основным резервуаром и переносчиком вируса являются иксодовые клещи. Циркуляцию вируса поддерживают зайцы, коровы и овцы. Человек чаще всего заражается при укусе клещей, однако заражение возможно при контакте с кровью больного через микроповреждения кожных покровов и слизистых оболочек при проведении медицинских манипуляций. Вирус поражает эндотелий капилляров, поэтому болезнь характеризуется тяжелыми геморрагическими проявлениями. Летальность достигает 40 %. Период выздоровления длительный.
Иммунитет напряженный.
Диагностика основана на результатах вирусологических и серологических методов.
Для лечения применяют иммунную сыворотку или специфический гомологичный иммуноглобулин. Для создания активного иммунитета используют инактивированную вакцину из мозга зараженных новорожденных белых мышей и белых крыс
Вирус желтой лихорадки
Вирус желтой лихорадки относится к семейству Flaviviridae, роду Flavivirus. Это РНК-геномный вирус, серологических вариантов не имеет, обладает вазотропизмом. Заболевание распространено в тропических и субтропических странах Центральной и Южной Америки, Африки. Различают две эпидемиологические формы желтой лихорадки — джунглевую и городскую. При джунглевой природно-очаговой зоонозной форме вирус циркулирует главным образом между обезьянами и комарами, которые могут нападать на людей. При городской, антропонозной форме желтой лихорадки вирус циркулирует между человеком и комарами. Заражение происходит при укусе и кровососании.
Желтая лихорадка относится не только к особо опасным, но и к карантинным инфекциям. Инкубационный период составляет 3—6 дней. Заболевание проявляется лихорадкой, интоксикацией, геморрагическим синдромом, поражением печени и почек. Летальность достигает 20—50 %.
Иммунитет напряженный.
Диагностика основана на выделении вируса из крови и определении нарастания титров антител в парных сыворотках с помощью РТГА, РСК, реакции нейтрализации, РРГ и ИФА.
Экспресс-диагностика основана на индикации вирусного антигена в крови больных или печени умерших с помощью ИФА.
Лечение симптоматическое. Всем лицам, выезжающим в неблагополучные по желтой лихорадке регионы, прививают живую вакцину (штамм 17D), которая создает иммунитет, сохраняющийся не менее 10 лет.
Другие арбовирусы
Помимо названных выше арбовирусов из вирусов семейства Flaviviridae наибольшее значение в патологии человека имеют вирусы лихорадки денге, японского энцефалита и др.; из вирусов семейства Togaviridae — вирусы венесуэльского, восточного и западного энцефаломиелитов лошадей, лихорадки Чикунгунья, О’Ньонг-Ньонг и др.; из вирусов семейства Bunyaviridae — вирусы Буньямвера, калифорнийского энцефалита, вирусы неапольской и сицилийской москитных лихорадок.
В настоящее время в отдельную экологическую группу ро- бовирусов (от англ. rodent — грызун + borne viruses) выделены сходные по свойствам с арбовирусами вирусы, связанные с грызунами, передающиеся нетрансмиссивным контактно-бытовым путем. К ним относятся прежде всего вирусы семейства Arenaviridae: вирус геморрагической лихорадки Ласса, вирус аргентинской геморрагической лихорадки Хунин, вирус боливийской геморрагической лихорадки Мачупо и вирус лимфоцитарного хориоменингита.
Из семейства Bunyaviridae важную роль в патологии человека играет вирус геморрагической лихорадки с почечным синдромом (ГЛПС), относящийся к роду Hantavirus (типовой представитель — вирус Хантаан). Резервуаром возбудителя ГЛПС являются мышевидные грызуны лесного комплекса. Заражение человека осуществляется главным образом воздушно-пылевым путем, а также при соприкосновении с грызунами или инфицированными предметами внешней среды, реже алиментарным путем. Вирус обладает вазотропизмом. Специфическая профилактика ГЛПС не разработана. Для лечения получен гомологичный иммуноглобулин направленного действия.
Возбудители протозойных кровяных инфекций
Возбудители малярии
Малярия — антропонозная протозойная болезнь, вызываемая несколькими видами простейших рода Plasmodium, передается комарами рода Anopheles, сопровождается лихорадкой, анемией, увеличением печени и селезенки.
Таксономия. Возбудители малярии относятся к Protozoa, типу Apicomplexa, классу Sporozoa и видам PI. vivax, PL malariae, PL falciparum, PL ovale.
Характеристика возбудителей. Жизненный цикл плазмодиев проходит со сменой хозяев: в комаре (окончательном хозяине) происходит половое размножение, или спорогония (образование мелких клеток — спорозоитов), а в организме человека (промежуточном хозяине) осуществляется бесполое размножение — шизогония, или точнее, мерогония, при которой образуются мелкие клетки — мерозоиты. После укуса спорозоиты из слюнных желез комара попадают в кровь и далее в печень, в клетках которой совершается первый этап размножения — тканевая шизогония. При этом в клетках печени спорозоит переходит в стадию тканевого шизонта, после развития которого наступает деление (меруляция), завершающееся образованием тканевых мерозоитов, которые поступают в кровь. Мерозоиты проникают в эритроциты, в которых совершается несколько циклов эритроцитарной шизогонии. Из мерозоита в эритроците развиваются трофозоиты — растущие формы паразита: юный кольцевидный трофозоит, полувзрослый, взрослый трофозоит, который делится и превращается в шизонт. Из шизонтов образуются мерозоиты, внедряющиеся в другие эритроциты. Этот процесс повторяется многократно. В эритроцитах мерозоиты дают также начало половым незрелым формам (га- монтам). Продолжительность цикла развития у PL vivax, PL falciparum и Pl. ovale составляет 48 ч, у PL malariae — 72 ч. При укусе незрелые половые формы попадают вместе с кровью больного человека в желудок самок комаров. В комаре гамонты приступают к гаметогонии. Они дозревают и оплодотворяются, образуя зиготу, превращающуюся в удлиненную подвижную форму — оокинету. Последняя проникает через стенку желудка и превращается в ооцисту, в которой завершается спорогония с образованием до 10 ООО спорозоитов. Затем через гемолимфу спорозоиты попадают в слюнные железы комара.
PI vivax — возбудитель трехдневной малярии, открыт в 1890 г. В Грасси и Р.Фелетти. В эритроците при окраске мазка из крови по Романовскому — Гимзе имеет форму правильного кольца: крупная вакуоль в центре, окаймленная голубой цитоплазмой с рубиново-красным ядром (кольцевидный трофозоит). Иногда в одном эритроците встречается 2—3 кольца. В эритроците полувзрослый трофозоит имеет форму амебы с псевдоподиями. На некоторых стадиях развития в пораженном эритроците выявляется кирпично-красная зернистость. В стадии деления паразита образуется 14—24 мерозоита.
Pi malariae — возбудитель четырехдневной малярии, открыт в 1880 г. А. Лавераном. Полувзрослый трофозоит внутри эритроцита в отличие от PI. vivax имеет лентовидную форму, паразит делится на 6—12 мерозоитов, располагающихся упорядоченно вокруг пигмента (обычно в виде розетки).
PI. falciparum — возбудитель тропической малярии, открыт в 1897 г. У.Уэлчем. Для него характерны юные формы в виде мелких колец в эритроците часто по 2—3 в одной клетке, а также появление в периферической крови половых клеток в виде полулуний.
PI. ovale — возбудитель малярии типа трехдневной, открыт в 1922 г. Ж. Стивенсеном. Паразит в стадии кольца в эритроците имеет более крупное ядро, чем PL vivax. В эритроците выявляется зернистость. Часть эритроцитов имеет овальную форму. Паразит делится на 6—12 мерозоитов.
Эпидемиология и патогене з. Восприимчивость людей высокая. Малярией болеют сотни миллионов людей, живущих в странах с тропическим и субтропическим климатом. Поэтому острой является проблема завоза малярии в нашу страну. Источник возбудителя — больной человек или паразитоноси- тель. Основной механизм заражения — трансмиссивный, через укус самки комара рода Anopheles (около 30 видов). Возможен парентеральный путь при гемотрансфузии.
Клиника. Инкубационный период при различных формах малярии колеблется от недели до года и более. Малярии свойственно приступообразное течение: озноб с сильной головной болью сменяется подъемом температуры тела до 39—40 °С и выше, после чего температура быстро снижается с обильным потоотделением и выраженной слабостью. Приступы могут быть ежедневными или повторяться через 1—2 дня и приводить при длительном течении к поражению печени и селезенки. Летальность составляет около 1 %.
Иммунитет. После малярии формируется нестойкий, видоспецифический, нестерильный иммунитет. Возможны повторные заболевания.
Микробиологическая диагностика. Основана на микроскопическом исследовании мазков из крови, окрашенных по Романовскому—Гимзе, и обнаружении различных форм возбудителя; применяют ДНК-гибридизацию и ПЦР для выявления ДНК паразитов в крови, а также серодиагностику (РИФ, РПГА, ИФА).
Лечение. Противомалярийные препараты оказывают различное действие на бесполые и половые стадии плазмодиев. К основным противомалярийным препаратам относят хинин, мефлохин, хлорохин, акрихин, примахин, бигумаль, хлоридин и др.
Профилактика. Профилактические мероприятия направ лены на ликвидацию источника возбудителя (лечение больных малярией и паразитоносителей) и уничтожение переносчиков возбудителя — комаров. Разрабатываются методы иммунизации, вакцинации на основе антигенов, полученных генно-инженерным методом.
Возбудители лейишаниозов
Лейшманиозы — протозойные болезни человека и животных, вызываемые простейшими — лейшма- ниями, передаются москитами, характеризуются поражением внутренних органов (висцеральный лейшманиоз) или кожи и слизистых оболочек (кожный лейшманиоз).
Таксономия. Возбудители лейшманиозов относятся к Protozoa — типу Sarcomastigophora, подтипу Mastigophora — жгутиконосцы.
Характеристика возбудителя. Лейшмании — внутриклеточные паразиты, развивающиеся в макрофагах или клетках ретикулоэндотелиальной системы. Проходят два цикла бесполого развития: жгутиковый (промастиготный) и безжгутико- вый (амастиготный). В жгутиковом цикле паразиты развиваются на питательных средах или в кишечнике москита, зараженного при сосании крови больного. Возбудитель имеет удлиненную веретенообразную форму (длина 10—20 мкм, поперечник около 5 мкм). Протоплазма имеет ядро, цитоплазму зерна волютина и кинетопласт — ДНК-содержащий органоид митохондриального происхождения.
Жгутик, отходящий от заостренного конца, способствует перемещению лейшманий. Для культивирования используют питательную агаризированную среду с добавлением дефибрини- рованной крови кролика. Лейшмании растут также на хорионал- лантоисной оболочке куриного эмбриона и в культурах клеток.
Безжгутиковый цикл проходит в ретикулоэндотелиальных клетках печени, селезенки, лимфатических узлов и макрофагах инфицированного организма. Паразиты имеют округлую фюрму (2—5 мкм), без жгутиков, при окраске по Романовскому—Гимзе цитоплазма приобретает серовато-голубой цвет, а ядро — красновато-фиолетовый.
К лабораторному заражению лейшманиями восприимчивы белые мыши, хомяки и обезьяны.
Эпидемиология. Заболевания распространены в странах с теплым и тропическим климатом. Механизм передачи возбудителей трансмиссивный, через укус переносчиков — москитов.
Основными источниками возбудителей при кожном антропо- нозном лейшманиозе являются человек и собаки; при кожном зоонозном лейшманиозе — песчанки и другие грызуны; при висцеральных лейшманиозах — люди (при индийском висцеральном лейшманиозе) или собаки, шакалы, лисы (при средиземноморском висцеральном лейшманиозе).
Патогенез и клиника. Различают два возбудителя кожного лейшманиоза: L. tropica minor — возбудитель антро- понозного лейшманиоза (городского типа) и L. tropica major — возбудитель зоонозного кожного лейшманиоза (сельского типа).
При антропонозном кожном лейшманиозе инкубационный период составляет несколько месяцев. На месте укуса москита появляется бугорок, который увеличивается и через 3—4 мес изъязвляется. Язвы чаще располагаются на лице и верхних конечностях. Зоонозный кожный лейшманиоз протекает более остро. Инкубационный период составляет 2—4 нед. Язвы чаще локализуются на нижних конечностях.
L. braziliensis вызывает кожно-слизистый лейшманиоз, характеризующийся гранулематозными и язвенным поражением кожи носа и слизистых оболочек рта и гортани. Встречается в основном в Южной Америке.
Индийский висцеральный лейшманиоз (син.: кала-азар, черная болезнь) вызывается L. donovani. Инкубационный период составляет 6—8 мес. Поражаются печень, селезенка, лимфатические узлы, костный мозг и пищеварительный тракт. Кожа темнеет. При средиземноморском висцеральном лейшманиозе (возбудитель L. donovani infantum) наблюдается сходная клиническая картина, кроме изменений со стороны кожи, которая бледнеет.
Иммунитет. У переболевших остается стойкий, пожизненный иммунитет.
Микробиологическая диагностика. В исследуемом материале (мазки из бугорков, содержимого язв, окрашенных по Романовскому — Гимзе) обнаруживают мелкие овальные лейшмании. Делают также посевы на питательные среды для выделения чистой культуры возбудителя.
Лечение. Для лечения висцерального лейшманиоза применяют препараты сурьмы (солюсурмин, неостибозан и др.) и ароматические диамидины (стильбамидин, пентамидин). При кожном лейшманиозе используют акрихин, препараты сулемы, амфотерицин В и др.
Профилактика. Для профилактики лейшманиозов уничтожают больных собак, грызунов и москитов. Иммунопрофилактику кожного лейшманиоза осуществляют прививкой живой культурой L. tropica major.Для человека патогенны Tripanosoma gambiense и Tripanosoma rhodesieme, вызывающие африканский трипаносомоз (сонную болезнь), и Tripanosoma cruzi — возбудитель американского трипаносомоза (болезнь Шагаса). Таксономическое положение на уровне высших таксонов такое же, как и у лейшманий. Три- паносомы имеют продолговатое узкое тело со жгутиком и ундулирующей мембраной. Переносчиком африканского трипаносомоза служат мухи цеце, а болезни Шагаса — триатомовые клопы. Болезнь характеризуется длительной лихорадкой, поражением центральной нервной системы, летальным исходом. Основные меры профилактики сводятся к уничтожению переносчиков. В нашей стране выявляются только завозные случаи трипаносомозов.
