
- •Глава 1. Предмет и задачи медицинской микробиологии и иммунологии
- •Мир микробов. Общие сведения
- •Микробиология — наука о микробах
- •Иммунология — наука об иммунитете
- •Связь микробиологии с иммунологией
- •История развития микробиологии и иммуно тогии
- •Isbn 5-225-04208-2 © Издательство «Медицина»,
- •Глава 1. Предмет и задачи медицинской микробиологии и иммунологии
- •Мир микробов. Общие сведения
- •Микробиология — наука о микробах
- •Связь микробиологии с иммунологией
- •История развития микробиологии и иммуно тогии
- •Глава 2. Классификация и морфология микробов
- •Систематика и номенклатура микробов
- •Классификация и морфология бактерий
- •Строение и классификация простейших
- •Основные методы изучения морфологии микробов
- •Глава 3. Физиология микробов
- •Физиология бактерий
- •Рост и размножение бактерий
- •Особенности физиологии грибов и простейших
- •Глава 4. Экология микробов
- •Распространение микробов в окружающей среде
- •Микрофлора почвы
- •4 1.2. Микрофлора воды
- •Микрофлора продуктов питания
- •Действие излучения
- •Действие химических веществ
- •Действие биологических факторов
- •Уничтожение микробов в окружающей среде
- •Стерилизация
- •Дезинфекция
- •Асептика и антисептика
- •Санитарная микробиология
- •Микробиологический контроль лекарственных средств
- •Глава 5. Генетика микробов
- •5‘ Конец
- •Фосфат fc-q
- •Особенности генетики вирусов
- •4. Применение генетических методов в диагностике инфекционных болезней
- •Метод молекулярной гибридизации
- •Глава 6. Биотехнология. Генная инженерия
- •Предмет и задачи биотехнологии
- •3. Объекты и процессы в биотехнологии
- •Генетическая инженерия в биотехнологии
- •Глава 7. Противомикробные препараты
- •Химиотерапевтические лекарства
- •Глава 8. Учение об инфекции
- •Понятие об инфекционной болезни
- •Участники инфекционного процесса
- •Стадии инфекционного процесса и его уровни
- •Патогенные и условно-патогенные микробы
- •Роль окружающей среды
- •Характерные особенности инфекционных болезней
- •8 7. Формы инфекционного процесса
- •Глава 9. Учение об иммунитете
- •Виды иммунитета
- •Созревание, размножение, дифферениировка
- •Патология иммунной системы
- •Реакции антиген — антитело и их практическое применение
- •Реакция преципитации
- •Реакция с использованием меченых антител или антигенов
- •Глава 10. Иммунопрофилактика и иммунотерапия болезней человека
- •Вакцины
- •Убитые вакцины
- •Лекарственные формы вакцин
- •Массовые способы вакцинации
- •10.2.7. Производство вакцин и их контроль
- •Бактериофаги
- •Эубиотики
- •Диагностические препараты
- •Классификация микробов по степени их биологической опасности. Номенклатура микробиологических лабораторий
- •112. Санитарно-техническое оснащение лаборатории
- •Правила работы в микробиологической лаборатории
- •Принципы микробиологической диагностики инфекционных болезней
- •11.S. Принципы иммунологической диагностики болезней человека
- •Глава 12. Возбудители кишечных инфекций
- •Возбудители бактериальных кишечных инфекций
- •Возбудители эшерихиозов
- •Возбудители дизентерии
- •Возбудители брюшного тифа и паратифов
- •Возбудители кишечного иерсиниоза и псевдотуберкулеза
- •1.7. Возбудители бруцеллеза
- •Возбудитель хеликобактериоза
- •Возбудители лептоспироза
- •Вирусы энтеральных гепатитов
- •Возбудитель лямблиоза
- •Глава 13 возбудители респираторных инфекционных болезней
- •Возбудители вирусных респираторных инфекций
- •Вирусы гриппа
- •2.2. Вирусы — возбудители других острых респираторных вирусных инфекций
- •Вирус эпидемического паротита
- •Вирус краснухи
- •Вирус оспы обезьян
- •Вирус ветряной оспы и опоясывающего герпеса
- •Глава 14. Возбудители кровяных инфекционных болезней
- •Возбудители бактериальных кровяных инфекций
- •Возбудитель туляремии
- •Возбудители риккетсиозов
- •Глава 15. Возбудители инфекционных болезней наружных покровов
- •Возбудители грибковых инф кций
- •Глава 16. Общие черты зоонозных инфекций
- •Глава 17. Онкогенные вирусы
- •Глава 18. Медленные вирусные инфекции
- •9Теории 210
Рис.
9.5. Межклеточная кооперация в индукции
гуморального иммунного ответа
(схема).
АГ—
антиген; Ф — фагоцит; Тх
— Т хелпер; В
— 5-лимфоцит; Г-Н— Г-П- антиген
гистосовместимости II класса (HLA-DR,
la),
РТ
— рецептор Г хелпера для HLA-DR,
АР — антигенспецифический рецептор
5-лимфоцита.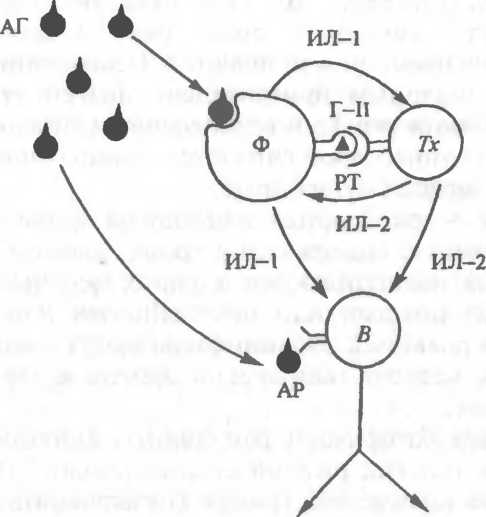
Созревание, размножение, дифферениировка
помощи особого рецептора чужеродное вещество в составе антигена гистосовместимости II класса и выделяет в окружающую среду ИЛ 2. Оказавшийся рядом 5-лимфоцит, специфичный к данному антигену, связывается с ним при помощи соответствующего рецептора. Сигнал, полученный от антигенсвязывающего рецептора, и стимуляция интерлейкинами (ИЛ-1 — от фагоцита и ИЛ-2 — от Т-хелпера) «включают» в 5-лимфоцитах проли- феративные и дифференцировочные процессы. Клетка созревает, размножается и дифференцируется, в результате чего образуется клон высокоактивных лимфоцитов, синтезирующих антитела, специфичные к данному антигену.
Таким образом, для активации 5-клеточного иммунного ответа необходим тройной сигнал: от антигенспецифичного рецептора, фагоцита и Г-хелпера. Отсутствие хотя бы одного из стимулов (нарушение межклеточной кооперации, неспецифичность рецептора 5-лимфоцита или элиминация антигена) блокирует развитие иммунного ответа.
Активация Г-киллера (Г-клеточный иммунный ответ) происходит по той же схеме. Отличие заключается в том, что мишенью для 7-киллера служит цельная клетка, а не отдельные молекулы антигена.Антиген — это полимер органической природы, генетически чужеродный для макроорганизма, при попадании в последний вызывающий иммунные реакции, направленные на его устранение.
Теоретически антигеном может быть молекула любого органического вещества, как вредного, так и безвредного для макроорганизма. В частности, антигенами являются компоненты и продукты жизнедеятельности бактерий, грибов, простейших, вирусных частиц, животных и растений.
Антигены имеют самое разнообразное происхождение. Они могут образовываться в процессе природного биологического синтеза в любом чужом организме или клетке. Иногда антигены могут появляться в собственном организме при структурных изменениях уже синтезированных нормальных молекул (эпигенетическая мутация) или при генетической мутации клеток. Кроме того, антигены могут быть получены искусственно в результате научной или производственной деятельности человека, в том числе направленного химического синтеза. Однако в любом случае молекулу антигена будет отличать генетическая чужеродность по отношению к макроорганизму, в который она попала.
Антигены могут попадать в макроорганизм самыми разнообразными путями: через кожные покровы или слизистые оболочки, непосредственно во внутреннюю среду минуя покровы или образовываясь внутри организма. Антигены распознаются имму- нокомпетентными клетками и вызывают разнообразные иммунные реакции, направленные на их инактивацию, разрушение и удаление.
Свойства антигенов
Характерными свойствами антигенов являются антигенность, специфичность и иммуногенность. Под антигенностью понимают потенциальную способность молекулы антигена к специфическому взаимодействию с факторами иммунной системы (антитела, клон лимфоцитов). При этом взаимодеиствие происходит не со всей молекулой одновременно, а только с ее небольшим участком, который получил название «антигенная детерминанта», или «эпитоп». Размер антигенной детерминанты невелик — всего 5—6 аминокислотных (для белков) или липо- сахаридных (для ЛПС) остатков. Замена хотя бы одного аминокислотного остатка или другого структурного компонента молекулы приводит к образованию принципиально новой антигенной детерминанты с иными свойствами.
Различают линейные, или секвенциальные, антигенные детерминанты (например, первичная аминокислотная последовательность пептидной цепи) и поверхностные, или конформационные (расположенные на поверхности молекулы антигена и возникшие в результате вторичной, третичной или четвертичной конформации). Кроме того, существуют концевые (расположенные на концевых участках молекулы антигена) и центральные эпитопы Определяют также «глубинные», или скрытые, антигенные детерминанты, которые проявляются при разрушении биополимера. Денатурация приводит к полной или частичной потере антигенных детерминант или появлению новых, при этом теряется специфичность антигена.
Поскольку молекулы большинства антигенов имеют довольно большие размеры, в их структуре определяется множество антигенных детерминант, которые распознаются разными по специфичности антителами и клонами лимфоцитов. Поэтому антигенность вещества зависит от наличия и числа антигенных детерминант в структуре его молекулы.
Специфичностью называют способность антигена избирательно реагировать со строго определенными антителами или клонами лимфоцитов. Это свойство также зависит от наличия в структуре молекулы вещества тех или иных антигенных детерминант.
Иммуногенность — свойство антигена вызывать в макроорганизме иммунный ответ. Степень иммуногенности зависит от ряда факторов, которые можно объединить в 3 группы.
Первая группа. К ней относятся свойства самого антигена: чужеродность, природа, химический состав, молекулярная масса, структура и др.
Чужеродность является обязательным условием для реализации иммуногенных свойств. Иммунная система невосприимчива к собственным биополимерам. Антигены, возникающие внутри макроорганизма, должны обязательно восприниматься как чужеродные. Если на какой-либо биополимер в макроорганизме возникла реакция, то соответственно он приобрел черты чуже- родности и перестал восприниматься иммунной системой как «свой» (см раздел 9.5.2).
Чем дальше в филогенетическом развитии организмы отстоят друг от друга, тем большей иммуногенностью обладают их антигены по отношению друг к другу. Это свойство используют биологи и палеонтологи (при изучении филогенеза, уточнении классификации и тд.), судебно-медицинские эксперты и криминалисты (установление кровного родства, принадлежности улик, фальсификации пищевых продуктов и т.д.).
Вместе с тем антигенные детерминанты генетически неродственных животных или структурно различных биополимеров могут иметь определенное подобие. В этом случае их антигены оказываются способными специфически взаимодействовать с одними и теми же факторами иммунитета. Такие антигены получили название перекрестно реагирующих. Указанное явление характерно, например, для альбуминов, коллагенов, миоглоби- нов различных видов животных. Обнаружено также сходство антигенных детерминант стрептококка, сарколеммы миокарда и базальной мембраны почек, Treponema pallidum и липидной вытяжки из миокарда крупного рогатого скота, возбудителя чумы и эритроцитов человека 0(1) группы крови. Явление, когда один микроб маскируется антигенами другого микроба или макроорганизма для защиты от факторов иммунитета, называется антигенной мимикрией.
Иммуногенность в значительной степени зависит от природы антигена. Известно, что наиболее выраженными иммуногенны- ми свойствами обладают белки. Чистые полисахариды, нуклеиновые кислоты и липиды, напротив, слабоиммуногенны. В то же время ЛПС, гликопротеины, липопротеины способны в достаточной мере активировать иммунную систему.
Определенное влияние на иммуногенность оказывает химический состав молекулы антигена. Так, большое значение для иммуногенности белков имеет наличие в их молекуле остатков ароматических аминокислот (тирозина, триптофана) и левовращающих изомеров. Полипептиды, построенные из D-аминокис- лот, практически лишены иммуногенности. Отмечено также, что сополимеры нескольких аминокислот более иммуногенны, чем одной.
Большое значение имеет относительная молекулярная масса антигена. Несмотря на то что белки хорошо стимулируют иммунную систему в ответ на свое введение, небольшие полипеп- тидные молекулы с массой менее 5000, как правило, неимму- ногенны. Практически не проявляет иммуногенности декстран, который используют в клинике для трансфузионной терапии — его масса составляет около 75 ООО. В то же время полисахарид с молекулярной массой 600 000 достаточно хорошо индуцирует в организме человека иммунную реакцию. Примечательно, что на нуклеиновые кислоты описанные закономерности практически не распространяются.
На иммуногенность также влияет структура антигена. Большей иммуногенностью обладают агрегаты молекул и корпускулярные антигены — целые клетки (эритроциты, бактерии и др.). Это связано с тем, что корпускулярные и высокоагрегирован- ные антигены лучше фагоцитируются, чем отдельные молекулы. При равной молекулярной массе (около 70 000) альбумин является более сильным антигеном, чем гемоглобин. Фибриллярный белок коллаген, имеющий большую молекулярную массу (около 330 000), обладает значительно меньшей иммуногенно- стью по сравнению с таким глобулярным белком, как альбумин, масса которого почти в 5 раз меньше. При денатурации коллагена до желатина практически полностью исчезает иммуногенность, что обусловлено потерей пространственной устойчивости молекулы.
Важным условием иммуногенности является растворимость антигена. Например, такие высокомолекулярные белки, как кератин и меланин, не могут быть получены в виде коллоидного раствора в нормальном состоянии, и они не являются антигенами
Вторая группа. К этой группе факторов относят динамику поступления антигена в организм и его выведения. Так, хорошо известна зависимость иммуногенности антигена от способа его введения Это свойство обязательно учитывают при вакцинации или иммунизации. Например, вакцину против полиомиелита вводят перорально, против сибирской язвы — накожно, БЦЖ — внутрикожно, АКДС — подкожно, против столбняка — внут- римь шечно.
На иммунный ответ влияет количество поступающего антигена: чем его больше, тем более выражен иммунный ответ. Однако передозировка антигена вызывает обратную реакцию — иммунологическую толерантность (см. раздел 9.6.6). Между количеством антигена и силой иммунного ответа в определенном интервале доз существует логарифмическая зависимость, выражаемая уравнением антигенности (ААВоробьев, А.В.Маркович):
lgH= а + р х IgD,
где аир — коэффициенты, характеризующие соответственно природу антигена и иммунореактивность макроорганизма, // — сила иммунного ответа, D — количество антигена.
Чувствительность к катаболическому разрушению ферментами макроорганизма также определяет степень иммуногенности Так, белки, построенные из L-аминокислот, легко поддаются ферментативной деградации и высокоиммуногенны. Полипептид- ная цепочка, построенная из правовращающих изомеров аминокислот, напротив, медленно расщепляется ферментами макроорганизма. Такие полипептиды могут проявлять ограниченную иммуногенность при введении в очень низких дозах, так как высокие дозы быстро приводят к развитию иммунологической толерантности.
Третья группа. Иммуногенность антигена зависит от состояния макроорганизма. Хорошо известно, что результат иммунизации в определенной мере связан с генотипом особи. Существуют чувствительные и нечувствительные роды и виды животных, которых используют в лабораторной работе. Например, кролики и крысы практически не реагируют на некоторые бактериальные антигены, которые могут вызывать у морской свинки или мыши чрезвычайно бурный иммунный ответ. Установлено, что даже внутри вида можно выделить группы близкородственных особей (например, инбредные линии животных), которые по-разному будут отвечать на вводимый антиген. Известны значительные (в десятки и сотни раз) индивидуальные различия между людьми в чувствительности к вакцинам: выделяют иммунологически реактивных и иммунологически инертных индивидуумов.
Немаловажное значение имеет также функциональное состояние макроорганизма (психоэмоциональный и гормональный фон, интенсивность обменных процессов и др.). Функциональное состояние обусловливает различную чувствительность к одному и тому же антигену у одного и того же индивидуума в разные периоды развития.
Иммуногенностью антигена можно управлять, воздействуя на перечисленные выше факторы. Существует группа веществ, называемых адъювантами (см. раздел 10.2.2.2), которые способны неспецифически усиливать это свойство антигена. Такой эффект широко используют при вакцинации и в научно-исследовательской работе.
Классификация антигенов
На основании отдельных характерных свойств антигены могут быть подразделены на несколько классификационных групп.
По происхождению', экзогенные (возникшие вне организма) и эндогенные (возникшие внутри организма).
По природе: биополимеры белковой (протеины) и небелковой природы (полисахариды, липиды, ЛПС, нуклеиновые кислоты и др.).
По структуре: глобулярные (молекула имеет шаровидную форму) и фибриллярные (молекула имеет форму нити).
По необходимости участия Т лимфоцитов в индукции иммунного ответа: 7-зависимые и 7-независимые. Иммунная реакция в ответ на введение 7 зависимого антигена реализуется при обязательном участии 7 лимфоцитов (Т-хел- перов). К 7-зависимым относится большая часть известных антигенов. Для развития иммунного ответа на 7-независимые антигены не требуется привлечения 7 хелперов. Эти антигены непосредственно стимулируют В лимфоциты к антителопродукции, дифференцировке и пролиферации. 7- независимые антигены имеют относительно простое строение — монотонно повторяющиеся последовательности с многочисленными однотипными эпитопами. В качестве
примера можно привести полимерную форму флагеллина (сократительный белок жгутиков бактерий), ЛПС, сополимеры /)-аминокислот и др. Такие молекулы в последнее время получили название суперантигенов.
По иммуногенности: полноценные и неполноценные. Полноценные антигены обладают выраженной антигенностью и иммуногенностью — иммунная система чувствительного организма реагирует на их введение выработкой факторов иммунитета. Такие вещества, как правило, имеют достаточно большую молекулярную массу (более 10 ООО), большой размер молекулы (частицы) в виде глобулы и хорошо взаимодействуют с факторами иммунитета.
Неполноценные антигены (или гаптены), напротив, не способны при введении в нормальных условиях индуцировать в организме иммунный ответ, так как обладают крайне низкой иммуногенностью. Однако свойство антигенности они не утратили, что позволяет им специфически взаимодействовать с уже готовыми факторами иммунитета (антителами, лимфоцитами). Чаще всего гаптенами являются низкомолекулярные соединения (молекулярная масса меньше 10 ООО).
При определенных условиях иммунную систему макроорганизма удается заставить специфически реагировать на гаптен как на полноценный антиген и вырабатывать факторы иммунитета. Для этого необходимо искусственно укрупнить молекулу гап- тена — соединить ее прочной связью с достаточно большой белковой молекулой. Молекула белка-носителя получила название «шлеппер» (в переводе — тягач). Синтезированный таким образом полноценный антиген при введении в организм будет вызывать выработку антител или клона лимфоцитов, специфичных к гаптенной части. Так получают антитела к гормонам, лекарственным препаратам и другим низкоиммуногенным соединениям. Созданные на основе антител к низкомолекулярным веществам диагностикумы, диагностические наборы и иммуносорбенты позволили значительно расширить возможности и повысить эффективность лабораторной диагностики, фармакотерапии и синтеза особо чистых биоорганических соединений.
По степени чужеродности: ксено-, алло- и изоантигены.
Ксеногенные антигены (или гетерологичные) — общие для организмов, стоящих на разных ступенях биологической классификации, например, относящихся к разным родам и видам. Впервые феномен общности ряда антигенов был отмечен Д.Фор- сманом (1911). Ученый иммунизировал кролика суспензией органов морской свинки. Оказалось, что полученная в ходе эксперимента иммунная сыворотка была способна не только взаимодействовать с антигенами морской свинки, но и агглютинировать эритроциты барана. Позже было установлено, что морская свинка и баран имеют ряд структурно сходных антигенных детерминант, дающих перекрестное реагирование. В дальнейшем перечень подобных ксеногенных антигенов был расширен десятками и сотнями пар, которые формировали между собой антигены как теплокровных, так и холоднокровных животных, растений и микробов. Все эти антигены получили обобщенное название «антигены Форемана». Исследование гетероантигенов широко применяется в судебно-медицинской экспертизе, палеонтологии и других областях медицины и естествознания.
Аллогенные антигены (или групповые) — антигены, общие для генетически не родственных организмов, но относящихся к одному виду. По аллоантигенам из общей популяции можно выделить отдельные группы организмов. Примером таких антигенов у людей являются антигены групп крови (системы А ВО и др.), раковоэмбриональные антигены (а-фетопротеин, транс- феррин) и многие другие. Аллогенные ткани при трансплантации иммунологически несовместимы — они отторгаются макроорганизмом. Микробы на основании групповых антигенов могут быть подразделены на серогруппы. Это имеет большое значение для микробиологической диагностики и эпидемиологического прогнозирования.
Изогенные антигены (или индивидуальные) — антигены, общие только для генетически идентичных организмов, например для однояйцовых близнецов, животных инбредных линий. Изотрансплантаты обладают практически полной иммунологической совместимостью и не отторгаются при пересадке. Примером таких антигенов в популяции людей являются антигены гистосовместимости, а у бактерий — типовые антигены, не дающие дальнейшего расщепления.
Классификация антигенов человека и животных может иметь и более глубокую дифференцировку. Так, внутри изоантигенов различают органа- и тканеспецифические антигены. Они характерны для строго определенных анатомо-морфологических образований и нигде в пределах целого организма больше не встречаются.
Аутогенные антигены (аутоантигены) — антигены собственного организма. В нормальных условиях они не вызывают реакции иммунной системы вследствие либо иммунологической толерантности (невосприимчивости), либо недоступности для контакта с факторами иммунитета — это так называемые за- барьерные антигены. При срыве толерантности или нарушении целостности биологических барьеров (наиболее частая причина — травма) компоненты иммунной системы начинают специфически реагировать на аутоантигены выработкой специфических факторов иммунитета (аутоантитела, клон аутореактивных лимфоцитов — см. раздел 9.10).
Антигены организма человека
С позиций клинической медицины наиболее интересны и важны индивидуально специфические (изогенные) и группоспецифические (аллогенные) антигены. Начало изучению аллоанти- генных свойств тканей было положено открытием системы групповых антигенов эритроцитов К.Ландштайнером в 1901 г. (система АВО). На сегодняшний день известно более 250 различных эритроцитарных антигенов.
Однако наиболее важное клиническое значение имеют антигены системы АВО и Rh (резус-фактор): при проведении гемотрансфузионной терапии, пересадке органов и тканей, для предупреждения и лечения осложнений беременности и т.д.
Антигены системы АВО располагаются на наружной мембране всех клеток крови и тканей человека, но наиболее выражены на эритроцитах. Кроме того, у большинства людей (80 %) эти антигены содержатся в плазме крови, лимфе, секретах слизистых оболочек и других биологических жидкостях. Антигены системы АВО синтезируются предшественниками эритроцитов и многими другими клетками организма. Они свободно секрети- руются в межклеточное пространство, поэтому могут появиться на мембране клетки либо как продукт клеточного биосинтеза, либо в результате сорбции из межклеточных жидкостей.
Антигены системы АВО представляют собой высокогликози- лированные пептиды: 85 % приходится на углеводную часть и 15 % — на полипептидную. Пептидный компонент состоит из 15 аминокислотных остатков. Он постоянен для всех групп крови АВО. Иммуногенность этого гликопептида определяется его углеводной частью.
В системе антигенов АВО выделяют 3 варианта антигенов, различающихся по строению углеводной части — Н, А и В. Базовой молекулой является антиген Я, специфичность которого обусловливают 3 углеводных остатка. Антиген А имеет в структуре дополнительный, четвертый, углеводный остаток — TV-ацетил-/)-галактозу, а антиген В — /)-галактозу.
Антигены системы АВО наследуются независимо аллельно, что определяет наличие в популяции 4 групп крови: 0(1), /1(11), 5(111) и /15(IV). Кроме того, следует отметить, что антигены А и В имеют несколько аллотипов (например, Ап АТ А3... или Вр Вт Вг..), которые встречаются в популяции людей с различной частотой. Переливание пациенту несовместимой по группе крови, как правило, приводит к развитию острого состояния — гемолитического шока.
Второй важнейшей системой эритроцитарных антигенов является система резус (Rh). Эти антигены синтезируются предшественниками эритроцитов и обнаруживаются главным образом на эритроцитах, так как они нерастворимы в биологических жидкостях. По химической структуре резус-антиген представляет собой термолабильный липопротеин. Выделяют 6 разновидностей этого антигена. Генетическая информация о строении резус-антигена находится в многочисленных аллелях 3 сцепленных между собой локусов (D/d, С/с, Е/е).
В зависимости от наличия или отсутствия резус- антигена в популяции людей различают две группы — резус-положительных и резус-отрицательных индивидуумов.
Совпадение по резус-антигену важно не только при переливании крови, но также для течения и исхода беременности. При беременности резус-отрицательной матери резус-положительным плодом может развиться резус-конфликт, который проявляется выработкой антирезусных антител и невынашиванием беременности или желтухой новорожденного (внутрисосудистый иммунный лизис).
Помимо указанных выше, на цитоплазматических мембранах клеток организма находятся антигены гистосовместимости. У человека эти антигены обозначают HLA (от англ. аббревиатуры Human Leukocyte Antigen — антигены лейкоцитов человека). HLA играют важную роль в развитии иммунного ответа, отторжении трансплантата и других реакциях. По химической природе эти антигены представляю! собой гликопротеины, которые прочно связаны с клеточной мембраной.
В зависимости от строения и функции HLA подразделяют на два класса. Молекулы I класса состоят из двух нековалентно связанных полипептидных цепей с разной молекулярной массой: тяжелой a-цепи и легкой p-цепи (это р2-микроглобулин). HLA I класса находятся на мембранах всех клеток организма за исключением эритроцитов. У человека их биосинтез контролируется генами, картированными в 3 сублокусах хромосомы 6 — HLA-A, HLA-В и HLA-C, которые наследуются и проявляются независимо. В настоящее время различают более 100 вариантов этих антигенов гистосовместимости. Типирование индивидуума по HLA I класса производят серологически, в реакции микро- лимфоцитолиза со специфическими антисыворотками.
Благодаря независимому наследованию генов сублокусов в популяции формируется бесконечное множество неповторяющихся комбинаций HLA 1 класса. Поэтому каждый человек строго уникален по набору антигенов гистосовместимости, исключение составляют только однояйцовые близнецы, которые абсолютно похожи по набору генов. Основная биологическая роль HLA
I класса состоит в том, что они обусловливают биологическую индивидуальность («биологический паспорт») и являются маркерами «своего» для иммунокомпетентных клеток (Т-хелперы, Т- киллеры). Клетки, отличающиеся по HLA I класса, уничтожаются как чужеродные. При заражении клетки вирусом или возникновении мутации изменяется структура HLA I класса. Это служит ориентиром для 7-киллеров и сигналом к уничтожению ставших «чужеродными» клеток.
HLA II класса имеют более сложное строение. Они состоят из двух примерно одинаковых по молекулярной массе полипеп- тидных цепей, прочно связанных с цитоплазматической мембраной клетки. Эти антигены обнаруживаются на клеточной мембране антигенпредставляющих клеток: фагоцитов, 5-лимфоцитов и др. Они участвуют в представлении чужеродного антигена иммунокомпетентным клеткам для их специфического распознавания. В состав HLA II класса входят HLA-DR, DP и DQ, генетическая информация о которых расположена также в хромосоме 6. Семейство этих антигенов тоже достаточно многочисленно. Наличие и тип HLA II класса определяют в серологических (например, в микролимфоцитотоксическом тесте) и клеточных реакциях иммунитета. У животных (мыши) антиген гистосовместимости II класса назван /д-антигеном.
9 5.2.2. Опухолевые антигены
Злокачественное перерождение нормальной клетки сформированного макроорганизма сопровождается началом биосинтеза особых белков, которые встречаются лишь в эмбриональном периоде развития. Такие белки получили название опухолевых, или раково-эмбриональных антигенов. Лабораторное определение этих антигенов имеет большое клиническое значение для ранней диагностики некоторых новообразований, в частности первичного рака печени.
Антигены микробов
В структуре микробов определяются несколько типов антигенов. Антигены бактерий, вирусов, грибов и простейших имеют принципиальные различия.
Микробные антигены могут быть и общими для отдельных систематических категорий. Так, существуют антигены, характерные для целых семейств, родов и видов. Внутри видов могут быть выделены серогруппы и серологические варианты (серова- ры). Антигены микробов используют для получения вакцин и сывороток, необходимых для диагностики, профилактики и лечения.
Рис.
9.6. Антигены бактерий. Объяснение в
тексте.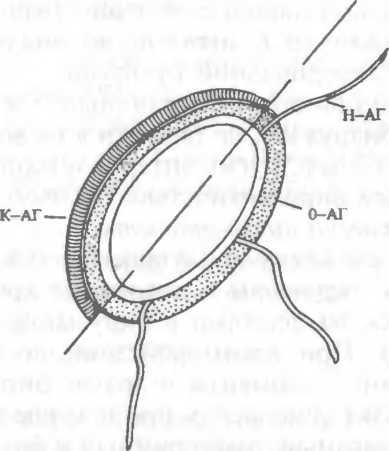
Антигены бактерий. В структуре бактериальной клетки различают жгутиковые, соматические, капсульные и некоторые другие антигены (рис. 9.6). Жгутиковые, или Н-антигены, локализуются в локомоторном аппарате бактерий — в жгутиках. Последние представляют собой сократительный белок флагеллин. При нагревании Н антигены денатурируют и теряют свою специфичность. Фенол не действует на эти антигены.
Соматический, или О-антиген, связан с клеточной стенкой бактерий. Его основу составляют липополисахариды. О-антиген проявляет термостабильные свойства он не разрушается при длительном кипячении. Однако соматический антиген подвержен действию альдегидов (например, формалина) и спиртов, которые нарушают его структуру.
Если иммунизировать животное живыми бактериями, имеющими жгутики, то будут вырабатываться антитела, направленные одновременно против О- и Я-антигенов. Введение животному прокипяченной культуры стимулирует биосинтез антител к соматическому антигену. Культура бактерий, обработанная фенолом, вызовет образование антител к жгутиковым антигенам.
Капсульные, или К-антигены, располагаются на поверхности клеточной стенки, встречаются у бактерий, образующих капсулу. Как правило, К антигены состоят из кислых полисахаридов (уроновые кислоты). В то же время у бациллы сибирской язвы этот антиген построен из полипептидных цепей. По чувствительности к нагреванию различают 3 типа А^-антигена: А, В и L. Наибольшая термостабильность характерна для группы А. Они не денатурируют даже при длительном кипячении. Группа В выдерживает непродолжительное нагревание (около 1 ч) до 60 °С, группа L быстро разрушается при этой температуре. В связи с этим частичное удаление Л'-антигена возможно путем длительного кипячения бактериальной культуры.
Вариантом капсульного антигена является И’-антиген. Этот антиген можно обнаружить на поверхности возбудителя брюшного тифа и некоторых других энтеробактерий, которые обладают очень высокой вирулентностью. Поэтому И-антиген получил название антигена вирулентности.
Антигенными свойствами обладают также бактериальные белковые токсины, ферменты и некоторые другие белки, которые секретируются бактериями в окружающую среду (например, туберкулин). При взаимодействии со специфическими антителами токсины, ферменты и другие биологически активные молекулы бактериального происхождения теряют свою активность. Столбнячный, дифтерийный и ботулинический токсины относятся к числу сильных полноценных антигенов, поэтому их используют для получения анатоксинов для вакцинации людей.
В антигенном составе некоторых бактерий выделяется группа антигенов с сильно выраженной иммуногенностью. Наличие такой группы может полностью обеспечивать иммунитет макроорганизма ко всему инфекционному агенту. Эти антигены названы протективными. Впервые протективный антиген был обнаружен в гнойном отделяемом карбункула, вызванного бациллой сибирской язвы.
Антигены вирусов. В структуре вирусной частицы различают несколько групп антигенов: ядерные (или коровые), капсидные (или оболочечные) и суперкапсидные. На поверхности некоторых вирусных частиц встречаются особые ^-антигены — гемаг- глютинин и фермент нейраминидаза. Антигены вирусов различаются по происхождению. Часть из них — вирусспецифические антигены. Информация об их строении картирована в нуклеиновой кислоте вируса. Другие являются компонентами клетки хозяина (углеводы, липиды), они захватываются во внешнюю оболочку вируса при его «рождении» путем почкования.
Антигенный состав вириона зависит от его строения. Антигенная специфичность просто организованных вирусов связана с рибо- и дезоксирибонуклеопротеидами. Эти вещества хорошо растворяются в воде и поэтому обозначаются как ^-антигены (от лат. solutio — раствор). У сложно организованных вирусов часть антигена связана с нуклеокапсидом, а другая локализуется во внешней оболочке — суперкапсиде.
Антигены многих вирусов отличаются высокой степенью изменчивости. Это связано с мутациями, которые происходят в генетическом аппарате вирусной частицы. Примером могут служить вирус гриппа, ВИЧ.9-5.3. Процессы, происходящие с антигеном в макроорганизме
Как уже говорилось ранее, антиген оказывается в макроорганизме в результате двух процессов. Они могут появляться внутри самого макроорганизма (эндогенное происхождение) или поступать извне (экзогенное происхождение).
Существуют разнообразные пути проникновения антигена в макроорганизм:
через дефекты кожных покровов и слизистых оболочек (как результат ранений, микротравм, укусов насекомых, расчесов и др.);
путем всасывания в ЖКТ (эндоцитоз эпителиальными клетками);
межклеточно (при незавершенном фагоцитозе, облигатном или факультативном внутриклеточном паразитировании микроб может разноситься по всему организму);
чресклеточно (так распространяются облигатные внутриклеточные паразиты, например вирусы).
Проникнув в организм тем или иным путем, антиген разносится лимфой и кровью по различным органам и тканям. Чаще всего он накапливается в лимфоидной ткани печени, селезенки, легких и других органов, где и вызывает иммунологические реакции. Процесс проникновения антигена и его контакт с иммунной системой протекают поэтапно и имеют свою динамику во времени.
На каждом этапе появления и распространения в макроорганизме антиген сталкивается с мощным противодействием развитой сети разнообразных факторов иммунитета. Ответная реакция этих факторов заключается в инактивации и удалении (элиминации) антигена из макроорганизма. Это достигается путем:
фильтрации и концентрирования антигена в лимфоидных образованиях;
специфического распознавания «свой—чужой»;
осуществления иммунного реагирования;
выработки факторов регуляции и иммунитета (антитела, клоны лимфоцитов);
связывания и блокирования биологически активных участков молекулы антигена;
разрушения или отторжения антигена;
полной утилизации, изоляции (инкапсуляции) или выведения из макроорганизма остатков антигена.
В итоге достигаются полное или частичное восстановление гомеостаза, формирование иммуннологической памяти, ареак- тивности или гиперергии.
Свою биологическую функцию иммунная система осуществляет с помощью сложного комплекса взаимосвязанных реакций, в которых «задействованы» все ее структурные и функциональные элементы. В зависимости от конкретного проявления весь комплекс иммунного реагирования можно подразделить на отдельные формы. Основными являются антителообразование, иммунный фагоцитоз, опосредованный клетками киллинг, реакции гиперчувствительности, формирование иммунологической памяти и иммунологической толерантности.
Все элементы иммунной системы имеют единый принцип активации и практически одновременно реагируют на изменение гомеостаза. Однако в зависимости от характера антигенного воздействия наблюдается неравномерное стимулирование: одна или несколько форм становятся ведущими, в то время как другие могут практически не проявляться. Например, при токсинеми- ческой инфекции преимущественно активируется продукция антител, так как организму необходимы иммуноглобулины-антитоксины, которые способны нейтрализовать активный центр молекулы токсина. При туберкулезной инфекции, наоборот, антитела практически не имеют значения. В этом случае основную функциональную нагрузку несут факторы клеточного иммунитета (Г-киллеры, фагоциты).
Антитела и антителообразование
Природа и функция антител
Одной из форм реагирования иммунной системы в ответ на внедрение в организм антигена является биосинтез антител, т.е. белков, специфически реагирующих с антигенами. Антитела относятся к у-глобул и новой фракции белков сыворотки крови. На долю у-глобулинов приходится 15—25 % белков сыворотки крови, что составляет примерно 10—20 г/л. Поэтому они получили название иммуноглобулинов, и их обозначают символом Ig. Следовательно, антитела — это иммуноглобулины, вырабатываемые в ответ на введение антигена и способные специфически связываться с антигеном и участвовать во многих иммунологических реакциях. Антитела синтезируются 5-лимфоцитами и их потомками — плазматическими клетками. Антитела, так же как и фагоцитоз, — это одна из наиболее филогенетически древних форм иммунной защиты. Иммуноглобулины можно обнаружить уже у некоторых видов рыб.
Иммуноглобулины существуют в форме циркулирующих антител, рецепторных молекул на иммунокомпетентных клетках и миеломных белков. Циркулирующие антитела подразделяются на сывороточные и секреторные. К антителам могут быть также отнесены белки Бенс-Джонса, которые являются фрагментами молекулы иммуноглобулина (его легкая цепь) и синтезируются в избытке при миеломной болезни.
Строение и функцию антител изучали многие выдающиеся ученые. П.Эрлих (1885) предложил первую теорию гуморального иммунитета. Э.Беринг и С.Китазато (1887) получили первые антитоксические сыворотки к дифтерийному и столбнячному токсинам. А.Безредка (1923) разработал метод безопасного введения пациентам лечебных иммунных сывороток. Большая заслуга в расшифровке строения молекулы иммуноглобулинов принадлежит Д.Эдельману и Р. Портеру (1959), а разгадка многообразия антител — трудам Ф.Бернета (1953) и С.Тонегавы (1983).
Вследствие высокой специфичности и значимости в формировании гуморального иммунитета антитела используют для диагностики, профилактики и лечения соматических и инфекционных болезней. На основе специфических иммуноглобулинов созданы соответствующие иммунобиологические препараты (лечебные и диагностические сыворотки, диагностикумы и др.).
Молекулярное строение антител
Иммуноглобулины являются гликопротеинами. Их молекула состоит из полипептидной цепи, стабилизированной сахаридны- ми остатками. При нагревании выше 60 °С молекула денатурирует. Иммуноглобулины различаются по структуре, антигенному составу, а также по выполняемым ими функциям. По этим свойствам они подразделены на 5 классов: IgG, IgM, IgA, IgE, IgD. Специфически связываясь с антигенными детерминантами, антитела осуществляют маркирование антигена, инактивацию биологически активных молекул (например, токсинов), участвуют в опсонизации антигена, антителоопосредованном лизисе клеток, иммунном фагоцитозе, в развитии реакций гиперчувствительности немедленного типа. Кроме того, антитела выполняют функцию антигенспецифического рецептора на поверхности 5-лимфоцитов.
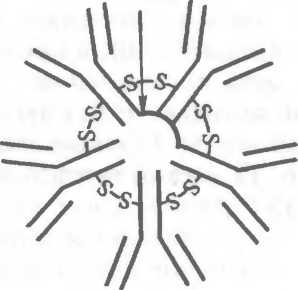
Молекулы иммуноглобулинов различных классов, несмотря на их видимое разнообразие, имеют универсальное строение (рис. 9.7). Если молекулу иммуноглобулина обработать мочевиной, то она распадется на две пары полипептидных цепей: две тяжелые (550—660 аминокислотных остатков, молекулярная масса 50 ООО) и две легкие (220 аминокислотных остатков, молекулярная масса 20 000—25 000). Обозначают их как Я- (от англ. heavy — тяжелый) и L- (от англ. light — легкий) цепи. Тяжелые и легкие цепи связаны между собой попарно дисульфидными связями (-S—S-). Мочевина разрушает дисульфидные мостики.Рис. 9.7. Строение молекулы иммуноглобулина класса G. Объяснение в тексте.
Между тяжелыми цепями также есть дисульфидная связь. Это так называемый «шарнирный» участок. Такой тип связи придает структуре молекулы динамичность: молекула может легко менять свою конформацию в зависимости от окружающих условий и состояния.
Легкие и тяжелые полипептидные цепи молекулы иммуноглобулинов имеют определенные варианты структуры, или типы. Они определяются первичной аминокислотной последовательностью цепей и степенью их гликозилирования. Легкие цепи бывают двух типов — к и X. Известно 5 типов тяжелых цепей: а, у, ц, е и 6, — которые имеют также и внутреннее подразделение. Среди многообразия цепей a-типа выделяют al- и а2-, а ц-цепей — ц1- и ц2-подтипы. Для у-цепи известно 4 подтипа: у 1, у2, уЗ и у4.
Вторичная структура полипептидных цепей молекулы иммуноглобулинов имеет доменное строение: отдельные участки цепи свернуты в глобулы (домены), которые соединены линейными фрагментами. Домены стабилизированы внутренней дисульфид - ной связью. Таких доменов в составе тяжелой цепи бывает 4— 5, а в легкой — 2. Каждый домен состоит примерно из 110 аминокислотных остатков.
Домены различаются по постоянству аминокислотного состава. Выделяют С-домены (от англ. constant — постоянный), с неизменной, или постоянной, структурой полипептиднои цепи и V-домены (от англ. variable — изменчивый), с переменной структурой. В составе легкой цепи есть по одному V- и С-домену
,а в тяжелой — один V- и 3—4 С-домена. Примечательно, что не весь вариабельный домен изменчив по своему аминокислотному составу, а лишь его незначительная часть (гипервариабель- ная область) — на ее долю приходится около 25 % F-домена.
Вариабельные домены легкой и тяжелой цепи совместно образуют участок, который специфически связывается с антигеном. Это антигенсвязывающий центр молекулы иммуноглобулина, или паратоп.
Гипервариабельные области тяжелой и легкой цепи определяют индивидуальные особенности строения антигенсвязывающего центра для каждого клона иммуноглобулинов и многообразие их специфичностей.
Обработка ферментами молекулы иммуноглобулина приводит к ее гидролизу на определенные фрагменты. Так, папаин разрывает молекулу выше шарнирного участка и ведет к образованию 3 фрагментов (см. рис. 9.7). Два из них способны специфически связываться с антигеном. Они состоят из цельной легкой цепи и участка тяжелой цепи (V- и С-домен), и в их структуру входят антигенсвязывающие участки. Эти фрагменты обозначают Fab (перев. с англ. — фрагмент, связывающийся с антигеном). Третий фрагмент, способный образовывать кристаллы, обозначен Fc (перев. с англ. — фрагмент кристаллизующийся). Он ответствен за взаимодействие с первым компонентом комплемента (СУ) и активацию его по классическому пути, за связывание с рецепторами на мембране клеток макроорганизма (/г-рецепторы) и некоторых микробов (например, с белком А стафилококка). Пепсин расщепляет молекулу иммуноглобулина ниже шарнирного участка и приводит к образованию двух фрагментов: Fc и двух сочлененных Fab, или F(ab)r
Помимо описанных выше, в структуре молекул иммуноглобулинов есть дополнительные полипептидные цепи. Так, полимерные молекулы IgM, IgA имеют J-nenmud (от англ. join — соединяю). Он объединяет отдельные мономеры в единое мак- ромолекулярное образование (см. раздел 9.6.1.5).
Молекулы секреторных иммуноглобулинов (в отличие от сывороточных) обладают особым S-пептидом (от англ. secret — секрет). Это так называемый секреторный компонент. Его молекулярная масса составляет 71 ООО, и он является р-глобулином. Секреторный компонент предохраняет антитела в секрете слизистых оболочек от ферментативного расщепления.
Рецепторный иммуноглобулин, который локализуется на цитоплазматической мембране 5-лимфоцитов и плазматических клеток, имеет дополнительный М-пептид (от англ. membrane — мембрана). Благодаря своим гидрофобным свойствам он прочно удерживается в липидном бислое цитоплазматической мембраны и, как якорь, фиксирует рецепторный иммуноглобулин на мембране иммунекомпетентной клетки.
J- и Л/-пептиды присоединяются к молекуле иммуноглобулина в процессе биосинтеза этого белка, ^-пептид синтезируется эпителиальными клетками и является их рецептором для IgA. Присоединение ^-пептида к молекуле IgA происходит при его прохождении через эпителиальную клетку.
Антигенностъ антител
Иммуноглобулин, как и всякий белок, обладает антигенностью и выраженной иммуногенностью. В молекуле иммуноглобулина различают 4 типа антигенных детерминант: видовые, изотопические, аллотипические и идиотипические.
Видовые детерминанты характерны для иммуноглобулинов всех особей данного вида (например, кролика, собаки, человека). Они определяются строением легкой и тяжелой цепей. По этим детерминантам можно идентифицировать видовую принадлежность антител.
Изотипические детерминанты являются групповыми. Они локализуются в тяжелой цепи и служат для дифференцировки семейства иммуноглобулинов на 5 изотипов (классов) и множество подклассов.
Амотипические детерминанты являются индивидуальными, т.е. присущими конкретному организму. Они располагаются в легкой и тяжелой полипептидных цепях. На основании строения аллотипических детерминант можно различать особи внутри одного вида.
Идиотипические детерминанты отражают особенности строения антигенсвязываюшего центра молекулы иммуноглобулина. Они образованы К-доменами легкой и тяжелой цепи молекулы иммуноглобулина. Обнаружение идиотипических антигенных детерминант послужило основанием для создания теории идио- тип-антиидиотипической регуляции биосинтеза антител.
Механизм взаимодействия антитела с антигеном
В процессе взаимодействия с антигеном участвует не вся молекула иммуноглобулина, а лишь ее ограниченный участок — ан- тигенсвязывающий центр, или паратоп, который локализован в /^-фрагменте Антитело взаимодействует не со всей молекулой антигена сразу, а лишь с ее антигенной детерминантой. Антитела отличает специфичность взаимодействия, т.е. способность связываться со строго определенной антигенной детерминантои. Наиболее доступные для взаимодеиствия эпитопы располагаются на поверхности молекулы антигена.
Связь антигена с антителом осуществляется за счет слабых взаимодействий (ван-дер-ваальсовы силы, водородные связи, электростатические взаимодействия) в пределах антигенсвязы- вающего центра. Такая связь отличается неустойчивостью. Образовавшийся иммунный комплекс (ИК) легко диссоциирует на составляющие его компоненты. Поэтому взаимодействие антигена (АГ) и антитела (АТ) можно представить в виде уравнения: [АГ] + [АТ] ^ [ИК]. Данная система существует в состоянии равновесия, которое определяется действием многих факторов. При этом важное значение имеют особенности антител и антигена, а также условия, в которых происходит их взаимодействие.
К особенностям антител следует отнести их аффинность и авидность.
Аффинность — сила специфического взаимодействия антитела с антигеном (или энергия их связи). Эта характеристика зависит от степени стерического (или пространственного) соответствия (комплементарности) структуры антигенсвязывающего центра и антигенной детерминанты. Чем выше их комплементарность, т.е. чем больше они подходят друг другу, тем больше образуется межмолекулярных связей и тем выше будет устойчивость образовавшегося И К. Структурные несоответствия антигенсвязывающего центра и антигенной детерминанты значительно снижают число образующихся связей и прочность взаимодействия антитела с антигеном. Иммунный комплекс, образованный низкоаффинными антителами, чрезвычайно неустойчив, имеет малую продолжительность существования и быстро распадается на исходные компоненты.
Установлено, что в условиях макроорганизма с одной и той же антигенной детерминантой способно одновременно прореагировать и образовать иммунный комплекс около 100 различных клонов антител. Все они будут отличаться структурой антигенсвязывающего центра и, следовательно, аффинностью. Наибольшим аффинитетом обладают моноклональные антитела, которые получают при клонировании гибридом. Наименее аффинными считаются нормальные антитела. Аффинность антител существенно меняется в процессе иммунного ответа в связи с селекцией наиболее специфичных клонов 5-лимфоцитов. По расчетам общее число различных антигенспецифических клонов В лимфоцитов достигает 106—107.
Другой характеристикой иммуноглобулинов является авидность. Под этим термином понимают прочность связывания антитела и антигена. Эта характеристика определяется аффинностью и числом антигенсвязывающих центров. При равной аффинности наибольшей авидностью обладают антитела класса М, так как они не имеют 10 антигенсвязывающих центров
.
О
IgG J8M IgA
Рис. 9.8. Строение молекул иммуноглобулинов различных классов. Объяснение в тексте.
w//
 собенности
антигена также влияют на эффективность
его взаимодействия с антителом. Так,
большое значение имеют стерическая
(пространственная) доступность антигенной
детерминанты для антигенсвязывающего
центра молекулы иммуноглобулина и
число эпитопов в составе молекулы
антигена.
собенности
антигена также влияют на эффективность
его взаимодействия с антителом. Так,
большое значение имеют стерическая
(пространственная) доступность антигенной
детерминанты для антигенсвязывающего
центра молекулы иммуноглобулина и
число эпитопов в составе молекулы
антигена.
Эффективность взаимодействия антитела с антигеном зависит от условий, в которых происходит реакция, прежде всего от pH среды, осмотической плотности, солевого состава и температуры среды. Наиболее приемлемыми для реакции антиген- антитело являются физиологические условия внутренней среды макроорганизма: близкая к нейтральной реакция среды, присутствие фосфат-, карбонат-, хлорид- и ацетат ионов, осмоляр- ность физиологического раствора (концентрация раствора 0,15 М) а также температура 36—37 °С.
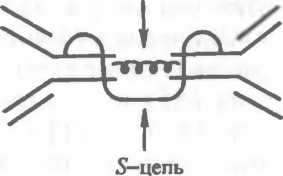
Структурно-функциональные особенности иммуноглобулинов различных классов
В зависимости от строения тяжелой цепи (т.е. наличия изотопических, или групповых, антигенных детерминант) различают классы, или изотипы иммуноглобулинов (рис. 9.8). Молекулы, содержащие тяжелую цепь a-типа, относят к изотипу А (сокращенно IgA), IgD обладает 6-цепью, IgE — е-цепью, IgG— у- цепью и IgM — ц-цепью. Соответственно особенностям строения подтипов тяжелых цепей различают и подклассы иммуноглобулинов.
В структуре молекул иммуноглобулинов разных классов прослеживается общая закономерность все они построены из одних и тех же элементов, которые были описаны в разделе 9.6.1.2. Однако для каждого изотипа характерны свои особенности. В частности, иммуноглобулины D, Е и G имеют мономерноестроение, IgM практически всегда является пентамером, а молекула IgA может быть моно-, ди- и тримером. Наиболее характерные черты, присущие различным изотипам иммуноглобулинов, приведены ниже.
Иммуноглобулин класса G. Изотип G составляет основную массу иммуноглобулинов сыворотки крови. На его долю приходится 70—80 % всех сывороточных иммуноглобулинов, при этом 50 % содержится в тканевой жидкости. Среднее содержание IgG в сыворотке крови здорового взрослого человека составляет 12 г/л. Этот уровень достигается к 7—10-летнему возрасту. Период полураспада IgG равен 21 дню.
IgG — мономер, имеет два антигенсвязывающих центра (он может связать две молекулы антигена подряд, следовательно, его валентность равна двум), молекулярную массу — около 160 ООО и константу седиментации — 7S. Различают подтипы Gl, G2, G3 и G4. IgG синтезируется зрелыми В-лимфоцитами (5) и плазматическими клетками. Он хорошо определяется в сыворотке крови на пике первичного и при вторичном иммунном ответе.
IgG обладает высокой аффинностью, связывает комплемент, может быть неполным антителом. IgG4, подобно IgE, обладает цитофильностью (тропностью, или сродством, к тучным клеткам и базофилам) и участвует в развитии аллергической реакции I типа (см. раздел 9.6.4). IgG легко проходит через плацентарный барьер и обеспечивает гуморальный иммунитет новорожденного в первые 3—4 мес после рождения, способен также выделяться в секрет слизистых оболочек путем диффузии.
Иммуноглобулин класса М. Это наиболее крупная молекула из всех иммуноглобулинов. IgM — пентамер, который имеет 10 антигенсвязывающих центров, т.е. его валентность равна 10. Его молекулярная масса около 900 000, константа седиментации 19£ Различают подтипы Ml и М2. Тяжелые цепи молекулы IgM в отличие от других изотипов построены из 5 доменов. Период полураспада IgM составляет 5 дней.
На долю IgM приходится около 5—10 % всех сывороточных иммуноглобулинов. Среднее содержание IgM в сыворотке крови здорового взрослого человека около 1 г/л. Этот уровень достигается уже к 2—4-летнему возрасту.
IgM — филогенетически наиболее древний иммуноглобулин, синтезируется предшественниками и зрелыми 5-лимфоцитами (В ). Он образуется в начале первичного иммунного ответа, также первым начинает синтезироваться в организме новорожденного (определяется уже на 20-й неделе внутриутробного развития).
IgM обладает высокой авидностью, связывает комплемент, участвует в формировании сывороточного и секреторного гуморального иммунитета. Он может выделиться в секрет слизистых оболочек путем диффузии. Бблыная часть нормальных антител и изоагглютининов относится к IgM.
IgM не проходит через плаценту. Обнаружение специфических антител изотипа М в сыворотке крови новорожденного указывает на бывшую внутриутробную инфекцию или дефект плаценты.
Иммуноглобулин класса A. IgA существует в сывороточной и секреторной формах. Около 60 % всех IgA содержится в секретах слизистых оболочек.
Сывороточный IgA\ на его долю приходится около 10—15 % всех сывороточных иммуноглобулинов. В сыворотке крови здорового взрослого человека содержится около 2,5 г/л IgA, этот уровень достигается к 10-летнему возрасту. Период полураспада IgA составляет 6 дней.
IgA — мономер, имеет два антигенсвязывающих центра (т.е. 2-валентный), его молекулярная масса около 170 ООО, константа седиментации 7S. Различают подтипы А1 и А2. IgA синтезируется зрелыми 5-лимфоцитами (Ва) и плазматическими клетками. IgA хорошо определяется в сыворотке крови на пике первичного и при вторичном иммунном ответе.
IgA обладает высокой аффинностью, может быть неполным антителом, не связывает комплемент, не проходит через плацентарный барьер.
Секреторный IgA: в отличие от сывороточного секреторный IgA чаше существует в форме ди- или тримера (4- или 6-валентный) и содержит J- и Л'-пептиды. Молекула секреторного IgA формируется при прохождении через эпителиальную клетку, где IgA присоединяется к секреторному компоненту. Молекулярная масса IgA 350 ООО и более, константа седиментации 1351 и выше.
Секреторный IgA — основной фактор местного иммунитета слизистых оболочек ЖКТ, мочеполовой системы и респираторного тракта. Этот иммуноглобулин препятствует адгезии микробов на эпителиальных клетках и генерализации инфекции в пределах слизистых оболочек.
Секреторный IgA активирует комплемент и стимулирует фагоцитарную реакцию в слизистых оболочках.
Иммуноглобулин класса Е IgE называют также реагином. Содержание его в сыворотке крови крайне невысоко — примерно 0,00025 г/л. Обнаружить IgE можно специальными высокочувствительными методами. Его молекулярная масса около 190 000, константа седиментации примерно 8S. IgE — мономер. На его долю приходится около 0,002 % всех циркулирующих иммуноглобулинов, этот уровень достигается к 10—15 годам.
IgE синтезируется зрелыми 5-лимфоцитами (5) и плазматическими клетками преимущественно в лимфоидной'ткани бронхолегочного дерева и ЖКТ. IgE не связывает комплемент, не проходит через плацентарный барьер. Он обладает выраженной цитофильностью — тропностью к тучным клеткам и базофи- лам, участвует в развитии аллергической реакции I типа (см. раздел 9.6.4).
Иммуноглобулин класса D. Сведений об IgD немного. IgD практически полностью содержится в сыворотке крови в концентрации около 0,03 г/л (около 0,2 % общего количества циркулирующих иммуноглобулинов). IgD имеет молекулярную массу 160 ООО и константу седиментации 7S, мономер.
IgD не связывает комплемент, не проходит через плацентарный барьер, является рецептором предшественников 5-лимфоцитов.
Рецепторные иммуноглобулины. Рецепторные, или мембранные, иммуноглобулины локализуются на цитоплазматической мембране В -лимфоцитов. Они выполняют функции антигенспецифи- ческих рецепторов. Рецепторные иммуноглобулины имеют тот же изотип и специфичность, что и синтезируемые в межклеточную среду антитела. Структурное отличие от секретируемых антител заключается в особом дополнительном Л/-пептиде, благодаря которому молекула рецепторного белка фиксируется в цитоплазматической мембране иммунокомпетентной клетки.
Нормальные антитела. В сыворотке крови человека всегда определяется базальный уровень иммуноглобулинов, которые получили название нормальных, или естественных, антител. К нормальным антителам относят изогемагглютинины — антитела, направленные против эритроцитарных антигенов групп крови (система АВО), а также против бактерий кишечной группы, кокков и некоторых вирусов. Эти антитела постоянно образуются в организме без явной антигенной стимуляции. С одной стороны, они отражают готовность макроорганизма к иммунному реагированию, а с другой — могут свидетельствовать об отдаленном контакте с антигеном.
Моноклональные антитела. Каждый 5-лимфоцит и его потомки, образовавшиеся в результате пролиферации (т.е. клон), способны синтезировать антитела строго определенной специфичности. Такие антитела названы моноклональными. В природных условиях макроорганизма получить моноклональные антитела практически невозможно. Дело в том, что на одну и ту же антигенную детерминанту одновременно реагирует до 100 различных клонов 5-лимфоцитов, незначительно различающихся антигенной специфичностью. Поэтому в результате иммунизации даже антигеном, состоящим из одной антигенной детерминанты, всегда получают поликлональные антитела.
Принципиально задача получения моноклональных антител выполнима, если провести предварительную селекцию антителопродуцирующих клеток и их клонирование (т.е. выделение отдельных клонов в чистые культуры). Однако это осложняется тем, что 5-лимфоциты, как и другие эукариотические клетки, имеют ограниченные продолжительность жизни и число возможных митотических делений.
Проблема получения моноклональных антител была успешно решена Д.Келлером и Ц.Мильштайном (1975). Авторы получили гибридные клетки путем слияния иммунных 5-лимфоцитов с миеломной (опухолевой) клеткой. Полученные гибриды обладали специфическими свойствами антителопродуцента и «бессмертием» раково-трансформированной клетки. Такой вид клеток получил название гибридом. Гибридома хорошо размножается на искусственных питательных средах и в организме животных, в неограниченном количестве продуцируют антитела. В результате дальнейшей селекции были отобраны отдельные клоны гибридных клеток, обладавшие наивысшими продуктивностью и аффинностью специфических антител.
Гибридомные моноклональные антитела широко применяются при создании диагностических и лечебных иммунобиологических препаратов.
Полные и неполные антитела Среди многообразных иммуноглобулинов выделяют полные и неполные антитела. Деление основано на способности образовывать в реакции агглютинации или преципитации (in vitro) хорошо различимую глазом макромолекулярную структуру гигантского иммунного комплекса. Таким свойством обладают полные антитела. К ним относятся полимерные молекулы IgM, а также некоторые IgA и IgG.
Неполные антитела лишены такой способности несмотря на то, что они специфически связываются с антигеном. В связи с этим их еще называют непреципитирующими (или блокирующими) антителами. Причиной данного явления могут быть экранирование или дефект второго антигенсвязывающего центра мономерной молекулы иммуноглобулина, а также недостаточное число или экранирование антигенных детерминант на молекуле антигена. Выявить неполные антитела можно при помощи реакции Кумбса — путем использования «вторых», антииммуноглобул иновых антител (см. раздел 9.11).
Другие виды антител. Помимо описанных выше, различают тепловые и холодовые антитела. Первые взаимодействуют с антигеном при температуре 37 °С, для вторых эффективность связывания наибольшая при 4—10 °С.
По способности активировать комплемент (классический путь) антитела подразделяются на комплементсвязывающие (IgM, IgGl, IgG2 и IgG3) и комплементнесвязывающие.
В последние годы открыт вид антител, которые выполняют функции катализаторов биохимических процессов. Они названы абзимами.
Большим достижением молекулярной биологии в области иммунологии явилось получение (помимо гибридом) белков со свойствами антител — это одноцепочечные антитела, бифункциональные антитела и иммунотоксины. Они синтезируются живыми биологическими системами. Одноцепочечные антитела представляют собой фрагмент вариабельного домена иммуноглобулина, который обладает определенной специфичностью и аффинностью и способен проявлять блокирующее действие. Размер такой молекулы очень мал, она практически не обладает иммуногенностью. Бифункциональные антитела имеют антигенсвя- зывающие центры разной специфичности, т.е. направлены к различным антигенным детерминантам. Иммунотоксины представляют собой гибрид молекулы иммуноглобулина и токсина. Они способны направленно доставить молекулу токсина к клетке- мишени и убить ее или нарушить в ней метаболические процессы.
Иммунотоксины и бифункциональные антитела имеют большое будущее. В перспективе их будут использовать для иммунодиагностики, а также для профилактики и лечения инфекционных, онкологических, аллергических и других болезней.
Генетика иммуноглобулинов
Для молекул иммуноглобулинов характерно не только уникальное строение, но и своеобразное генетическое кодирование. Методами молекулярной генетики было доказано, что в отличие от других белков структура молекулы иммуноглобулинов изначально контролируется не одним, а большим числом генов. Гены иммуноглобулинов имеют фрагментарную организацию и образуют 3 группы, которые располагаются на 3 различных хромосомах и наследуются независимо.
Первая группа генов содержит информацию о первичной аминокислотной последовательности легкой цепи А.-типа, вторая — легкой цепи к-типа, а третья — всех типов тяжелых цепей (а, 6, е» у и ц). Гены, относящиеся к каждой группе, находятся на соответствующей хромосоме в непосредственной близости друг от друга. Они располагаются последовательно (рис. 9.9) и разделены интронами (некодирующими областями).
Участок ДНК, кодирующий строение легкой цепи А.-типа, содержит два К-сегмента (контролируют структуру V доменов) и 4 С-сегмента (контролируют структуру С-доменов). Между С-У, у2 J с, с2 с, с„
А(«л.и«ь—§j-j—|—DOCK]—
y
■п-
i К J, Л Jj лК (плп*) -цепь
Qt с’т Q 1
даош
А
Hi
Р м
//-цепь •
Рис. 9.9. Строение генов цепей молекул иммуноглобулинов. Объяснение в тексте.
и К-сегментами располагается J-сегмент (от англ. join — соединяющий). Легкая цепь к-типа кодируется несколькими сотнями К-сегментов ДНК, 4 У-сегментам и и одним С-сегментом. Группа генов, контролирующих структуру тяжелых цепей, имеет еще более сложное строение. Наряду с V-, С- и /-сегментами ДНК в их состав входят 20 D-сегментов (от англ. divercity — разнообразие). Кроме того, имеется Л/-сегмент, который кодирует биосинтез мембраноассоциированного участка молекулы рецепторного иммуноглобулина.
При созревании пре-5-лимфоцитов наблюдаются мощные перестройки в их генетическом аппарате. В результате происходят произвольное сближение отдельных фрагментированных генов и сборка в пределах соответствующих хромосом единых функциональных генов, которые кодируют всю молекулу иммуноглобулина. С этих генов транскрибируются про-мРНК, а затем мРНК как матрица для синтеза молекул циркулирующих либо рецепторных иммуноглобулинов. Пропущенные участки ДНК исключаются из дальнейшего счить вания. Этот процесс имеет случайный характер и называется сплайсингом (англ. splicing - сращивание, состыковывание).
Параллельно со сплайсингом в отдельных участках V-cer- ментов генов иммуноглобулинов наблюдается мутационный процесс. Эти участки ДНК называются гипермутабельными областями.
В результате произвольного сплайсинга возникает бесконечно большое число (миллионы) вариантов структуры антигенсвязы
-
вающего центра. Мутационный процесс, происходящий в генах иммуноглобулинов, в сотни раз повышает разнообразие V доменов. Эти два механизма и являются причиной множественности структуры идиотипических антигенных детерминант и специфичности антител. Таким образом, в пределах организма уже предсуществуют или в любой момент могут возникнуть В лимфоциты, специфичные к практически любому антигену. Молекулярно-генетическая теория происхождения многообразия специфичностей антител была подробно разработана С.Тонегавой (1983).
Дальнейшая дифференцировка 5-лимфоцитов, которая идет параллельно с их размножением, также сопровождается рекомбинационными перестройками в пределах иммуноглобулиновых генов и про-мРНК. Этот процесс проявляется, в частности, последовательной сменой класса иммуноглобулинов. На ранних этапах дифференцировки 5-лимфоциты синтезируют иммуноглобулины класса М, на более поздних — классов G, А или Е.
Динамика антителопродукции
Способность синтезировать антитела как одну из форм реагирования иммунной системы макроорганизм приобретает довольно рано. Уже на 13-й неделе эмбрионального периода развития 5 лимфоциты способны синтезировать IgM, а на 20-й неделе этот белок можно уже определить в сыворотке крови. С этого момента в организме начинают непрерывно появляться новые антителопродуцирующие клетки с различной специфичностью, которые исходно продуцируют базальный уровень антител преимущественно изотипа М — это нормальные антитела. Содержание иммуноглобулинов в сыворотке крови существенно меняется с возрастом, а также зависит от состояния макроорганизма. Концентрация антител достигает максимума к периоду полового созревания и держится на высоких цифрах в течение всего репродуктивного периода (период половой зрелости до старости). В старческом возрасте содержание антител снижается. Повышение количества иммуноглобулинов наблюдается при инфекционных болезнях, аутоиммунных расстройствах; снижение отмечается при некоторых опухолях и иммунодефицитных состояниях.
На появление во внутренней среде макроорганизма антигена иммунная система реагирует усилением биосинтеза специфических антител, что достигается путем размножения клонов анти- генспецифичных клеток-антителопродуцентов. При этом антиген выступает в роли селектирующего фактора, и преимущества получают клоны с наивысшей к нему специфичностью, т.е. с наибольшей аффинностью рецепторных молекул иммуноглобу-
Уровень
антител
введения
антигена
Рис.
9.10. Динамика образования антител при
первичном (А) и вторичном (Б) иммунном
ответе.
Фазы
антителообразования: а — латентная;
б — логарифмическая; в — стационарная;
г — снижения.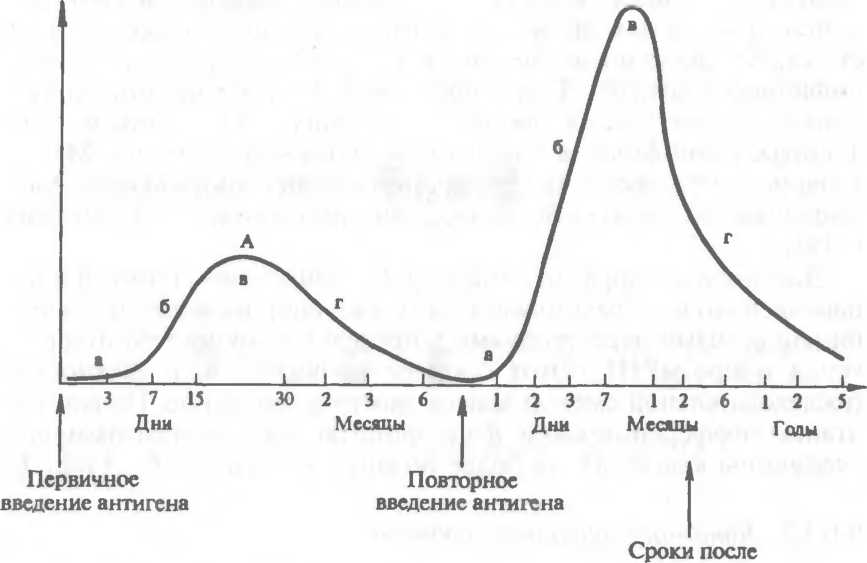
линов. Параллельно с размножением идет процесс дифференци- ровки 5-лимфоцитов. Наблюдаются перестройка в геноме клеток и переключение биосинтеза с крупной высокоавидной молекулы IgM на более легкие и экономичные высокоаффинные IgG или IgA.
Антителопродукция в ответ на антигенный стимул имеет характерную динамику (рис. 9.10). Выделяют следующие фазы: латентную (индуктивную), логарифмическую, стационарную и снижения.
В латентную фазу антителопродукция практически не изменяется и остается на базальном уровне. В этот период происходят переработка и представление антигена иммунокомпетентным клеткам, а также запуск пролиферации антигенспецифичных клонов клеток антителопродуцентов. Ввиду того что клетки делятся дихотомически (т.е. надвое), их численность возрастает в геометрической прогрессии. Поэтому после первых циклов деления прирост числа клеток в общей массе невелик, и титры специфических антител практически не изменяются. Параллельно происходит созревание пре-5-лимфоцитов в зрелые формы, включаются процессы дифференцировки антителопродуцентов в плазматические клетки и переключение синтезируемых изотипов иммуноглобулинов.
Во время логарифмической фазы наблюдается интенсивный прирост числа антигенспецифичных 5-лимфоцитов, что находит отражение в существенном нарастании титров специфических антител.
В стационарной фазе количество специфических антител и синтезирующих их клеток достигает максимума и стабилизируется. Освобождение макроорганизма от антигена устраняет антигенный стимул, поэтому вслед за стационарной фазой начинается фаза снижения. В этот период наблюдается постепенное уменьшение численности клонов специфических антителопродуцентов и титров соответствующих антител.
Динамика антителообразования имеет характерную временную зависимость. Она также существенно зависит от первичности или вторичности контакта с антигеном. При первичном контакте с антигеном развивается первичный иммунный ответ. Для него характерна длительная латентная (3—5 сут) и логарифмическая (7—15 сут) фазы. Первые диагностически значимые титры специфических антител регистрируются на 10—14-е сутки от момента иммунизации. Стационарная фаза продолжается 15—30 сут, а фаза снижения — 1—6 мес.
В течение первичного иммунного ответа созревают и размножаются клоны антигенспецифичных 5-лимфоцитов. Их диффе- ренцировка приводит к образованию плазматических клеток. Происходит также переключение биосинтеза иммуноглобулинов с изотипа М на А или G. В итоге первичного иммунного реагирования формируются многочисленные клоны антигенспецифичных антителопродуцирующих клеток (5-лимфоциты иммунологической памяти), а во внутренней среде макроорганизма в высоком титре накапливаются специфические IgG и/или IgA. Таким образом обеспечиваются активное противодействие иммунной системы внедрению в макроорганизм антигена и высокая готовность к повторной с ним встрече.
Повторный контакт иммунной системы с тем же антигеном ведет к формированию вторичного иммунного ответа (см. рис. 9.10). В отличие от первичного для вторичного ответа характерна укороченная латентная фаза — от нескольких часов до 1—2 сут. Логарифмическая фаза отличается более интенсивной динамикой прироста и более высокими титрами специфических антител. Стационарной фазе и фазе снижения свойственна затяжная динамика (несколько месяцев или даже лет). При вторичном иммунном ответе в организме сразу же в подавляющем большинстве случаев синтезируется IgG. Характерная динамика ан- тителопродукции обусловлена подготовленностью иммунной системы к повторной встрече с антигеном за счет формирования иммунологической памяти (см. раздел 9.6.5). В результате этого клоны антигенспецифичных 5-лимфоцитов, оставшиеся после первичного иммунного реагирования, быстро размножаются и интенсивно включаются в процесс антителогенеза.
Явление интенсивного антителообразования при повторном контакте с антигеном широко используется в практических целях, например при вакцинопрофилактике. Для создания и поддержания иммунитета на высоком уровне схемы вакцинации предусматривают первичное введение антигена для формирования иммунологической памяти и последующие ревакцинации через различные интервалы времени (см. главу 10). Этот же феномен используют при получении высокоактивных лечебных и диагностических иммунных сывороток (гипериммунных). Для этого животным или донорам многократно вводят препараты антигена по специальной схеме.
Динамика и интенсивность антителообразования в значительной степени зависят от иммуногенности и дозы антигена, способа и кратности его введения, а также состояния макроорганизма. Попытка повторного введения антигена в латентной фазе может привести к иммунологическому параличу.
9.6.1.8. Теории разнообразия антител
Для объяснения механизмов антителопродукции и разнообразия специфичности антител было высказано множество гипотез и теорий. Однако только немногие из них получили практическое подтверждение. Большинство теорий имеет лишь историческое значение.
Первой принципиально важной концепцией была теория «боковых цепей» П.Эрлиха (1898). Согласно этой теории, клетки органов и тканей имеют на своей поверхности рецепторы, способные в силу химического сродства связывать антиген и инактивировать его. Связанные с антигеном рецепторные молекулы отделяются от поверхности клетки и замещаются вновь синтезированными. Эта теория заложила основные представления о гуморальном иммунитете и рецепторах иммунокомпетентных клеток.
Заслуживают внимания «инструктивные» (или «матричные») теории. Согласно концепциям, предложенным Ф.Брейнлем и Ф.Гауровитцем (1930), J1.Полингом (1940), антиген является матрицей, с которой штампуется молекула антител. Эти теории оказались тупиковыми в связи с открытием Д.Уотсоном и Ф.Криком (1953) механизма кодирования в ДНК генетической информации.
Некоторые теории исходили из предположения о предсуществовании в организме антител практически ко всем возможным антигенам [Ерне Н., 1955; Вернет Ф., 1959]. В настоящее время наиболее обоснованной считается теория Ф.Бернета, которая получила название «клонально-селекционной». Согласно этой теории, лимфоидная ткань состоит из огромного числа клонов антигенреактивных клеток (лимфоцитов), которые специализируются на продукции антител к разнообразным антигенам. Клоны возникли в ходе эволюции в результате мутаций и селекции под влиянием антигенов и уже предсуществуют в новорожденном организме. Попавший в организм антиген селективно (избирательно) активирует специфичный к нему клон лимфоцитов, который размножается и начинает вырабатывать специфичные к данному антигену антитела. Если доза антигена велика, то клон реагирующих на него лимфоцитов устраняется (элиминируется) из организма. В соответствии с теорией Ф.Бернета этот путь ведет к формированию в эмбриональном периоде иммунологической толерантности (нечувствительности) к собственным антигенам.
Теория Ф.Бернета объясняет многие иммунологические реакции (антителообразование, гетерогенность антител, иммунологическую память, толерантность), однако она не может объяснить происхождение всего многообразия специфичности антител. Ф.Бернет предположил, что в организме существует около 10 ООО клонов специфических антителопродуцирующих клеток. Однако, как показывает практика, мир антигенов намного обширнее и организм отвечает практически на любой из них.
Значительную ясность в представление о разнообразии специфичностей антител внес С.Тонегава (1983), который дал этому явлению генетическое обоснование. Молекулярно-генетическая теория С.Тонегавы исходит из того, что в генах иммуноглобулинов постоянно происходят мощные рекомбинационные и мутационные процессы. В результате этого возникает огромное число вариантов генов, которые кодируют разнообразные по специфичности иммуноглобулины. Каждый клон антителопродуцирующих лимфоцитов обладает своим уникальным вариантом гена иммуноглобулина.
Следует также упомянуть теорию сетевой регуляции иммунной системы. Ее основой является выдвинутая Н.Ерне (1974) идея идиотип-антиидиотипического взаимодействия. Согласно этой теории, иммунная система представляет собой цепь взаимодействующих антигенных идиотипов иммуноглобулинов и направленных к ним антиидиотипических антител. Введение антигена вызывает каскадную реакцию образования антител 1,
3-го и т.д. порядка. Антитело 1-го порядка, действуя как антиген, вызывает образование к своему идиотипу антител 2-го порядка. К идиотипу антител 2-го порядка синтезируются антитела 3 го порядка и т.д. При этом антитело каждого порядка как бы несет «внутренний образ» антигена, который передается эстафетно в цепи образования антиидиотипических антител. Доказательством этой теории являются обнаружение антиидиотипических антител, способных вызвать в организме иммунитет к соответствующему антигену, а также существование лимфоцитов, сенсибилизированных к антиидиотипическим антителам. С помощью теории Н.Ерне можно понять формирование иммунологической памяти и возникновение аутоиммунных реакций. Однако она неспособна объяснить многие другие явления иммунитета: механизм иммунологического распознавания «свой—чужой», управление каскадом идиотип-антиидиоти- пических реакций и т.д Данная теория не получила дальнейшего развития.
В 60-е годы вьщающийся отечественный иммунолог П.Ф.Здро- довский сформулировал физиологическую концепцию иммуногенеза — гипоталамо-адреналовую теорию регуляции иммунитета. Основная идея сводилась к тому, что продукция антител подчиняется общим физиологическим законам. Ведущая роль в этом процессе принадлежит гормонам и нервной системе.
Иммунный фагоцитоз
Феномен иммунного фагоцитоза основан на поглощении фагоцитами (см. раздел 9.3.3.3) антигенов, входящих в состав иммунных комплексов. При этом антигенами могут быть как отдельные молекулы или их агрегаты, так и цельные клетки или их обломки. Для осуществления иммунного фагоцитоза необходимо участие молекул иммуноглобулинов и/или комплемента. Имеющиеся на клеточной мембране фагоцитирующей клетки рецепторы для /с-участка молекулы иммуноглобулина и компонентов комплемента обеспечивают «узнавание» и захват фагоцитом иммунных комплексов или опсонизированных антигенов. Таким образом, фагоциты участвуют в элиминации (удалении) антигенов из организма и восстановлении его гомеостаза.
Киллинг, опосредованный клетками
Иммунная система располагает независимым от системы комплемента способом уничтожения чужеродных клеток. Эта форма иммунного реагирования осуществляется непосредственно клетками-киллерами и получила название «киллинг, опосредованный клетками». Киллинг способны осуществлять активированные фагоциты, Т киллеры, естественные киллеры (NK- клетки), К-клетки и некоторые другие. Мишенью для них являются раково-трансформированные, мутантные или зараженные вирусами клетки, грибы, простейшие, гельминты, некоторые бактерии и другие чужеродные клетки.
Киллеры вырабатывают рад веществ, обладающих цитоток- сическим или цитолитическим действием. Эти клетки осуществляют свою функцию дистантно (на расстоянии) или при непосредственном контакте. Распознавание генетической чужерод- ности клеток-мишеней имеет различные механизмы.
Активированные фагоциты (см. раздел 9.3.3.3) продуцируют перекисные ион-радикалы и ферменты, которые могут поражать клетки на расстоянии или после фагоцитоза. Первичное распознавание чужеродных клеток происходит по антителам, которые предварительно связались с поверхностными антигенами клеток-мишеней. Киллерную функцию фагоцитов активируют лимфокины, эндотоксин, двунитевая ДНК и некоторые другие биологически активные соединения.
Т-киллеры самостоятельно, без участия антител, распознают генетически чужеродные клетки по строению антигенов гистосовместимости, расположенных на поверхности цитоплазматической мембраны этой клетки. Процесс инактивации (убийства) клетки-мишени осуществляется в несколько этапов.
Установление плотного контакта: Г-киллер прикрепляется к поверхности клетки-мишени; при этом между клетками образуется узкое синаптическое пространство.
Активация Т-киллера: происходит полярное перераспределение внутриклеточных органелл киллера — гранулы, содержащие фермент-токсин, и аппарат Гольджи перемещаются в сторону клетки-мишени.
Экзоцитоз фермента-токсина: фермент-токсин выделяется в узкое синаптическое пространство между клетками.
Токсическое воздействие: в результате воздействия фермента-токсина в мембране клетки-мишени образуются сквозные поры, и клетка лизируется.
Т-киллеры активируются при непосредственном контакте с чужеродными клетками и при воздействии интерлейкинов (ИЛ-1, ИЛ-2), интерферона у и других иммуноцитокинов. Один киллер способен последовательно убить несколько клеток-мишеней. Точный механизм специфического распознавания Т- киллером мембранных антигенов клетки-мишени предотвращает ошибочный лизис собственных нормальных клеток как путем контакта, так и через выделение ферментов-токсинов в межклеточную среду. В процессе контакта с чужеродными клетками формируется иммунологическая память, и повторное появление в организме клеток, несущих те же антигенные детерминанты, приводит к формированию реакции по типу вторичного иммунного ответа, т.е. киллерная активность отличается высокой интенсивностью и проявляется в очень короткие сроки.
Г-киллеры различаются по типу синтезируемого фермента- токсина и быстроте действия. Наиболее изучены киллеры, продуцирующие фермент-токсин перфорин. Между моментом выброса перфорина и гибелью клетки проходит несколько десятков минут. Другие Г-киллеры, лишенные перфорина, синтезируют медленно действующие медиаторы. Они лизируют клетку-мишень только через несколько недель.
Механизм действия естественных киллеров (см. раздел 9.4.3) изучен мало. Известно, что он отличается от действия Г-киллера. У yVAT-клеток нет рецепторов для специфического распознавания антигенов, тем не менее естественные киллеры способны убивать отдельные виды раково-трансформированных клеток без предварительной подготовки. Известно, что их функциональная активность регулируется ИЛ-2 и интерфероном у.
К-клетки — это особая субпопуляция лимфоцитов, которые также способны лизировать клетки в присутствии специфических антител — антителозависимая клеточная цитотоксичность (АЗКЦ). Механизм этой реакции подобен действию активированных фагоцитов.
Обсуждая вопросы клеточно-опосредованного киллинга, нужно обязательно отметить не так давно открытый феномен индуцированной запрограммированной гибели клеток, или апогх- тоз. Механизм апоптоза еще до конца не известен и находится в стадии интенсивного изучения. Апоптоз имеет большое биологическое значение. При помощи апоптоза организм управляет численностью клонов иммунокомпетентных клеток и может ее значительно снижать или вообще уничтожать эти клетки в случае ненадобности или аутоагрессивности. Апоптоз индуцируется лим- фокинами. Данный феномен предполагается использовать для лечения опухолей, рассеянного склероза и некоторых других заболеваний.
Реакции гиперчувствительности
В отличие от иммунологических реакций на введение антигена, выражающихся в антителообразовании, клеточных защитных реакциях, толерантности, иногда в ответ на антиген может развиться аномальная гиперергическая реакция, которая имеет черты патологического процесса и является прямой противоположностью иммунологической толерантности. Эта необычная форма реагирования, основу которой составляют естественные физиологические механизмы, получила название аллергии (от греч. alios — иной и ergon — действие). Изучает аллергию самостоятельная наука — аллергология. Соответственно антигены, вызывающие аллергические реакции, названы аллергенами.
Впервые понятие «аллергия» было введено в практику французским ученым К.Пирке (1906). Он понимал аллергию как измененную реакцию макроорганизма на повторное введение антигена. При этом к аллергии ученый относил как гипер-, так и гипореактивность. Современный термин понимает аллергию как повышенную извращенную реакцию макроорганизма на повторный контакт организма с антигеном (аллергеном).
Для формирования аллергии необходима предварительная сенсибилизация макроорганизма аллергеном. Сенсибилизацию можно вызвать введением очень малых субиммунизирующих доз антигена (например, введением морской свинке 0,000001 мл лошадиной сыворотки). Доза антигена, вызывающая сенсибилизацию, называется сенсибилизирующей. Повторное введение того же антигена через определенный промежуток времени вызывает аллергическую реакцию. Дозу антигена, вызывающую аллергическую реакцию, называют разрешающей.
В генезе аллергической реакции выделяют 3 стадии: иммунологическую, патохимическую и патофизиологическую. В течение иммунологической стадии в ответ на антиген (аллерген) образуются антиген- чувствительные клетки, специфические антитела и иммунные комплексы. Патохимическая стадия характеризуется образованием медиаторов воспаления и биологически активных аминов, которые играют основную роль в механизме аллергических реакций. В течение патофизиологической стадии проявляется клиническая картина аллергической реакции. Как правило, клинические проявления аллергии полиморфны.
Первая классификация аллергий была предложена Р. Куком в 1947 г. В ее основу положено время развития аллергической реакции. Выделена гиперчувствительность немедленного типа (ГНТ) и замедленного типа (ГЗТ). Свойства ГНТ и ГЗТ перечислены в табл. 9.3. К ГНТ были отнесены аллергические реакции, проявляющиеся уже через 20—30 мин после повторной встречи с аллергеном, тогда как реакции ГЗТ возникают через
8 ч и позже. Механизмы и клинические проявления ГНТ и ГЗТ различны. ГНТ связана с выработкой специфических антител (опосредована 5-звеном иммунитета), а ГЗТ — непосредственно с лимфоцитами (опосредована Г-звеном иммунитета).
ГНТ описали в 1902—1905 гг. французские ученые Ш.Рише и Ж.Портье и русский ученый Г.П.Сахаров. Они показали, что ГНТ имеет стереотипное течение, которое может заканчиватьсяПоказатель |
ГНТ |
ПТ |
Время развития |
Менее 20—30 мин |
Более 6—8 ч |
реакции |
|
|
Фактор |
Антитела |
Г-лимфоциты |
Фактор переноса в |
Пассивный (антите |
Адоптивный |
интактный организм |
лами) и адоптивный |
(иммунокомпетентны- |
|
(иммунокомпетент- |
ми клетками) |
|
ными клетками) |
|
Десенсибилизация |
Возможна |
Невозможна |
смертью. Она может проявляться в виде анафилаксии, атопических болезней, сывороточной болезни, феномена Артюса (см. раздел 9.10). ГЗТ была описана Р.Кохом (1890). Этот тип аллергии может протекать в виде контактной аллергии, реакции на кожно-аллергическую пробу, замедленной аллергии к белкам (см. раздел 9.10).
Изучение молекулярно-генетических механизмов аллергий привело к созданию П.Джеллом и Р.Кумбсом в 1968 г. новой классификации аллергий в зависимости от вовлечения в генез аллергии тех или иных механизмов. В соответствии с этой классификацией различают 4 основных типа аллергий: анафилактический (I тип), цитотоксический (II тип), иммунокомп- лексный (III тип) и клеточно-опосредованный (IV тип). Первых 3 типа относят к ГНТ, 4-й — к ГЗТ. Сравнительная характеристика механизмов указанных групп аллергий приведена в табл.
из которой следует, что в механизме аллергий основную роль играют IgE, IgG и IgM, а также Г-лимфоциты. IgE и IgG4 обладают цитофильностью, т.е. сродством к тучным клеткам и базофилам, на поверхности которых они образуют иммунные комплексы аллерген—антитело. ИК активируют тучные клетки и базофилы, которые высвобождают гистамин и гистаминоподобные вещества (серотонин, кинины и др.). Эти биологически активные вещества вызывают сокращение гладкой мускулатуры кишечника, бронхов, мочевого пузыря, действуют на секреторные и другие клетки. В результате развиваются клинические симптомы аллергии.
Цитотоксические антитела (IgG, IgM)y направленные против поверхностных структур (антигенов) соматических клеток макроорганизма, связываются с клеточными мембранами клеток- мишеней. Это ведет к функциональному и органическому повреждению клеток (цитотоксическое действие) и соответствующим клиническим проявлениям. Цитотоксическим (цитолити-
|
Таблица 9.4. Классификация аллергических реакций по патогенезу [Джелл П., Кумбс Р., 1968] Тип |
Форма |
Фактор |
Механизм патогенеза |
Клинический |
реакции |
реагиро |
патоге |
|
пример |
вания |
неза |
|
|
|
I анафи |
ГНТ |
IgE, |
Образование |
Анафилаксия |
лактичес |
|
IgG4 |
иммунного комп |
Анафилактичес |
кий |
|
|
лекса IgE (G4) — аллерген Активация тучных клеток и базофи- лов Высвобождение медиаторов воспаления и других БАВ |
кий шок Поллинозы |
II цито- |
ГНТ |
IgM, |
Выработка цито- |
Лекарственная |
токсичес- |
|
IgG |
токсических анти |
волчанка |
кий |
|
тел Активация антителозависимого цитолиза с участи ■ ем комплемента или фагоцитов |
Аутоиммунная гемолитическая болезнь Аутоиммунная тромбоцитопения |
|
III имму- |
ГНТ |
IgM, |
Образование избыт |
Сывороточная |
нокомп- |
|
IgG |
ка иммунных |
болезнь |
лексный |
|
|
комплексов Отложение иммунных комплексов на базальных мембранах, эндотелии и в соединительноткан ной строме Активация антителозависимого цитолиза с участием комплемента или фагоцитов и повреждение соединительнотканной стромы |
Системные заболевания соединительной ткани Феномен Артюса |
IV |
пт |
Г-лим |
Сенсибилизация Т- |
Кожно-аллерги |
клеточ- |
|
фоциты |
лимфоцитов |
ческие пробы |
но- |
|
|
Активация клеточ- |
Контактная |
опосре- |
|
|
но-опосредованно- |
аллергия |
дован- |
|
|
го цитолиза с |
Белковая аллер |
ный |
|
|
участием Т- киллеров и фаго цитов |
гия замедленного типа |
Примечание. Более подробное описание аллергических болезней см. в разделе 9.10.3.
ческим) действием обладают также циркулирующие в крови комплексы антиген—антитело, осаждающиеся на клетках и в тканях макроорганизма. Перечисленные выше механизмы вызывают реакции ГНТ.
Реакция ГЗТ осуществляется цитотоксическими клетками (Г-киллеры в «содружестве» с фагоцитами), сенсибилизированными к аллергену при первом контакте. Повторный контакт с аллергеном вызывает клинически выраженную цитотоксическую реакцию.
Лабораторная диагностика аллергии при аллергических реакциях I типа основана на выявлении суммарных и специфических реагинов (IgE, IgG4) в сыворотке крови. При аллергических реакциях II типа в сыворотке крови определяют цитотоксичес- кие антитела (антиэритроцитарные, антилейкоцитарные, анти- тромбоцитарные и др.). При аллергических реакциях III типа в сыворотке крови выявляют иммунные комплексы. Для диагностики аллергических реакций IV типа используют кожно-аллергические пробы. Последние широко применяют в диагностике инфекционных и паразитарных болезней и микозов, которые сопровождаются аллергизацией макроорганизма (туберкулез, лепра, бруцеллез, туляремия и др.).
Лечение аллергий основано на десенсибилизации макроорганизма малыми субиммунизирующими дозами аллергена, который вводят в макроорганизм в течение продолжительного периода времени. В тяжелых случаях применяют глкжокортикоид- ную терапию.
Следует отметить, что гиперергические иммунные реакции имеют большое значение и в норме. Их механизмы лежат в основе воспалительных реакций, которые способствуют локализации инфекционного агента или иного антигена в пределах входных ворот и формированию полноценной иммунной реакции защитного характера.
Иммунологическая память
При повторной встрече с одним и тем же антигеном организм реагирует более активным и более быстрым формированием иммунитета (вторичный иммунный ответ). Этот феномен получил название иммунологической памяти.
Иммунологическая память распространяется как на гуморальный, так и на клеточный иммунитет, имеет высокую специфичность к конкретному антигену и обусловлена 5-лимфоцитами и Г-киллерами. Иммунологическая память формируется практически всегда и сохраняется годами и даже десятилетиями. Благодаря ей организм надежно защищен от повторных антигенных интервенций.
На сегодняшний день существует две наиболее вероятные теории формирования иммунологической памяти. Одна из них считает, что иммунологическая память обусловлена длительно сохраняющимся в организме антигеном, и этому имеется множество примеров. Так, инкапсулированный возбудитель туберкулеза, персистирующие вирусы кори, полиомиелита, ветряной оспы и некоторые другие длительное время (иногда всю жизнь) сохраняются в организме и таким образом могут оказывать антигенное воздействие на иммунную систему. По другой теории, на наш взгляд более приемлемой, в процессе развития первичной иммунной реакции в организме часть лимфоцитов размножается без дифференцировки и превращается в малые покоящиеся клетки (В- и Г-клетки иммунологической памяти). Эти клетки отличаются высокой специфичностью к конкретной антигенной детерминанте и большой продолжительностью жизни (до 10 лет и более), что обеспечивает постоянную готовность иммунной системы реагировать на повторный контакт с антигеном по вторичному типу.
Феномен иммунологической памяти широко используется в практике вакцинации людей для создания напряженного иммунитета и поддержания его длительное время на защитном уровне. Осуществляют это 2—3-кратными иммунизациями при первичной вакцинации и периодическими повторными прививками — ревакцинациями (см. главу 10).
Однако феномен иммунологической памяти имеет и отрицательные стороны Так, пересадка иммунологически несовместимых органов и тканей завершается отторжением трансплантата и формированием посттрансплантационного иммунитета. Повторная попытка пересадить те же ткани вызывает быструю и бурную реакцию — криз отторжения.
9.6.6. Иммунологическая толерантность
Иммунологическая толерантность — явление, противоположное иммунному ответу и иммунологической памяти. Оно проявляется в том, что на повторное введение антигена вместо выработки иммунитета организм проявляет ареактивность, инертность, неотвечаемость на антиген, т.е. толерантен к антигену.
В организме прекращается продукция специфических антител, блокируется киллинг, опосредованный клетками.
Феномен иммунологической толерантности был открыт в 1953 г. независимо чешским ученым М.Гашеком и группой английских исследователей во главе с П.Медаваром. Так, П.Медавар и соавт. показали, что если ввести какой-либо антиген в эмбрион мыши,
то родившееся животное будет нечувствительно к этому антигену. Открытию иммунологической толерантности предшество вали работы Р.Оуэна (1945), который обследовал разнояйцовых телят близнецов. Ученый установил, что животные в эмбриональном периоде обмениваются через плаценту кровяными ростками. Поэтому после рождения они обладают одновременно двумя типами эритроцитов — своими и чужими. Наличие чужеродных эритроцитов не вызывало иммунной реакции и не приводило к их внутрисосудистому гемолизу. Явление было названо эритроцитарной мозаикой. Однако Р.Оуэн не смог его объяснить.
Иммунологическую толерантность вызывают антигены, которые получили название толерогены. Ими могут быть практически все антигены, однако наибольшей толерогенностью обладают полисахариды.
Иммунологическая толерантность бывает врожденной и приобретенной. Примером врожденной толерантности является отсутствие реакции иммунной системы на свои собственные антигены. Приобретенную толерантность можно создать, вводя в организм вещества, подавляющие иммунитет (иммунодепрессанты]), или же путем введения антигена в эмбриональном периоде или в первые дни после рождения человека или животного. Приобретенная толерантность может быть активной и пассивно t Активная толерантность создается путем введения в организм толерогена, который формирует специфическую толерантность Пассивную толерантность можно вызвать введением в организм веществ, снижающих биосинтетическую или пролиферативную активность иммунокомпетентных клеток (антилимфоцитарная сыворотка, цитостатики и др).
Иммунологическая толерантность отличается специфичностью: она направлена к строго определенным антигенам. По степени распространенности различают поливалентную и расщепленную толерантность. Поливалентная иммунологическая толерантность возникает одновременно на все антигенные детерминанты, входящие в состав конкретного антигена. Для расщепленной (или моновалентной) толерантности характерна избирательная невосприимчивость каких то отдельных антигенных детерминант.
Степень проявления иммунологической толерантности существенно зависит от ряда свойств макроорганизма и толерогена. Так, на проявление толерантности влияют возраст и состояние иммунореактивности организма. Иммунологическую толерантность легче индуцировать в эмбриональном периоде развития и в первые дни после рождения, лучше всего она проявляется у животных со сниженной иммунореактивностью и с определенным генотипом.
Из особенностей антигена, которые определяют успешность индукции иммунологической толерантности, нужно отметить степень чужеродности антигена для организма, его иммуногенность и природу, дозу препарата и продолжительность воздействия антигена на организм. Наибольшей толерогенностью обладают наименее чужеродные по отношению к организму антигены, имеющие низкие иммуногенность и молекулярную массу и отличающиеся высокой гомогенностью. Легче всего формируется толерантность на тимуснезависимые антигены, например на бактериальные полисахариды.
Важное значение в индукции иммунологической толерантности имеют доза антигена и продолжительность его воздействия. Различают высоко- и низкодозовую толерантность. Высокодозо- вую толерантность вызывают введением больших количеств высококонцентрированного антигена. При этом наблюдается прямая зависимость между дозой вещества и производимым им действием. Низкодозовая толерантность, наоборот, вызывается очень малым количеством высокогомогенного молекулярного антигена. Соотношение доза—эффект в этом случае имеет обратную зависимость.
В эксперименте толерантность возникает через несколько дней (а иногда часов) после введения толерогена и, как правило, проявляется в течение всего времени, пока толероген циркулирует в организме. Эффект ослабевает или прекращается при удалении из организма толерогена. Обычно иммунологическая толерантность наблюдается непродолжительный срок — всего несколько дней. Для пролонгирования толерантности необходимы повторные инъекции препарата.
Механизм толерантности многообразен и до конца не исследован. Известно, что в развитии иммунологической толерантности участвуют Т- и 5-лимфоциты и основу ее составляют нормальные механизмы функционирования иммунной системы. Наиболее вероятными причинами развития иммунологической толерантности могут быть следующие:
Возможен адоптивный перенос2 иммунологической толерантности интактному животному путем введения ему иммунокомпетентных клеток, взятых от донора. Толерантность можно также искусственно отменить. Для этого необходимо активировать иммунную систему адъювантами, интерлейкинами или переключить направленность ее реакции иммунизацией модифицированными антигенами. Другой путь — удалить из организма толероген, сделав инъекцию специфических антител.
Феномен иммунологической толерантности имеет большое практическое значение. Он используется для решения многих важных проблем медицины, таких как пересадка органов и тканей, подавление аутоиммунных реакций, лечение аллергий и других патологических состояний.
Особенности местного иммунитета
Как отмечено ранее, в структуре системы иммунной защиты выделяют местный umiymmem. Впервые концепцию местного иммунитета как системы защиты «забарьерных» структур предложил А.М Безредка (1919). В отличие от общего местный иммунитет имеет локальное расположение: он формируется в пределах кожных покровов и слизистых оболочек — наиболее вероятных входных ворот экзогенных антигенов.
Основная задача местного иммунитета — обеспечение местной, локальной, иммунной зашиты в пределах ткани.
Кроме того, факторы местного иммунитета могут действовать экстракорпорально (выходить за пределы макроорганизма): на поверхности кожных покровов и в составе секрета слизистых оболочек.
Система местного иммунитета не имеет выраженного анато- мо-морфологического обособления. Между общим и местным иммунитетом существует тесная связь. Во-первых, система общего иммунитета служит резервным источником факторов защиты. При нарушении микроциркуляции локальный воспалительный процесс быстро переходит в затяжную септическую форму. Во вторых, при развитии инфекционного процесса от
четливо прослеживается взаимный переход местной и общей иммунной реакции одна в другую. В-третьих, между этими двумя системами постоянно осуществляется обмен факторами иммунитета (антитела, клоны лимфоцитов, фагоциты). Это важно для распространения по всему организму клеток иммунологической памяти (см. раздел 9.6.5), но также часто приводит к генерализации инфекции. Тем не менее система местного иммунитета функционирует достаточно обособленно и имеет рад особенностей.
Иммунитет кожи
Кожа выполняет пограничную функцию. Она предохраняет макроорганизм от внешних воздействий как фактор механической защиты и в случае повреждения способна самостоятельно восстанавливать целостность покрова. Кожный покров имеет также физико-химическую защиту в виде потовых и сальных желез, продукты которых обладают бактерицидной активностью. Кроме того, кожа наделена эффективной системой местного иммунного реагирования.
Внешний слой кожи, эпидермис, формируется эпителиальными клетками — кератиноцитами. Эти клетки образуют несколько слоев. В толще кератиноцитов встречаются дендритные клетки двух типов: белые отростчотые эпидермоциты (клетки Лонгергонса) и клетки Гретитайна. В тканях дермы и эпидермиса локализуются лимфоциты и тучные клетки. Лимфоидная популяция представлена в основном Т-хелперами и 7-киллерами. В дерме и эпидермисе незрелые Г-лимфоциты дифференцируются в зрелые клетки.
Кератиноциты выполняют в коже важную иммунорегуля- торную функцию. Они, подобно тимоцитам, продуцируют ти- мопоэтин и другие цитокины, необходимые для созревания Т-лимфоцитов, а также ИЛ-1, который стимулирует развитие иммунной реакции. Белые отростчатые эпидермоциты и осуществляют функции фагоцитов — захватывают и перерабатывают антигены, представляют их лимфоцитам, регулируют активность иммунного реагирования. Белые отростчатые эпидермоциты чувствительны к ультрафиолетовому излучению, которое их убивает и тем самым угнетает развитие иммунной реакции в коже.
В коже преимущественно развивается клеточный иммунный ответ. Напряженность местного иммунитета в коже, так же как и интегральное состояние клеточного звена иммунитета в целом, диагностируется постановкой кожно-аллергических проб,
Иммунитет слизистых оболочек
Местный иммунитет слизистых оболочек обеспечивает иммунную защиту желудочно-кишечного и респираторного тракта, мочеполовой системы и других органов и тканей. Слизистые оболочки отличаются развитой лимфоидной тканью и высокой насыщенностью иммунокомпетентными клетками. В собственной пластинке обнаруживается большое число фагоцитов. Привлеченные хемоаттрактантами, они способны совершать маятникообразные миграции: выходить через эпителий за его пределы (в просвет кишки, бронха, ротовой полости и т.д.) и возвращаться обратно. Подсчитано, что в ротовой полости постоянно присутствует около 100 ООО фагоцитов.
В собственной пластинке слизистой оболочки находятся лимфоциты, рассеянные и в виде скоплений, или лимфоидных фолликулов. Рассеянные лимфоциты представлены в основном 5-лимфоцитами (до 90 %) и 7’-хелперами. Также среди них, но ближе к эпителиоцитам, обнаруживаются постоянно мигрирующие Т- киллеры.
Центр лимфоидных скоплений — это зона 5-лимфоцитов. Здесь происходят дозревание пре-5-лимфоцитов, их дифференциров- ка в зрелые формы, образование плазматических клеток и клеток иммунологической памяти. На периферии лимфатических фолликулов находится зона 7’-хелперов.
В слизистых оболочках идет интенсивный биосинтез иммуноглобулинов классов А, М, G и Е. Они действуют как в пределах самих тканей, так и в составе секрета слизистых оболочек, куда проступают в результате диффузии. Однако наибольшую функциональную нагрузку несет секреторный IgA (см. раздел 9.6.1.5), хорошо защищенный от протеолитических ферментов секрета.
В пределах слизистых оболочек обнаруживается много тучных клеток. Синтезируя гистамин, фактор некроза опухоли (ФНО), лейкотриены и другие биологически активные вещества, они участвуют в регуляции иммунной и воспалительной реакции в пределах ткани. В случае гиперпродукции IgE и особой генетической предрасположенности тучные клетки потенцируют развитие ГНТ I типа (анафилактическая реакция).
Сами эпителиоциты также участвуют в осуществлении местного иммунитета. Они представляют собой хороший механический барьер и, кроме того, способны эндоцитировать (поглощать) антигены и синтезировать при контакте с микробом ИЛ-8, который является хемоатграктантом для фагоцитов.
Секрет слизистых оболочек выполняет функции физикохимического барьера (см. раздел 9.3.3.2), а нормальная микрофлора — иммунобиологического барьера за счет участия в формировании колонизационной резистентности (см. раздел 4.2).
Особенности иммунитета при различных инфекциях и состояниях
Реакция макроорганизма на антигены достаточно однотипна, гак как она ограничена набором факторов иммунной защиты и физиологическими возможностями макроорганизма. Однако в зависимости от природы антигена иммунная система необязательно должна включать для его устранения все механизмы и факторы защиты — достаточно использовать лишь наиболее эффективные в отношении конкретного антигена. Поэтому характер иммунного реагирования макроорганизма имеет свои особенности при воздействии различных по природе и свойствам антигенов.
Особенности иммунитета при бактериальных инфекциях
Иммунная реакция макроорганизма в ответ на бактериальную инфекцию в значительной степени определяется факторами патогенности микроба, в том числе его способностью к токси- нобразованию. Различают антибактериальный (против структурно-функциональных компонентов бактериальной клетки) и антитоксический (против белковых токсинов) иммунитет.
Основными факторами антибактериальной защиты в подавляющем большинстве случаев являются антитела и фагоциты. Ан итела инактивируют биологически активные молекулы бактериальной клетки (токсины, ферменты агрессии и др.), маркируют их, запускают механизм комплементзависимого бактериолиза и участвуют в иммунном фагоцитозе. Фагоциты осуществляют фагоцитоз, в том числе иммунный, внеклеточный киллинг патогена при помощи ион радикалов и антителозависимый бактериолиз.
Некоторые бактерии, относящиеся к факультативным внутриклеточным паразитам, отличаются повышенной устойчивостью к действию комплемента, лизоцима и фагоцитов (незавершенный фагоцитоз). К ним относятся микобактерии туберкулеза, возбудители лепры, бруцеллы, сальмонеллы и др. В отношении этих микробов антитела и фагоциты недостаточно эффективны, а сам инфекционный процесс имеет склонность к хроническому течению. В такой ситуации макроорганизм вынужден переключать нагрузку на клеточное звено иммунитета: активируются 7-лимфоциты (в том числе 7-киллеры), что ведет к аллергизации организма и формированию специфической реакции ГЗТ.
Кроме перечисленных, на внедрившиеся бактерии воздействует весь арсенал факторов неспецифической резистентности. Среди них важная роль в борьбе с грамположительными микробами принадлежит лизоциму
Напряженность специфического антибактериального иммунитета оценивают в серологических тестах по титру или динамике титра специфических антител, а также по состоянию его клеточного звена (например, по результатам кожно-аллергической пробы).
Особенности противовирусного иммунитета
Иммунную защиту макроорганизма при вирусных инфекциях осуществляет противовирусный иммунитет. Его особенности обусловлены двумя формами существования вируса: внеклеточной и внутриклеточной. Основными факторами, обеспечивающими противовирусный иммунитет, являются специфические антитела, Т-киллеры, интерферон и сывороточные ингибиторы вирусных частиц.
Специфические противовирусные антитела способны взаимодействовать только с внеклеточным вирусом, внутриклеточные структуры прижизненно для них недоступны. Антитела нейтрализуют вирусную частицу, препятствуя ее адсорбции на клетке- мишени, инфицированию и генерализации процесса, и обеспечивают иммунный фагоцитоз «маркированных» вирусных частиц. Специфические антитела также связывают вирусные белки и нуклеиновые кислоты, которые попадают в межклеточную среду и секреты после разрушения зараженных вирусами клеток.
Клетки, инфицированные вирусом и приступившие к его репликации, экспрессируют (представляют) вирусные белки на поверхности цитоплазматической мембраны в составе молекул антигенов гистосовместимости — HLA I класса (см. раздел 9.5.2.1). Изменение структуры этих антигенов гистосовместимости служит сигналом для активации Т-киллеров. Последние специфически распознают клетки макроорганизма, зараженные вирусом и приступившие к биосинтезу его компонентов, и уничтожают их (см. раздел 9.6.3).
Мощным противовирусным действием обладает интерферон (см. раздел 9.3.3). Он не влияет непосредственно на внеклеточный и внутриклеточный вирус, а адсорбируется на мембране клеток и индуцирует ферментные системы, подавляющие синтез компонентов вируса
Сывороточные ингибиторы неспецифически связываются с вирусной частицей и нейтрализуют ее, тем самым препятствуя адсорбции вируса на клетках-мишенях.
Напряженность противовирусного иммунитета оценивают преимущественно в серологических тестах — по нарастанию титра специфических антител в парных сыворотках в процессе болезни. Иногда определяют концентрацию интерферона в сыворотке крови.Особенности противогрибкового иммунитета
Благодаря особенностям своей структуры антигены грибов имеют относительно низкую иммуногенность. Они практически не индуцируют антителообразование (титры специфических антител остаются низкими), но стимулируют клеточное звено иммунитета. Основными действующими факторами противогрибкового иммунитета являются Г-киллеры и фагоциты, которые осуществляют антителозависимый лизис грибов.
При микозах наблюдается аллергизация макроорганизма. Кожные и глубокие микозы сопровождаются, как правило, реакцией ГЗТ (реакция IV типа) на антигены грибов. Грибковые поражения слизистых оболочек дыхательных и мочеполовых путей вызывают аллергизацию по типу ГНТ (реакция I типа). Напряженность противогрибкового иммунитета оценивают по результатам кожно-аллергических проб с грибковыми аллергенами.
Особенности иммунитета при протозойных инфекциях
Противопаразитарный иммунитет изучен недостаточно. Известно, что паразитарная инвазия сопровождается формированием в макроорганизме гуморального и клеточного иммунитета. В крови определяются специфические антитела классов М и G, которые чаще всего не обладают протективным действием. Активируется также звено Т-киллеров, что проявляется усилением аллерги- зации макроорганизма — реакции ГЗТ (реакции IV типа) на протозойные антигены. Активируется также фагоцитоз.
Характер противопаразитарного иммунитета определяется структурно-функциональными особенностями паразита и его жизненного цикла при инвазии макроорганизма. Многие паразиты обладают большой антигенной изменчивостью, что позволяет им избегать действия факторов иммунитета. Например, каждой стадии развития плазмодия малярии соответствуют свои специфические антигены.
Напряженность противопаразитарного иммунитета оценивают в серологических тестах по титру специфических антител и в кожно-аллергических пробах с протозойным антигеном.
Трансплантационный иммунитет
Трансплантационным иммунитетом называют иммунную реакцию макроорганизма, направленную против пересаженной в него чужеродной ткани (трансплантата). Знание механизмов трансплантационного иммунитета необходимо для решения одной из важнейших проблем современной медицины — пересадки органов и тканей. Многолетний опыт показал, что успех операции по пересадке чужеродных органов и тканей в подавляющем большинстве случаев зависит от иммунологической совместимости тканей донора и реципиента.
Иммунная реакция на чужеродные клетки и ткани обусловлена тем, что в их составе содержатся генетически чужеродные для организма антигены. Эти антигены получили название трансплантационных, или антигенов гистосовместимости (см. раздел 9.5.2.1). Комплекс антигенов гистосовместимости наиболее полно представлен на цитоплазматической мембране лейкоцитов крови — в системе HLA.
Реакция отторжения не возникает в случае полной совместимости донора и реципиента по антигенам гистосовместимости — такое возможно лишь у однояйцовых близнецов. Выраженность реакции отторжения во многом зависит от степени чуже- родности и объема трансплантируемого материала.
При контакте с чужеродными трансплантационными антигенами организм реагирует факторами клеточного и гуморального звеньев иммунитета. Основным фактором трансплантационного иммунитета являются Г-киллеры. Эти клетки после сенсибилизации антигенами донора мигрируют в пересаженную ткань (трансплантат) и оказывают на нее цитолитическое действие.
Механизм иммунного отторжения пересаженных клеток и тканей имеет две фазы. В первой фазе вокруг трансплантата и сосудов наблюдается скопление иммунокомпетентных клеток (лимфоидная инфильтрация), в том числе сенсибилизированных Г-киллеров. Во второй фазе клетки трансплантата разрушаются Г-киллерами, возникают воспаление и тромбоз кровеносных сосудов, нарушается питание трансплантата и последний гибнет. Погибшие клетки утилизируются фагоцитами. Формируется клон Г-клеток иммунологической памяти.
Повторная попытка пересадки тех же органов и тканей вызывает вторичный иммунный ответ, который протекает очень бурно и быстро заканчивается реакцией отторжения трансплантата. Этот феномен назван кризом отторжения.
Киллерный эффект лимфоцитов воспроизводится in vitro в опытах на культурах клеток и тканей. Возможен адоптивный перенос трансплантационного иммунитета с помощью активированных лимфоцитов от сенсибилизированного животного интактному.
Специфические антитела, которые образуются в ответ на чужеродные антигены (гемагглютинины, гемолизины, лейкотокси- ны, цитотоксины), имеют меньшее значение в формировании трансплантационного иммунитета. Однако возможен перенос трансплантационного иммунитета со специфической антисывороткой.
Напряженность трансплантационного иммунитета определяют в клеточных тестах in vitro.
Противоопухолевый иммунитет
В сложном организме наряду с нормальными физиологическими процессами, направленными на поддержание гомеостаза, происходят и дезинтегрирующие процессы, обусловленные ошибками и старением сложно организованной биологической системы. В частности, под действием различных факторов возникают мутации, в результате .которых появляются клетки-мутанты, и раковая трансформация клеток, которая ведет к образованию опухолей
Мутантные и раково-трансформированные клетки отличаются от нормальных клеток метаболическими процессами и антигенным составом. Так, мутантные клетки имеют измененные антигены гистосовместимости. Некоторые опухолевые клетки начинают синтезировать раково-эмбриональные антигены (см. раздел 9.5.1), которые не встречаются в норме в постнатальном периоде, но характерны для развития зародыша. Опухоли, индуцированные вирусами, а также химическими и физическими канцерогенами, имеют свои специфические антигены. Поскольку многие опухолевые антигены являются чужеродными для организма, они вызывают клеточные и гуморальные реакции.
Между состоянием иммунной защиты и развитием злокачественных опухолей существует тесная связь. Об этом свидетельствуют следующие факты:
повышенная заболеваемость злокачественными новообразованиями у лиц с первичными и вторичными иммунодефицитами, а также у лиц в пожилом и старческом возрасте в связи с понижением активности иммунной системы;
наличие у больных с опухолями специфических противоопухолевых антител и 7-киллеров, сенсибилизированных к опухолевым антигенам;
возможность экспериментального воспроизведения иммунитета к опухолям.
Основную роль в противоопухолевом иммунитете играют клеточные реакции. Мутантные клетки распознаются и уничтожаются Т киллерами, раково-трансформированные клетки — естественными киллерами. Адоптивный перенос иммунных Т- киллеров формирует в организме реципиента противоопухолевый иммунитет.
Гуморальный иммунитет имеет второстепенное значение и не всегда играет защитную роль. Специфические антитела могут, по-видимому, экранировать антигены опухолевых клеток от иммунных лимфоцитов. Пассивный перенос противоопухолевых антител не обусловливает у реципиента соответствующего иммунитета.
Отмечено, что противоопухолевый иммунитет эффективен против мутантных клеток и мало влияет на течение уже раз вившегося опухолевого процесса. Причиной, вероятно, является блокада антигенраспознающих рецепторов Г-киллеров опухолевыми антигенами, отсутствие защитного действия у противоопухолевых антител, иммуносупрессивное влияние опухоли.
Иммунодиагностика рака основана на определении в сыворотке крови раково-эмбриональных антигенов и антигенов, специфичных для каждой опухоли. Так, в настоящее время диагностируют рак печени, желудка, кишечника и др. Для лечения опухолей нашли применение иммуномодуляторы (интерлейкины, интерфероны), а также адъюванты (мурамилдипептиды, вакцина БЦЖ и др.).
Иммунный статус
Иммунный статус — это структурное и функциональное состояние иммунной системы индивидуума, определяемое комплексом клинических и лабораторных иммунологических показателей.
Таким образом, иммунный статус (иммунный профиль, иммунореактивность) характеризует способность организма данного конкретного индивидуума к иммунному ответу на определенный антиген в данный момент времени.
Наличие у человека иммунной системы автоматически подразумевает способность к иммунному ответу, но сила и форма иммунного ответа на один и тот же антиген у разных индивидуумов может варьировать в широких пределах. Поступление антигена в организм у одного человека вызывает антителооб- разование, у другого развивается гиперчувствительность, у третьего формируется иммунологическая толерантность и т.д. Иммунный ответ на один и тот же антиген у разных лиц может различаться не только по форме, но и силе, т.е. по степени выраженности (например, по различному уровню сывороточных антител у иммунизированных лиц).
Иммунореактивность различна не только у разных людей, она изменяется и у одного и того же человека в различные периоды его жизни. Так, иммунный статус у ребенка, особенно новорожденного или 1-го года жизни, когда иммунная система еще функционально не созрела, существенно отличается от иммунного статуса взрослого человека. У детей легче индуцировать иммунологическую толерантность, у них ниже титры сывороточных антител при иммунизации. Иммунный статус молодого и пожилого человека также различны. Тимус рассматривается как «биологические часы» иммунной системы Возрастная инволюция тимуса означает медленное угасание Т-клеточных реакций по мере старения. Способность к распознаванию «своего» и «чужого» с возрастом постепенно снижается, поэтому в старческом возрасте выше частота злокачественных новообразований. Частота обнаружения аутоантител с возрастом нарастает, в связи с чем старение иногда даже рассматривается как хронически текущая аутоагрессия.
Иммунный статус подвержен не только возрастным, но и суточным колебаниям в зависимости от биоритма. Эти колебания обусловлены изменениями гормонального фона и другими причинами.
Таким образом, при оценке иммунного статуса следует учитывать большой размах колебаний иммунологических параметров даже в норме.
Иммунная система филогенетически относится к молодым (наряду с нервной и эндокринной) и очень лабильным к различным внешним воздействиям. На состояние иммунной системы влияют климатогеографические, социальные, экологические (физические, химические и биологические) и «медицинские» факторы.
Из климатогеографических факторов на иммунный статус влияют температура, влажность, солнечная радиация, длина светового дня и др. Например, фагоцитарная реакция и кожные аллергические пробы менее выражены у жителей северных регионов, чем у южан. Вирус Эпштейна—Барр у представителей белой расы вызывает инфекционное заболевание — мононукле-
оз, у лиц негроидной расы — лимфому Беркитта, а у лиц желтой расы — назофарингеальную карциному, причем только у мужчин. Жители Африки менее подвержены заболеваниям дифтерией, чем население Европы.
К социальным факторам, влияющим на иммунный статус, относятся питание, жилищно-бытовые условия, профессиональные вредности и т.д. Важность сбалансированного рационального питания обусловлена тем, что с пищей в организм поступают вещества, необходимые для синтеза иммуноглобулинов и для построения иммунокомпетентных клеток. Поэтому нарушения питания быстро отражаются на состоянии иммунореактивности. Особенно важны для организма незаменимые аминокислоты и витамины, в частности А и С. Значительное влияние на иммунный статус организма оказывают жилищно-бытовые условия. Проживание в плохих жилищных условиях ведет к повышению инфекционной заболеваемости.
К производственным факторам, которые могут неблагоприятно воздействовать на организм, снижая его иммунореактивность, относятся ионизирующая радиация, разнообразные химические вещества, белковые аэрозоли, температура, шум, вибрация и др. Следовательно, профессиональные вредности, влияющие на иммунный статус, могут испытывать работники различных отраслей промышленности и сельского хозяйства.
На иммунный статус человека воздействуют экологические факторы, прежде всего физические, химические и биологические, обусловленные радиоактивным загрязнением территорий отработанным топливом из ядерных реакторов, утечкой радионуклидов из реакторов при авариях, широким применением пестицидов в сельском хозяйстве, промышленными выбросами химических предприятий, выхлопными газами автотранспорта, отходами биотехнологических производств заводами по производству антибиотиков, ферментов, гормонов, кормового белка и др.
Среди «медицинских» факторов на иммунный статус могут влиять различные диагностические и лечебные манипуляции и процедуры, лекарственная терапия, стресс, травмы, оперативные вмешательства.
Несмотря на вариабельность иммунологических показателей в норме и влияние на них разнообразных факторов, иммунный статус можно объективно оценить путем постановки комплекса лабораторных тестов, по которым можно судить о состоянии факторов неспецифической резистентности, гуморального (if- система) и клеточного (Г-система) иммунитета.
Оценку иммунного статуса проводят в клинике при трансплантации органов и тканей, при аутоиммунных и других иммунопатологических заболеваниях, тяжелых аллергиях, онкологических, инфекционных и многих соматических болезнях. Для заключения о состоянии иммунной системы необходимо руководствоваться: 1) данными общего клинического обследования; 2) состоянием факторов неспецифической резистентности; 3) показателями гуморального иммунитета; 4) показателями клеточного иммунитета; 5) результатами дополнительных тестов (например, состояние нейрогормональной системы, биохимические реакции).
Данные общего клинического обследования включают жалобы пациента, анамнез, описание клинического состояния, результаты общего анализа крови (в том числе абсолютное число лимфоцитов) и биохимического исследования. Знакомство врача с больным начинается обычно со сбора анамнеза. Уже на этом этапе врач может отметить наличие профессиональных вредностей, обратить внимание на рецидивирующую оппортунистическую инфекцию, аллергию. При сборе анамнеза важно знать, какие болезни были перенесены в детстве (особенно вирусные и паразитарные, часто «оставляющие» после себя иммунодефицит), наличие наследственных болезней, аллергий, злокачественных новообразований, сведения о перенесенных травмах и операциях, о наличии хронических соматических болезней, надо знать о тех лекарственных препаратах, которые пациент принимает.
При осмотре больного обращают внимание на чистоту кожных покровов и слизистых оболочек, на которых можно обнаружить проявления аллергических заболеваний, оппортунистических инфекций. При пальпации и перкуссии обращают внимание на состояние центральных (тимус) и периферических (лимфатические узлы) органов иммунной системы, их размер, спаенность с окружающими тканями, болезненность. При перкуссии и аускультации необходимо фиксировать симптомы, характерные для оппортунистических инфекций при поражении внутренних органов.
Заканчиваются клинические исследования общим анализом крови, в том числе определением абсолютного числа лимфоцитов и фагоцитов.
Для оценки состояния факторов неспецифической резистентности определяют состояние системы фагоцитоза и комплемента. Иногда при необходимости определяют содержание интерферона и лизоцима. Функциональную активность фагоцитов определяют по их подвижности, адгезии, способности к поглощению бактерий, дегрануляции клеток, внутриклеточному киллингу и образованию активных форм кислорода. С этой целью используют такие тесты, как определение фагоцитарного индекса, НСТ-тест (нитросиний тетразолий), хемилюминесцен- цию и др. Для оценки системы комплемента его обычно титруют в реакции гемолиза и результат учитывают по 50 % гемолизу.
Для изучения гуморального звена иммунитета определяют содержание иммуноглобулинов разных классов в сыворотке крови, титры специфических антител, катаболизм иммуноглобулинов, ГНТ, количество В-лимфоцитов в периферической крови, их бласттрансформацию под действием В клеточных митогенов и др.
Концентрацию иммуноглобулинов в сыворотке крови определяют радиальной иммунодиффузией по Манчини, титр специфических антител — в серологических реакциях, катаболизм иммуноглобулинов — радионуклидным методом. Для определения числа 5-лимфоцитов в периферической крови используют кластерный анализ (выявление специфических С/)-рецепторов с помощью моноклональных антител) или реакцию розеткообра- зования с эритроцитами; бласттрансформацию 5-лимфоцитов, свидетельствующую о функциональном состоянии этих клеток, оценивают после стимуляции митогенами (туберкулин и др.).Для оценки состояния клеточного звена иммунитета определяют количество Г-лимфоцитов и их субпопуляций в периферической крови, бласттран- сформацию Г-лимфоцитов под действием Г-кле- точных митогенов, содержание гормонов тимуса, уровень секретируемых цитокинов, а также ставят кожные пробы с аллергенами, проводят контактную сенсибилизацию динитрохлорбензолом (ДНХБ).
Для постановки кожных аллергических проб используют антигены, к которым в норме должна быть сенсибилизация у большинства людей (например, проба Манту с туберкулином или с ДНХБ). Число Г-лимфоцитов, а также субпопуляции Г-лим- фоцитов в периферической крови определяют кластерным анализом по специфическим С/)-рецепторам с помощью моноклональных антител или реакции розеткообразования с эритроцитами барана. Для оценки бластгрансформации Г-лимфоцитов их стимулируют Г-клеточными митогенами, такими как конкана- валин А (Кон А) или фитогемагглютинин (ФГА). Под влиянием митогенов зрелые лимфоциты трансформируются в лимфобласты, которые можно подсчитать под микроскопом или обнаружить по радиоактивной метке. Уровень гормонов тимуса (тимо- зина, тималина) и секретируемых цитокинов (интерлейкины, миелопептиды и др.) определяют иммуноферментным методом, основанным на применении специфических к ним моноклональных антител.
В качестве дополнительных тестов для оценки иммунного статуса можно использовать определение бактерицидности сыворотки крови, титрование СЗ- и С4-компонентов комплемента, содержания С-реактивного белка в сыворотке крови, ревматоидных факторов и других аутоантител и т.д.
Таким образом, оценку иммунного статуса проводят на основании результатов большого числа лабораторных тестов. Некоторые тесты сложны для исполнения, требуют дорогостоящих иммунохимических реагентов и лабораторного оборудования, а также высокой квалификации персонала, выполнимы в ограниченном круге лабораторий. Поэтому по рекомендации академика Р.В.Петрова все тесты разделены на 1-й и 2-й уровни. К тестам 1-го уровня отнесены основные показатели состояния иммунной системы; эти тесты могут быть выполнены в любой клинической иммунологической лаборатории и достаточны для первичного выявления лиц с иммунопатологией. Для более точной диагностики выявленных отклонений в состоянии иммунной системы используют тесты 2-го уровня.
В случае выявления отклонений от нормы показателей иммунного статуса назначают иммунокорригирующую терапию.Т
Тесты 1-го уровня
есты 2-го уровня
Определение количества и морфологии лимфоцитов в периферической крови (абс., %) Определение субпопуляций Т- и fi-лимфоцитов по С/)-антигенам или в реакции Е- и ЕЛ С-розеткообразован ия
Определение сывороточных иммуноглобулинов Определение фагоцитарной активности лейкоцитов Кожные тесты
Рентгенография, рентгеноскопия лимфоидных органов, а также других внутренних органов (прежде всего легких) в зависимости от клинических показаний
Гистохимический анализ лимфоидных органов
Анализ поверхностных маркеров мононуклеарных клеток с использованием моноклональных антител
Бласттрансформация Т- и В- лимфоцитов
Определение цитотоксичности Определение активности ферментов, ассоциированных с иммунной недостаточностью Определение синтеза и секреции цитокинов
Определение гормонов тимуса Анализ респираторного взрыва фагоцитов
Определение компонентов комплемента
Анализ смешанных клеточных культу
р
