
- •Глава 1. Предмет и задачи медицинской микробиологии и иммунологии
- •Мир микробов. Общие сведения
- •Микробиология — наука о микробах
- •Иммунология — наука об иммунитете
- •Связь микробиологии с иммунологией
- •История развития микробиологии и иммуно тогии
- •Isbn 5-225-04208-2 © Издательство «Медицина»,
- •Глава 1. Предмет и задачи медицинской микробиологии и иммунологии
- •Мир микробов. Общие сведения
- •Микробиология — наука о микробах
- •Связь микробиологии с иммунологией
- •История развития микробиологии и иммуно тогии
- •Глава 2. Классификация и морфология микробов
- •Систематика и номенклатура микробов
- •Классификация и морфология бактерий
- •Строение и классификация простейших
- •Основные методы изучения морфологии микробов
- •Глава 3. Физиология микробов
- •Физиология бактерий
- •Рост и размножение бактерий
- •Особенности физиологии грибов и простейших
- •Глава 4. Экология микробов
- •Распространение микробов в окружающей среде
- •Микрофлора почвы
- •4 1.2. Микрофлора воды
- •Микрофлора продуктов питания
- •Действие излучения
- •Действие химических веществ
- •Действие биологических факторов
- •Уничтожение микробов в окружающей среде
- •Стерилизация
- •Дезинфекция
- •Асептика и антисептика
- •Санитарная микробиология
- •Микробиологический контроль лекарственных средств
- •Глава 5. Генетика микробов
- •5‘ Конец
- •Фосфат fc-q
- •Особенности генетики вирусов
- •4. Применение генетических методов в диагностике инфекционных болезней
- •Метод молекулярной гибридизации
- •Глава 6. Биотехнология. Генная инженерия
- •Предмет и задачи биотехнологии
- •3. Объекты и процессы в биотехнологии
- •Генетическая инженерия в биотехнологии
- •Глава 7. Противомикробные препараты
- •Химиотерапевтические лекарства
- •Глава 8. Учение об инфекции
- •Понятие об инфекционной болезни
- •Участники инфекционного процесса
- •Стадии инфекционного процесса и его уровни
- •Патогенные и условно-патогенные микробы
- •Роль окружающей среды
- •Характерные особенности инфекционных болезней
- •8 7. Формы инфекционного процесса
- •Глава 9. Учение об иммунитете
- •Виды иммунитета
- •Созревание, размножение, дифферениировка
- •Патология иммунной системы
- •Реакции антиген — антитело и их практическое применение
- •Реакция преципитации
- •Реакция с использованием меченых антител или антигенов
- •Глава 10. Иммунопрофилактика и иммунотерапия болезней человека
- •Вакцины
- •Убитые вакцины
- •Лекарственные формы вакцин
- •Массовые способы вакцинации
- •10.2.7. Производство вакцин и их контроль
- •Бактериофаги
- •Эубиотики
- •Диагностические препараты
- •Классификация микробов по степени их биологической опасности. Номенклатура микробиологических лабораторий
- •112. Санитарно-техническое оснащение лаборатории
- •Правила работы в микробиологической лаборатории
- •Принципы микробиологической диагностики инфекционных болезней
- •11.S. Принципы иммунологической диагностики болезней человека
- •Глава 12. Возбудители кишечных инфекций
- •Возбудители бактериальных кишечных инфекций
- •Возбудители эшерихиозов
- •Возбудители дизентерии
- •Возбудители брюшного тифа и паратифов
- •Возбудители кишечного иерсиниоза и псевдотуберкулеза
- •1.7. Возбудители бруцеллеза
- •Возбудитель хеликобактериоза
- •Возбудители лептоспироза
- •Вирусы энтеральных гепатитов
- •Возбудитель лямблиоза
- •Глава 13 возбудители респираторных инфекционных болезней
- •Возбудители вирусных респираторных инфекций
- •Вирусы гриппа
- •2.2. Вирусы — возбудители других острых респираторных вирусных инфекций
- •Вирус эпидемического паротита
- •Вирус краснухи
- •Вирус оспы обезьян
- •Вирус ветряной оспы и опоясывающего герпеса
- •Глава 14. Возбудители кровяных инфекционных болезней
- •Возбудители бактериальных кровяных инфекций
- •Возбудитель туляремии
- •Возбудители риккетсиозов
- •Глава 15. Возбудители инфекционных болезней наружных покровов
- •Возбудители грибковых инф кций
- •Глава 16. Общие черты зоонозных инфекций
- •Глава 17. Онкогенные вирусы
- •Глава 18. Медленные вирусные инфекции
- •9Теории 210
Виды иммунитета
Различают иммунитет врожденный и приобретенный.
Врожденным (или видовым) иммунитетом называют присущую данному виду животных или человека генетически закрепленную (поэтому его называют иногда генетическим) невосприимчивое ь (нечувствительность I к определенным возбудителям болезней или антигенам.
Этот вид иммунитета передается из поколения в поколение и обусловлен генетическими и биологическими особенностям
ивида. В результате этого, например, микробы или не воспринимаются как генетически чужеродные вещества, или не находят условий для своего жизнеобеспечения и существования в организме. Видовой иммунитет неспецифичен и может быть абсолютным и относительным. Например, человек нечувствителен к некоторым возбудителям (поэтому не болеет чумой крупного рогатого скота, вирусными инфекциями, поражающими птиц), к фагам бактерий и т.д. (абсолютный видовои иммунитет). Однако нечувствительная к столбнячному токсину лягушка может за болеть столбняком, если повысить температуру ее тела. В классических опытах JI.Пастера куры заболевали сибирской язвой, если их лапы переохлаждали.
Приобретенный иммунитет формируется в процессе жизни индивидуума, в результате перенесенного инфекционного заболевания (постинфекционный иммунитет) или в результате вакцинации (поствакциналъный иммунитет), а также пассивной передачи антител от иммунной матери плоду при внутриутробном развитии, при серотерапии или гемотрансфузиях. Приобре тенный иммунитет может возникать естественным путем (естественно приобретенный иммунитет) как результат перенесенных инфекций или искусственным путем (искусственно приобретенный иммунитет) после иммунизации, вакцинации, серотерапии и других манипуляций.
Иммунитет по своему механизму бывает активным и пассивным. Активный иммунитет — это вид невосприимчивости, который формируется в результате активного вовлечения в процесс иммунной системы под влиянием конкретного микроба или антигена, например при вакцинации или инфекции. Пассивный иммунитет обеспечивается введением в организм извне уже готовых специфически «настроенных» к определенному антигену иммунореагентов, например иммуноглобулинов, иммунных сывороток или сенсибилизированных лимфоцитов. Как активный, так и пассивный иммунитеты могут быть гуморальными (обусловлены преимущественно антителами), клеточными (обусловлены преимущественно иммунными клетками) и гуморально-клеточными (смешанная форма реагирования).
Если активный иммунитет может быть напряженным и длительным, то пассивный — непродолжительным и кратковременным. Создание пассивного иммунитета используется для экстренной профилактики, а также для лечения инфекционных болезней, особенно при токсикоинфекциях (столбняк, ботулизм).
Различают также иммунитет стерильный и нестерильный. Стерильный иммунитет сохраняется и в отсутствие антигена в организме, а нестерильный существует только при наличии в организме возбудителя (например, при туберкулезе).
В зависимости от локализации иммунитет может быть также общим и местным. Местный иммунитет осуществляет защиту кожных покровов и слизистых оболочек — наиболее вероятных входных ворот для экзогенных инфекционных агентов (подробнее см. раздел 9.7). Общий иммунитет обеспечивает генерализо ванную иммунную защиту внутренней среды макроорганизма. Местный и общий иммунитет могут переходить друг в друга при прогрессировании инфекционного процесса.
По направленности к тому или иному агенту иммунитет подразделяют на противобактериальныи, противовирусный, противогрибковый, противогельминтный, антитоксический противоопухолевый, трансплантационный и т.д.
Факторы неспецифической резистентности организма
В неспецифической защите от антигенов важную роль, как указывалось выше, играют три барьера: механический, физикохимический и иммунобиологический. Основными защитными факторами этих барьеров являются кожа и слизистые оболочки, ферменты, фагоцитирующие клетки, комплемент, интерферон, ингибиторы сыворотки крови.
Кожа и слизистые оболочки
Многослойный эпителий здоровой кожи и слизистых оболочек непроницаем для микробов и макромолекул. Однако при малозаметных микроповреждениях, воспалительных изменениях, укусах насекомых, ожогах и травмах через кожу и слизистые оболочки могут проникать микробы и макромолекулы. Вирусы и некоторые бактерии могут проникать в макроорганизм меж- клеточно, через клетки и с помощью фагоцитов, переносящих поглощенных микробов через эпителий слизистых оболочек. Свидетельством этому служат инфицирование в естественных условиях через слизистые оболочки верхних дыхательных путей, легких, ЖКТ и урогенитального тракта, а также возможность пероральной и ингаляционной иммунизации живыми вакцинами.
Физико-химическая защита
На чистои и неповрежденной коже обычно содержится мало микробов, так как потовые и сальные железы постоянно выделяют на поверхности кожи вещества, обладающие бактерицидным действием (уксусная, муравьиная, молочная кислоты).
Желудок также является барьером для проникающих перорально бактерий, вирусов, антигенов, так как эти агенты инактивируются и разрушаются под влиянием кислого содержимого желудка (pH 1,5—2,5) и ферментов. В кишечнике инактивирующими факторами служат ферменты и бактериоцины, образуемые нормальной микробной флорой кишечника, а также трипсин, панкреатин, липаза, амилазы и желчь.
Иммунобиологическая защита
Фагоцитоз. Фагоцитоз (от греч. phagos — пожираю, cyios — клетка), открытый и изученный И.И.Мечниковым, является одним из основных мощных факторов, обеспечивающих резистентность организма, защиту от чужеродных и инородных веществ, в том числе микробов. Это наиболее древняя форма иммунной защиты, которая появилась уже у кишечнополостных. Механизм фагоцитоза состоит в поглощении, переваривании, инактива ции инородных для организма веществ специализированными клетками — фагоцитами. К фагоцитирующим клеткам И.И.Мечников отнес макрофаги и микрофаги. В настоящее время все фагоциты объединены в единую мононуклеарную фагоцитирующую систему. В нее включены тканевые макрофаги (альвеолярные, перитонеальные и др.), клетки Лангерганса (белые отро- стчатые эпидермоциты) и Гренштайна (эпидермоциты кожи), клетки Купфера (звездчатые ретикулоэндотелиоциты), эпители- оидные клетки, нейтрофилы и эозинофилы крови и др.
Функции фагоцитов очень обширны. Фагоциты 1) удаляют из организма отмирающие клетки и их структуры (эритроциты, раковые клетки); 2) удаляют неметаболизируемые неорганические вещества, попадающие во внутреннюю среду организма тем или иным путем (например, частички угля, минеральную и другую пыль, проникающую в дыхательные пути); 3) поглощают и инактивируют микробы (бактерии, вирусы, грибы), их останки и продукты; 4) синтезируют разнообразные биологически активные вещества, необходимые для обеспечения резистентности организма (некоторые компоненты комплемента, лизоцим, интерферон, интерлейкины и др.); 5) участвуют в регуляции иммунной системы; 6) осуществляют «ознакомление»
хелперов с антигенами. Следовательно, фагоциты являются, с одной стороны, своеобразными «мусорщиками», очищающими организм от всех инородных частиц независимо от их природы и происхождения (неспецифическая функция), а с другой стороны, участвуют в процессе специфического иммунитета путем представления антигена иммунокомпетентным клеткам (Т- и В- лимфоцитам) и в регуляции их активности.
Процесс фагоцитоза, т.е. поглощения инородного вещества клетками, имеет несколько стадий: 1) приближение фагоцита к объекту поглощения (хемотаксис); 2) адсорбция поглощаемого вещества на поверхности фагоцита; 3) поглощение веществаРис. 9.1. Функциональные структуры фагоцита.
АГ — антиген; ДТ — антигенная детерминанта; Ф — фагоцитоз; ФС — фаго- сома; ЛС — лизосома; ЛФ — лизосомные ферменты; ФЛ — фаголизосома; МАГ — метаболизированный антиген; Г-П — антиген гистосовместимости II класса (HLA-DR, /о); /с-рецептор для /г-фрагмента молекулы иммуноглобулина; С/, СЗа, С5а — рецепторы для компонентов комплемента; ИЛ-2 — рецептор для ИЛ-2; Г — рецептор для гистамина; С — секреция компонентов комплемента; ПР — секреция перекисных радикалов; ИЛ-1 — секреция ИЛ-1; ФИО — секреция фактора некроза опухолей
путем инвагинации клеточной мембраны с образованием в цитоплазме фагосомы, содержащей вещество; 4) слияние фаго- сомы с лизосомой клетки с образованием фаголизосомы; 5) переваривание вещества в фаголизосоме с помощью ферментов.
Для осуществления своих функций (рис. 9.1) фагоциты имеют рецепторный аппарат и набор литических ферментов. На цитоплазматической мембране находятся, например, рецепторы для компонентов комплемента, /с-фрагментов иммуноглобулинов, а также антигены гистосовместимости I и II классов. Внутриклеточные лизосомы содержат около 40 различных ферментов, способных «переварить» практически любое вещество.
Фагоциты имеют развитую поверхность и очень подвижны. Они способны активно перемещаться к объекту фагоцитоза по градиенту концентрации особых биологически активных веществ — хемоаттрактантов или хемокинов. Такое передвижение названо хемотаксисом (от греч. chymeia — искусство сплавления металлов и taxis — расположение, построение). Это АТФ-зави- симый процесс, в котором участвуют сократительные белки актин и миозин. К хемоаттрактантам относятся, например, фрагмент
ыкомпонентов комплемента (СЗа и С5а), некоторые лимфоки- ны, продукты распада клеток и бактерий.
Адсорбция вещества на поверхности фагоцита осуществляется за счет слабых химических взаимодействий и происходит либо спонтанно, неспецифически, либо путем связывания со специфическими рецепторами (для иммуноглобулинов, компонентов комплемента). «Захват» фагоцитом вещества вызывает выработку большого количества перекисных радикалов («кислородный взрыв»), которые вызывают необратимые летальные повреждения как цельных клеток, так и отдельных молекул.
Поглощение адсорбированного на фагоците вещества происходит путем эндоцитоза. Это энергозависимый процесс, связанный с преобразованием энергии химических связей молекулы АТФ в сократительную активность внутриклеточных актина и миозина. Окружение фагоцитируемого вещества двуслойной цитоплазматической мембраной и образование изолированного внутриклеточного пузырька — фагосомы напоминает «застегивание молнии». Внутри фагосомы продолжается атака поглощенного вещества перекисными радикалами.
После слияния фагосомы и лизосомы и образования в цитоплазме фаголизосомы происходит активация лизосомных ферментов. Эти ферменты разрушают поглощенное вещество до элементарных составляющих, пригодных для дальнейшей утилизации для нужд самого фагоцита. При этом случайный небольшой фрагмент перевариваемого вещества (размером до 9 аминокислот) может быть включен в молекулу антигена гистосовместимости II класса и в ее составе выставлен (экспрессирован) на поверхности фагоцита для «ознакомления» с ним Г-хелперов (см. раздел 9.4.4). Непереваренные остатки вещества «хоронятся» вместе с погибшим от старости фагоцитом. Ферментативное расщепление вещества может также происходить вне- клеточно при выходе ферментов за пределы фагоцита.
Фагоциты, как правило, «переваривают» захваченные бактерии, грибы, вирусы, осуществляя таким образом завершенный фагоцитоз. Однако иногда этот процесс бывает незавершенным: поглощенные бактерии (например, гонококки) или вирусы (например, возбудители ВИЧ-инфекции, натуральной оспы) блокируют ферментативную активность фагоцита, не погибают, не разрушаются и даже размножаются в фагоцитах. Такой процесс назван незавершенным фагоцитозом.
Процесс фагоцитоза активируется под влиянием антител- опсонинов, адъювантов, комплемента, иммуноцитокинов (интерлейкин-2) и других факторов. Механизм активирующего действия антител основан на связывании комплекса антиген- антитело с рецепторами для /с-фрагментов иммуноглобулинов на фагоцитах. Аналогично действует комплемент, который способствует связыванию на специфических для него рецепторах фагоцита (С рецепторы) комплекса антиген антитело. Адъюванты укрупняют молекулы антигена и таким образом облегчают процесс его поглощения, так как активность фагоцитоза зависит от величины поглощаемой частицы.
Активность фагоцитов характеризуется фагоцитарными показателями и опсоно-фагоцитарным индексом. Фагоцитарные показатели оценивают по числу бактерий, поглощенных или переваренных одним фагоцитом в единицу времени. Опсоно- фагоцитарный индекс представляет собой отношение фагоцитарных показателей, полученных с сывороткой, содержащей опсонины, и контролем. Эти показатели используют в клинической практике для определения иммунного статуса пациента.
Тромбоциты. Тромбоциты также играют важную роль в иммунитете. Они возникают из мегакариоцитов, пролиферацию которых усиливает интерлейкин-11 (ИЛ-11). Тромбоциты имеют на своей поверхности рецепторы для IgG и IgE, компонентов комплемента (С/ и СЗ), а также антигены гистосовместимости I класса. На тромбоциты влияют образующиеся в организме иммунные комплексы антиген—антитело и активированный комплемент. В результате такого воздействия тромбоциты выделяют биологически активные вещества (гистамин, лизоцим, р-лизины, лейкоплакины, простагландины и др.), которые участвуют в процессах иммунитета и воспаления.
Комплемент. Комплемент является одним из важных факторов гуморального иммунитета, играющим большую роль в защите организма от антигенов. Он был открыт в 1899 г. французским иммунологом Ж.Борде, назвавшим его «алексином». Современное название комплементу дал П.Эрлих.
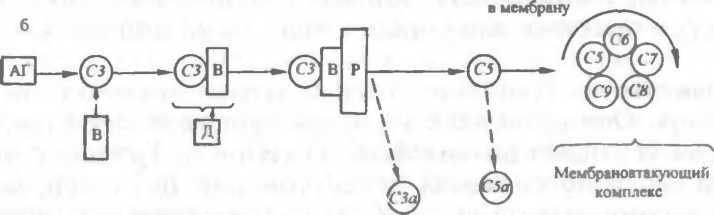
Комплемент представляет собой сложный комплекс белков сыворотки крови, находящийся обычно в неактивном состоянии и активирующийся при образовании комплекса антигена с антителом или при агрегации антигена, т.е. в начале иммунного процесса. В состав комплемента входят 20 взаимодействующих между собой белков, 9 из которых являются основными компонентами комплемента, их обозначают как С/, С2, СЗ...С9. Важную роль играют также факторы В, Z) и Р (пропердин). Белки комплемента относятся к глобулинам и различаются по ряду физико-химических свойств. Компоненты комплемента синтезируются в большом количестве (составляют 5—10 % всех белков крови), часть из них образуют фагоциты.
Функции комплемента многообразны: а) он участвует в лизисе микробных и других клеток (цитотоксическое действие); б) обладает хемотаксической активностью, в) участвует в анафилак
сии; г) участвует в фагоцитозе. Следовательно, комплемент является компонентом многих иммунолитических реакций, направленных на освобождение организма от микробов и других чужеродных клеток и антигенов (например, опухолевых клеток, трансплантата).
М
CI...C9 — компоненты комплемента, АГ — антиген, АТ — антитело, В и D — протеины (см. в тексте), Р — пропердин.
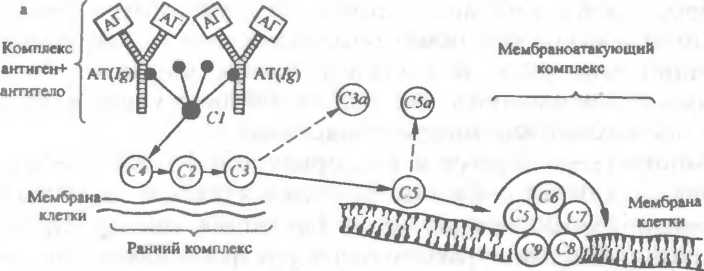
По классическому пути комплемент активируется комплексом антиген- антитело.
Для этого достаточно участия в связывании антигена одной молекулы IgM или двух молекул IgG. Процесс начинается с присоединения к комплексу антиген- антитело компонента С/, который распадается на субъединицы Clq, Clr и С Is. Далее в реакции участвуют последовательно активированные «ранние» компоненты комплемента* С4~> С2 —> СЗ. Эта реакция имеет характер усиливающегося каскада: одна молекула предыдущего компонента активирует несколько молекул последующего. «Ран
ний» компонент комплемента СЗ активирует компонент С5, который обладает свойством прикрепляться к мембране клетки. На компоненте С5 путем последовательного присоединения «поздних» компонентов С6, С7, С8 и С9 образуется литический или мембраноатакующий комплекс, который нарушает целостность мембраны (образует в ней дыру), в результате чего клетка погибает.
Альтернативный путь активации комплемента происходит без участия антител. Этот путь характерен для защиты от грамотрицательных микробов. Каскадная цепная реакция при альтернативном пути начинается с взаимодействия антигена (например, полисахарида) с протеинами В и D и пропердином (Р), затем активируется компонент СЗ. Далее реакция идет так же, как и при классическом пути: образуется мембраноатакующий комплекс.
В процессе активации комплемента образуются продукты протеолиза его компонентов — субъединицы СЗа и СЗЬ, С5а и С5Ь и другие, которые обладают высокой биологической активностью. Например, СЗа и С5а участвуют в анафилактических реакциях, являются хемоаттрактантами, СЗЬ является опсонином и т.д.
Сложная каскадная реакция комплемента осуществляется с участием Са2+ и Mg2*.
Лизоцим. Особая и важная роль в естественной резистентности принадлежит лизоциму, открытому в 1909 г. П.Л.Лащенко и выделенному и изученному в 1922 г. А.Флемингом.
Лизоцим — это протеолитический фермент мурамидаза (от лат. murus — стенка) с молекулярной массой 14 000—16 ООО. Он синтезируется макрофагами, неитрофилами и другими фагоцитирующими клетками и постоянно поступает в жидкости и ткани организма. Фермент содержится в крови, лимфе, слезах, молоке, сперме, в урогенитальном тракте, на слизистых оболочках дыхательных путей, в ЖКТ. Лизоцим отсутствует лишь только в спинномозговой жидкости и передней камере глаза. В сутки синтезируется несколько десятков граммов фермента. Механизм действия лизоцима сводится к разрушению гликопротеинов (мурамилдипептида) клеточной стенки бактерий, что приводит к их лизису и способствует фагоцитозу поврежденных клеток. Следовательно, лизоцим обладает бактерицидным и бактерио- статическим действием. Кроме того, лизоцим активирует фагоцитоз и образование антител.
Нарушение синтеза лизоцима ведет к снижению резистентности организма, возникновению воспалительных и инфекционных болезней. В таких случаях для лечения используют препарат лизоцима, получаемый из яичного белка или путем биосинтеза, так как он продуцируется некоторыми бактериями.
Химическая структура лизоцима известна, он синтезирован химическим способом.
Интерферон. Интерферон относится к важным защитным белкам иммунной системы. Он был открыт в 1957 г. А.Айзексом и Ж.Линдеманом при изучении интерференции вирусов (от лат. inter — между и ferens — несущий), т.е. явления, когда животные или культуры клеток, инфицированные одним вирусом, становились нечувствительными к заражению другим вирусом. Оказалось, что интерференция обусловлена образующимся при этом белком, обладающим защитным противовирусным свойством. Этот белок назвали интерфероном. В настоящее время интерферон хорошо изучен, известны его структура и свойства, он широко используется в медицине как лечебное и профилактическое средство.
Интерферон представляет собой семейство гликопротеинов с молекулярной массой от 15 ООО до 70 ООО, которые синтезируются клетками иммунной системы и соединительной ткани. В зависимости от того, какими клетками синтезируется интерферон, различают его три вида: а, р и у.
Интерферон-а вырабатывается лейкоцитами, отсюда он получил название лейкоцитарного. Интерфе рон-р называют фибробластным, поскольку он синтезируется фибробластами — клетками соединительной ткани. Интерферон-у — иммунный, так как он вырабатывается Т лимфоцитами.
Интерферон синтезируется клетками постоянно, и его концентрация в крови держится на уровне примерно 2 МЕ/мл [1 международная единица (ME) — это количество интерферона, защищающее культуру клеток от 1 ЦПД50 вируса]. Продукция интерферона резко возрастает при инфицировании вирусами, а также при воздействии индукторов интерферона, например РНК, ДНК, сложных полимеров.
Помимо противовирусного, интерферон обладает противоопухолевым действием, так как задерживает пролиферацию (размножение) опухолевых клеток, а также иммуномодулирующей активностью, стимулируя фагоцитоз, естественные киллеры, регулируя антителообразование 5-лимфоцитами, активируя экспрессию главного комплекса гистосовместимости.
Механизм действия интерферона сложен. Интерферон непосредственно на вирус вне клетки не действует, а связывается со специальными рецепторами клеток и влияет на репродукцию вируса в клетке на стадии синтеза белков.
Действие интерферона тем эффективнее, чем раньше он начинает синтезироваться или поступать в организм извне. Поэтому его используют с профилактической целью при многих вирусных инфекциях (например, гриппе), а также с лечебной целью при хронических вирусных инфекциях, таких как парентеральные гепатиты (В, С, D), герпес, а также рассеянный склероз и др. Интерферон дает положительные результаты при лечении злокачественных опухолей и заболеваний, связанных с иммунодефицитами.
Интерфероны обладают видоспецифичностью: интерферон человека менее эффективен для животных, и наоборот. Однако видоспецифичность относительна. Получают интерферон двумя способами: а) путем инфицирования безопасным вирусом лейкоцитов или лимфоцитов крови человека, в результате чего инфицированные клетки синтезируют интерферон, который затем выделяют и готовят из него препарат интерферона; б) генно- инженерным — путем выращивания в производственных условиях рекомбинантных штаммов бактерий, способных продуцировать интерферон (см. главу 6). Обычно применяют рекомбинантные штаммы псевдомонад, кишечной палочки со встроенными в их ДНК генами интерферона.
Интерферон, полученный генно-инженерным способом, называется рекомбинантным В нашей стране рекомбинантный интерферон получил официнальное название «реаферон». Производство реаферона во многом эффективнее и дешевле, чем лейкоцитарного интерферона. Рекомбинантный интерферон широко применяется как профилактическое и лечебное средство при вирусных инфекциях, новообразованиях и иммунодефицитах
Защитные белки сыворотки крови. К защитным белкам сыворотки крови относятся некоторые протеины, участвующих в защите организма от микробов и других антигенов: белки острой фазы, опсонины, пропердин, р-лизин, фибронектин и др.
К белкам острой фазы относится С-реактивный белок, противовоспалительные и другие белки, которые вырабатываются в печени в ответ на повреждение тканей и клеток. С-реактивный белок способствует опсонизации бактерий и является индикатором воспаления.
Пропердин представляет собой у-глобулин нормальной сыворотки крови. Он способствует активации комплемента по альтернативному пути и таким образом участвует во многих иммунологических реакциях.
Фибронектин — универсальный белок плазмы крови и тканевых жидкостей, синтезируемый макрофагами. Он обеспечивает опсонизацию антигенов и связывание клеток с чужеродными веществами, например фагоцитов с антигенами и микробами, «экранирует» дефекты эндотелия сосудов, препятствуя тромбо- образованию.
р-Лизины — белки сыворотки крови, синтезируемые тромбоцитами, повреждают цитоплазматическую мембрану бактерий.
Иммунная система человека
Для осуществления специфической функции надзора за постоянством внутренней среды организма, сохранения его биологической и видовой индивидуальности, защиты от появления генетически .чужеродных молекул и клеток в организме человека существует иммунная система. Эта система достаточно древняя: ее зачатки обнаружены еще у круглоротых. Принцип действия иммунной системы основан на распознавании «свой — чужой».
Иммунная система — это специализированная, анатомически обособленная лимфоидная ткань. Она «разбросана» по всему организму в виде различных лимфоидных образований и отдельных клеток. Суммарная масса этой ткани составляет 1—2 % массы тела. Анатомически иммунная система подразделена на центральные и периферические органы. К центральным органам относятся костный мозг и тимус (вилочковая железа), а к периферическим — лимфатические узлы, скопления лимфоидной ткани [групповые лимфатические фолликулы (пейеровы бляшки), миндалины], а также селезенка, кровь и лимфа. Основу лимфоидной ткани составляют эпителиальные и ретикулярные клетки. Основными функциональными клетками являются лимфоциты. Их число в организме достигает 1012. Кроме лимфоцитов, к функциональным клеткам в составе лимфоидной ткани относят мононуклеарные и гранулярные лейкоциты и тучные клетки. Часть клеток сосредоточена в отдельных органах иммунной системы, другие клетки свободно перемещаются по всему организму. Схематическое строение иммунной системы изображено на рис. 9.3.
Центральные органы иммунной системы
Центральными органами иммунной системы являются костный мозг и вилочковая железа, или тимус. Это органы воспроизведения клеток иммунной системы. Здесь происходят «рождение», размножение (пролиферация), дифференцировка и «обучение» иммунокомпетентных клеток. Внутри тела человека эти органы имеют как бы центральное расположение.
У
птиц к центральным органам иммунной
системы относят сумку Фабрициуса (bursa
Fabricii),
локализованную в области клоаки. В этом
органе происходят созревание и
размножение популяции лимфоцитов —
продуцентов антител, вследствие чего
они получили название «В-лимфоцитов»
(см. раздел 9.4.3).
Аденоиды
Миндалина
Левая
подключичная
вена
Вилочковая
железа
Толстая
кишка
Аппендикс
Лимфатические
сосуды тоней
Г
рупповые лимфати ческие фолликулы
Рис.
9.3. Лимфоидная ткань и органы человека.
У млекопитающих этого анатомического образования нет, и его функции в полной мере выполняет костный мозг. Однако традиционное название «5-лимфоциты» сохранилось.
Костный мозг локализуется в губчатом веществе костей (эпифизы трубчатых костей, грудина). В костном мозге находятся полипотентные стволовые клетки (ППСК), которые являются родоначальницами всех форменных элементов крови и соответственно иммунокомпетентных клеток. В строме костного мозга происходят дифференцировка и размножение популяции В- лимфоцитов, которые затем разносятся по всему организму кровотоком. Здесь же образуются предшественники лимфоцитов, которые впоследствии мигрируют в тимус, — это популяция 7’-лимфоцитов. Фагоциты и их предшественники также образуются в костном мозге.
Вилочковая железа (тимус, или зобная железа) располагается в верхней части загрудинного пространства. Этот орган появляется в период внутриутробного развития, к моменту рождения достигает массы 10—15 г. Тимус окончательно созревает к 5- летнему возрасту, а максимального размера достигает к 10—
годам жизни (масса 30—40 г). После периода полового созревания начинается инволюция органа — происходит замещение лимфоидной ткани жировой и соединительной.
Тимус имеет долчатое строение. В его стуктуре различают мозговой и корковый слои. В строме тимуса находится большое количество эпителиальных клеток — тимоцитов («клетки-нянь- ки»), которые своими отростками образуют мелкоячеистую сеть, где располагаются лимфоциты.
Предшественники Г-лимфоцитов (см. раздел 9.4.3), которые образовались из стволовой клетки в костном мозге, поступают в корковый слой тимуса. Здесь под влиянием гормонов тимуса (тимозин, тимопоэтин и др.), иммуноцитокинов и других факторов микроокружения предшественники активно размножаются и дифференцируются (превращаются) в зрелые Т-пим- фоциты. Кроме того, в этой зоне происходит «обучение» Т- лимфоцитов распознаванию чужеродных антигенных детерминант. При этом клетки, которые воспринимают биополимеры собственного организма как чужеродные (см. раздел 9.5.2), нейтрализуются и уничтожаются. Зрелые формы 7Чпимфоцитов мигрируют с кровотоком из тимуса в другие органы и ткани.
Созревание и «обучение» 7’-лимфоцитов в тимусе имеют важное значение для формирования иммунитета. Отмечено, что отсутствие или недоразвитие тимуса ведет к резкому снижению эффективности иммунной защиты макроорганизма. Такое явление наблюдается при врожденном дефекте развития тимуса — аплазии или гипоплазии органа (см. раздел 9.10), его хирургическом удалении или радиационном поражении.
Периферические органы иммунной системы
К периферическим органам и тканям иммунной системы относят селезенку, аппендикс, миндалины глоточного кольца, групповые лимфатические фолликулы (пейеровы бляшки), лимфатические узлы, кровь, лимфу и др. В этих органах локализуются иммуно- компетентные клетки, которые непосредственно осуществляют иммунный надзор, а также размножаются и претерпевают окончательную дифференцировку. В функциональном плане перифе рические органы иммунной системы могут быть подразделены на органы контроля жидких сред организма (лимфатические узлы, селезенка), контроля его кожных и слизистых покровов (лимфатические фолликулы) и контроля внутренней среды (тканевые мигрирующие клетки).
Групповые лимфатические фолликулы (пейеровы бляшки) являются скоплением лимфоидной ткани в слизистой оболочке тонкой кишки. Такие образования также находятся в червеобразном отростке слепой кишки — аппендиксе. Кроме того, на всем протяжении ЖКТ, начиная с пищевода и кончая анальным отверстием, располагаются единичные лимфатические фолликулы. Они обеспечивают местный иммунитет слизистой оболочки кишки и ее просвета, а также регулируют видовой и количественный состав микрофлоры кишки.
Скопление лимфоидных элементов в виде миндалин глоточного кольца обеспечивает местный иммунитет в носоглотке, ротовой полости и верхних дыхательных путях, защищает их слизистые оболочки от внедрения микробов и других генетически чужеродных агентов воздушно-капельным или воздушнопылевым путем, а также регулирует видовой и количественный состав локальной нормальной микрофлоры.
Лимфатические узлы — мелкие округлые анатомические образования бобовидной формы, которые располагаются по ходу лимфатических сосудов. Каждый участок тела имеет региональные лимфатические узлы. В организме человека насчитывается до 1000 лимфатических узлов. Лимфатические узлы выполняют функцию биологического сита через них фильтруется лимфа задерживаются и концентрируются антигены. В пределах узла происходит антигенная стимуляция иммунокомпетентных клеток и включается система специфического иммунного реагирования, направленная на обезвреживание антигена.
В лимфатическом узле различают корковое и мозговое вещество. В корковом веществе выделяют поверхностный корковый слой и глубокую кору, или паракортикальную зону. В поверхностном корковом слое расположены лимфатические фолликулы. Это элементарная структурная единица лимфатического узла. Внутри лимфатических фолликулов находятся центры размно
жения лимфоцитов (герминативные центры). Мозговое вещество образовано тяжами соединительной ткани, между которыми располагаются лимфоциты разной степени зрелости. Т- и В- лимфоциты составляют подавляющее большинство иммуноком- петентных клеток лимфатического узла. Они постоянно мигрируют в крово- и лимфоток и обратно. В строме узла также много ретикулярных дендритных клеток и фагоцитов. Они захватывают и перерабатывают антигены.
Селезенка — орган, через который фильтруется вся кровь. Он располагается в левой подвздошной области и имеет дольчатое строение. В селезенке различают первичные лимфоидные фолликулы, которые окружают артерии по их ходу, и вторичные, располагающиеся на границах первичных фолликулов. Периар- териальные лимфоидные скопления заселены преимущественно Г-лимфоцитами, а вторичные — 5-лимфоцитами и плазматическими клетками. Кроме того, в строме селезенки обнаруживают фагоциты и ретикулярные дендритные клетки. В селезенке, как в сите, задерживаются антигены, оказавшиеся в кровотоке, и «состарившиеся» эритроциты. Поэтому этот орган еще называют «кладбищем эритроцитов». Здесь происходят антигенная стимуляция иммунокомпетентных клеток, развитие специфической иммунной реакции на антиген и обезвреживание последнего.
Лимфа — жидкая ткань организма, которая содержится в лимфатических сосудах и узлах. Она включает в себя все соединения, поступающие из межтканевой жидкости. Основными и практически единственными клетками лимфы являются лимфоциты В ее составе эти клетки осуществляют кругооборот в организме.
Кровь относится к периферическим органам иммунитета В ней циркулируют предшественники и зрелые Т- и 5-лимфоциты, псшиморфно-ядерные лейкоциты, моноциты Лимфоциты составляют 30 % общего количества лейкоцитов.
Иммупокомпетентные клетки

С
Рис. 9.4. Иммунопоэз.
ППСК — полипотентная стволовая клетка пре Г — предшественники Г-лимфоцитов; пре 2? — предш гственники 5-лимфоцитов; пре/1 — предшественники фагоцитов; пре Тх — предшественники Г-хелперов; пре Тк — предшественники Г-киллеров; Тх — Г-хелпер; Тк — Г-киллер; В — В лимфоцит (а, у, е, ц — изотип синтезируемой молекулы иммуноглобулина); Пп — плазматическая кл< ка А — фагоцит NK — естественный киллер.
пецифическую функцию иммунной системы непосредственно выполняют иммунокомпетентные клетки. К ним относят лимфоциты и фагоциты. Это основные клетки иммунной системы. Кроме них, к этому ряду относят также гранулоциты, моноциты крови и некоторые другие клетки. Перечисленные клетки различаются не только морфологически, но и по своей функциональной направленности, маркерам (специфические молекулярные метки), по рецепторному аппарату и продуктам биосинтеза. Тем не менее ббльшую часть иммунокомпетентных клеток объединяет близкое генетическое родство: они имеют общего предшественника — полипотентную стволовую клетку костного мозга (рис. 9.4).По функциональной активности иммунокомпетентные клетки подразделяют на регуляторные и эффекторные. Регуляторные клетки «управляют» функцией иммунной системы путем выработки медиаторов — иммуноцитокинов. Эти клетки обуловли- вают направление развития иммунной реакции, ее интенсивность и продолжительность. Эффекторные клетки являются непосредственными исполнителями иммунного реагирования. Они действуют на объект либо непосредственно, либо путем биосинтеза биологически активных веществ со специфическим эффектом (антитела, или иммуноглобулины).
На поверхности цитоплазматической мембраны иммунокомпетентных клеток есть особые молекулы, которые служат их маркерами. С помощью специфических антител против этих молекул иммунокомпетентные клетки удалось разделить на отдель-
ные субпопуляции. В 80-х годах была принята Международная номенклатура мембранных маркеров лейкоцитов человека. Они получили название CD антигенов (от англ. аббревиатуры — cluster of differentiation). В настоящее время для идентификации важнейших субпопуляций иммунокомпетентных клеток используют моноклональные антитела.
Фагоциты (см. раздел 9.3.3.3) — самая многочисленная фракция иммунокомпетентных клеток, гетерогенная по морфологическим свойствам. Фагоциты обладают регуляторной и эффекторной активностью, вырабатывают иммуноцитокины, ферменты, ион-радикалы кислорода и другие биологически активные вещества. Они обеспечивают вне- и внутриклеточный киллинг, фагоцитоз, переработку и представление антигена Т- хелперам.
Лимфоциты — подвижные мононуклеарные клетки, имеют определенные морфологические особенности и отличаются онтогенезом и функциональной принадлежностью. В зависимости от места созревания в организме они подразделяются на Т- (тимус) и 5- (бурса Фабрициуса, костный мозг) лимфоциты.
Лимфоциты непосредственно распознают генетически чужеродные молекулы и клетки. Они также участвуют в регуляции иммунного ответа, формировании гуморального и клеточного иммунитета, иммунологической толерантности (неотвечаемости) и памяти, а также в реакциях гиперчувствительности.
Для лимфоцитов характерна постоянная рециркуляция — миграция между различными органами и тканями. В организме идет непрерывный процесс их разрушения—образования. Иммунная система постоянно содержит лимфоциты с широким репертуаром специфической направленности, готовые в любой момент ответить защитной реакцией на новые антигены.
В-лимфоциты — это эффекторные иммунокомпетентные клетки. Они и их потомки ответственны за биосинтез иммуноглобулинов, участвуют в формировании гуморального иммунитета, иммунологической памяти и гиперчувствительности немедленного типа (ГНТ).
На долю этих клеток приходится около 15 % всей лимфоидной популяции.
Дифференцировка и созревание происходят сначала в костном мозге, а затек» в периферических органах иммунной системы. 5-лимфоцит может жить до 10 лет и более (клетка иммунной памяти). Потомками 5-лимфоцитов являются антителопродуцирующие клетки иммунной памяти и плазматические клетки. Основные морфологические признаки последних — развитый эндоплазматический ретикулум и аппарат Гольджи с
большим количеством рибосом. Активно синтезирующая плазматическая клетка живет недолго, не более 2—3 сут.
В популяции 5-лимфоцитов в настоящее время выделяют субпопуляцию 57-лимфоцитов, которые считают филогенетически наиболее древней ветвью антителопродуцирующих клеток. 57-лимфоциты обнаруживают в слизистой оболочке ЖКТ. Эти клетки синтезируют низкоаффинные IgA и IgM к полисахаридным и липидным антигенам микробов и несут на своей мембране маркер CD5.
На электронограммах 5-лимфоциты имеют шероховатую поверхность. На последней определяются маркеры CD19—22, 45 и некоторые другие, а также рецепторы для эритроцитов мыши (см. раздел 9.9) и 7т-участка иммуноглобулина. Основным продуктом зрелых 5-лимфоцитов и их потомков — плазмоцитов являются иммуноглобулины. Функцию антигенспецифического рецептора выполняют особые формы мембранных иммуноглобулинов.
Активностью 5-лимфоцитов «управляют» молекулярные антигены и клетки-регуляторы: Г хелперы и фагоциты (см. раздел 9.4.4).
Г лимфоциты — это сложная популяция, которая происходит от полипотентной стволовой клетки костного мозга, а созревает и дифференцируется в тимусе из предшественников (пре-Т-лимфоциты). В состав популяции Г-лимфоцитов входят субпопуляция клеток-регуляторов (Т-хелперы) и субпопуляция клеток-эффекторов (Т-киллеры). Данные субпопуляции различаются по специфическим продуктам биосинтеза, рецепторному аппарату и функциональной активности. Отмечено, что на элек- тронограмме все Г-лимфоциты имеют гладкую поверхность. Общим маркером для всех Г-лимфоцитов является CD3. На долю этих клеток приходится около 75 % всей лимфоидной популяции.
Г-лимфоциты обеспечивают клеточные формы иммунного ответа (ГЗТ, трансплантационный иммунитет, противоопухолевый иммунитет и тд.), определяют силу и продолжительность иммунной реакции.
Т-хелперы (или Т-помощники) — субпопуляция Г-лимфоци- тов, которые выполняют регуляторную функцию. На наружной поверхносш цитоплазматической мембраны Г-хелпера определяются молекулы CD4.
Имеются также рецепторы для эритроцитов барана (см. раздел 9.9) и молекул HLA II класса. На долю Г-хелперов приходится около 75 % всей популяции Г-лимфоцитов.
Основным продуктом биосинтеза Г-хелперов являются им- муноцитокины (интерлейкин-2, интерферон у и др.). Получив от макрофагов информацию об антигене, Г-хелперы с помощью иммуноцитокинов воздействуют на клоны Г- и 5-лимфоцитов. Этот сигнал включает созревание, пролиферацию и диф- ференцировку эффекторных клеток (7-киллеров или 5-лимфоцитов).
В последнее время в популяции Г-хелперов обнаружена морфофункциональная гетерогенность. Выделяют две субпопуляции — Т-хелпер, (Thl) и Т-хелпер2 (ТЪ2), которые различаются по структуре рецептора для молекулы HLA II класса и синтезируемым интерлейкинам. Установлено, что Tht стимулирует пролиферацию эффекторных клеток (активация клеточного иммунитета) и вырабатывает ИЛ-2 и интерферон у. Th, направляет созревание и дифференцировку эффекторных клеток путем биосинтеза ИЛ-4,5,6,10 и 13 (активация гуморального иммунитета).
Дистальный участок молекулы CD4 служит местом прикрепления ВИЧ на поверхности клеточной мембраны.
Т-киллеры — субпопуляция Г-лимфоцитов-эффекторов. На поверхности цитоплазматической мембраны Г-киллера определяются молекулы CD8, а также рецептор для молекул HLA I класса. По этому рецептору «свои» клетки отличаются от «чужих». На долю Г-киллеров приходится примерно 25 % всей популяции Г-лимфоцитов.
Г-киллер распознает клетки с измененной структурой молекул HLA I класса. Поэтому его мишенью являются мутантные клетки, клетки, пораженные вирусом, или клетки аллогенного трансплантата. Г-киллер синтезирует особый фермент-токсин — перфорин, который лизирует генетически чужеродные клетки при непосредственном контакте. Функцией Г-киллера управляют корпускулярный антиген (эукариотическая клетка целиком), фагоцит и Г-хелпер. Г-киллеры обеспечивают в организме формирование клеточного иммунитета, иммуннологической памяти и ГЗТ.
0-клетки — лимфоциты без отличительных признаков Г- и
клеток. В костном мозге на их долю приходится около 50 % всех лимфоцитов, а в крови — примерно 5 %. Их функциональная активность остается неясной.
Помимо перечисленных выше, в организме есть ряд других иммунокомпетентных клеток, например естественные киллеры, или NK-клетки (Natural killer). Это эффекторные клетки. К ним относят большие гранулярные лимфоциты. А^-клетки способны распознать в организме некоторые виды злокачественно трансформированных клеток и уничтожить их без предварительной подготовки (этот факт обусловил название клеток). Рецепторный аппарат и механизм действия остаются во многом неясными. Между тем известно, что TV/f-клетки активируются и раз множаются под влиянием интерлейкина-2 и интерферона у.
До недавнего времени в популяции Т-лимфоцитов выделяли Г-супрессоры, которым приписывали функцию торможения развития иммунной реакции (супрессия). Однако в настоящее время наличие супрессоров считается сомнительным, хотя сам супрессорный эффект существует.
Эозинофилы — гранулярные лейкоциты крови. Эти клетки в большом количестве содержатся в крови, рыхлой соединительной ткани. Они накапливаются в очагах местных воспалений, вызванных гельминтами или простейшими или связанных с аллергической реакцией. Эозинофилы могут выполнять функцию киллеров, которая направлена против клеток гельминтов или простейших.
В цитоплазме базофилов (гранулярные лейкоциты крови) и тучных клеток (клетки рыхлой соединительной ткани) содержится большое количество гранул (пузырьков), наполненных биологически активными веществами — гистамином, брадики- нином, гепарином и др. Эти вещества участвуют в формировании воспаления и реакции гиперчувствительности немедленного типа (ГНТ). При воздействии на базофилы и тучные клетки комплекса антиген—антитело гранулы секретируются в межклеточное пространство. В результате действия перечисленных веществ в ткани возникают местный стаз крови и отек.
Межклеточная кооперация
Итак, в осуществлении иммунной защиты участвует три вида клеток: фагоциты, Т- и 5-лимфоциты. Деятельность этих клеток направлена на распознавание и уничтожение генетически чужеродных веществ, регуляцию функционирования компонентов иммунной системы и поддержание гомеостаза. Такая работа осуществляется в постоянном взаимодеиствии всех типов иммунокомпетентных клеток, т.е. в условиях межклеточной кооперации. Связующим звеном между клетками иммунной системы служат рецепторы, иммуноцитокины и другие медиаторы. Схему межклеточной кооперации можно упрощенно проиллюстрировать на примере активации 5-лимфоцита (рис. 9.5).
Как видно из рис. 9.5, при появлении в организме антигена в молекулярной форме антиген захватывается фагоцитом, переваривается; его фрагмент в составе антигена гистосовместимости II класса (HLA-DR или /о-антигены) представляется Т хелперу для определения «свой—чужой». При контакте с чужеродным веществом фагоцит активируется и начинает вырабатывать иммуноцитокины, в том числе ИЛ-1. 7’-хелпер, привлеченный реакцией фагоцита, прикрепляется к нему, распознает при
