
- •I. Введение
- •1.1. Место коллоидной химии в общей системе наук
- •1.2. Краткие исторические сведения
- •1.3. Предмет коллоидной химии
- •1.4. Физические и химические поверхностные явления
- •1.5. Основные признаки объектов коллоидной химии
- •1.6. Фундаментальные особенности ультрадисперсного (коллоидного) состояния вещества
- •1.7. Влияние дисперсности на свойства вещества
- •1.8. Значение коллоидной химии в природе и технике
- •II. Поверхностные явления и адсорбция
- •2.1. Классификация поверхностных явлений
- •2.2. Основы термодинамики поверхностного слоя
- •2.3. Интенсивные свойства гетерогенных систем
- •2.4. Экстенсивные свойства гетерогенных систем
- •2.5. Метод избыточных величин Гиббса
- •2.8. Уравнение Гиббса для плоского поверхностного слоя
- •2.9. Понятие об адсорбции
- •III. Адсорбция на различных границах раздела
- •3.1. Понятие об адсорбции
- •3.2 Количественные характеристики адсорбции
- •3.3. Типы адсорбционных зависимостей
- •3.4. Адсорбция газов и паров на твердом теле
- •3.5. Адсорбция как обратимый экзотермический процесс
- •3.6. Физическая адсорбция и хемосорбция
- •3.7. Значение координационных связей при хемосорбции
- •3.8. Природа адсорбционных сил
- •3.9. Изотермы адсорбции
- •3.10. Кинетика адсорбции
- •3.11. Классическая теория адсорбции
- •3.11.1. Теория мономолекулярной адсорбции Ленгмюра
- •Вывод уравнения Ленгмюра.
- •Анализ уравнения Ленгмюра
- •Полимолекулярная (потенциальная) теория адсорбции Поляни
- •3.11.3. Теория Брунауэра, Эииета и Теллера (бэт).
- •3.11.4. Схема полимолекулярной адсорбции
- •4.1 Поведение растворенных веществ на границе раствора с газом
- •4.2 Поверхностная активность.
- •4.3 Поверхностно – инактивные вещества
- •4.4 Вывод адсорбционного уравнения Гиббса
- •4.5 Строение адсорбционного слоя пав на границе раствора с газом
- •4.6 Уравнение состояния двумерного газа.
- •4.7 Диаграммы состояния поверхностных пленок
- •4.8 Химические реакции в поверхностных пленках.
- •4.9 Самоорганизованные монослои и пленки, перенесенные на твердую подложку с поверхности вода-воздух (пленки Ленгмюра –Блоджетт).
- •4.10 Двухсторонние пленки
- •4.11 Вид изотермы поверхностного натяжения. Уравнение Шишковского
- •4.12 Связь уравнений Ленгмюра и Гиббса с помощью уравнения Шишковского
- •4.13 Вывод уравнения Ленгмюра при совместном решении уравнений Гиббса и Шишковского
- •4.14 Правило Траубе
- •V. Адсорбция на границе раздела твердое тело – раствор
- •5.1. Введение
- •5.2. Правило вытеснения
- •5.3. Когезия и адгезия
- •5.4. Смачивание и растекание
- •5.5. Практическое значение смачивания
- •5.6. Правило выравнивания полярностей
- •5.7. Адсорбция полимеров из растворов на твердой поверхности
- •VI. Коллоидные пав
- •6.1. Введение
- •6.2. Производство и применение пав
- •6.3. Биоразлагаемость и токсичность
- •6.4. Классификация и общая характеристика пав
- •6.5. Свойства водных растворов пав. Мицеллообразование
- •6.6. Влияние различных факторов на ккм
- •6.6.1. Влияние длины углеводородного радикала
- •6.6.2. Влияние строения углеводородного радикала
- •6.6.3. Влияние добавок электролитов
- •6.6.4. Влияние полярных органических веществ
- •6.7. Термодинамика мицеллообразования в водной среде
- •6.8. Зависимость растворимости пав в воде от температуры
- •6.9. Мицеллообразование в неводных средах
- •6.10. Оценка дифильных свойств пав
- •6.11. Солюбилизация
- •6.12. Физико-химия моющего действия
- •6.13. Смеси ионных и неионных пав
- •6.14. Контрольные вопросы
- •VII. Получение дисперсных систем
- •7.1. Введение
- •7.2. Конденсационные способы образования дисперсных систем
- •Реакция обмена
- •Реакции восстановления
- •Реакция окисления
- •Гидролиз солей
- •Конденсация паров
- •Замена растворителя
- •7.3. Строение мицелл различных золей
- •Типы потенциалопределяющих ионов
- •Принципы построения формулы мицелл
- •7.4. Диспергационные методы получения дисперсных систем
- •7.4.1. Механическое диспергирование
- •7.4.2. Эффект Ребиндера и его роль в диспергировании
- •7.4.3. Физико-химическое дробление осадков (пептизация)
- •7.5. Образование лиофильных коллоидных систем
- •VIII. Молекулярно-кинетические свойства коллоидных систем
- •8.1. Введение
- •8.2. Броуновское движение
- •8.2.1. Природа броуновского движения
- •8.2.2. Общенаучное значение броуновского движения
- •8.2.3. Средний сдвиг частицы
- •8.3. Диффузия
- •8.3.1. Выражения для идеальной диффузии. Первый и второй законы Фика
- •8.3.2. Градиент концентрации при диффузии
- •8.3.3. Диффузия и проницаемость
- •8.4. Седиментация и методы седиментационного анализа
- •8.4.1. Гипсометрический закон
- •8.4.2. Седиментационное уравнение незаряженной частицы
- •8.4.3. Ультрацентрифуга
- •8.4.4. Скоростное ультрацентрифугирование
- •8.4.5. Равновесное ультрацентрифугирование
- •8.5. Контрольные вопросы
- •IX. Оптические свойства коллоидных систем.
- •9.1. Явления, наблюдаемые при взаимодействии видимого света с веществом.
- •9.2. Рэлеевское рассеяние света.
- •9.3. Рассеяние малыми частицами.
- •9.4. Рассеяние большими частицами.
- •9.5. Анализ уравнения Рэлея.
- •9.6. Поглощение света дисперсными системами.
- •9.7. Турбидиметрический метод определения коллоидных частиц.
- •9.7.1. Дисперсные системы, подчиняющиеся уравнению Рэлея.
- •9.7.2. Дисперсные системы, не подчиняющиеся уравнению Рэлея.
- •9.8. Световая микроскопия.
- •9.8.1. Световая микроскопия.
- •9.8.2. Темнопольная микроскопия.
- •9.8.3. Электронная микроскопия Предел разрешения электронного микроскопа.
- •Взаимодействие электронов с объектом.
- •Характеристики изображения.
- •Типы электронных микроскопов.
- •Основные части электронного микроскопа и их назначение.
- •Образцы для просвечивающей электронной микроскопии.
- •Методы препарирования образцов.
- •X. Электроповерхностные свойства дисперсных систем
- •10.1. Значение электрокинетических явлений в природе и технике
- •10.3. Связь поверхностного натяжения с электрическим потенциалом. Уравнение Липпмана.
- •Строение двойного электрического слоя.
- •10.5. Изменение потенциала в дэс с изменением расстояния от поверхности.
- •10.6. Внутренняя часть дэс
- •10.7. Электрокинетические явления.
- •10.8. Уравнение Гельмгольца-Смолуховского для определения -потенциала.
- •10.9. Влияние электролитов на двойной электрический слой.
- •10.10. Влияние концентрации электролита.
- •10.11.Влияние валентности противоиона на дэс.
- •10.12. Влияние радиуса иона на дэс.
- •Перезарядка золей индифферентными электролитами
- •Действие неиндифферентных электролитов на двойной электрический слой
- •Влияние температуры и разбавления на дэс
- •XI. Устойчивость и коагуляция коллойдных систем
- •11.1. Понятие об устойчивости
- •11.2. Расклинивающее давление
- •11.3. Теория агрегативной устойчивости и коагуляции лиофобных дисперсных систем (теория длфо)
- •11.4. Кинетический подход к устойчивости дисперсных систем
- •11.5. Природа сил, действующих между частицами.
- •Силы отталкивания
- •11.6.Коагуляция.
- •11.7. Механизм коагуляции электролитами по теории длфо.
- •11.8. Коагулирующее действие электролитов.
- •11.9. Правила коагуляции электролитами.
- •XII. Структурно–механические свойства дисперсных систем
- •12.1. Основные понятия. Реология как метод исследования структуры дисперсных систем
- •12.2. Идеальные законы реологии
- •12.3. Моделирование реологических свойств тел
- •12.8. Реологические свойства твердообразных тел
- •XIII. Растворы высокомолекулярных соединений. Основные положения статистики полимерных цепей
- •13.1. Гибкость и размеры цепи
- •13.2. Количественные характеристики размеров макромолекул
- •13.3. Свойства Гауссова клубка
- •13.4. Состояния полимеров в растворе
- •13.5. Термодинамика растворения полимеров
- •13.6. Набухание как первая стадия растворения
- •13.7. Разбавленные растворы полимеров
- •13.8. Осмотическое давление растворов
- •13.9. Термодинамическое сродство растворителя к полимеру
- •13.10. Взаимодействия в растворах полимеров
- •13.11. Концентрированные растворы полимеров
- •13.12. Термодинамическая равновесность растворов полимеров и подчинение их правилу фаз
13.7. Разбавленные растворы полимеров
Растворы полимеров условно делят на две области: область разбавленных растворов и область концентрированных растворов. Разбавленными считаются растворы, концентрация которых не превышает десятых долей %. При такой концентрации растворы имеют молекулярную степень дисперсности. Строго говоря, их нельзя относить к коллоидным системам, в которых частицы являются агрегатами молекул, в разбавленных растворах полимеров существуют отдельные макромолекулы. В этом случае не имеется поверхности раздела между макромолекулой и растворителем, то есть система является однофазной, гомогенной.
В разбавленном растворе сегменты макромолекулы располагаются так, что занимаемые ими объемы не перекрываются. Объем, из которого сегмент или макромолекула в целом вытесняет другие сегменты или макромолекулы, называется исключенным объемом сегмента (макромолекулы). Эффективный исключенный объем сегмента не является реальным объемом, а представляет общий результат сил притяжения и отталкивания между элементами системы.
Таким образом, разбавленные растворы полимеров представляют собой системы, в которых отдельные макромолекулы разделены областями чистого растворителя. Объем, занимаемый макромолекулой в разбавленном растворе, называется координационной сферой. При фотографировании макромолекулы фотоустройством, закрепленным неподвижно относительно центра инерции макромолекулы, координационная сфера получается в виде некоторого объема вследствие теплового движения сегментов.
В разбавленных растворах координационные сферы макромолекул не перекрываются. Это положение является структурным критерием разделения растворов полимеров на разбавленные и концентрированные.
Как будет показано ниже, существует еще и термодинамический критерий такого разделения. В разбавленных растворах концентрация сегментов внутри координационной сферы превышает их среднюю концентрацию в растворе.
Значение разбавленных растворов полимеров состоит в том, что они позволяют изучать свойства индивидуальной макромолекулы, получить модель газового состояния полимера. На свойствах разбавленных растворов основаны все методы определения молекулярной массы полимеров и их молекулярно-массового распределения.
13.8. Осмотическое давление растворов
В качестве примера
одного из общих свойств растворов
полимеров, зависящих от числа частиц,
т. е. коллигативных
свойств, рассмотрим осмотическое
давление раствора
полимера. Измерение осмотического
давления позволяет косвенно определить
понижение упругости пара растворителя
над раствором по сравнению с чистым
растворителем
![]() и активность
растворителя
.
Рассмотрим схему осмотического опыта
(рис. 13.7).
и активность
растворителя
.
Рассмотрим схему осмотического опыта
(рис. 13.7).
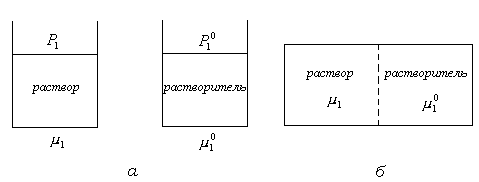
Рис.13.7. Схемы осмотического опыта: ( ) – равновесие устанавливается через газовую фазу; (б) равновесие устанавливается через жидкую фазу.
Коллигативные свойства сильно разбавленных растворов проявляются в том, что работа отделения растворенного компонента от растворителя пропорциональна числу растворенных частиц, не зависит от их природы и описывается законом Рауля.
В один из открытых
сосудов нальем раствор полимера, в
другой – чистый растворитель, и поместим
эти сосуды в замкнутое пространство
(рис. 13.7.
).
По закону Рауля упругость пара растворителя
над чистым растворителем
![]() больше, чем упругость пара растворителя
над раствором:
больше, чем упругость пара растворителя
над раствором:
![]() .
Поэтому произойдет изотермическая
перегонка растворителя из сосуда с
чистым растворителем в сосуд с раствором.
При этом станут равными химические
потенциалы растворителя в чистом
растворителе и растворе.
.
Поэтому произойдет изотермическая
перегонка растворителя из сосуда с
чистым растворителем в сосуд с раствором.
При этом станут равными химические
потенциалы растворителя в чистом
растворителе и растворе.
В сосуде, разделенном полупроницаемой мембраной, в одной половине которого находится чистый растворитель, а в другой раствор полимера (рис. 13.7.б), также произойдет выравнивание химического потенциала растворителя, но через жидкую фазу. Выравнивание химического потенциала растворителя в обеих частях сосуда связано с осмотическим давлением системы.
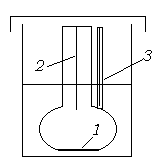
Рис. 13.8. Схема осмометра.
1 – полупроницаемая мембрана; 2 – Измерительный капилляр; 3 – Контрольный капилляр.
Осмотическое давление
– это сила, приходящаяся на единицу
площади мембраны, которая заставляет
растворитель проникать в раствор и
является результатом взаимодействия
между компонентами системы.
Осмометр (рис.13.8) состоит из ячейки,
основой которой служит полупроницаемая
мембрана, и двух капилляров (рис.13.8),
измерительного и контрольного. В ячейку
заливается раствор полимера, в широкий
сосуд – чистый растворитель. При
установлении равновесия высот поднятия
уровня жидкости в капилляре пропорциональна
осмотическому давлению. Отметим, что
мембрана в осмотическом опыте не имеет
принципиального значения и служит
рабочим средством для установления
равновесия. При отсутствии мембраны
равновесие все равно установилось бы
через газовою фазу, но для этого
потребовалось бы много времени из-за
малого сечения капилляра. При равновесии
упругость пара растворителя над чистым
растворителем на высоте
становится равной упругости пара
растворителя над раствором на высоте
![]() .
Растворение устанавливается вследствие
гипсометрического закона:
.
Растворение устанавливается вследствие
гипсометрического закона:
![]() (13.8)
(13.8)
Между осмотическим давлением раствора и молекулярной массой полимера существует зависимость.
Для идеальных растворов по закону Вант-Гоффа:
![]() ;
;
![]() ;
;
![]() (13.9)
(13.9)
т.е. должны соблюдаться
пропорциональность между осмотическим
давлением и концентрацией. Для неидеальных
растворов при равновесии выполняется
условие:
![]() ,
где
– активность растворителя. В разбавленных
растворах
,
где
– активность растворителя. В разбавленных
растворах
![]() ,
где
,
где
![]() и
и
![]() – мольные доли растворителя и полимера
соответственно
– мольные доли растворителя и полимера
соответственно
![]()
Разлагая выражение для осмотического давления в ряд, получим соотношение, аналогичное вириальному разложению для газов:
 (13.10)
(13.10)
Коэффициенты при членах этого выражения называются вириальными коэффициентами.
В разбавленных растворах полимеров вследствие малой концентрации ее квадратом можно пренебречь, и выражение (10) приобретет вид:
![]() (13.11)
(13.11)
Для определения
молекулярной массы строят зависимость
![]() ,
экстраполируют эту зависимость к нулевой
концентрации и получают величину,
обратную молекулярной массе полимера
(рис.13.9). Угол наклона этой зависимости
позволяет определить значение второго
вириального
коэффициента
.
,
экстраполируют эту зависимость к нулевой
концентрации и получают величину,
обратную молекулярной массе полимера
(рис.13.9). Угол наклона этой зависимости
позволяет определить значение второго
вириального
коэффициента
.
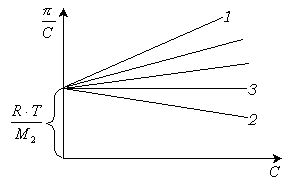
Рис. 13.9 Зависимость осмотического давления растворов от концентрации: 1 - хороший растворитель, 2 - плохой растворитель, 3 - идеальный растворитель
