
- •I. Введение
- •1.1. Место коллоидной химии в общей системе наук
- •1.2. Краткие исторические сведения
- •1.3. Предмет коллоидной химии
- •1.4. Физические и химические поверхностные явления
- •1.5. Основные признаки объектов коллоидной химии
- •1.6. Фундаментальные особенности ультрадисперсного (коллоидного) состояния вещества
- •1.7. Влияние дисперсности на свойства вещества
- •1.8. Значение коллоидной химии в природе и технике
- •II. Поверхностные явления и адсорбция
- •2.1. Классификация поверхностных явлений
- •2.2. Основы термодинамики поверхностного слоя
- •2.3. Интенсивные свойства гетерогенных систем
- •2.4. Экстенсивные свойства гетерогенных систем
- •2.5. Метод избыточных величин Гиббса
- •2.8. Уравнение Гиббса для плоского поверхностного слоя
- •2.9. Понятие об адсорбции
- •III. Адсорбция на различных границах раздела
- •3.1. Понятие об адсорбции
- •3.2 Количественные характеристики адсорбции
- •3.3. Типы адсорбционных зависимостей
- •3.4. Адсорбция газов и паров на твердом теле
- •3.5. Адсорбция как обратимый экзотермический процесс
- •3.6. Физическая адсорбция и хемосорбция
- •3.7. Значение координационных связей при хемосорбции
- •3.8. Природа адсорбционных сил
- •3.9. Изотермы адсорбции
- •3.10. Кинетика адсорбции
- •3.11. Классическая теория адсорбции
- •3.11.1. Теория мономолекулярной адсорбции Ленгмюра
- •Вывод уравнения Ленгмюра.
- •Анализ уравнения Ленгмюра
- •Полимолекулярная (потенциальная) теория адсорбции Поляни
- •3.11.3. Теория Брунауэра, Эииета и Теллера (бэт).
- •3.11.4. Схема полимолекулярной адсорбции
- •4.1 Поведение растворенных веществ на границе раствора с газом
- •4.2 Поверхностная активность.
- •4.3 Поверхностно – инактивные вещества
- •4.4 Вывод адсорбционного уравнения Гиббса
- •4.5 Строение адсорбционного слоя пав на границе раствора с газом
- •4.6 Уравнение состояния двумерного газа.
- •4.7 Диаграммы состояния поверхностных пленок
- •4.8 Химические реакции в поверхностных пленках.
- •4.9 Самоорганизованные монослои и пленки, перенесенные на твердую подложку с поверхности вода-воздух (пленки Ленгмюра –Блоджетт).
- •4.10 Двухсторонние пленки
- •4.11 Вид изотермы поверхностного натяжения. Уравнение Шишковского
- •4.12 Связь уравнений Ленгмюра и Гиббса с помощью уравнения Шишковского
- •4.13 Вывод уравнения Ленгмюра при совместном решении уравнений Гиббса и Шишковского
- •4.14 Правило Траубе
- •V. Адсорбция на границе раздела твердое тело – раствор
- •5.1. Введение
- •5.2. Правило вытеснения
- •5.3. Когезия и адгезия
- •5.4. Смачивание и растекание
- •5.5. Практическое значение смачивания
- •5.6. Правило выравнивания полярностей
- •5.7. Адсорбция полимеров из растворов на твердой поверхности
- •VI. Коллоидные пав
- •6.1. Введение
- •6.2. Производство и применение пав
- •6.3. Биоразлагаемость и токсичность
- •6.4. Классификация и общая характеристика пав
- •6.5. Свойства водных растворов пав. Мицеллообразование
- •6.6. Влияние различных факторов на ккм
- •6.6.1. Влияние длины углеводородного радикала
- •6.6.2. Влияние строения углеводородного радикала
- •6.6.3. Влияние добавок электролитов
- •6.6.4. Влияние полярных органических веществ
- •6.7. Термодинамика мицеллообразования в водной среде
- •6.8. Зависимость растворимости пав в воде от температуры
- •6.9. Мицеллообразование в неводных средах
- •6.10. Оценка дифильных свойств пав
- •6.11. Солюбилизация
- •6.12. Физико-химия моющего действия
- •6.13. Смеси ионных и неионных пав
- •6.14. Контрольные вопросы
- •VII. Получение дисперсных систем
- •7.1. Введение
- •7.2. Конденсационные способы образования дисперсных систем
- •Реакция обмена
- •Реакции восстановления
- •Реакция окисления
- •Гидролиз солей
- •Конденсация паров
- •Замена растворителя
- •7.3. Строение мицелл различных золей
- •Типы потенциалопределяющих ионов
- •Принципы построения формулы мицелл
- •7.4. Диспергационные методы получения дисперсных систем
- •7.4.1. Механическое диспергирование
- •7.4.2. Эффект Ребиндера и его роль в диспергировании
- •7.4.3. Физико-химическое дробление осадков (пептизация)
- •7.5. Образование лиофильных коллоидных систем
- •VIII. Молекулярно-кинетические свойства коллоидных систем
- •8.1. Введение
- •8.2. Броуновское движение
- •8.2.1. Природа броуновского движения
- •8.2.2. Общенаучное значение броуновского движения
- •8.2.3. Средний сдвиг частицы
- •8.3. Диффузия
- •8.3.1. Выражения для идеальной диффузии. Первый и второй законы Фика
- •8.3.2. Градиент концентрации при диффузии
- •8.3.3. Диффузия и проницаемость
- •8.4. Седиментация и методы седиментационного анализа
- •8.4.1. Гипсометрический закон
- •8.4.2. Седиментационное уравнение незаряженной частицы
- •8.4.3. Ультрацентрифуга
- •8.4.4. Скоростное ультрацентрифугирование
- •8.4.5. Равновесное ультрацентрифугирование
- •8.5. Контрольные вопросы
- •IX. Оптические свойства коллоидных систем.
- •9.1. Явления, наблюдаемые при взаимодействии видимого света с веществом.
- •9.2. Рэлеевское рассеяние света.
- •9.3. Рассеяние малыми частицами.
- •9.4. Рассеяние большими частицами.
- •9.5. Анализ уравнения Рэлея.
- •9.6. Поглощение света дисперсными системами.
- •9.7. Турбидиметрический метод определения коллоидных частиц.
- •9.7.1. Дисперсные системы, подчиняющиеся уравнению Рэлея.
- •9.7.2. Дисперсные системы, не подчиняющиеся уравнению Рэлея.
- •9.8. Световая микроскопия.
- •9.8.1. Световая микроскопия.
- •9.8.2. Темнопольная микроскопия.
- •9.8.3. Электронная микроскопия Предел разрешения электронного микроскопа.
- •Взаимодействие электронов с объектом.
- •Характеристики изображения.
- •Типы электронных микроскопов.
- •Основные части электронного микроскопа и их назначение.
- •Образцы для просвечивающей электронной микроскопии.
- •Методы препарирования образцов.
- •X. Электроповерхностные свойства дисперсных систем
- •10.1. Значение электрокинетических явлений в природе и технике
- •10.3. Связь поверхностного натяжения с электрическим потенциалом. Уравнение Липпмана.
- •Строение двойного электрического слоя.
- •10.5. Изменение потенциала в дэс с изменением расстояния от поверхности.
- •10.6. Внутренняя часть дэс
- •10.7. Электрокинетические явления.
- •10.8. Уравнение Гельмгольца-Смолуховского для определения -потенциала.
- •10.9. Влияние электролитов на двойной электрический слой.
- •10.10. Влияние концентрации электролита.
- •10.11.Влияние валентности противоиона на дэс.
- •10.12. Влияние радиуса иона на дэс.
- •Перезарядка золей индифферентными электролитами
- •Действие неиндифферентных электролитов на двойной электрический слой
- •Влияние температуры и разбавления на дэс
- •XI. Устойчивость и коагуляция коллойдных систем
- •11.1. Понятие об устойчивости
- •11.2. Расклинивающее давление
- •11.3. Теория агрегативной устойчивости и коагуляции лиофобных дисперсных систем (теория длфо)
- •11.4. Кинетический подход к устойчивости дисперсных систем
- •11.5. Природа сил, действующих между частицами.
- •Силы отталкивания
- •11.6.Коагуляция.
- •11.7. Механизм коагуляции электролитами по теории длфо.
- •11.8. Коагулирующее действие электролитов.
- •11.9. Правила коагуляции электролитами.
- •XII. Структурно–механические свойства дисперсных систем
- •12.1. Основные понятия. Реология как метод исследования структуры дисперсных систем
- •12.2. Идеальные законы реологии
- •12.3. Моделирование реологических свойств тел
- •12.8. Реологические свойства твердообразных тел
- •XIII. Растворы высокомолекулярных соединений. Основные положения статистики полимерных цепей
- •13.1. Гибкость и размеры цепи
- •13.2. Количественные характеристики размеров макромолекул
- •13.3. Свойства Гауссова клубка
- •13.4. Состояния полимеров в растворе
- •13.5. Термодинамика растворения полимеров
- •13.6. Набухание как первая стадия растворения
- •13.7. Разбавленные растворы полимеров
- •13.8. Осмотическое давление растворов
- •13.9. Термодинамическое сродство растворителя к полимеру
- •13.10. Взаимодействия в растворах полимеров
- •13.11. Концентрированные растворы полимеров
- •13.12. Термодинамическая равновесность растворов полимеров и подчинение их правилу фаз
13.9. Термодинамическое сродство растворителя к полимеру
При растворении полимеров, так же как и при растворении низкомолекулярных веществ, соблюдается правило: «подобное растворяется в подобном». Согласно этому правилу полярные полимеры лучше растворяются в полярных растворителях, а неполярные - в неполярных. Под термодинамическим сродством понимают способность компонентов раствора взаимодействовать друг с другом. Существует несколько количественных критериев термодинамического сродства растворителя к полимеру. Одним из таких критериев является изменение химического потенциала растворителя при переходе его в раствор:
![]() (13.12),
(13.12),
где
![]() – химический потенциал чистого
растворителя,
– химический потенциал чистого
растворителя,
![]() – химический
потенциал растворителя в растворе. Чем
больше
– химический
потенциал растворителя в растворе. Чем
больше
![]() ,
тем лучше идет растворение. Значение
характеризует не скорость растворения,
а взаимодействие растворителя с
полимером. Растворитель, сильно
взаимодействующий с полимером, называют
хорошим
растворителем. Хороший растворитель
сильнее взаимодействует с полимером,
чем молекулы полимера друг с другом.
Молекулы хорошего растворителя стремятся
окружить полимерные цепи и уменьшить
число контактов полимер – полимер.
Полимерный клубок сильно набухает в
хорошем растворителе. Вследствие этого
при увеличении концентрации увеличивается
отталкивание соседних молекул полимера.
В результате этого химическая активность
увеличивается сильнее, чем концентрация
,
и в вириальном разложении:
,
тем лучше идет растворение. Значение
характеризует не скорость растворения,
а взаимодействие растворителя с
полимером. Растворитель, сильно
взаимодействующий с полимером, называют
хорошим
растворителем. Хороший растворитель
сильнее взаимодействует с полимером,
чем молекулы полимера друг с другом.
Молекулы хорошего растворителя стремятся
окружить полимерные цепи и уменьшить
число контактов полимер – полимер.
Полимерный клубок сильно набухает в
хорошем растворителе. Вследствие этого
при увеличении концентрации увеличивается
отталкивание соседних молекул полимера.
В результате этого химическая активность
увеличивается сильнее, чем концентрация
,
и в вириальном разложении:
![]()
второй коэффициент положителен.
Растворитель, который слабо взаимодействует с полимером, называют плохим растворителем.
Другим критерием качества растворителя является коэффициент набухания , равный отношению размера макромолекулы, взаимодействующей с растворителем, к размерам клубка, не возмущенного взаимодействиями:
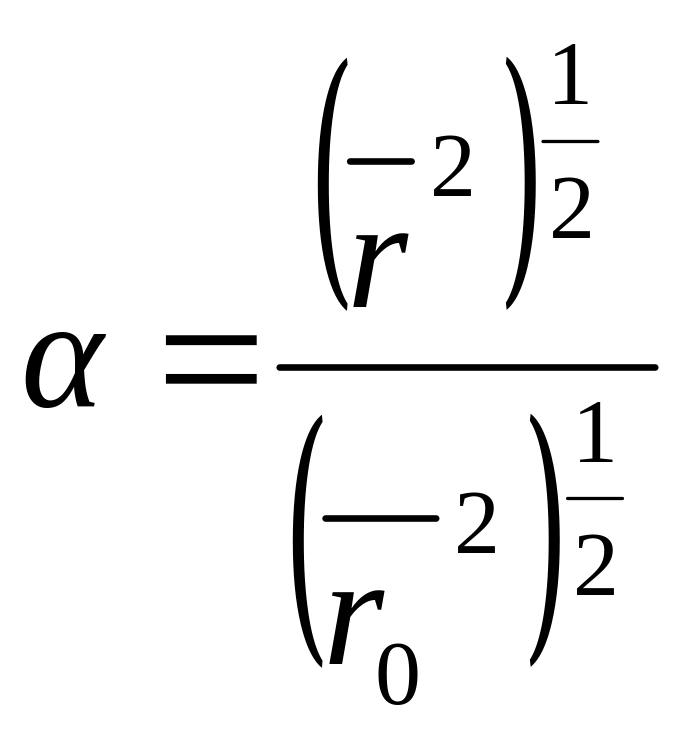 (13.13)
(13.13)
Изменение объема молекулярного клубка в результате его взаимодействия с хорошим растворителем называется объемным, или осмотическим, эффектом.
Третий критерий
термодинамического сродства растворителя
к полимеру – величина
второго вириального коэффициента
в уравнении
осмотического давления (рис. 13.9). Чем
больше значение
,
тем лучше растворитель. Если
![]() ,
то такой растворитель является идеальным.
В плохом растворителе значения
отрицательны.
,
то такой растворитель является идеальным.
В плохом растворителе значения
отрицательны.
Четвертым критерием
термодинамического качества растворителя
является константа Хаггинса
.
Константа Хаггинса является важнейшим
параметром в теории растворов полимеров.
Ее величина характеризует избыточную
энергию межмолекулярного взаимодействия,
приходящуюся на один моль раствора и
является мерой термодинамического
сродства полимера к растворителю.
Константа Хаггинса представляет собой
изменение свободной энергии, необходимой
для переноса молекулы растворителя из
чистого растворителя в полимерную фазу.
В основном значения
![]() равны
равны
![]() .
При
- температуре значение
.
При
- температуре значение
![]() .
.
13.10. Взаимодействия в растворах полимеров
В растворах полимеров существуют различные типы межмолекулярного и внутримолекулярного взаимодействия. Межмолекулярные взаимодействия – это взаимодействия различных макромолекул и взаимодействие полимера с растворителем. Внутримолекулярные взаимодействия – это взаимодействие соседних сегментов, характеризующее термодинамическую жесткость цепи, так называемое близкодействие, и взаимодействие удаленных по цепи сегментов, но вследствие изгиба цепи оказавшихся рядом (дальнодействие). При дальнодействии образуется петля минимального размера, зависящего от гибкости цепи, и удаленные сегменты образуют контакты типа полимер - полимер.
Второй вириальный коэффициент связан с температурой и исключенным объемом следующим соотношением:
![]() (13.14)
(13.14)
где
![]() и
и
![]() – удельные объемы растворителя и
полимера,
– удельные объемы растворителя и
полимера,
![]() - параметр, связывающий объемную долю
полимера с изменением энтропии:
- параметр, связывающий объемную долю
полимера с изменением энтропии:
![]()
Легко видеть, что при
![]() .
.
При температуре, равной , раствор полимера ведет себя как идеальный, т.е. как бы не взаимодействует с растворителем. Эта температура называется - точкой или температурой Флори.
При - температуре взаимодействия в растворе не устраняются, а лишь компенсируют друг друга. Происходит компенсация дальнодействия и взаимодействия с растворителем. - температура подобна температуре Бойля для реального газа, когда собственный объем молекул газа компенсируется силами межмолекулярного взаимодействия. Таким образом, разбавленный раствор полимера при - температуре является моделью газового состояния макромолекулы, когда индивидуальная макромолекула не возмущена никакими посторонними взаимодействиями.
Измерение свойств разбавленных растворов полимеров позволяет определять молекулярную массу полимеров и молекулярно-массовое распределение.
