
- •I. Введение
- •1.1. Место коллоидной химии в общей системе наук
- •1.2. Краткие исторические сведения
- •1.3. Предмет коллоидной химии
- •1.4. Физические и химические поверхностные явления
- •1.5. Основные признаки объектов коллоидной химии
- •1.6. Фундаментальные особенности ультрадисперсного (коллоидного) состояния вещества
- •1.7. Влияние дисперсности на свойства вещества
- •1.8. Значение коллоидной химии в природе и технике
- •II. Поверхностные явления и адсорбция
- •2.1. Классификация поверхностных явлений
- •2.2. Основы термодинамики поверхностного слоя
- •2.3. Интенсивные свойства гетерогенных систем
- •2.4. Экстенсивные свойства гетерогенных систем
- •2.5. Метод избыточных величин Гиббса
- •2.8. Уравнение Гиббса для плоского поверхностного слоя
- •2.9. Понятие об адсорбции
- •III. Адсорбция на различных границах раздела
- •3.1. Понятие об адсорбции
- •3.2 Количественные характеристики адсорбции
- •3.3. Типы адсорбционных зависимостей
- •3.4. Адсорбция газов и паров на твердом теле
- •3.5. Адсорбция как обратимый экзотермический процесс
- •3.6. Физическая адсорбция и хемосорбция
- •3.7. Значение координационных связей при хемосорбции
- •3.8. Природа адсорбционных сил
- •3.9. Изотермы адсорбции
- •3.10. Кинетика адсорбции
- •3.11. Классическая теория адсорбции
- •3.11.1. Теория мономолекулярной адсорбции Ленгмюра
- •Вывод уравнения Ленгмюра.
- •Анализ уравнения Ленгмюра
- •Полимолекулярная (потенциальная) теория адсорбции Поляни
- •3.11.3. Теория Брунауэра, Эииета и Теллера (бэт).
- •3.11.4. Схема полимолекулярной адсорбции
- •4.1 Поведение растворенных веществ на границе раствора с газом
- •4.2 Поверхностная активность.
- •4.3 Поверхностно – инактивные вещества
- •4.4 Вывод адсорбционного уравнения Гиббса
- •4.5 Строение адсорбционного слоя пав на границе раствора с газом
- •4.6 Уравнение состояния двумерного газа.
- •4.7 Диаграммы состояния поверхностных пленок
- •4.8 Химические реакции в поверхностных пленках.
- •4.9 Самоорганизованные монослои и пленки, перенесенные на твердую подложку с поверхности вода-воздух (пленки Ленгмюра –Блоджетт).
- •4.10 Двухсторонние пленки
- •4.11 Вид изотермы поверхностного натяжения. Уравнение Шишковского
- •4.12 Связь уравнений Ленгмюра и Гиббса с помощью уравнения Шишковского
- •4.13 Вывод уравнения Ленгмюра при совместном решении уравнений Гиббса и Шишковского
- •4.14 Правило Траубе
- •V. Адсорбция на границе раздела твердое тело – раствор
- •5.1. Введение
- •5.2. Правило вытеснения
- •5.3. Когезия и адгезия
- •5.4. Смачивание и растекание
- •5.5. Практическое значение смачивания
- •5.6. Правило выравнивания полярностей
- •5.7. Адсорбция полимеров из растворов на твердой поверхности
- •VI. Коллоидные пав
- •6.1. Введение
- •6.2. Производство и применение пав
- •6.3. Биоразлагаемость и токсичность
- •6.4. Классификация и общая характеристика пав
- •6.5. Свойства водных растворов пав. Мицеллообразование
- •6.6. Влияние различных факторов на ккм
- •6.6.1. Влияние длины углеводородного радикала
- •6.6.2. Влияние строения углеводородного радикала
- •6.6.3. Влияние добавок электролитов
- •6.6.4. Влияние полярных органических веществ
- •6.7. Термодинамика мицеллообразования в водной среде
- •6.8. Зависимость растворимости пав в воде от температуры
- •6.9. Мицеллообразование в неводных средах
- •6.10. Оценка дифильных свойств пав
- •6.11. Солюбилизация
- •6.12. Физико-химия моющего действия
- •6.13. Смеси ионных и неионных пав
- •6.14. Контрольные вопросы
- •VII. Получение дисперсных систем
- •7.1. Введение
- •7.2. Конденсационные способы образования дисперсных систем
- •Реакция обмена
- •Реакции восстановления
- •Реакция окисления
- •Гидролиз солей
- •Конденсация паров
- •Замена растворителя
- •7.3. Строение мицелл различных золей
- •Типы потенциалопределяющих ионов
- •Принципы построения формулы мицелл
- •7.4. Диспергационные методы получения дисперсных систем
- •7.4.1. Механическое диспергирование
- •7.4.2. Эффект Ребиндера и его роль в диспергировании
- •7.4.3. Физико-химическое дробление осадков (пептизация)
- •7.5. Образование лиофильных коллоидных систем
- •VIII. Молекулярно-кинетические свойства коллоидных систем
- •8.1. Введение
- •8.2. Броуновское движение
- •8.2.1. Природа броуновского движения
- •8.2.2. Общенаучное значение броуновского движения
- •8.2.3. Средний сдвиг частицы
- •8.3. Диффузия
- •8.3.1. Выражения для идеальной диффузии. Первый и второй законы Фика
- •8.3.2. Градиент концентрации при диффузии
- •8.3.3. Диффузия и проницаемость
- •8.4. Седиментация и методы седиментационного анализа
- •8.4.1. Гипсометрический закон
- •8.4.2. Седиментационное уравнение незаряженной частицы
- •8.4.3. Ультрацентрифуга
- •8.4.4. Скоростное ультрацентрифугирование
- •8.4.5. Равновесное ультрацентрифугирование
- •8.5. Контрольные вопросы
- •IX. Оптические свойства коллоидных систем.
- •9.1. Явления, наблюдаемые при взаимодействии видимого света с веществом.
- •9.2. Рэлеевское рассеяние света.
- •9.3. Рассеяние малыми частицами.
- •9.4. Рассеяние большими частицами.
- •9.5. Анализ уравнения Рэлея.
- •9.6. Поглощение света дисперсными системами.
- •9.7. Турбидиметрический метод определения коллоидных частиц.
- •9.7.1. Дисперсные системы, подчиняющиеся уравнению Рэлея.
- •9.7.2. Дисперсные системы, не подчиняющиеся уравнению Рэлея.
- •9.8. Световая микроскопия.
- •9.8.1. Световая микроскопия.
- •9.8.2. Темнопольная микроскопия.
- •9.8.3. Электронная микроскопия Предел разрешения электронного микроскопа.
- •Взаимодействие электронов с объектом.
- •Характеристики изображения.
- •Типы электронных микроскопов.
- •Основные части электронного микроскопа и их назначение.
- •Образцы для просвечивающей электронной микроскопии.
- •Методы препарирования образцов.
- •X. Электроповерхностные свойства дисперсных систем
- •10.1. Значение электрокинетических явлений в природе и технике
- •10.3. Связь поверхностного натяжения с электрическим потенциалом. Уравнение Липпмана.
- •Строение двойного электрического слоя.
- •10.5. Изменение потенциала в дэс с изменением расстояния от поверхности.
- •10.6. Внутренняя часть дэс
- •10.7. Электрокинетические явления.
- •10.8. Уравнение Гельмгольца-Смолуховского для определения -потенциала.
- •10.9. Влияние электролитов на двойной электрический слой.
- •10.10. Влияние концентрации электролита.
- •10.11.Влияние валентности противоиона на дэс.
- •10.12. Влияние радиуса иона на дэс.
- •Перезарядка золей индифферентными электролитами
- •Действие неиндифферентных электролитов на двойной электрический слой
- •Влияние температуры и разбавления на дэс
- •XI. Устойчивость и коагуляция коллойдных систем
- •11.1. Понятие об устойчивости
- •11.2. Расклинивающее давление
- •11.3. Теория агрегативной устойчивости и коагуляции лиофобных дисперсных систем (теория длфо)
- •11.4. Кинетический подход к устойчивости дисперсных систем
- •11.5. Природа сил, действующих между частицами.
- •Силы отталкивания
- •11.6.Коагуляция.
- •11.7. Механизм коагуляции электролитами по теории длфо.
- •11.8. Коагулирующее действие электролитов.
- •11.9. Правила коагуляции электролитами.
- •XII. Структурно–механические свойства дисперсных систем
- •12.1. Основные понятия. Реология как метод исследования структуры дисперсных систем
- •12.2. Идеальные законы реологии
- •12.3. Моделирование реологических свойств тел
- •12.8. Реологические свойства твердообразных тел
- •XIII. Растворы высокомолекулярных соединений. Основные положения статистики полимерных цепей
- •13.1. Гибкость и размеры цепи
- •13.2. Количественные характеристики размеров макромолекул
- •13.3. Свойства Гауссова клубка
- •13.4. Состояния полимеров в растворе
- •13.5. Термодинамика растворения полимеров
- •13.6. Набухание как первая стадия растворения
- •13.7. Разбавленные растворы полимеров
- •13.8. Осмотическое давление растворов
- •13.9. Термодинамическое сродство растворителя к полимеру
- •13.10. Взаимодействия в растворах полимеров
- •13.11. Концентрированные растворы полимеров
- •13.12. Термодинамическая равновесность растворов полимеров и подчинение их правилу фаз
4.4 Вывод адсорбционного уравнения Гиббса
Запишем фундаментальное уравнение Гиббса для поверхностного слоя.
![]() (1)
(1)
Введем полную (внутреннюю) энергию поверхностного слоя.
![]() ;
;
![]() (2)
(2)
Приравниваем правые части уравнений (1) и (2)
![]()
![]() (3)
(3)
Это уравнение однородно и первой степени относительно экстенсивных величин, стоящих под знаком дифференциала.
По теореме Эйлера его можно интегрировать. После интегрирования это уравнение принимает вид:
![]() (4)
(4)
Рассмотрим любые возможные изменения системы, т.е. возьмем полный дифференциал от выражения (4).
![]() (5)
(5)
Уравнение (3) и (5) совместимы при условии:
![]()
Это общий вид адсорбционного уравнения Гиббса. Введем некоторые ограничения. При уравнение Гиббса принимает вид:
![]() ,
,
Все
экстенсивные параметры поверхности
(
,
,
![]() )
зависят от площади поверхности
и,
поэтому их удобно относить к единице
площади.
)
зависят от площади поверхности
и,
поэтому их удобно относить к единице
площади.
![]()
![]() ,
т. к.
,
т. к.
![]() – мера
избыточного содержания компонента в
поверхностном слое, мера адсорбции, т.
е. величина гиббсовой адсорбции.
– мера
избыточного содержания компонента в
поверхностном слое, мера адсорбции, т.
е. величина гиббсовой адсорбции.
![]()
Для бинарной системы:
![]() ;
;
где
индекс 1 относится к растворителю, 2 –
к растворенному веществу. Изменение
связано с адсорбцией и с изменением
концентрации растворителя и растворенного
вещества. Это уравнение содержит два
неизвестных,
![]() ,
,
![]() и поэтому однозначное его решение
отсутствует. Один из путей его решения
следующий. Величины адсорбции зависят
от положения разделяющей поверхности.
В зависимости от выбора положения
разделяющей поверхности адсорбция
первого компонента оказывается
положительной, отрицательной или равной
нулю. Гиббс показал, что разделяющую
поверхность можно провести так чтобы
и поэтому однозначное его решение
отсутствует. Один из путей его решения
следующий. Величины адсорбции зависят
от положения разделяющей поверхности.
В зависимости от выбора положения
разделяющей поверхности адсорбция
первого компонента оказывается
положительной, отрицательной или равной
нулю. Гиббс показал, что разделяющую
поверхность можно провести так чтобы
![]() и
и
![]() .
При таком выборе разделяющей поверхности
можно считать, что адсорбция растворителя
отсутствует
.
При таком выборе разделяющей поверхности
можно считать, что адсорбция растворителя
отсутствует
![]() .
.
Перейдем к концентрации.
![]() ,
где
– равновесная концентрация в объеме.
,
где
– равновесная концентрация в объеме.
![]() ;
;
![]() ;
;
![]() ;
;
Это одно из наиболее важных уравнений коллоидной химии. Оно связывает величину адсорбции с поверхностным натяжением.
Уравнение Гиббса подтверждено экспериментально методом среза тонких слоев и их анализа.
Из
этого уравнения видно, что для ПАВ
величина адсорбции растет с увеличением
концентрации и понижением температуры.
Величину
![]() называют поверхностной активностью
и обозначают символом
называют поверхностной активностью
и обозначают символом
![]() в честь Гиббса. Единицей измерения
поверхностной активности служит 1 Гиббс.
в честь Гиббса. Единицей измерения
поверхностной активности служит 1 Гиббс.
Проведем
анализ уравнения Гиббса. Если
![]() ,
то
,
что характерно для ПИАВ, проявляющих
отрицательную адсорбцию.
,
то
,
что характерно для ПИАВ, проявляющих
отрицательную адсорбцию.
Если
![]() ,
то
,
что характерно для ПАВ, проявляющих
положительную адсорбцию. Если
,
то
,
что характерно для ПАВ, проявляющих
положительную адсорбцию. Если
![]() ,
то
,
что характерно для неактивных веществ.
,
то
,
что характерно для неактивных веществ.
Используя
уравнение Гиббса, можно найти величину
адсорбции
![]() для любого значения
,
из тангенса угла наклона касательной
к экспериментальной кривой
для любого значения
,
из тангенса угла наклона касательной
к экспериментальной кривой
![]() .
Таким путем можно перейти от изотермы
поверхностного натяжения к изотерме
адсорбции (рис.4.5)
.
Таким путем можно перейти от изотермы
поверхностного натяжения к изотерме
адсорбции (рис.4.5)
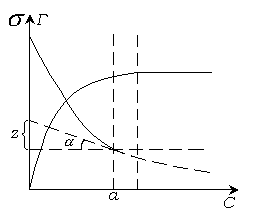
Рис. 4.5. Переход от изотермы поверхностного натяжения к изотерме адсорбции.
![]()
![]()
Решив уравнение Гиббса для ряда точек, строят изотерму адсорбции.
4.5 Строение адсорбционного слоя пав на границе раствора с газом
Мы рассмотрели основные закономерности адсорбции ПАВ на границе раствора с газом с термодинамической точки зрения. Рассмотрим теперь ориентацию молекул ПАВ на поверхности и строение адсорбционного слоя.
Пленки ПАВ, образующиеся на поверхности воды, могут находиться в трех агрегатных состояниях: твердом, жидком, газообразном. Агрегатное состояние пленки определяется силами межмолекулярного взаимодействия и площадью, занимаемой молекулой на поверхности. Выталкивание молекул ПАВ на поверхность и их упаковка в адсорбционном слое приводят к растяжению адсорбционного слоя и к существованию поверхностного давления . Силы поверхностного натяжения, наоборот, сжимают поверхностный слой.
Если между молекулами действуют слабые силы, а поверхность велика, то молекулы на поверхности вследствие теплового движения находятся в состоянии двумерного газа. Газообразные пленки образуют дифильные органические вещества с определенной длиной углеводородного радикала, например, жирные кислоты с числом атомов углерода от 11 до 14.
В зависимости от длины углеводородного радикала ПАВ и площади, занимаемой молекулой, монослои ПАВ обладают морфизмом, т.е. способны к фазовым переходам. Сжатие монослоя обеспечивается плавучим барьером, на который действует определенная сила. При отсутствии действия силы на подвижный барьер монослой находится в газообразном состоянии (рис.4.6, ).
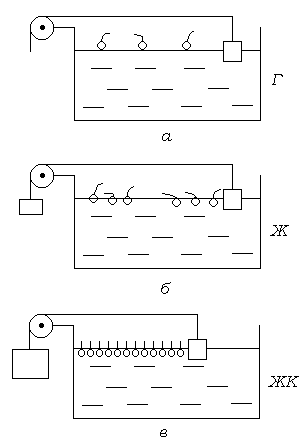
Рис.4.6. Агрегатные состояния поверхностных пленок ПАВ.
Под действием сравнительно небольшой силы на плавучий барьер монослой переходит в жидкое состояние. Молекулы ПАВ на поверхности группируются и образуют островки (рис.5, б). При дальнейшем увеличении действующей на барьер силы, т. е. уменьшение площади, занимаемой молекулой ПАВ, монослой переходит в жидко-кристаллическое состояние (рис.5, в).
