
- •I. Введение
- •1.1. Место коллоидной химии в общей системе наук
- •1.2. Краткие исторические сведения
- •1.3. Предмет коллоидной химии
- •1.4. Физические и химические поверхностные явления
- •1.5. Основные признаки объектов коллоидной химии
- •1.6. Фундаментальные особенности ультрадисперсного (коллоидного) состояния вещества
- •1.7. Влияние дисперсности на свойства вещества
- •1.8. Значение коллоидной химии в природе и технике
- •II. Поверхностные явления и адсорбция
- •2.1. Классификация поверхностных явлений
- •2.2. Основы термодинамики поверхностного слоя
- •2.3. Интенсивные свойства гетерогенных систем
- •2.4. Экстенсивные свойства гетерогенных систем
- •2.5. Метод избыточных величин Гиббса
- •2.8. Уравнение Гиббса для плоского поверхностного слоя
- •2.9. Понятие об адсорбции
- •III. Адсорбция на различных границах раздела
- •3.1. Понятие об адсорбции
- •3.2 Количественные характеристики адсорбции
- •3.3. Типы адсорбционных зависимостей
- •3.4. Адсорбция газов и паров на твердом теле
- •3.5. Адсорбция как обратимый экзотермический процесс
- •3.6. Физическая адсорбция и хемосорбция
- •3.7. Значение координационных связей при хемосорбции
- •3.8. Природа адсорбционных сил
- •3.9. Изотермы адсорбции
- •3.10. Кинетика адсорбции
- •3.11. Классическая теория адсорбции
- •3.11.1. Теория мономолекулярной адсорбции Ленгмюра
- •Вывод уравнения Ленгмюра.
- •Анализ уравнения Ленгмюра
- •Полимолекулярная (потенциальная) теория адсорбции Поляни
- •3.11.3. Теория Брунауэра, Эииета и Теллера (бэт).
- •3.11.4. Схема полимолекулярной адсорбции
- •4.1 Поведение растворенных веществ на границе раствора с газом
- •4.2 Поверхностная активность.
- •4.3 Поверхностно – инактивные вещества
- •4.4 Вывод адсорбционного уравнения Гиббса
- •4.5 Строение адсорбционного слоя пав на границе раствора с газом
- •4.6 Уравнение состояния двумерного газа.
- •4.7 Диаграммы состояния поверхностных пленок
- •4.8 Химические реакции в поверхностных пленках.
- •4.9 Самоорганизованные монослои и пленки, перенесенные на твердую подложку с поверхности вода-воздух (пленки Ленгмюра –Блоджетт).
- •4.10 Двухсторонние пленки
- •4.11 Вид изотермы поверхностного натяжения. Уравнение Шишковского
- •4.12 Связь уравнений Ленгмюра и Гиббса с помощью уравнения Шишковского
- •4.13 Вывод уравнения Ленгмюра при совместном решении уравнений Гиббса и Шишковского
- •4.14 Правило Траубе
- •V. Адсорбция на границе раздела твердое тело – раствор
- •5.1. Введение
- •5.2. Правило вытеснения
- •5.3. Когезия и адгезия
- •5.4. Смачивание и растекание
- •5.5. Практическое значение смачивания
- •5.6. Правило выравнивания полярностей
- •5.7. Адсорбция полимеров из растворов на твердой поверхности
- •VI. Коллоидные пав
- •6.1. Введение
- •6.2. Производство и применение пав
- •6.3. Биоразлагаемость и токсичность
- •6.4. Классификация и общая характеристика пав
- •6.5. Свойства водных растворов пав. Мицеллообразование
- •6.6. Влияние различных факторов на ккм
- •6.6.1. Влияние длины углеводородного радикала
- •6.6.2. Влияние строения углеводородного радикала
- •6.6.3. Влияние добавок электролитов
- •6.6.4. Влияние полярных органических веществ
- •6.7. Термодинамика мицеллообразования в водной среде
- •6.8. Зависимость растворимости пав в воде от температуры
- •6.9. Мицеллообразование в неводных средах
- •6.10. Оценка дифильных свойств пав
- •6.11. Солюбилизация
- •6.12. Физико-химия моющего действия
- •6.13. Смеси ионных и неионных пав
- •6.14. Контрольные вопросы
- •VII. Получение дисперсных систем
- •7.1. Введение
- •7.2. Конденсационные способы образования дисперсных систем
- •Реакция обмена
- •Реакции восстановления
- •Реакция окисления
- •Гидролиз солей
- •Конденсация паров
- •Замена растворителя
- •7.3. Строение мицелл различных золей
- •Типы потенциалопределяющих ионов
- •Принципы построения формулы мицелл
- •7.4. Диспергационные методы получения дисперсных систем
- •7.4.1. Механическое диспергирование
- •7.4.2. Эффект Ребиндера и его роль в диспергировании
- •7.4.3. Физико-химическое дробление осадков (пептизация)
- •7.5. Образование лиофильных коллоидных систем
- •VIII. Молекулярно-кинетические свойства коллоидных систем
- •8.1. Введение
- •8.2. Броуновское движение
- •8.2.1. Природа броуновского движения
- •8.2.2. Общенаучное значение броуновского движения
- •8.2.3. Средний сдвиг частицы
- •8.3. Диффузия
- •8.3.1. Выражения для идеальной диффузии. Первый и второй законы Фика
- •8.3.2. Градиент концентрации при диффузии
- •8.3.3. Диффузия и проницаемость
- •8.4. Седиментация и методы седиментационного анализа
- •8.4.1. Гипсометрический закон
- •8.4.2. Седиментационное уравнение незаряженной частицы
- •8.4.3. Ультрацентрифуга
- •8.4.4. Скоростное ультрацентрифугирование
- •8.4.5. Равновесное ультрацентрифугирование
- •8.5. Контрольные вопросы
- •IX. Оптические свойства коллоидных систем.
- •9.1. Явления, наблюдаемые при взаимодействии видимого света с веществом.
- •9.2. Рэлеевское рассеяние света.
- •9.3. Рассеяние малыми частицами.
- •9.4. Рассеяние большими частицами.
- •9.5. Анализ уравнения Рэлея.
- •9.6. Поглощение света дисперсными системами.
- •9.7. Турбидиметрический метод определения коллоидных частиц.
- •9.7.1. Дисперсные системы, подчиняющиеся уравнению Рэлея.
- •9.7.2. Дисперсные системы, не подчиняющиеся уравнению Рэлея.
- •9.8. Световая микроскопия.
- •9.8.1. Световая микроскопия.
- •9.8.2. Темнопольная микроскопия.
- •9.8.3. Электронная микроскопия Предел разрешения электронного микроскопа.
- •Взаимодействие электронов с объектом.
- •Характеристики изображения.
- •Типы электронных микроскопов.
- •Основные части электронного микроскопа и их назначение.
- •Образцы для просвечивающей электронной микроскопии.
- •Методы препарирования образцов.
- •X. Электроповерхностные свойства дисперсных систем
- •10.1. Значение электрокинетических явлений в природе и технике
- •10.3. Связь поверхностного натяжения с электрическим потенциалом. Уравнение Липпмана.
- •Строение двойного электрического слоя.
- •10.5. Изменение потенциала в дэс с изменением расстояния от поверхности.
- •10.6. Внутренняя часть дэс
- •10.7. Электрокинетические явления.
- •10.8. Уравнение Гельмгольца-Смолуховского для определения -потенциала.
- •10.9. Влияние электролитов на двойной электрический слой.
- •10.10. Влияние концентрации электролита.
- •10.11.Влияние валентности противоиона на дэс.
- •10.12. Влияние радиуса иона на дэс.
- •Перезарядка золей индифферентными электролитами
- •Действие неиндифферентных электролитов на двойной электрический слой
- •Влияние температуры и разбавления на дэс
- •XI. Устойчивость и коагуляция коллойдных систем
- •11.1. Понятие об устойчивости
- •11.2. Расклинивающее давление
- •11.3. Теория агрегативной устойчивости и коагуляции лиофобных дисперсных систем (теория длфо)
- •11.4. Кинетический подход к устойчивости дисперсных систем
- •11.5. Природа сил, действующих между частицами.
- •Силы отталкивания
- •11.6.Коагуляция.
- •11.7. Механизм коагуляции электролитами по теории длфо.
- •11.8. Коагулирующее действие электролитов.
- •11.9. Правила коагуляции электролитами.
- •XII. Структурно–механические свойства дисперсных систем
- •12.1. Основные понятия. Реология как метод исследования структуры дисперсных систем
- •12.2. Идеальные законы реологии
- •12.3. Моделирование реологических свойств тел
- •12.8. Реологические свойства твердообразных тел
- •XIII. Растворы высокомолекулярных соединений. Основные положения статистики полимерных цепей
- •13.1. Гибкость и размеры цепи
- •13.2. Количественные характеристики размеров макромолекул
- •13.3. Свойства Гауссова клубка
- •13.4. Состояния полимеров в растворе
- •13.5. Термодинамика растворения полимеров
- •13.6. Набухание как первая стадия растворения
- •13.7. Разбавленные растворы полимеров
- •13.8. Осмотическое давление растворов
- •13.9. Термодинамическое сродство растворителя к полимеру
- •13.10. Взаимодействия в растворах полимеров
- •13.11. Концентрированные растворы полимеров
- •13.12. Термодинамическая равновесность растворов полимеров и подчинение их правилу фаз
3.10. Кинетика адсорбции
Кинетика адсорбции
подчиняется уравнению первого порядка.
Чем больше насыщение поверхности, т. е.
меньше разность (![]() ),
тем меньше скорость адсорбции.
),
тем меньше скорость адсорбции.
![]()
С повышением температуры скорость адсорбции увеличивается, а равновесная адсорбция уменьшается (рис. 3.13).

Рис. 3. 13. Кинетика адсорбции.
Константа зависит от теплоты адсорбции, температуры и коэффициента диффузии адсорбата. Температурный коэффициент адсорбции мал, т. к. энергия активации физической адсорбции равна 0.
3.11. Классическая теория адсорбции
Ленгмюр и Поляни одновременно в 1915 году разработали теории адсорбции. Эти теории являются ограниченными. Они применяются в зависимости от природы адсорбента и адсорбата и условий адсорбции. Теория Ленгмюра рассматривает физическую и химическую адсорбцию при малом давлении и температуре ниже критической. Она неприменима к тонкопористым сорбентам. Теория Поляни применима только к физической адсорбции.
3.11.1. Теория мономолекулярной адсорбции Ленгмюра
Теория Ленгмюра учитывает ограниченность поверхности адсорбента, что приводит к адсорбционному насыщению поверхности по мере увеличения концентрации адсорбата.
При разработке этой теории Ленгмюром были сделаны следующие допущения:
Адсорбция локализована, адсорбционные силы близки к химическим.
Адсорбция происходит на активных центрах адсорбента, которые энергетически эквивалентны.
Радиус действия адсорбционных сил мал, и один активный центр адсорбирует одну молекулу адсорбата, причем образуется мономолекулярный адсорбционный слой.
Устанавливается динамическое равновесие адсорбция десорбция.
Между адсорбированными молекулами отсутствует взаимодействие, вследствие чего время пребывания на поверхности не зависит от того, занят соседний активный центр или нет.
Вывод уравнения Ленгмюра.
Ленгмюр рассматривал адсорбцию как квазихимическую реакцию между газом и активными центрами с образованием адсорбционного комплекса.
![]()
Обозначим давление
газа через
,
концентрацию свободных активных центров
через
![]() ,
концентрацию занятых активных центров
через
.
Тогда константа равновесия
,
концентрацию занятых активных центров
через
.
Тогда константа равновесия
![]() .
.
![]() ;
;
![]() ;
;
![]()
![]() ;
;
![]()
![]() ;
;
![]()
Очевидно, величина равна поверхностной концентрации адсорбата, т. е. количеству адсорбированного вещества а, т.к. один активный центр занимает одна молекула адсорбата.
![]() ;
Иногда числитель и знаменатель этого
выражения делят на
.
;
Иногда числитель и знаменатель этого
выражения делят на
.
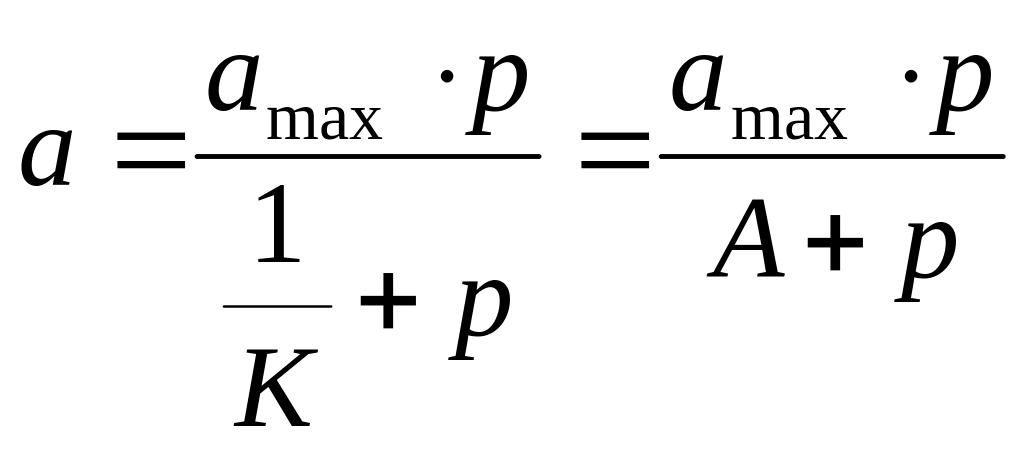 .
.
Константы уравнения
Ленгмюра имеют следующий смысл.
![]() - это максимальная адсорбция при
образовании мономолекулярного слоя,
т. е. емкость монослоя.
- константа адсорбционного равновесия,
связанная с теплотой адсорбции. К
характеризует энергию взаимодействия
адсорбата с адсорбентом, т. е. химическое
сродство. Для любой химической реакции
справедливо выражение
- это максимальная адсорбция при
образовании мономолекулярного слоя,
т. е. емкость монослоя.
- константа адсорбционного равновесия,
связанная с теплотой адсорбции. К
характеризует энергию взаимодействия
адсорбата с адсорбентом, т. е. химическое
сродство. Для любой химической реакции
справедливо выражение
![]() ;
;
;
;
![]() ;
;
![]()
Анализ уравнения Ленгмюра
Рассмотрим насколько хорошо описывает уравнение Ленгмюра изотерму адсорбции на всех ее участках.
На изотерме адсорбции,
изображенной на рис. 3.10 можно выделить
три участка. При малых значениях
всегда можно подобрать такое значение
,
когда значение
![]() ,
и уравнение Ленгмюра принимает вид:
,
и уравнение Ленгмюра принимает вид:
![]() ,
,
То есть
пропорциональна
,
что соответствует начальному линейному
участку кривой. При больших значениях
можно подобрать такие значения
,
когда величина
![]() и
и
![]() ,
что соответствует третьему участку
изотермы. Второй криволинейный участок
изотермы описывается полным уравнением
Ленгмюра. Таким образом, это уравнение
хорошо описывает всю изотерму адсорбции,
в отличие от уравнения Фрейндлиха.
,
что соответствует третьему участку
изотермы. Второй криволинейный участок
изотермы описывается полным уравнением
Ленгмюра. Таким образом, это уравнение
хорошо описывает всю изотерму адсорбции,
в отличие от уравнения Фрейндлиха.
Существует два способа графического решения уравнения Ленгмюра (рис 3.14).
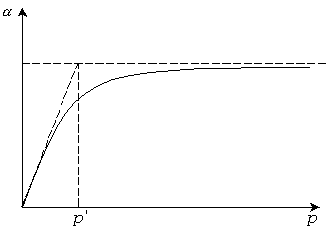
Рис. 3.14. Решение уравнения Ленгмюра.
По первому способу по
изотерме находят значение
.
Затем продолжают начальный прямолинейный
участок изотермы до пересечения с линией
и из точки пересечения опускают
перпендикуляр до точки
![]() на оси абсцисс. При малых
значение
на оси абсцисс. При малых
значение
![]() ,
и им знаменателе можно пренебречь. Тогда
уравнение принимает вид:
,
и им знаменателе можно пренебречь. Тогда
уравнение принимает вид:
![]() .
При
.
При
![]() .
Отсюда
.
Отсюда
![]() .
.
Второй способ решения уравнения Ленгмюра применяется, когда экспериментальная изотерма не имеет третьего линейного участка, т. е. значение неизвестно. Уравнение преобразуется в уравнение прямой:
![]() ;
;
![]() ;
;

Рис.3.15.
Решение уравнения Ленгмюра
![]() ;
;
![]()
Уравнение Ленгмюра позволяет определить удельную поверхность адсорбента.
Действительно,
произведение
![]() равно числу
молекул, приходящихся на 1 см2
поверхности. Умножив это значение на
площадь, занимаемую одной молекулой
равно числу
молекул, приходящихся на 1 см2
поверхности. Умножив это значение на
площадь, занимаемую одной молекулой
![]() получим величину удельной поверхности
получим величину удельной поверхности
![]() .
.

Рис. 3.16. Изотерма полимолекулярной адсорбции.
Часто изотермы адсорбции имеют вид, отличающийся от ленгмюровской изотермы, а именно -образный вид (Рис. 3.16). Это объясняется полимолекулярной адсорбцией, или капиллярной конденсацией. Изотермы адсорбции полимеров, как правило, не являются ленгмюровскими, т. к. одна макромолекула занимает несколько активных центров адсорбента, т. е. предпосылки, положенные в основу уравнения Ленгмюра, не соблюдаются.
