
- •I. Введение
- •1.1. Место коллоидной химии в общей системе наук
- •1.2. Краткие исторические сведения
- •1.3. Предмет коллоидной химии
- •1.4. Физические и химические поверхностные явления
- •1.5. Основные признаки объектов коллоидной химии
- •1.6. Фундаментальные особенности ультрадисперсного (коллоидного) состояния вещества
- •1.7. Влияние дисперсности на свойства вещества
- •1.8. Значение коллоидной химии в природе и технике
- •II. Поверхностные явления и адсорбция
- •2.1. Классификация поверхностных явлений
- •2.2. Основы термодинамики поверхностного слоя
- •2.3. Интенсивные свойства гетерогенных систем
- •2.4. Экстенсивные свойства гетерогенных систем
- •2.5. Метод избыточных величин Гиббса
- •2.8. Уравнение Гиббса для плоского поверхностного слоя
- •2.9. Понятие об адсорбции
- •III. Адсорбция на различных границах раздела
- •3.1. Понятие об адсорбции
- •3.2 Количественные характеристики адсорбции
- •3.3. Типы адсорбционных зависимостей
- •3.4. Адсорбция газов и паров на твердом теле
- •3.5. Адсорбция как обратимый экзотермический процесс
- •3.6. Физическая адсорбция и хемосорбция
- •3.7. Значение координационных связей при хемосорбции
- •3.8. Природа адсорбционных сил
- •3.9. Изотермы адсорбции
- •3.10. Кинетика адсорбции
- •3.11. Классическая теория адсорбции
- •3.11.1. Теория мономолекулярной адсорбции Ленгмюра
- •Вывод уравнения Ленгмюра.
- •Анализ уравнения Ленгмюра
- •Полимолекулярная (потенциальная) теория адсорбции Поляни
- •3.11.3. Теория Брунауэра, Эииета и Теллера (бэт).
- •3.11.4. Схема полимолекулярной адсорбции
- •4.1 Поведение растворенных веществ на границе раствора с газом
- •4.2 Поверхностная активность.
- •4.3 Поверхностно – инактивные вещества
- •4.4 Вывод адсорбционного уравнения Гиббса
- •4.5 Строение адсорбционного слоя пав на границе раствора с газом
- •4.6 Уравнение состояния двумерного газа.
- •4.7 Диаграммы состояния поверхностных пленок
- •4.8 Химические реакции в поверхностных пленках.
- •4.9 Самоорганизованные монослои и пленки, перенесенные на твердую подложку с поверхности вода-воздух (пленки Ленгмюра –Блоджетт).
- •4.10 Двухсторонние пленки
- •4.11 Вид изотермы поверхностного натяжения. Уравнение Шишковского
- •4.12 Связь уравнений Ленгмюра и Гиббса с помощью уравнения Шишковского
- •4.13 Вывод уравнения Ленгмюра при совместном решении уравнений Гиббса и Шишковского
- •4.14 Правило Траубе
- •V. Адсорбция на границе раздела твердое тело – раствор
- •5.1. Введение
- •5.2. Правило вытеснения
- •5.3. Когезия и адгезия
- •5.4. Смачивание и растекание
- •5.5. Практическое значение смачивания
- •5.6. Правило выравнивания полярностей
- •5.7. Адсорбция полимеров из растворов на твердой поверхности
- •VI. Коллоидные пав
- •6.1. Введение
- •6.2. Производство и применение пав
- •6.3. Биоразлагаемость и токсичность
- •6.4. Классификация и общая характеристика пав
- •6.5. Свойства водных растворов пав. Мицеллообразование
- •6.6. Влияние различных факторов на ккм
- •6.6.1. Влияние длины углеводородного радикала
- •6.6.2. Влияние строения углеводородного радикала
- •6.6.3. Влияние добавок электролитов
- •6.6.4. Влияние полярных органических веществ
- •6.7. Термодинамика мицеллообразования в водной среде
- •6.8. Зависимость растворимости пав в воде от температуры
- •6.9. Мицеллообразование в неводных средах
- •6.10. Оценка дифильных свойств пав
- •6.11. Солюбилизация
- •6.12. Физико-химия моющего действия
- •6.13. Смеси ионных и неионных пав
- •6.14. Контрольные вопросы
- •VII. Получение дисперсных систем
- •7.1. Введение
- •7.2. Конденсационные способы образования дисперсных систем
- •Реакция обмена
- •Реакции восстановления
- •Реакция окисления
- •Гидролиз солей
- •Конденсация паров
- •Замена растворителя
- •7.3. Строение мицелл различных золей
- •Типы потенциалопределяющих ионов
- •Принципы построения формулы мицелл
- •7.4. Диспергационные методы получения дисперсных систем
- •7.4.1. Механическое диспергирование
- •7.4.2. Эффект Ребиндера и его роль в диспергировании
- •7.4.3. Физико-химическое дробление осадков (пептизация)
- •7.5. Образование лиофильных коллоидных систем
- •VIII. Молекулярно-кинетические свойства коллоидных систем
- •8.1. Введение
- •8.2. Броуновское движение
- •8.2.1. Природа броуновского движения
- •8.2.2. Общенаучное значение броуновского движения
- •8.2.3. Средний сдвиг частицы
- •8.3. Диффузия
- •8.3.1. Выражения для идеальной диффузии. Первый и второй законы Фика
- •8.3.2. Градиент концентрации при диффузии
- •8.3.3. Диффузия и проницаемость
- •8.4. Седиментация и методы седиментационного анализа
- •8.4.1. Гипсометрический закон
- •8.4.2. Седиментационное уравнение незаряженной частицы
- •8.4.3. Ультрацентрифуга
- •8.4.4. Скоростное ультрацентрифугирование
- •8.4.5. Равновесное ультрацентрифугирование
- •8.5. Контрольные вопросы
- •IX. Оптические свойства коллоидных систем.
- •9.1. Явления, наблюдаемые при взаимодействии видимого света с веществом.
- •9.2. Рэлеевское рассеяние света.
- •9.3. Рассеяние малыми частицами.
- •9.4. Рассеяние большими частицами.
- •9.5. Анализ уравнения Рэлея.
- •9.6. Поглощение света дисперсными системами.
- •9.7. Турбидиметрический метод определения коллоидных частиц.
- •9.7.1. Дисперсные системы, подчиняющиеся уравнению Рэлея.
- •9.7.2. Дисперсные системы, не подчиняющиеся уравнению Рэлея.
- •9.8. Световая микроскопия.
- •9.8.1. Световая микроскопия.
- •9.8.2. Темнопольная микроскопия.
- •9.8.3. Электронная микроскопия Предел разрешения электронного микроскопа.
- •Взаимодействие электронов с объектом.
- •Характеристики изображения.
- •Типы электронных микроскопов.
- •Основные части электронного микроскопа и их назначение.
- •Образцы для просвечивающей электронной микроскопии.
- •Методы препарирования образцов.
- •X. Электроповерхностные свойства дисперсных систем
- •10.1. Значение электрокинетических явлений в природе и технике
- •10.3. Связь поверхностного натяжения с электрическим потенциалом. Уравнение Липпмана.
- •Строение двойного электрического слоя.
- •10.5. Изменение потенциала в дэс с изменением расстояния от поверхности.
- •10.6. Внутренняя часть дэс
- •10.7. Электрокинетические явления.
- •10.8. Уравнение Гельмгольца-Смолуховского для определения -потенциала.
- •10.9. Влияние электролитов на двойной электрический слой.
- •10.10. Влияние концентрации электролита.
- •10.11.Влияние валентности противоиона на дэс.
- •10.12. Влияние радиуса иона на дэс.
- •Перезарядка золей индифферентными электролитами
- •Действие неиндифферентных электролитов на двойной электрический слой
- •Влияние температуры и разбавления на дэс
- •XI. Устойчивость и коагуляция коллойдных систем
- •11.1. Понятие об устойчивости
- •11.2. Расклинивающее давление
- •11.3. Теория агрегативной устойчивости и коагуляции лиофобных дисперсных систем (теория длфо)
- •11.4. Кинетический подход к устойчивости дисперсных систем
- •11.5. Природа сил, действующих между частицами.
- •Силы отталкивания
- •11.6.Коагуляция.
- •11.7. Механизм коагуляции электролитами по теории длфо.
- •11.8. Коагулирующее действие электролитов.
- •11.9. Правила коагуляции электролитами.
- •XII. Структурно–механические свойства дисперсных систем
- •12.1. Основные понятия. Реология как метод исследования структуры дисперсных систем
- •12.2. Идеальные законы реологии
- •12.3. Моделирование реологических свойств тел
- •12.8. Реологические свойства твердообразных тел
- •XIII. Растворы высокомолекулярных соединений. Основные положения статистики полимерных цепей
- •13.1. Гибкость и размеры цепи
- •13.2. Количественные характеристики размеров макромолекул
- •13.3. Свойства Гауссова клубка
- •13.4. Состояния полимеров в растворе
- •13.5. Термодинамика растворения полимеров
- •13.6. Набухание как первая стадия растворения
- •13.7. Разбавленные растворы полимеров
- •13.8. Осмотическое давление растворов
- •13.9. Термодинамическое сродство растворителя к полимеру
- •13.10. Взаимодействия в растворах полимеров
- •13.11. Концентрированные растворы полимеров
- •13.12. Термодинамическая равновесность растворов полимеров и подчинение их правилу фаз
4.2 Поверхностная активность.
Для
кривой
![]() как убывающей функции характерна
отрицательная первая производная
как убывающей функции характерна
отрицательная первая производная
![]() ,
называемая поверхностной активностью.
,
называемая поверхностной активностью.
Поверхностная активность не является абсолютным свойством веществ, а зависит от природы поверхности раздела фаз. Спирты поверхностно – активны по отношению к воде, но инактивны по отношению к границе неполярного углеводорода с воздухом.
Молекулы
поверхностно – активных веществ (ПАВ)
состоят из полярной и неполярной частей,
т.е. они дифильны (амфифильны). Углеводородная
часть молекулы ответственна за
растворимость в масле, тогда как полярная
![]() или
или
![]() группа имеет большое сродство к воде и
увлекает за собой неполярную углеводородную
часть в водный раствор. Если эти молекулы
находятся на поверхности раздела воды
с воздухом или маслом, то гидрофильные
группы находятся в водной фазе, а
липофильные углеводородные цепи – в
воздушной или масляной фазе (рис. 4.2).
группа имеет большое сродство к воде и
увлекает за собой неполярную углеводородную
часть в водный раствор. Если эти молекулы
находятся на поверхности раздела воды
с воздухом или маслом, то гидрофильные
группы находятся в водной фазе, а
липофильные углеводородные цепи – в
воздушной или масляной фазе (рис. 4.2).
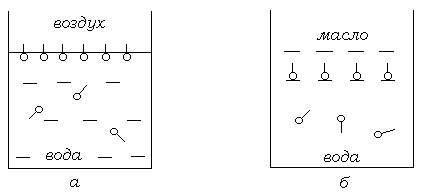
Рис. 4.2. Расположение молекул ПАВ на границе воды с воздухом ( ) и с маслом (б)
Такое расположение молекул энергетически более выгодно, чем полное растворение в каждой фазе. Сильная адсорбция таких веществ на поверхности или в межфазном слое в форме ориентированного мономолекулярного слоя (монослоя) связана с высокой поверхностной активностью этих веществ. Поверхностная активность является динамическим явлением, так как конечное состояние поверхности или межфазного слоя определяется равновесием между адсорбцией и полным смешением вследствии теплового движения молекул.
Способность
молекул ПАВ упаковываться в межфазном
слое приводит к его растяжению, тогда
как силы поверхностного натяжения
приводят к сжатию поверхностного слоя.
Если растягивающее (или поверхностное)
давление адсорбированного слоя ПАВ
обозначить через
![]() ,
то поверхностное или межфазное натяжение
будет меньше исходного
,
то поверхностное или межфазное натяжение
будет меньше исходного
![]() .
Если межфазное натяжение между двумя
жидкостями уменьшается до достаточно
низкого значения при добавлении ПАВ,
то то легко протекает эмульгирование,
так как это требует относительно малого
увеличения свободной поверхностной
энергии системы. Если
.
Если межфазное натяжение между двумя
жидкостями уменьшается до достаточно
низкого значения при добавлении ПАВ,
то то легко протекает эмульгирование,
так как это требует относительно малого
увеличения свободной поверхностной
энергии системы. Если
![]() ,
то
жидкости
либо смешиваются, либо происходит
самопроизвольное эмульгирование.
,
то
жидкости
либо смешиваются, либо происходит
самопроизвольное эмульгирование.
4.3 Поверхностно – инактивные вещества
Поверхностно
– инактивные вещества являются антиподами
ПАВ. Молекулы ПИАВ более полярны, чем
молекулы растворителя
![]() .
Для них силы притяжения молекул
растворенного вещества и растворителя
больше, чем силы притяжения молекул
растворителя между собой,т.е. взаимодействие
типа 1-1 < 1-2, и молекулам растворенного
вещества выгоднее находиться в окружении
молекул растворителя. Вследствии этого
молекулы растворенного вещества
стремятся мигрировать с поверхности в
объем, для системы это термодинамически
выгодно. Поэтому ПИАВ характеризуются
отрицательной адсорбцией, недостатком
вещества на поверхности, для них
.
Для них силы притяжения молекул
растворенного вещества и растворителя
больше, чем силы притяжения молекул
растворителя между собой,т.е. взаимодействие
типа 1-1 < 1-2, и молекулам растворенного
вещества выгоднее находиться в окружении
молекул растворителя. Вследствии этого
молекулы растворенного вещества
стремятся мигрировать с поверхности в
объем, для системы это термодинамически
выгодно. Поэтому ПИАВ характеризуются
отрицательной адсорбцией, недостатком
вещества на поверхности, для них
![]() .
ПИАВ обладают высокой растворимостью
и значением поверхностного натяжения
большим, чем у растворителя,
.
ПИАВ обладают высокой растворимостью
и значением поверхностного натяжения
большим, чем у растворителя,
![]() .
.
Вследствии
высокой растворимости, сродства к
растворителю, поверхностно-инактивное
вещество хорошо взаимодействует с
растворителем и находится в объеме, а
не на поверхности. Поверхностное
натяжение раствора становится больше,
чем чистого растворителя
![]() ,
так как взаимодействие между молекулами
ПИАВ и растворителя больше, чем между
молекулами растворителя. Поэтому
,
так как взаимодействие между молекулами
ПИАВ и растворителя больше, чем между
молекулами растворителя. Поэтому
![]() .
.
Вид изотермы поверхностного натяжения и адсорбции растворов, содержащих ПИАВ, показан на рис. 4.3.
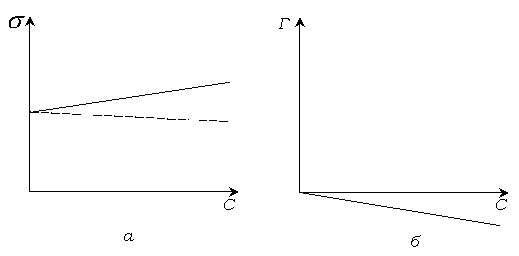
Рис. 3.3 Изотермы поверхностного натяжения (а) и адсорбции (б) растворов ПИАВ.
Наклон изотерм не большой, так как повышение свободной поверхностной энергии невыгодно. Вследствие теплового движения молекулы ПИАВ находятся и в поверхностном слое. Некоторое увеличение поверхностного натяжения, а значит и перекрывается ростом энтропии системы за счет распределения вещества. Если бы в поверхностном слое не было бы молекул адсорбата, энтропия системы была бы меньше.
К ПИАВ относятся неорганические электролиты, образующие гидратированные ионы, кислоты, щелочи, соли, а также хорошо ионизирующиеся органические кислоты, у которых органическая часть отсутствует или мала, например, муравьиная, аминоуксусная кислоты. Так как ионы электролита гидратированы, они не могут подходить к поверхности ближе, чем на толщину гидратной оболочки. Выход иона непосредственно в поверхностный слой термодинамически невыгоден вследствие затраты энергии на гидратацию иона.
Т![]() .
Поэтому вещество равномерно распределяется
в объеме и на поверхности и адсорбция
равна нулю,
.
Поэтому вещество равномерно распределяется
в объеме и на поверхности и адсорбция
равна нулю,
![]() .
Значения поверхностного натяжения
раствора и чистого растворителя равны,
.
Значения поверхностного натяжения
раствора и чистого растворителя равны,
![]() .
К поверхностно-неактивным веществам
относятся сахара. Изотермы поверхностного
натяжения ПАВ, ПИАВ и поверхностно-неактивных
веществ показаны на рис. 4.4.
.
К поверхностно-неактивным веществам
относятся сахара. Изотермы поверхностного
натяжения ПАВ, ПИАВ и поверхностно-неактивных
веществ показаны на рис. 4.4.
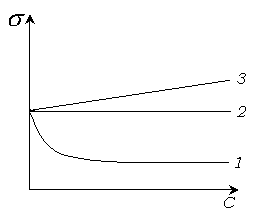
Рис. 4.4 Изотермы поверхностного натяжения.
1 -
ПАВ.
;
![]() .
.
2 -
неактивные вещества
;
![]() .
.
3 - ПИВ. ; .
После качественного рассмотрения связи адсорбции с поверхностным натяжением перейдем к количественному.
