
- •I. Введение
- •1.1. Место коллоидной химии в общей системе наук
- •1.2. Краткие исторические сведения
- •1.3. Предмет коллоидной химии
- •1.4. Физические и химические поверхностные явления
- •1.5. Основные признаки объектов коллоидной химии
- •1.6. Фундаментальные особенности ультрадисперсного (коллоидного) состояния вещества
- •1.7. Влияние дисперсности на свойства вещества
- •1.8. Значение коллоидной химии в природе и технике
- •II. Поверхностные явления и адсорбция
- •2.1. Классификация поверхностных явлений
- •2.2. Основы термодинамики поверхностного слоя
- •2.3. Интенсивные свойства гетерогенных систем
- •2.4. Экстенсивные свойства гетерогенных систем
- •2.5. Метод избыточных величин Гиббса
- •2.8. Уравнение Гиббса для плоского поверхностного слоя
- •2.9. Понятие об адсорбции
- •III. Адсорбция на различных границах раздела
- •3.1. Понятие об адсорбции
- •3.2 Количественные характеристики адсорбции
- •3.3. Типы адсорбционных зависимостей
- •3.4. Адсорбция газов и паров на твердом теле
- •3.5. Адсорбция как обратимый экзотермический процесс
- •3.6. Физическая адсорбция и хемосорбция
- •3.7. Значение координационных связей при хемосорбции
- •3.8. Природа адсорбционных сил
- •3.9. Изотермы адсорбции
- •3.10. Кинетика адсорбции
- •3.11. Классическая теория адсорбции
- •3.11.1. Теория мономолекулярной адсорбции Ленгмюра
- •Вывод уравнения Ленгмюра.
- •Анализ уравнения Ленгмюра
- •Полимолекулярная (потенциальная) теория адсорбции Поляни
- •3.11.3. Теория Брунауэра, Эииета и Теллера (бэт).
- •3.11.4. Схема полимолекулярной адсорбции
- •4.1 Поведение растворенных веществ на границе раствора с газом
- •4.2 Поверхностная активность.
- •4.3 Поверхностно – инактивные вещества
- •4.4 Вывод адсорбционного уравнения Гиббса
- •4.5 Строение адсорбционного слоя пав на границе раствора с газом
- •4.6 Уравнение состояния двумерного газа.
- •4.7 Диаграммы состояния поверхностных пленок
- •4.8 Химические реакции в поверхностных пленках.
- •4.9 Самоорганизованные монослои и пленки, перенесенные на твердую подложку с поверхности вода-воздух (пленки Ленгмюра –Блоджетт).
- •4.10 Двухсторонние пленки
- •4.11 Вид изотермы поверхностного натяжения. Уравнение Шишковского
- •4.12 Связь уравнений Ленгмюра и Гиббса с помощью уравнения Шишковского
- •4.13 Вывод уравнения Ленгмюра при совместном решении уравнений Гиббса и Шишковского
- •4.14 Правило Траубе
- •V. Адсорбция на границе раздела твердое тело – раствор
- •5.1. Введение
- •5.2. Правило вытеснения
- •5.3. Когезия и адгезия
- •5.4. Смачивание и растекание
- •5.5. Практическое значение смачивания
- •5.6. Правило выравнивания полярностей
- •5.7. Адсорбция полимеров из растворов на твердой поверхности
- •VI. Коллоидные пав
- •6.1. Введение
- •6.2. Производство и применение пав
- •6.3. Биоразлагаемость и токсичность
- •6.4. Классификация и общая характеристика пав
- •6.5. Свойства водных растворов пав. Мицеллообразование
- •6.6. Влияние различных факторов на ккм
- •6.6.1. Влияние длины углеводородного радикала
- •6.6.2. Влияние строения углеводородного радикала
- •6.6.3. Влияние добавок электролитов
- •6.6.4. Влияние полярных органических веществ
- •6.7. Термодинамика мицеллообразования в водной среде
- •6.8. Зависимость растворимости пав в воде от температуры
- •6.9. Мицеллообразование в неводных средах
- •6.10. Оценка дифильных свойств пав
- •6.11. Солюбилизация
- •6.12. Физико-химия моющего действия
- •6.13. Смеси ионных и неионных пав
- •6.14. Контрольные вопросы
- •VII. Получение дисперсных систем
- •7.1. Введение
- •7.2. Конденсационные способы образования дисперсных систем
- •Реакция обмена
- •Реакции восстановления
- •Реакция окисления
- •Гидролиз солей
- •Конденсация паров
- •Замена растворителя
- •7.3. Строение мицелл различных золей
- •Типы потенциалопределяющих ионов
- •Принципы построения формулы мицелл
- •7.4. Диспергационные методы получения дисперсных систем
- •7.4.1. Механическое диспергирование
- •7.4.2. Эффект Ребиндера и его роль в диспергировании
- •7.4.3. Физико-химическое дробление осадков (пептизация)
- •7.5. Образование лиофильных коллоидных систем
- •VIII. Молекулярно-кинетические свойства коллоидных систем
- •8.1. Введение
- •8.2. Броуновское движение
- •8.2.1. Природа броуновского движения
- •8.2.2. Общенаучное значение броуновского движения
- •8.2.3. Средний сдвиг частицы
- •8.3. Диффузия
- •8.3.1. Выражения для идеальной диффузии. Первый и второй законы Фика
- •8.3.2. Градиент концентрации при диффузии
- •8.3.3. Диффузия и проницаемость
- •8.4. Седиментация и методы седиментационного анализа
- •8.4.1. Гипсометрический закон
- •8.4.2. Седиментационное уравнение незаряженной частицы
- •8.4.3. Ультрацентрифуга
- •8.4.4. Скоростное ультрацентрифугирование
- •8.4.5. Равновесное ультрацентрифугирование
- •8.5. Контрольные вопросы
- •IX. Оптические свойства коллоидных систем.
- •9.1. Явления, наблюдаемые при взаимодействии видимого света с веществом.
- •9.2. Рэлеевское рассеяние света.
- •9.3. Рассеяние малыми частицами.
- •9.4. Рассеяние большими частицами.
- •9.5. Анализ уравнения Рэлея.
- •9.6. Поглощение света дисперсными системами.
- •9.7. Турбидиметрический метод определения коллоидных частиц.
- •9.7.1. Дисперсные системы, подчиняющиеся уравнению Рэлея.
- •9.7.2. Дисперсные системы, не подчиняющиеся уравнению Рэлея.
- •9.8. Световая микроскопия.
- •9.8.1. Световая микроскопия.
- •9.8.2. Темнопольная микроскопия.
- •9.8.3. Электронная микроскопия Предел разрешения электронного микроскопа.
- •Взаимодействие электронов с объектом.
- •Характеристики изображения.
- •Типы электронных микроскопов.
- •Основные части электронного микроскопа и их назначение.
- •Образцы для просвечивающей электронной микроскопии.
- •Методы препарирования образцов.
- •X. Электроповерхностные свойства дисперсных систем
- •10.1. Значение электрокинетических явлений в природе и технике
- •10.3. Связь поверхностного натяжения с электрическим потенциалом. Уравнение Липпмана.
- •Строение двойного электрического слоя.
- •10.5. Изменение потенциала в дэс с изменением расстояния от поверхности.
- •10.6. Внутренняя часть дэс
- •10.7. Электрокинетические явления.
- •10.8. Уравнение Гельмгольца-Смолуховского для определения -потенциала.
- •10.9. Влияние электролитов на двойной электрический слой.
- •10.10. Влияние концентрации электролита.
- •10.11.Влияние валентности противоиона на дэс.
- •10.12. Влияние радиуса иона на дэс.
- •Перезарядка золей индифферентными электролитами
- •Действие неиндифферентных электролитов на двойной электрический слой
- •Влияние температуры и разбавления на дэс
- •XI. Устойчивость и коагуляция коллойдных систем
- •11.1. Понятие об устойчивости
- •11.2. Расклинивающее давление
- •11.3. Теория агрегативной устойчивости и коагуляции лиофобных дисперсных систем (теория длфо)
- •11.4. Кинетический подход к устойчивости дисперсных систем
- •11.5. Природа сил, действующих между частицами.
- •Силы отталкивания
- •11.6.Коагуляция.
- •11.7. Механизм коагуляции электролитами по теории длфо.
- •11.8. Коагулирующее действие электролитов.
- •11.9. Правила коагуляции электролитами.
- •XII. Структурно–механические свойства дисперсных систем
- •12.1. Основные понятия. Реология как метод исследования структуры дисперсных систем
- •12.2. Идеальные законы реологии
- •12.3. Моделирование реологических свойств тел
- •12.8. Реологические свойства твердообразных тел
- •XIII. Растворы высокомолекулярных соединений. Основные положения статистики полимерных цепей
- •13.1. Гибкость и размеры цепи
- •13.2. Количественные характеристики размеров макромолекул
- •13.3. Свойства Гауссова клубка
- •13.4. Состояния полимеров в растворе
- •13.5. Термодинамика растворения полимеров
- •13.6. Набухание как первая стадия растворения
- •13.7. Разбавленные растворы полимеров
- •13.8. Осмотическое давление растворов
- •13.9. Термодинамическое сродство растворителя к полимеру
- •13.10. Взаимодействия в растворах полимеров
- •13.11. Концентрированные растворы полимеров
- •13.12. Термодинамическая равновесность растворов полимеров и подчинение их правилу фаз
3.7. Значение координационных связей при хемосорбции
Хемосорбция может быть обусловлена образованием как ковалентных, так и координационных связей. Это показано при изучении адсорбции различных адсорбатов на поверхности металлов. Во всех случаях, независимо от природы адсорбата, наблюдаются определенные закономерности адсорбции. Первая закономерность заключается в том, что интенсивность хемосорбции велика для переходных металлов1. Вторая закономерность состоит в том, что, с увеличением атомного номера металла в одной группе интенсивность хемосорбции снижается, т.к. уменьшается возможность образования координационных связей.
В качестве примера на
рис. 3.8 показано изменение теплоты
адсорбции
![]() на поверхности металлов первой переходной
группы, с увеличением атомного номера
металла.
на поверхности металлов первой переходной
группы, с увеличением атомного номера
металла.
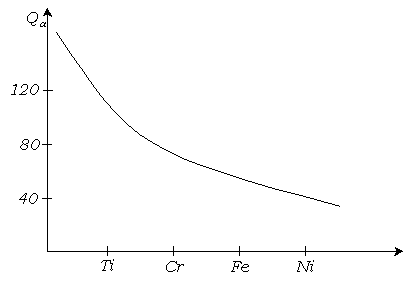
Рис. 3.8. Зависимость теплоты адсорбции на поверхности металлов от атомного номера металла
Эти закономерности важны для понимания механизма катализа. Так в состав катализатора стереоспецифической полимеризации Циглера-Натта входит титана. Активный центр комплексного катализатора имеет вид:

Рис. 3.9.
На атоме
![]() происходит предварительная координация
молекул мономера.
происходит предварительная координация
молекул мономера.
Развитие химической промышленности, в числе промышленности СК, идет с учетом экологических проблем. Так на Ефремовском заводе СК бутадиеновый каучук СКД получчается на катализаторах Циглера-Натта. При этом образуется сильно пахнущие, летучие и токсичные олигомеры бутадиена, загрязняющие атмосферу в производственной и жилой зоне. Поэтому на Ефремовском заводе в последние годы осваивается производство каучука на редкоземельном (катализаторе). В этом процессе олигомеры бутадиена, загрязняющие атмосферу, не образуются.
3.8. Природа адсорбционных сил
Физическая адсорбция происходит под действием Ван-дер Ваальсовых сил межмолекулярного взаимодействия, которое складывается из ориентационных, индукционных и дисперсионных сил.
Ниже показана природа взаимодействия в зависимости от характера адсорбента и адсорбата. Полярным веществом называется вещество, обладающее интенсивным полем межмолекулярных сил.
Адсорбент |
Адсорбат |
Силы взаимодействия |
полярный полярный неполярный неполярный |
полярный неполярный полярный неполярный |
ориентационные индукционные
дисперсионные |
Дисперсионные силы
проявляются между мгновенными диполями,
возникающими при сближении молекул за
счет флуктуаций электронной плотности.
Резонанс таких флуктуаций приводит к
уменьшению общей энергии системы,
обусловленному притяжением атомов.
Потенциал межмолекулярного взаимодействия
определяется выражением:![]() .
.
Если оценить вклад каждого из трех типов взаимодействий - ориентационного, индукционного и дисперсионного в общую энергию притяжения молекул, то оказывается, что доля индукционного эффекта составляет не более 5%. Доля ориентационного эффекта зависит от дипольных моментов взаимодействующих молекул. Для таких сильно полярных молекул, как аммиак и вода, ориентационный эффект равен дисперсионному. Следовательно, для неполярных и слабополярных молекул основным типом межмолекулярного взаимодействия является дисперсионное.
Различные виды
межмолекулярного взаимодействия
характеризуются одним и тем же законом
изменения энергии притяжения от
расстояния между молекулами
![]() ,
где
- расстояние между центрами атомов или
молекул,
,
где
- расстояние между центрами атомов или
молекул,
![]() - константа, в которую входят характеристики
молекул или атомов, соответствующие
для каждого эффекта.
- константа, в которую входят характеристики
молекул или атомов, соответствующие
для каждого эффекта.
На очень близких расстояниях при перекрывании электронных оболочек атомов, возникает отталкивание, называемое борновским отталкиванием и описываемое эмпирическим соотношением:
![]()
Полная энергия
адсорбционного взаимодействия
определяется уравнением Леннард-Джонса
![]() ,
где
- константа межмолекулярного притяжения,
,
где
- константа межмолекулярного притяжения,
![]() - константа борновского отталкивания,
происходящего при перекрывании
электронных орбит,
- константа борновского отталкивания,
происходящего при перекрывании
электронных орбит,
![]() -
энергия межмолекулярного (дисперсионного)
притяжения,
-
энергия межмолекулярного (дисперсионного)
притяжения,
![]() -
энергия борновского отталкивания,
которое происходит при малых
и обусловлено запретом Паули. Потенциал
притяжения всегда отрицателен, а
потенциал отталкивания - положителен.
-
энергия борновского отталкивания,
которое происходит при малых
и обусловлено запретом Паули. Потенциал
притяжения всегда отрицателен, а
потенциал отталкивания - положителен.
Межмолекулярные силы
действуют на малых расстояниях порядка
10-9
м. При адсорбции дисперсионные силы
действуют одновременно между молекулами
адсорбата и поверхностью, т.е. многими
атомами адсорбента. дисперсионные силы
обладают свойством аддитивности,
происходит суммирование адсорбционных
сил, и суммарный потенциал адсорбции
определяется выражением
![]() .
.
В результате суммирования
парных взаимодействий, т. е. тройного
интегрирования по объему адсорбента,
степень
уменьшается, и межмолекулярное
взаимодействие увеличивается. Поэтому
адсорбционные силы значительны, и
действуют на больших расстояниях по
сравнению с межмолекулярными силами
![]() .
.
Энергия притяжения пир адсорбции зависит от расстояния в третьей степени вместо шестой, как это имеет место при взаимодействии двух атомов. Такая зависимость указывает на более медленное уменьшение энергии притяжения при адсорбции и на дальнодействие адсорбционых сил. Полная потенциальная энергия взаимодействия при адсорбции выражается уравнением
![]() ,
,
где n - число атомов в единице объема адсорбента. Важными практическим выводом при рассмотрении природы адсорбционных сил является вывод о том, что, когда преобладают дисперсионные силы, наблюдается лучшая адсорбция в трещинах и порах, т.к. вблизи адсорбированной молекулы находится большое число атомов твердого тела. Если преобладают электростатические силы, то в трещинах и порах заряды компенсируют друг друга, и наибольший потенциал оказывается на выступах, где и будет преобладать адсорбция, особенно при образовании водородных связей.
