
- •I. Введение
- •1.1. Место коллоидной химии в общей системе наук
- •1.2. Краткие исторические сведения
- •1.3. Предмет коллоидной химии
- •1.4. Физические и химические поверхностные явления
- •1.5. Основные признаки объектов коллоидной химии
- •1.6. Фундаментальные особенности ультрадисперсного (коллоидного) состояния вещества
- •1.7. Влияние дисперсности на свойства вещества
- •1.8. Значение коллоидной химии в природе и технике
- •II. Поверхностные явления и адсорбция
- •2.1. Классификация поверхностных явлений
- •2.2. Основы термодинамики поверхностного слоя
- •2.3. Интенсивные свойства гетерогенных систем
- •2.4. Экстенсивные свойства гетерогенных систем
- •2.5. Метод избыточных величин Гиббса
- •2.8. Уравнение Гиббса для плоского поверхностного слоя
- •2.9. Понятие об адсорбции
- •III. Адсорбция на различных границах раздела
- •3.1. Понятие об адсорбции
- •3.2 Количественные характеристики адсорбции
- •3.3. Типы адсорбционных зависимостей
- •3.4. Адсорбция газов и паров на твердом теле
- •3.5. Адсорбция как обратимый экзотермический процесс
- •3.6. Физическая адсорбция и хемосорбция
- •3.7. Значение координационных связей при хемосорбции
- •3.8. Природа адсорбционных сил
- •3.9. Изотермы адсорбции
- •3.10. Кинетика адсорбции
- •3.11. Классическая теория адсорбции
- •3.11.1. Теория мономолекулярной адсорбции Ленгмюра
- •Вывод уравнения Ленгмюра.
- •Анализ уравнения Ленгмюра
- •Полимолекулярная (потенциальная) теория адсорбции Поляни
- •3.11.3. Теория Брунауэра, Эииета и Теллера (бэт).
- •3.11.4. Схема полимолекулярной адсорбции
- •4.1 Поведение растворенных веществ на границе раствора с газом
- •4.2 Поверхностная активность.
- •4.3 Поверхностно – инактивные вещества
- •4.4 Вывод адсорбционного уравнения Гиббса
- •4.5 Строение адсорбционного слоя пав на границе раствора с газом
- •4.6 Уравнение состояния двумерного газа.
- •4.7 Диаграммы состояния поверхностных пленок
- •4.8 Химические реакции в поверхностных пленках.
- •4.9 Самоорганизованные монослои и пленки, перенесенные на твердую подложку с поверхности вода-воздух (пленки Ленгмюра –Блоджетт).
- •4.10 Двухсторонние пленки
- •4.11 Вид изотермы поверхностного натяжения. Уравнение Шишковского
- •4.12 Связь уравнений Ленгмюра и Гиббса с помощью уравнения Шишковского
- •4.13 Вывод уравнения Ленгмюра при совместном решении уравнений Гиббса и Шишковского
- •4.14 Правило Траубе
- •V. Адсорбция на границе раздела твердое тело – раствор
- •5.1. Введение
- •5.2. Правило вытеснения
- •5.3. Когезия и адгезия
- •5.4. Смачивание и растекание
- •5.5. Практическое значение смачивания
- •5.6. Правило выравнивания полярностей
- •5.7. Адсорбция полимеров из растворов на твердой поверхности
- •VI. Коллоидные пав
- •6.1. Введение
- •6.2. Производство и применение пав
- •6.3. Биоразлагаемость и токсичность
- •6.4. Классификация и общая характеристика пав
- •6.5. Свойства водных растворов пав. Мицеллообразование
- •6.6. Влияние различных факторов на ккм
- •6.6.1. Влияние длины углеводородного радикала
- •6.6.2. Влияние строения углеводородного радикала
- •6.6.3. Влияние добавок электролитов
- •6.6.4. Влияние полярных органических веществ
- •6.7. Термодинамика мицеллообразования в водной среде
- •6.8. Зависимость растворимости пав в воде от температуры
- •6.9. Мицеллообразование в неводных средах
- •6.10. Оценка дифильных свойств пав
- •6.11. Солюбилизация
- •6.12. Физико-химия моющего действия
- •6.13. Смеси ионных и неионных пав
- •6.14. Контрольные вопросы
- •VII. Получение дисперсных систем
- •7.1. Введение
- •7.2. Конденсационные способы образования дисперсных систем
- •Реакция обмена
- •Реакции восстановления
- •Реакция окисления
- •Гидролиз солей
- •Конденсация паров
- •Замена растворителя
- •7.3. Строение мицелл различных золей
- •Типы потенциалопределяющих ионов
- •Принципы построения формулы мицелл
- •7.4. Диспергационные методы получения дисперсных систем
- •7.4.1. Механическое диспергирование
- •7.4.2. Эффект Ребиндера и его роль в диспергировании
- •7.4.3. Физико-химическое дробление осадков (пептизация)
- •7.5. Образование лиофильных коллоидных систем
- •VIII. Молекулярно-кинетические свойства коллоидных систем
- •8.1. Введение
- •8.2. Броуновское движение
- •8.2.1. Природа броуновского движения
- •8.2.2. Общенаучное значение броуновского движения
- •8.2.3. Средний сдвиг частицы
- •8.3. Диффузия
- •8.3.1. Выражения для идеальной диффузии. Первый и второй законы Фика
- •8.3.2. Градиент концентрации при диффузии
- •8.3.3. Диффузия и проницаемость
- •8.4. Седиментация и методы седиментационного анализа
- •8.4.1. Гипсометрический закон
- •8.4.2. Седиментационное уравнение незаряженной частицы
- •8.4.3. Ультрацентрифуга
- •8.4.4. Скоростное ультрацентрифугирование
- •8.4.5. Равновесное ультрацентрифугирование
- •8.5. Контрольные вопросы
- •IX. Оптические свойства коллоидных систем.
- •9.1. Явления, наблюдаемые при взаимодействии видимого света с веществом.
- •9.2. Рэлеевское рассеяние света.
- •9.3. Рассеяние малыми частицами.
- •9.4. Рассеяние большими частицами.
- •9.5. Анализ уравнения Рэлея.
- •9.6. Поглощение света дисперсными системами.
- •9.7. Турбидиметрический метод определения коллоидных частиц.
- •9.7.1. Дисперсные системы, подчиняющиеся уравнению Рэлея.
- •9.7.2. Дисперсные системы, не подчиняющиеся уравнению Рэлея.
- •9.8. Световая микроскопия.
- •9.8.1. Световая микроскопия.
- •9.8.2. Темнопольная микроскопия.
- •9.8.3. Электронная микроскопия Предел разрешения электронного микроскопа.
- •Взаимодействие электронов с объектом.
- •Характеристики изображения.
- •Типы электронных микроскопов.
- •Основные части электронного микроскопа и их назначение.
- •Образцы для просвечивающей электронной микроскопии.
- •Методы препарирования образцов.
- •X. Электроповерхностные свойства дисперсных систем
- •10.1. Значение электрокинетических явлений в природе и технике
- •10.3. Связь поверхностного натяжения с электрическим потенциалом. Уравнение Липпмана.
- •Строение двойного электрического слоя.
- •10.5. Изменение потенциала в дэс с изменением расстояния от поверхности.
- •10.6. Внутренняя часть дэс
- •10.7. Электрокинетические явления.
- •10.8. Уравнение Гельмгольца-Смолуховского для определения -потенциала.
- •10.9. Влияние электролитов на двойной электрический слой.
- •10.10. Влияние концентрации электролита.
- •10.11.Влияние валентности противоиона на дэс.
- •10.12. Влияние радиуса иона на дэс.
- •Перезарядка золей индифферентными электролитами
- •Действие неиндифферентных электролитов на двойной электрический слой
- •Влияние температуры и разбавления на дэс
- •XI. Устойчивость и коагуляция коллойдных систем
- •11.1. Понятие об устойчивости
- •11.2. Расклинивающее давление
- •11.3. Теория агрегативной устойчивости и коагуляции лиофобных дисперсных систем (теория длфо)
- •11.4. Кинетический подход к устойчивости дисперсных систем
- •11.5. Природа сил, действующих между частицами.
- •Силы отталкивания
- •11.6.Коагуляция.
- •11.7. Механизм коагуляции электролитами по теории длфо.
- •11.8. Коагулирующее действие электролитов.
- •11.9. Правила коагуляции электролитами.
- •XII. Структурно–механические свойства дисперсных систем
- •12.1. Основные понятия. Реология как метод исследования структуры дисперсных систем
- •12.2. Идеальные законы реологии
- •12.3. Моделирование реологических свойств тел
- •12.8. Реологические свойства твердообразных тел
- •XIII. Растворы высокомолекулярных соединений. Основные положения статистики полимерных цепей
- •13.1. Гибкость и размеры цепи
- •13.2. Количественные характеристики размеров макромолекул
- •13.3. Свойства Гауссова клубка
- •13.4. Состояния полимеров в растворе
- •13.5. Термодинамика растворения полимеров
- •13.6. Набухание как первая стадия растворения
- •13.7. Разбавленные растворы полимеров
- •13.8. Осмотическое давление растворов
- •13.9. Термодинамическое сродство растворителя к полимеру
- •13.10. Взаимодействия в растворах полимеров
- •13.11. Концентрированные растворы полимеров
- •13.12. Термодинамическая равновесность растворов полимеров и подчинение их правилу фаз
5.6. Правило выравнивания полярностей
Правило выравнивания полярностей Ребиндера определяет условия выбора того или иного адсорбента и структуру поверхностного слоя. Оно заключается в том что процесс адсорбции идет в сторону выравнивания полярностей фаз и тем сильнее, чем больше первоначальная разность полярностей. Растворенное вещество обладает обычно промежуточной полярностью и способностью скомпенсировать существующий на границе раздела скачок полярностей двух разнородных веществ. При выполнении этого условия уменьшается межфазное натяжение и свободная поверхностная энергия, что и является причиной адсорбции.
Правило
Ребиндера можно пояснить следующим
образом. Пусть дисперсная фаза и
дисперсионная среда резко различаются
по своей полярности, т. е. интенсивности
поля межмолекулярного взаимодействия,
характеризуемой значением
диэлектрической постоянной
![]() .
Обозначим диэлектрическую постоянную
твердой частицы через
.
Обозначим диэлектрическую постоянную
твердой частицы через
![]() ,
растворенного вещества через
,
растворенного вещества через
![]() ,
растворителя – через
,
растворителя – через
![]() .
.
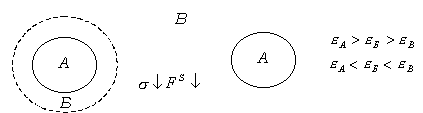
Рис. 5.5. Пояснение правила Ребиндера.
При резком различии полярностей дисперсной фазы и дисперсионной среды взаимодействие между фазами незначительно, межфазное поверхностное натяжение велико, свободная энергия на межфазной границе велика.
Это
создает благоприятные условия для
адсорбции растворенного вещества,
обладающего промежуточной полярностью,
а не растворителя. Адсорбция приведет
к уменьшению разности полярностей,
снижению поверхностного натяжения
и свободной энергии на межфазной границе,
![]()
![]() .
Поэтому для адсорбции жирных кислот из
водного раствора необходимо применять
неполярный адсорбент - уголь, а для
адсорбции кислот из бензольного раствора
- полярный адсорбент, силикагель.
.
Поэтому для адсорбции жирных кислот из
водного раствора необходимо применять
неполярный адсорбент - уголь, а для
адсорбции кислот из бензольного раствора
- полярный адсорбент, силикагель.
Молекулы ПАВ ориентируются так, чтобы максимально скомпенсировать, уравнять разность полярностей фаз. Для ПАВ правило Ребиндера проявляется путем ориентации молекул ПАВ на границе раздела. Так, при адсорбции на угле из водных растворов молекула кислоты ориентируется полярной группой к воде (рис. 5.6).

Рис. 5.6. Ориентация молекул ПАВ на границе твердое тело – раствор, - неполярный адсорбент из полярной среды, - полярный адсорбент из неполярной среды.
Неполярная поверхность угля, обращенная к воде, становится более полярной, разность полярностей уменьшается, поверхностное натяжение и свободная энергия на межфазной границе уменьшаются в самопроизвольном процессе адсорбции и ориентации. При адсорбции из неводного раствора на полярном адсорбенте разность полярностей фаз уменьшается вследствие обратной ориентации молекул ПАВ, обращенных полярными группами к полярному адсорбенту (рис. б). При этом процесс протекает также самопроизвольно вследствие уменьшения свободной энергии на поверхности раздела фаз.
Правило Ребиндера выполняется только для физической адсорбции и не выполняется для хемосорбции.
5.7. Адсорбция полимеров из растворов на твердой поверхности
Взаимодействие макромолекулы с твердой поверхностью лежит в основе многих физико-химических процессов и явлений: гель-хроматографии полимеров, стабилизации коллоидов полимерами. Испытываемые молекулами внешние пространственные ограничения определяют структуру цепей в аморфных прослойках микрогетерогенных систем (наполненные полимеры, блок-сополимеры, аморфно-кристаллические полимеры). Эффекты адсорбции макромолекул определяют адгезию полимеров к различным субстратам, проявляются при взаимодействии биополимеров с поверхностями клеток. Нативная структура биополимеров образуется в результате адсорбции макромолекулы на самой себе (белковая глобула) или на комплементарной цепи (двойная спираль ДНК).
Особенностью
адсорбции в полимерных системах является
существование фазовых переходов
различного рода. Важнейшим отличием
адсорбции полимеров от адсорбции
низкомолекулярных соединений является
наличие порогового эффекта. Если значение
энергии притяжения звена цепи к
поверхности меньше критической энергии
![]() ,
требуемой для начала адсорбции
,
требуемой для начала адсорбции
![]()
![]() полимерные
клубки остаются в растворе, доля
связанного полимера
мала и не зависит от
.
При больших энергиях притяжения
полимерные
клубки остаются в растворе, доля
связанного полимера
мала и не зависит от
.
При больших энергиях притяжения
![]() ,
все полимерные цепи связаны с поверхностью,
доля свободных молекул в растворе
(I - m
) - уменьшается до нуля с ростом
.
С увеличением молекулярной массы при
,
все полимерные цепи связаны с поверхностью,
доля свободных молекул в растворе
(I - m
) - уменьшается до нуля с ростом
.
С увеличением молекулярной массы при
![]() связывание молекул осуществляется
скачкообразно:
связывание молекул осуществляется
скачкообразно:
![]() в докритической области и
в докритической области и
![]() непосредственно при переходе через
критическую точку
непосредственно при переходе через
критическую точку
![]() .
При этом изменяется конформация
цепей. В докритической области
макромолекула представляет собой
невозмущенный гауссов клубок. После
адсорбции, при слабом покрытии поверхности,
макромолекулы теряют свойства гауссовых
клубков в направлении, перпендикулярном
поверхности адсорбента и представляют
собой последовательность адсорбированных
участков и соединяющих их петель,
средние размеры которых определяются
величиной энергии сорбции. Переход
макромолекул из раствора на поверхность,
происходящий в критической точке,
является фазовым переходом II рода,
о чем свидетельствуют изломы в энергии
и энтропии системы.
.
При этом изменяется конформация
цепей. В докритической области
макромолекула представляет собой
невозмущенный гауссов клубок. После
адсорбции, при слабом покрытии поверхности,
макромолекулы теряют свойства гауссовых
клубков в направлении, перпендикулярном
поверхности адсорбента и представляют
собой последовательность адсорбированных
участков и соединяющих их петель,
средние размеры которых определяются
величиной энергии сорбции. Переход
макромолекул из раствора на поверхность,
происходящий в критической точке,
является фазовым переходом II рода,
о чем свидетельствуют изломы в энергии
и энтропии системы.
Рост
термодинамической жесткости цепи
(увеличение сегмента) приводит к убыванию
критической энергии
![]() ,
требуемой для начала адсорбции. Это
объясняется тем, что энтропийные потери
цепи при адсорбции убывают с ростом
жесткости, т.е. для их компенсации
требуется меньшая энергия связывания
с поверхностью.
,
требуемой для начала адсорбции. Это
объясняется тем, что энтропийные потери
цепи при адсорбции убывают с ростом
жесткости, т.е. для их компенсации
требуется меньшая энергия связывания
с поверхностью.
Вторичная структура макромолекулы влияет на ее адсорбцию, т. к. сорбционная активность спиральных и клубковых звеньев различна. И наоборот, степень спиральности адсорбированных цепей отличается от исходной степени спиральности макромолекул в растворе.
При
рассмотрении адсорбции полимеров из
разбавленного раствора необходимо
принимать во внимание конформацию
макромолекулы, характеризуемую средними
размерами цепи
![]() и
и
![]() .
.
Изотермы адсорбции полимеров из раствора отличаются от изотерм Ленгмюра. Иногда изотермы представляют собой кривые с одним или двумя максимумами. Один максимум имеет изотерма адсорбции полиметилметакрилата из толуольного раствора.
При
адсорбции макромолекул на твердой
поверхности различают четыре типа
центров поверхности: занятые
![]() ,
экранированные макромолекулой
,
экранированные макромолекулой
![]() ,
находящиеся между адсорбированными
макромолекулами в количестве, меньшем
минимально необходимого для удержания
макромолекулы на поверхности
,
находящиеся между адсорбированными
макромолекулами в количестве, меньшем
минимально необходимого для удержания
макромолекулы на поверхности
![]() ,
свободные
,
свободные
![]() (рис. 5.7). Сумма относительных количеств
центров каждого типа, равна единице,
т.е.
(рис. 5.7). Сумма относительных количеств
центров каждого типа, равна единице,
т.е.
![]() .
.
Многоцентровый характер адсорбции полимеров из раствора приводит к образованию в пределах одной макромолекулы участков непосредственно контактирующих с поверхностью, (эшелонов), свободных "хвостов" и "петель". Современные теории адсорбции позволяют дать количественную характеристику адсорбированной макромолекулы. Можно вычислить средние длины хвостов, участков, контактирующих с поверхностью, петель и их распределение по размерам. С учетом энтропии образование "хвостов" предпочтительнее образования "петель". Петли обладают меньшей конформационной свободой, чем хвосты такой же длины, что затрудняет приближение "петель" к поверхности. Можно получить также концентрационные профили сегментов петель и хвостов.
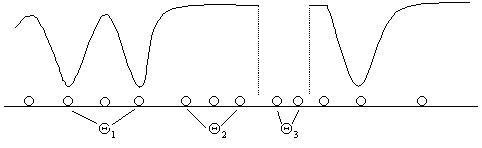
Рис. 5.7. Адсорбция макромолекул на твердой поверхности.
При построении теоретической ленгмюровской изотермы адсорбции учитываются только два типа центров: свободные и занятые.
При построении экспериментальной изотермы адсорбции учитываются все четыре типа центров. Это приводит к значительному отличию теоретической и экспериментальной изотерм (рис. 5.8).
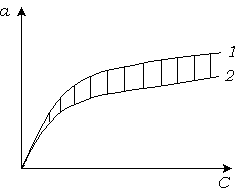
Рис. 5.8. Расчетная (1) и экспериментальная (2) изотермы адсорбции.
При
малой концентрации макромолекул в
растворе расчетная и экспериментальная
изотермы совпадают, т.к. число свободных
центров много больше числа занятых
центров,
![]() ,
а
,
а
![]() .
.
