
- •I. Введение
- •1.1. Место коллоидной химии в общей системе наук
- •1.2. Краткие исторические сведения
- •1.3. Предмет коллоидной химии
- •1.4. Физические и химические поверхностные явления
- •1.5. Основные признаки объектов коллоидной химии
- •1.6. Фундаментальные особенности ультрадисперсного (коллоидного) состояния вещества
- •1.7. Влияние дисперсности на свойства вещества
- •1.8. Значение коллоидной химии в природе и технике
- •II. Поверхностные явления и адсорбция
- •2.1. Классификация поверхностных явлений
- •2.2. Основы термодинамики поверхностного слоя
- •2.3. Интенсивные свойства гетерогенных систем
- •2.4. Экстенсивные свойства гетерогенных систем
- •2.5. Метод избыточных величин Гиббса
- •2.8. Уравнение Гиббса для плоского поверхностного слоя
- •2.9. Понятие об адсорбции
- •III. Адсорбция на различных границах раздела
- •3.1. Понятие об адсорбции
- •3.2 Количественные характеристики адсорбции
- •3.3. Типы адсорбционных зависимостей
- •3.4. Адсорбция газов и паров на твердом теле
- •3.5. Адсорбция как обратимый экзотермический процесс
- •3.6. Физическая адсорбция и хемосорбция
- •3.7. Значение координационных связей при хемосорбции
- •3.8. Природа адсорбционных сил
- •3.9. Изотермы адсорбции
- •3.10. Кинетика адсорбции
- •3.11. Классическая теория адсорбции
- •3.11.1. Теория мономолекулярной адсорбции Ленгмюра
- •Вывод уравнения Ленгмюра.
- •Анализ уравнения Ленгмюра
- •Полимолекулярная (потенциальная) теория адсорбции Поляни
- •3.11.3. Теория Брунауэра, Эииета и Теллера (бэт).
- •3.11.4. Схема полимолекулярной адсорбции
- •4.1 Поведение растворенных веществ на границе раствора с газом
- •4.2 Поверхностная активность.
- •4.3 Поверхностно – инактивные вещества
- •4.4 Вывод адсорбционного уравнения Гиббса
- •4.5 Строение адсорбционного слоя пав на границе раствора с газом
- •4.6 Уравнение состояния двумерного газа.
- •4.7 Диаграммы состояния поверхностных пленок
- •4.8 Химические реакции в поверхностных пленках.
- •4.9 Самоорганизованные монослои и пленки, перенесенные на твердую подложку с поверхности вода-воздух (пленки Ленгмюра –Блоджетт).
- •4.10 Двухсторонние пленки
- •4.11 Вид изотермы поверхностного натяжения. Уравнение Шишковского
- •4.12 Связь уравнений Ленгмюра и Гиббса с помощью уравнения Шишковского
- •4.13 Вывод уравнения Ленгмюра при совместном решении уравнений Гиббса и Шишковского
- •4.14 Правило Траубе
- •V. Адсорбция на границе раздела твердое тело – раствор
- •5.1. Введение
- •5.2. Правило вытеснения
- •5.3. Когезия и адгезия
- •5.4. Смачивание и растекание
- •5.5. Практическое значение смачивания
- •5.6. Правило выравнивания полярностей
- •5.7. Адсорбция полимеров из растворов на твердой поверхности
- •VI. Коллоидные пав
- •6.1. Введение
- •6.2. Производство и применение пав
- •6.3. Биоразлагаемость и токсичность
- •6.4. Классификация и общая характеристика пав
- •6.5. Свойства водных растворов пав. Мицеллообразование
- •6.6. Влияние различных факторов на ккм
- •6.6.1. Влияние длины углеводородного радикала
- •6.6.2. Влияние строения углеводородного радикала
- •6.6.3. Влияние добавок электролитов
- •6.6.4. Влияние полярных органических веществ
- •6.7. Термодинамика мицеллообразования в водной среде
- •6.8. Зависимость растворимости пав в воде от температуры
- •6.9. Мицеллообразование в неводных средах
- •6.10. Оценка дифильных свойств пав
- •6.11. Солюбилизация
- •6.12. Физико-химия моющего действия
- •6.13. Смеси ионных и неионных пав
- •6.14. Контрольные вопросы
- •VII. Получение дисперсных систем
- •7.1. Введение
- •7.2. Конденсационные способы образования дисперсных систем
- •Реакция обмена
- •Реакции восстановления
- •Реакция окисления
- •Гидролиз солей
- •Конденсация паров
- •Замена растворителя
- •7.3. Строение мицелл различных золей
- •Типы потенциалопределяющих ионов
- •Принципы построения формулы мицелл
- •7.4. Диспергационные методы получения дисперсных систем
- •7.4.1. Механическое диспергирование
- •7.4.2. Эффект Ребиндера и его роль в диспергировании
- •7.4.3. Физико-химическое дробление осадков (пептизация)
- •7.5. Образование лиофильных коллоидных систем
- •VIII. Молекулярно-кинетические свойства коллоидных систем
- •8.1. Введение
- •8.2. Броуновское движение
- •8.2.1. Природа броуновского движения
- •8.2.2. Общенаучное значение броуновского движения
- •8.2.3. Средний сдвиг частицы
- •8.3. Диффузия
- •8.3.1. Выражения для идеальной диффузии. Первый и второй законы Фика
- •8.3.2. Градиент концентрации при диффузии
- •8.3.3. Диффузия и проницаемость
- •8.4. Седиментация и методы седиментационного анализа
- •8.4.1. Гипсометрический закон
- •8.4.2. Седиментационное уравнение незаряженной частицы
- •8.4.3. Ультрацентрифуга
- •8.4.4. Скоростное ультрацентрифугирование
- •8.4.5. Равновесное ультрацентрифугирование
- •8.5. Контрольные вопросы
- •IX. Оптические свойства коллоидных систем.
- •9.1. Явления, наблюдаемые при взаимодействии видимого света с веществом.
- •9.2. Рэлеевское рассеяние света.
- •9.3. Рассеяние малыми частицами.
- •9.4. Рассеяние большими частицами.
- •9.5. Анализ уравнения Рэлея.
- •9.6. Поглощение света дисперсными системами.
- •9.7. Турбидиметрический метод определения коллоидных частиц.
- •9.7.1. Дисперсные системы, подчиняющиеся уравнению Рэлея.
- •9.7.2. Дисперсные системы, не подчиняющиеся уравнению Рэлея.
- •9.8. Световая микроскопия.
- •9.8.1. Световая микроскопия.
- •9.8.2. Темнопольная микроскопия.
- •9.8.3. Электронная микроскопия Предел разрешения электронного микроскопа.
- •Взаимодействие электронов с объектом.
- •Характеристики изображения.
- •Типы электронных микроскопов.
- •Основные части электронного микроскопа и их назначение.
- •Образцы для просвечивающей электронной микроскопии.
- •Методы препарирования образцов.
- •X. Электроповерхностные свойства дисперсных систем
- •10.1. Значение электрокинетических явлений в природе и технике
- •10.3. Связь поверхностного натяжения с электрическим потенциалом. Уравнение Липпмана.
- •Строение двойного электрического слоя.
- •10.5. Изменение потенциала в дэс с изменением расстояния от поверхности.
- •10.6. Внутренняя часть дэс
- •10.7. Электрокинетические явления.
- •10.8. Уравнение Гельмгольца-Смолуховского для определения -потенциала.
- •10.9. Влияние электролитов на двойной электрический слой.
- •10.10. Влияние концентрации электролита.
- •10.11.Влияние валентности противоиона на дэс.
- •10.12. Влияние радиуса иона на дэс.
- •Перезарядка золей индифферентными электролитами
- •Действие неиндифферентных электролитов на двойной электрический слой
- •Влияние температуры и разбавления на дэс
- •XI. Устойчивость и коагуляция коллойдных систем
- •11.1. Понятие об устойчивости
- •11.2. Расклинивающее давление
- •11.3. Теория агрегативной устойчивости и коагуляции лиофобных дисперсных систем (теория длфо)
- •11.4. Кинетический подход к устойчивости дисперсных систем
- •11.5. Природа сил, действующих между частицами.
- •Силы отталкивания
- •11.6.Коагуляция.
- •11.7. Механизм коагуляции электролитами по теории длфо.
- •11.8. Коагулирующее действие электролитов.
- •11.9. Правила коагуляции электролитами.
- •XII. Структурно–механические свойства дисперсных систем
- •12.1. Основные понятия. Реология как метод исследования структуры дисперсных систем
- •12.2. Идеальные законы реологии
- •12.3. Моделирование реологических свойств тел
- •12.8. Реологические свойства твердообразных тел
- •XIII. Растворы высокомолекулярных соединений. Основные положения статистики полимерных цепей
- •13.1. Гибкость и размеры цепи
- •13.2. Количественные характеристики размеров макромолекул
- •13.3. Свойства Гауссова клубка
- •13.4. Состояния полимеров в растворе
- •13.5. Термодинамика растворения полимеров
- •13.6. Набухание как первая стадия растворения
- •13.7. Разбавленные растворы полимеров
- •13.8. Осмотическое давление растворов
- •13.9. Термодинамическое сродство растворителя к полимеру
- •13.10. Взаимодействия в растворах полимеров
- •13.11. Концентрированные растворы полимеров
- •13.12. Термодинамическая равновесность растворов полимеров и подчинение их правилу фаз
3.9. Изотермы адсорбции
Вид изотермы адсорбции изображен на рис. 3.10.

Рис. 3.10. Изотерма адсорбции 1 типа.
На кривой имеется три
участка, расположенных в области низких,
средних и высоких давлений. При малых
наблюдается линейна зависимость, т. к.
поверхность адсорбента свободна, идет
активное заполнение поверхности. В этой
области адсорбция прямо пропорциональна
давлению в соответствии с законом Генри:
![]() .
Уравнение Генри можно получить путем
рассмотрения адсорбции из газовой фазы
на основе кинетического подхода.
.
Уравнение Генри можно получить путем
рассмотрения адсорбции из газовой фазы
на основе кинетического подхода.
Рассмотрим динамическую картину адсорбционного процесса, поведение молекул в поверхностном слое, т.е. кинетику адсорбции.
Кинетические закономерности адсорбции определяют скорость установления равновесия при адсорбции, или сокращенно, скорость адсорбции. При столкновении с поверхностью молекула либо отражается от поверхности под углом, равном углу падения, либо некоторое время остается на поверхности, затем десорбируется. Чем больше времени молекула находится на поверхности, тем длительнее устанавливается равновесие. иными словами, скорость установления равновесия V увеличивается с уменьшением времени пребывания молекулы на поверхности .
Величина адсорбции
равна произведению времени пребывания
молекулы на поверхности
![]() на число молекул, контактирующих с
поверхностью в единицу времени. В этом
и состоит динамическое уравнение
адсорбции, которое записывается следующим
образом:
на число молекул, контактирующих с
поверхностью в единицу времени. В этом
и состоит динамическое уравнение
адсорбции, которое записывается следующим
образом:
![]()
Из кинетической теории
следует, что
![]()
![]() .
При относительной влажности 10%
.
При относительной влажности 10%
![]() ,
,
![]() ,
число молекул
воды, сталкивающихся с поверхностью в
секунду равно 10.
,
число молекул
воды, сталкивающихся с поверхностью в
секунду равно 10.
Площадь занимаемой
молекулой воды на поверхности равна 10
Å2
, т. е.
![]() ,
следовательно
,
следовательно
![]() .
Это означает, что
.
Это означает, что
![]() ,
а скорость установления равновесия
крайне велика, монослой образуется
практически мгновенно. А за время
пребывания на поверхности молекулы
адсорбата обмениваются тепловой энергией
с поверхностью адсорбента. Таким образом,
без адсорбции теплообмен был бы
невозможен. Роль адсорбции в теплообмене
составляет одно из важнейших ее проявлений
в технических и природных процессах.
,
а скорость установления равновесия
крайне велика, монослой образуется
практически мгновенно. А за время
пребывания на поверхности молекулы
адсорбата обмениваются тепловой энергией
с поверхностью адсорбента. Таким образом,
без адсорбции теплообмен был бы
невозможен. Роль адсорбции в теплообмене
составляет одно из важнейших ее проявлений
в технических и природных процессах.
Я.И.Френкель в 1924 году получил выражение для зависимости от .
![]()
![]() - константа, равная
периоду колебаний в решетке адсорбента
порядка
- константа, равная
периоду колебаний в решетке адсорбента
порядка
![]() .
Как видно из уравнения,
сильно зависит от
и
.
Как видно из уравнения,
сильно зависит от
и
![]() ,
т. к. они стоят в показателе степени.
,
т. к. они стоят в показателе степени.
Ниже приведены значения , вычисленные для различных при комнатной температуре.
Физическая адсорбция |
Хемосорбция |
||
, кДж/моль |
, с |
, кДж/моль |
, с |
1,6 6 24 40 |
1,110-12 1,310-12 110-10 310-6 |
60 80 100 120 160 808 |
210-2 1102 6105 4109 1017 10126 |
Последнее значение
,
больше возраста Земли и Солнечной
системы. При
![]() молекула живет на месте недели, годы
или тысячелетия, поэтому хемосорбция
в большинстве случаев является
локализованной.
молекула живет на месте недели, годы
или тысячелетия, поэтому хемосорбция
в большинстве случаев является
локализованной.
При адсорбции газов на гладкой поверхности равновесие устанавливается очень быстро, в течение долей секунды. При адсорбции на твердой пористой поверхности адсорбция замедляется вследствие проникновения адсорбата в поры адсорбента, контролируемого диффузией.
Объединяя уравнения (), () и (), получим закон Генри:
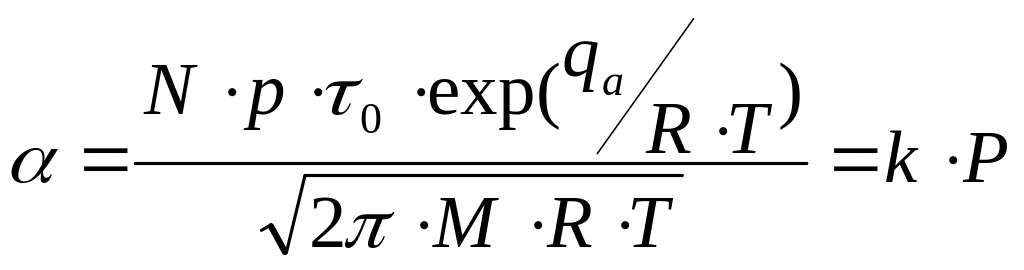
Участок 2, соответствующий средним давлениям является криволинейным, т.к. на этом участке достигается промежуточная степень заполнения поверхности адсорбента.
Изотерма адсорбции
имеет вид параболы и описывается
эмпирическим уравнением Фрейндлиха:
![]() ,
где
и
,
где
и
![]() - константы, не имеющие физического
смысла, но имеющие математический смысл.
Эти константы не зависят от концентрации
адсорбата. Это уравнение хорошо описывает
среднюю часть изотермы. На начальном,
линейном участке изотермы
- константы, не имеющие физического
смысла, но имеющие математический смысл.
Эти константы не зависят от концентрации
адсорбата. Это уравнение хорошо описывает
среднюю часть изотермы. На начальном,
линейном участке изотермы
![]() ,
и а
пропорциональна
.
На третьем участке
,
и а
пропорциональна
.
На третьем участке
![]() и
и
![]() .
Следовательно, показатель степени
характеризует кривизну криволинейного
участка изотермы адсорбции. Это правильная
дробь, характеризующая степень приближения
изотермы к прямой. Чем больше значение
,
тем круче криволинейный участок изотермы
адсорбции. Для решения уравнения
Фрейндлиха применяют логарифмирование.
После логарифимирования уравнение
принимает вид
.
Следовательно, показатель степени
характеризует кривизну криволинейного
участка изотермы адсорбции. Это правильная
дробь, характеризующая степень приближения
изотермы к прямой. Чем больше значение
,
тем круче криволинейный участок изотермы
адсорбции. Для решения уравнения
Фрейндлиха применяют логарифмирование.
После логарифимирования уравнение
принимает вид
![]() .
Из графической зависимости находят
константы
и
.
Отрезок, отсекаемый прямой линией на
оси ординат, равен
.
Из графической зависимости находят
константы
и
.
Отрезок, отсекаемый прямой линией на
оси ординат, равен
![]() ,
а
,
а
![]() (рис. 3.11)
(рис. 3.11)
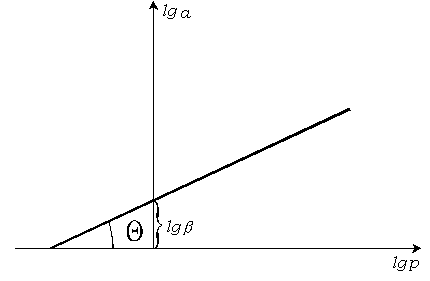
Рис. 3.11. Решение уравнения Фрейндлиха.
Я.Б.Зельдович показал, что при экспоненциальном распределении неоднородностей поверхности и среднем заполнении уравнение Фрейндлиха может быть получено теоретически.
Существует 5 основных типов изотерм адсорбции (рис. 3.12)
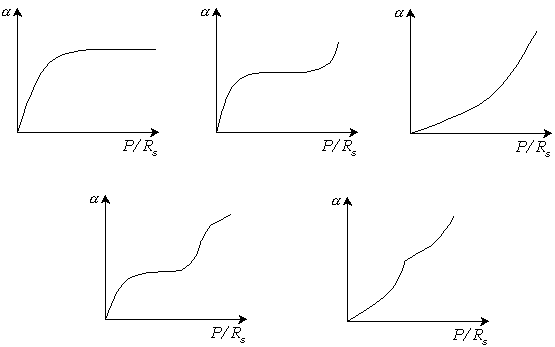
Рис. 3.12. Изотермы физической адсорбции.
Изотерма адсорбции 1 типа описывается уравнением Ленгмюра:
![]()
Этот
тип изотермы соответствует мономолекулярной
адсорбции. Остальные типы изотерм
соответствуют полимолекулярной
адсорбции: 2 – S-образная
кривая с линейным участком в области
средних давлений; 3 – кривая, вогнутая
к оси адсорбции без перегибов с монотонным
увеличением
![]() ;
4, 5 – кривые типов 2, 3, осложненные
капиллярной конденсацией, сопровождающей
полимолекулярную адсорбцию.
;
4, 5 – кривые типов 2, 3, осложненные
капиллярной конденсацией, сопровождающей
полимолекулярную адсорбцию.
