
- •Министерство здравоохранения республики беларусь
- •Оглавление
- •Глава 1. Патология углеводного обмена. Сахарный диабет.
- •Глава 2. Нарушения липидного обмена. Атеросклероз. Ожирение. Жировая дистрофия органов. Желчно-каменная болезнь.
- •Глава 3. Патология белкового обмена. Патология нуклеопротеидного обмена. Подагра. Голодание.
- •Глава 4. Нарушения водно-электролитного и минерального обмена. Отеки.
- •Глава 5. Патология кислотно-основного состояния (кос). Ацидозы. Алкалозы.
- •Глава 6. Патология обмена витаминов.
- •Витамин н – биотин
- •Витамин к (Нафтохиноны, антигеморрагический витамин)
- •Перечень сокращений:
- •Глава 1. Патология углеводного обмена. Сахарный диабет
- •Нарушение расщепления и всасывания углеводов
- •Лактазная недостаточность
- •Нарушения межуточного обмена углеводов
- •Синтез липидов из углеводов
- •Циклы Кори и аланина
- •Роль инсулина в регуляции обмена веществ
- •Нарушения уровня глюкозы в крови
- •Гипогликемия
- •Сахарный диабет
- •Патогенез изсд Развитие изсд включает ряд стадий:
- •Патогенез инсд
- •Тесты толерантности к глюкозе
- •Осложнения сахарного диабета
- •Диабетические ангиопатии
- •Метаболический синдром (мс) (синдром инсулинорезистентности, синдром X)
- •Задачи:
- •Глава 2. Нарушения липидного обмена. Атеросклероз. Ожирение. Жировая дистрофия органов
- •Нарушение расщепления и всасывания липидов в жкт
- •«Феномен просветления плазмы крови»
- •Патология межуточного обмена липидов. Роль печени
- •ЛипопротеиНы крови. Характеристика
- •Апопротеины
- •Холестерол, его роль в организме. Нарушение обмена холестерола
- •Атеросклероз
- •Факторы риска атеросклероза
- •Эйкозаноиды
- •Лейкотриеновый путь
- •Метаболические предпосылки развития желчно-каменной болезни
- •Образование и метаболизм фосфолипидов
- •Нарушения депонирования жира в жировых депо (ожирение, исхудание)
- •Виды ожирения
- •Жировая дистрофия и инфильтрация органов
- •Исхудание
- •Перекисное окисление липидов (пол)
- •Глава 3. Патология белкового обмена. Патология обмена нуклеопротеинов. Подагра. Голодание
- •Виды нарушения азотистого баланса
- •Белково-калорийная недостаточность
- •Нарушение переваривания и недостаток всасывания белка;
- •Нарушение биосинтеза и распада белка в органах и тканях
- •Сахарный диабет (недостаток инсулина);
- •Обмен аминокислот и его нарушение
- •Синтез других азотсодержащих соединений
- •Нарушения межуточного обмена аминокислот
- •Наследственные нарушения обмена аминокислот
- •Диспротеинемии
- •Нарушение образования и выведения конечных продуктов белкового обмена. Гиперазотемии
- •Патология обмена нуклеОпротеидов
- •Голодание
- •Лечебное голодание
- •Задачи:
- •Глава 4. Патология водно-электролитного и минерального обмена. Отеки
- •Основные механизмы регуляции водно-электролитного обмена
- •Нарушение водно-электролитного баланса
- •Дегидратация
- •Гипергидратация
- •Патология обмена макроэлементов
- •Нарушения обмена натрия
- •Нарушение обмена калия
- •Нарушение обмена магния
- •Нарушение кальциево-фосфорного обмена
- •Нарушение обмена хлора и гидрокарбоната
- •Биологическая роль и патология обмена микроэлементов
- •Железо (Fe)
- •Медь (Сu)
- •Цинк (Zn)
- •Кадмий (Сd)
- •Кобальт (Со)
- •Молибден (Мо)
- •Фтор (f)
- •Глава 5. Патология кислотно-основного состояния (кос). Ацидозы. Алкалозы
- •Роль буферных систем, легких и почек в регуляции кос
- •Показатели кос:
- •Виды нарушений кос
- •Ситуационные задачи:
- •Ответы к ситуационным задачам:
- •Глава 6. Патология обмена витаминов
- •Гиповитаминозы
- •Витамин в2 (рибофлавин)
- •Витамин в6 (пиридоксин)
- •Витамин в12 (цианокобаламин)
- •Витамин с (аскорбиновая кислота)
- •Витамин р (биофлавоноиды)
- •Фолиевая кислота
- •Недостаточность фолатов развивается более быстро, чем дефицит витамина в12. Тканевые запасы фолатов исчерпываются в течение 3-6 месяцев.
- •Витамин н – Биотин
- •Ежедневная потребность в биотине для ребенка в возрасте до 1 года – 1-15 мкг, с 1 до 7 лет – 15-30 мкг, с 7 до 15 лет – 30-100 мкг.
- •Патология обмена жирорастворимых витаминов витамин а
- •Суточная потребность для взрослого человека - около 5000 ме или 1,5 мг (1 ме - 0,344 мкг).
- •Витамин d (кальциферол)
- •Физиологические и фармакологические эффекты
- •Суточная потребность в витамине d для людей всех возрастных категорий составляет около 400 ме (10 мкг).
- •Витамин к (нафтохиноны, антигеморрагический витамин)
- •Литература:
- •Приложение
- •Показатели крови
«Феномен просветления плазмы крови»
После принятия жирной пищи плазма выглядит мутной (хилезной). Через 12 часов она просветляется. В капиллярах легких, жировой, мышечной ткани и селезенке под влиянием фермента эндотелиальной липопротеинлипазы (ЛПЛ, «фактор просветления») происходит расщепление триглицеридов, входящих в состав хиломикронов, до свободных жирных кислот и глицерина – «феномен просветления плазмы крови».
В активации ЛПЛ принимает участие гепарин из тучных клеток, расположенных по ходу сосудов, а также апопротеин апо-С-II, входящий в состав хиломикронов. Дефицит апо- С-II является причиной одного из видов гиперлипопротеинемий – хиломикронемии (см. ниже). Феномен просветления осуществляется также в жировой ткани и других органах.
Нерасщепленные хиломикроны (ремнанты хиломикронов) продолжают циркуляцию и захватываются печенью, где происходит их окончательное расщепление под влиянием печеночной липопротеинлипазы. Также в соединении с альбуминами в печень поступают неэтерифицированные жирные кислоты, образовавшиеся в результате распада триглицеридов хиломикронов в сосудистом русле.
Патология межуточного обмена липидов. Роль печени
Одним из этапов липидного обмена в печени является образование липидов (эндогенных триглицеридов, фосфолипидов, холестерола, кетоновых тел). За исключением витамина D, все встречающиеся в организме животных стероиды (производные сложных спиртов) – холестерол (холестерол), желчные кислоты, мужские и женские половые гормоны и гормоны надпочечников синтезируются в организме. Исходным материалом для синтеза служит ацетил-КоА.
При связывании эндогенных триглицеридов аполипопротеинами образуются липопротеиновые комплексы очень низкой плотности – ЛОНП. Они попадают в кровь и переносятся в другие ткани, прежде всего в жировую и мышечную ткань (рис.11).
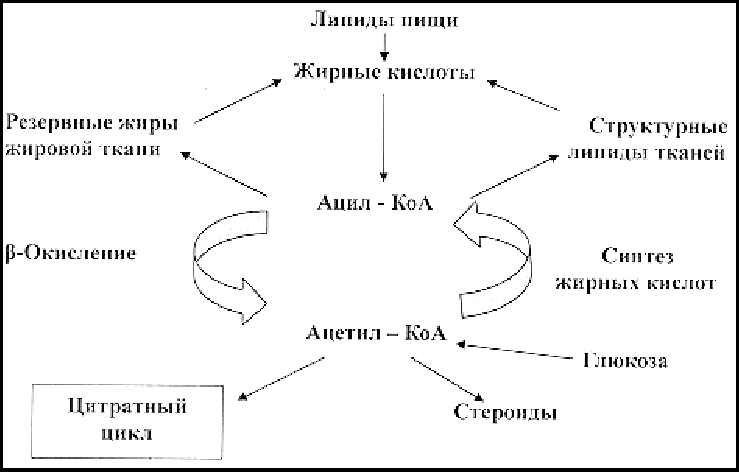
Рис.11. Межуточный обмен липидов.
Окисление жирных кислот протекает путем последовательного отщепления от молекулы жирной кислоты двууглеродного фрагмента с образованием ацетилкофермента A (ацетил-КоА) и одновременной передачей двух пар электронов в цепь переноса электронов. Образовавшийся ацетил-КоА – компонент цикла трикарбоновых кислот, судьба которого в дальнейшем не отличается от судьбы ацетил-КоА, поставляемого углеводным обменом. Таким образом, механизмы синтеза АТФ при окислении, как жирных кислот, так и метаболитов глюкозы практически одинаковы.
Если организм животного получает энергию почти целиком за счет одного только окисления жирных кислот (голодание, сахарный диабет), то скорость образования ацетил-КоА превышает скорость его окисления в цикле трикарбоновых кислот. В этом случае лишние молекулы ацетил-КоА реагируют друг с другом, в результате чего образуются в конечном счете ацетоуксусная и β-оксимасляная кислоты.
Кетоновые тела (содержание в норме 0,08-0,43 mМ) поступают из печени в кровь. Во второй период голодания наряду с жирными кислотами 3-гидроксибутират и ацетоацетат в являются основными энергоносителями. Ацетон, не имеющий метаболической ценности, удаляется через легкие. Если биосинтез кетоновых тел превышает потребности организма, они накапливаются в крови (кетонемия) и выводятся с мочой (кетонурия). Возрастание концентрации кетоновых тел вызывает изменение рН в крови (кетоацидоз). Кетонурия и кетоацидоз могут быстро привести к электролитному сдвигу (нарушению ионного гомеостаза), потере сознания вследствие развития кетоацидотической комы и опасны для жизни.
При патологии печени происходят изменения межуточного обмена липидов, проявляющие уменьшением β-окисления жирных кислот, усилением кетообразования, синтеза холестерола, уменьшением образования фосфолипидов.
Уровень кетоновых тел достигает при длительной мышечной работе не >0,1mМ, голодании – до 6,45 mМ, сахарном диабете – до 40-50 mМ.
