
- •Коллоидная химия
- •1.Коллоидные системы и предмет коллоидной химии
- •1.1. Коллоидные системы
- •1.2. Предмет коллоидной химии
- •Первый вариант количественной оценки - основной
- •Например, у частицы кубической формы с размером ребра
- •1.3. Классификация дисперсных систем
- •Классификация коллоидных систем по агрегатному состоянию фаз
- •2. Физическая химия поверхностных явлений
- •2.1. Межмолекулярные связи
- •Отличия молекулярных сил притяжения от химических:
- •Вклад различных видов энергии в общую энергию притяжения молекул
- •2.2.1. Определения поверхностного натяжения
- •1. Поверхностное натяжение численно равно работе обратимого изотермического образования единицы поверхности
- •2.2.3. Факторы, влияющие на величину поверхностного натяжения
- •1. Температура т
- •Поверхностное натяжение веществ на границе с воздухом
- •3) Природа контактирующих фаз
- •2.2.4. Экспериментальные методы определения поверхностного натяжения
- •2.3. Внутренняя (полная) удельная поверхностная энергия
- •Термодинамические характеристики поверхности некоторых жидкостей на границе их с воздухом
- •2.4. Адсорбция
- •2.4.1. Основные понятия и определения
- •2.4.2.1.Уравнение Ленгмюра(*)
- •Основные положения теории Ленгмюра:
- •Экспериментальное определение констант уравнения Ленгмюра
- •Правило Дюкло — Траубе:
- •Экспериментальное определение геометрических размеров молекулы пав
- •2.4.2.3. Изотермы адсорбции на неоднородной поверхности
- •А) теория Поляни(*)
- •Основные положения теории Поляни:
- •Основные положения теории бэт
- •Основные характеристики адсорбентов
- •Классификация адсорбентов:
- •2. По полярности
- •3. По размеру пор
- •2.4.5.2. Влияние кривизны поверхности на равновесие фаз
- •2.4.5.3. Капиллярные явления
- •2.4.5.4.Теория капиллярной конденсации
- •Условия действия капиллярных сил
- •2.4.5.5. Классификация изотерм адсорбции
- •2.4.6. Адсорбция из растворов на твердых адсорбентах
- •2.4.6.1. Молекулярная адсорбция
- •2.4.6.1.2. Основные закономерности адсорбции из растворов неэлектролитов на поверхности твердых адсорбентов)
- •2. Природа растворителя
- •3. Влияние природы адсорбента
- •4. Влияние природы адсорбтива
- •2.4.6.1.2. Основные закономерности адсорбции из растворов электролитов на поверхности твердых адсорбентов.
- •2.4.6.1.3. Ионно-обменная адсорбция
- •2.5. Смачивание. Адгезия. Когзия
- •2.5.1. Адгезия. Когзия
- •Механизм процесса адгезии
- •Несколько механизмов и теорий адгезии
- •2.5.2. Краевой угол смачивания и работа адгезии
- •2.5.3. Избирательное смачивание
- •2.5.4. Инверсия смачиваемости поверхности
- •2.5.5. Количественные характеристики процесса смачивания поверхности.
- •Qсм и b порошкообразных веществ
- •2.5.6. Измерение краевого угла смачивания
- •Использование пав для изменения смачиваемости поверхности
- •Избирательное смачивание
- •3. Молекулярно-кинетические свойства дисперсных систем
- •3.2. Диффузия в коллоидных системах
- •3.3. Седиментация суспензий
- •3.3. Седиментационно-диффузионное равновесие. Седиментационная устойчивость
- •Седиментационная устойчивость
- •4. Модель реального тела. Модель Бингама(*) – вязкопластическое тело
- •Лекция 9. .4.3. Реологические свойства реальных тел
- •Классификация тел по их реологическим свойствам
- •Вязкость агрегативно устойчивых дисперсных систем
- •4.3.2.Реологические свойства структурированных жидкообразных систем
- •Электрические свойства коллоидных растворов (золей)
- •5.1. Электрокинетические явления
- •5.2. Механизм образования дэс
- •4. Поляризация поверхности за счёт внешнего электрического поля.
- •5.3. Строение дэс
- •5.4. Факторы, влияющие на величину ζ-потенциала:
- •5.5.3. Влияние температуры на электрокинетический потенциал
- •5.5.4. Влияние рН среды
- •5.5.5. Экспериментальное определение - потенциала
- •6.Коагуляция и устойчивость дисперсных систем
- •6.1. Устойчивость дисперсных систем
- •6.2. Факторы агрегативной устойчивости
- •6.3. Ионный фактор стабилизации дисперсных систем Теория устойчивости лиофобных золей длфо
- •6.4. Коагуляция лиофобных дисперсных систем
- •6.4.1. Основные закономерности электролитной коагуляции
- •6.4.2. Кинетика электролитной коагуляции
- •6.4.3. Частные случаи электролитной коагуляции
- •6.4.4. Коллоидная защита
- •7. Лиофильные дисперсные системы. Коллоидные поверхностно-активные вещества
- •Классификация и общая характеристика пав
- •Коллоидные пав
- •2. Гидрофильно-липофильный баланс
- •Групповые числа атомных группировок
- •Применение пав
- •3. Строение мицелл пав. Солюбилизация
- •Факторы, влияющие на ккм
- •1) В растворах ипав ↑ Сэл-та ↓ ккм.
- •2) Добавление органических веществ в водные растворы пав по-разному влияет на ккм:
- •3). Влияние температуры т.
- •Значение мицеллярных растворов
- •Лиофобные дисперсные системы. Эмульсии
- •Классификация
- •Устойчивость и стабилизация эмульсий
- •Эмульгаторы
- •Механизм стабилизации:
2.2.4. Экспериментальные методы определения поверхностного натяжения
Основная характеристика свойств поверхности раздела фаз – удельная свободная поверхностная энергия и численно равная ей величина поверхностного натяжения могут быть сравнительно легко и с большой точностью определены для легкоподвижных границ раздела – ж/г и ж1/ж2.
Существует большое число методов определения поверхностного натяжения. Остановимся на общих принципах основных методов измерения σ на границе ж/г.
Для измерения поверхностного натяжения индивидуальных жидкостей пригодны любые методы. У растворов же результаты измерений поверхностного натяжения разными методами могут сильно отличаться из-за медленного установления равновесного распределения растворённых веществ между только что образованной поверхностью и объёмом раствора.
Для правильного выбора метода исследования необходимо учитывать кинетику установления равновесных значений поверхностного натяжения. Например, диффузия молекул ПАВ к поверхности раздела фаз происходит достаточно медленно, за короткое время замера не успевает установиться их равновесная поверхностная концентрация, при этом молекулы не успевают должным образом ориентироваться в поверхностном слое. Поэтому для измерений σ в этом случае следует использовать статические или полустатическиме методы, но не динамические.
Рассмотрим некоторые наиболее распространенные статические и полустатические методы определения поверхностного натяжения.
1. Статические – основаны на изучении устойчивого равновесного состояния, к которому самопроизвольно приходит система. К ним относятся методы: уравновешивания пластинки, капиллярного поднятия, лежачей или висячей капли.
Метод Вильгельми(*) (метод уравновешивания пластинки).
Тонкую пластинку толщиной d, закрепленную на коромысле весов, погружают в исследуемую жидкость, которая хорошо смачивает ее поверхность. На поверхности пластинки образуются мениски. Форма их поверхности и максимальная высота поднятия жидкости определяется уравнением Лапласа.
Вес пластинки определяется статически и при отрыве от поверхности. Суммарный вес жидкости (а, следовательно, сила F, которую надо приложить для уравновешивания пластинки), приходящийся на единицу параметра пластинки, не зависит от формы мениска и при θ =0 равен поверхностному натяжению:
![]() , (2.22)
, (2.22)
Метод капиллярного поднятия основан на использовании расчетов поверхностного натяжения по формуле Жюрена(*):
![]()
![]() , (2.23)
, (2.23)
где Н – высота поднятия жидкости в капилляре, ρ и ρо – плотности жидкости и ее насыщенного пара, θ – краевой угол смачивания, g – ускорение силы тяжести.
Разность давлений, возникающая по обе стороны от поверхности жидкости при её искривлении, называется капиллярным давлением. Если капилляр опустить в жидкость, то за счёт смачивания или несмачивания стенок капилляра образуется мениск, т.е. искривление поверхности жидкости и возникает капиллярное давление.
Под его влиянием граница жидкости перемещается до тех пор, пока не установится равновесие между гидростатическим давлением и капиллярным. При этом смачивающая жидкость поднимается, а несмачивающая опускается. Измерения σ производят в приборе, схематически изображённом на рис.2.8. Исследуемую жидкость заливают в широкую трубку (см. схему прибора), далее с помощью катетометра измеряют высоту капиллярного поднятия h. Она зависит от поверхностного натяжения жидкости:
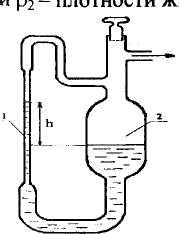
Рис. 2.8. Схема прибора для измерения поверхностного натяжения жидкостей методом капиллярного поднятия: 1 - капилляр, 2 -широкая трубка.
Жидкость в капилляре поднимается вверх, пока гидростатическое давление Р не уравновесится с капиллярным Рσ (Рσ=2σ/r), r=ro/сosθ. Применяют тонкие капилляры, что обеспечивает сферичность мениска, хорошо смачиваемые жидкостью, поэтому можно упростить расчет (угол θ ≈ 0о).
Группа методов (лежачей или висячей капли) основаны на изучении формы капель в поле силы тяжести. В этих случаях ведется учет отклонения их формы от сферической. Этот метод ценен для определения поверхностного натяжения при высоких температурах. В этих случаях капли фотографируют длиннофокусной оптикой либо в рентгеновских лучах.
Сопоставляют результаты измерений геометрических параметров, показывающих степень отклонения поверхности от сферической, с табулированными значениями этих параметров (их получают численным интегрированием уравнения Лапласа(*)), находят величину σ.
2) Полустатические методы основаны на изучении условий, при которых система теряет равновесие.
Метод наибольшего давления в пузырьке газа
Основан на измерении давления, при котором происходит отрыв пузырька газа (воздуха), выдуваемого в жидкость через капилляр.
Силы поверхностного натяжения препятствуют образованию пузырька (при этом создаётся новая поверхность раздела фаз жидкость - газ). При медленном продавливании пузырька из капилляра в жидкость в нем возникает избыточное внутреннее давление, которое определяется поверхностным натяжением жидкости и кривизной поверхности пузырька. В момент отрыва пузырька от кончика капилляра внутреннее давление максимально и пропорционально σ.
Измерения проводят на приборе Ребиндера(*) (см. рис.2.9). Кончик капилляра погружают в жидкость так, чтобы он лишь касался жидкости и приподнимал мениск вверх на 1 - 2 мм. При таком условии поправкой на гидростатическое давление при образовании пузырьков можно пренебречь. Измеряют давление Р0, необходимое для выдавливания пузырька газа в жидкость с известным поверхностным натяжением σ0 (обычно воды), а затем - Рe исследуемой жидкости.
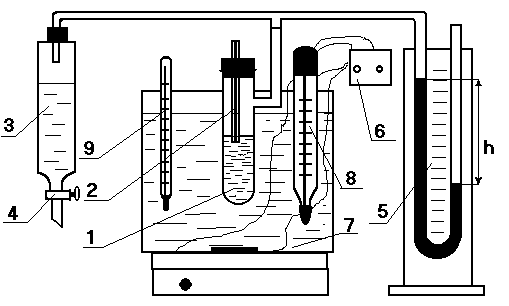
Рис.2.9. Схема установки для измерения поверхностного натяжения методом наибольшего давления в пузырьке газа:
1 –измерительная ячейка, 2 – капилляр, 3 – аспиратор, 4 – кран, 5 – манометр, 6 – регулятор температуры, 7 – термостат, 8 – контактный, 9 – термометр
Под действием приложенного извне избыточного давления ΔР через капилляр продавливается пузырек воздуха. По мере роста пузырька радиус кривизны уменьшается и становится минимальным при r= rо (когда поверхность пузырька принимает форму полусферы). При увеличении объема пузырька радиус кривизны возрастает r> rо, следовательно, капиллярное давление Рσ=2σ/r при r= rо достигает максимума Рσ=2σ/rо.
При ΔР> 2σ/rо капиллярное давление не может уравновесить приложенного давления ΔР, и пузырёк теряет устойчивость:
σ= ½ ΔРmax rо
Нужно вводить поправки на сферичность поверхности.
Метод отрыва кольца (Дю-Нуи). Измеряется усилие F, необходимое для отрыва от поверхности жидкости тонкого кольца rk, хорошо смачиваемого жидкостью (θ=0). Метод похож на метод Вильгельми:
![]() , (2.24)
, (2.24)
где К – поправочный коэффициент., зависит от геометрии кольца.
Сталагмометрический метод (счета или взвешивания капель)
Основан на определении веса капли, отрывающейся под действием силы тяжести от среза капилляра. В момент отрыва капли ее вес Р уравновешивается силами поверхностного натяжения, умноженными на длину окружности капилляра с радиусом rо: Р=2π rоσ/k. (2.25)
где k - поправочный коэффициент, учитывающий, что отрыв капель происходит по радиусу шейки капли, который меньше радиуса самой капли.
В этом методе есть сложности в определении формы и размера капли, отрывающейся от капилляра.
Можно определить поверхностное натяжение жидкости по счету капель (см.рис.2.10):
Рис.2.10.
Схема сталагмометра: 1 - капилляр, 2
-верхняя метка, 3 - нижняя метка.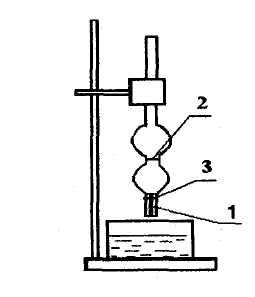
Начинают считать капли при прохождении жидкостью верхней отметки (2) и заканчивают - при достижении нижней (3).
Определив количество капель nо жидкости, поверхностное натяжение σ0 и плотность ро которой хорошо известны (обычно воды), а затем - число капель n исследуемой жидкости, вытекающей из того же объема, определяют искомое поверхностное натяжение исследуемой жидкости по уравнению:
![]() (2.26)
(2.26)
где р - плотность исследуемой жидкости.
3) Динамические методы. Имеют более специальное назначение: применяются для изучения неравновесных состояний поверхностных слоев жидкости.
Это особенно относится к методу колеблющихся струй. Он изучает свойства поверхности жидкости через малые промежутки времени после их образования. С помощью эллиптического отверстия образуют струю в форме эллиптического цилиндра. Под действием сил поверхностного натяжения, которые стремятся придать струе форму цилиндра с круговым сечением и инерционных сил устанавливаются поперечные колебания струи – большая и малая оси эллипса поочередно меняются местами.
Теория, развитая Рэлеем(16), а затем Нильсом Бором(17) и Сатерлендом позволяет связать длину волны λ на поверхности струи с σж.
