
- •Коллоидная химия
- •1.Коллоидные системы и предмет коллоидной химии
- •1.1. Коллоидные системы
- •1.2. Предмет коллоидной химии
- •Первый вариант количественной оценки - основной
- •Например, у частицы кубической формы с размером ребра
- •1.3. Классификация дисперсных систем
- •Классификация коллоидных систем по агрегатному состоянию фаз
- •2. Физическая химия поверхностных явлений
- •2.1. Межмолекулярные связи
- •Отличия молекулярных сил притяжения от химических:
- •Вклад различных видов энергии в общую энергию притяжения молекул
- •2.2.1. Определения поверхностного натяжения
- •1. Поверхностное натяжение численно равно работе обратимого изотермического образования единицы поверхности
- •2.2.3. Факторы, влияющие на величину поверхностного натяжения
- •1. Температура т
- •Поверхностное натяжение веществ на границе с воздухом
- •3) Природа контактирующих фаз
- •2.2.4. Экспериментальные методы определения поверхностного натяжения
- •2.3. Внутренняя (полная) удельная поверхностная энергия
- •Термодинамические характеристики поверхности некоторых жидкостей на границе их с воздухом
- •2.4. Адсорбция
- •2.4.1. Основные понятия и определения
- •2.4.2.1.Уравнение Ленгмюра(*)
- •Основные положения теории Ленгмюра:
- •Экспериментальное определение констант уравнения Ленгмюра
- •Правило Дюкло — Траубе:
- •Экспериментальное определение геометрических размеров молекулы пав
- •2.4.2.3. Изотермы адсорбции на неоднородной поверхности
- •А) теория Поляни(*)
- •Основные положения теории Поляни:
- •Основные положения теории бэт
- •Основные характеристики адсорбентов
- •Классификация адсорбентов:
- •2. По полярности
- •3. По размеру пор
- •2.4.5.2. Влияние кривизны поверхности на равновесие фаз
- •2.4.5.3. Капиллярные явления
- •2.4.5.4.Теория капиллярной конденсации
- •Условия действия капиллярных сил
- •2.4.5.5. Классификация изотерм адсорбции
- •2.4.6. Адсорбция из растворов на твердых адсорбентах
- •2.4.6.1. Молекулярная адсорбция
- •2.4.6.1.2. Основные закономерности адсорбции из растворов неэлектролитов на поверхности твердых адсорбентов)
- •2. Природа растворителя
- •3. Влияние природы адсорбента
- •4. Влияние природы адсорбтива
- •2.4.6.1.2. Основные закономерности адсорбции из растворов электролитов на поверхности твердых адсорбентов.
- •2.4.6.1.3. Ионно-обменная адсорбция
- •2.5. Смачивание. Адгезия. Когзия
- •2.5.1. Адгезия. Когзия
- •Механизм процесса адгезии
- •Несколько механизмов и теорий адгезии
- •2.5.2. Краевой угол смачивания и работа адгезии
- •2.5.3. Избирательное смачивание
- •2.5.4. Инверсия смачиваемости поверхности
- •2.5.5. Количественные характеристики процесса смачивания поверхности.
- •Qсм и b порошкообразных веществ
- •2.5.6. Измерение краевого угла смачивания
- •Использование пав для изменения смачиваемости поверхности
- •Избирательное смачивание
- •3. Молекулярно-кинетические свойства дисперсных систем
- •3.2. Диффузия в коллоидных системах
- •3.3. Седиментация суспензий
- •3.3. Седиментационно-диффузионное равновесие. Седиментационная устойчивость
- •Седиментационная устойчивость
- •4. Модель реального тела. Модель Бингама(*) – вязкопластическое тело
- •Лекция 9. .4.3. Реологические свойства реальных тел
- •Классификация тел по их реологическим свойствам
- •Вязкость агрегативно устойчивых дисперсных систем
- •4.3.2.Реологические свойства структурированных жидкообразных систем
- •Электрические свойства коллоидных растворов (золей)
- •5.1. Электрокинетические явления
- •5.2. Механизм образования дэс
- •4. Поляризация поверхности за счёт внешнего электрического поля.
- •5.3. Строение дэс
- •5.4. Факторы, влияющие на величину ζ-потенциала:
- •5.5.3. Влияние температуры на электрокинетический потенциал
- •5.5.4. Влияние рН среды
- •5.5.5. Экспериментальное определение - потенциала
- •6.Коагуляция и устойчивость дисперсных систем
- •6.1. Устойчивость дисперсных систем
- •6.2. Факторы агрегативной устойчивости
- •6.3. Ионный фактор стабилизации дисперсных систем Теория устойчивости лиофобных золей длфо
- •6.4. Коагуляция лиофобных дисперсных систем
- •6.4.1. Основные закономерности электролитной коагуляции
- •6.4.2. Кинетика электролитной коагуляции
- •6.4.3. Частные случаи электролитной коагуляции
- •6.4.4. Коллоидная защита
- •7. Лиофильные дисперсные системы. Коллоидные поверхностно-активные вещества
- •Классификация и общая характеристика пав
- •Коллоидные пав
- •2. Гидрофильно-липофильный баланс
- •Групповые числа атомных группировок
- •Применение пав
- •3. Строение мицелл пав. Солюбилизация
- •Факторы, влияющие на ккм
- •1) В растворах ипав ↑ Сэл-та ↓ ккм.
- •2) Добавление органических веществ в водные растворы пав по-разному влияет на ккм:
- •3). Влияние температуры т.
- •Значение мицеллярных растворов
- •Лиофобные дисперсные системы. Эмульсии
- •Классификация
- •Устойчивость и стабилизация эмульсий
- •Эмульгаторы
- •Механизм стабилизации:
6.3. Ионный фактор стабилизации дисперсных систем Теория устойчивости лиофобных золей длфо
Адсорбционная, электростатическая и ряд других теорий устойчивости и коагуляции не могли объяснить ряд наблюдаемых для дисперсных систем фактов. Их важнейшие положения вошли составной частью в современную теорию устойчивости, которая хорошо согласуется с поведением типично лиофобных золей.
Образование ДЭС приводит с одной стороны к уменьшению межфазного натяжения, что повышает термодинамическую устойчивость систем, а с другой стороны, создает на пути агрегации частиц потенциальный барьер электростатического отталкивания, обуславливая т.н. ионный (электростатический) фактор устойчивости.
Рассмотрим природу этого барьера. Согласно теории устойчивости гидрофобных коллоидов Дерягина(*),Ландау(*), Фервея(*), Овербека(*) (теория ДЛФО), между частицами, имеющими ДЭС, действуют силы притяжения и силы отталкивания. Силы отталкивания вызываются расклинивающим давлением: при сближении частиц происходит перекрывание диффузных частей ДЭС и концентрация противоионов между частицами становится выше, чем внутри фазы. Возникает поток дисперсионной среды в пространство между частицами, стремящийся разъединить их. Этот поток и создаетрасклинивающее давление. Согласно теории ДЛФО энергия отталкивания частиц выражается уравнением:
Современная физическая теория устойчивости была развита российскими учеными Дерягиным и Ландау (1937) и получила всеобщее признание. Несколько позднее (1941) теоретическая разработка, которая привела к тем же результатам, была осуществлена голландскими учеными Фервеем и Овербеком. В соответствии с первыми буквами авторов теория устойчивости известна как теория ДЛФО(DLVO).
Межфазное поверхностное натяжение дисперсных систем не является единственной причиной агрегативной устойчивости. При сближении одноименно заряженных частиц золей их диффузные слои перекрываются. Это взаимодействие протекает в тонкой прослойке дисперсионной среды, разделяющей частицы.
Устойчивость лиофобных золей определяется особыми свойствами этих жидких слоев. Утончение этого слоя заканчивается либо его разрывом при некоторой малой толщине, либо достижением некоторой равновесной толщины, которая далее не уменьшается. В первом случае частицы слипаются, во втором – нет.
Утончение тонкого слоя происходит путем вытекания из его жидкости. Когда жидкий слой становится тонким (100 – 200 нм), свойства жидкости в нем начинают сильно отличаться от свойств жидкости в объёме. В слое появляется дополнительное давление, которое Дерягин назвал «расклинивающим давлением» π.
Расклинивающее давление – это избыточное давление, которое необходимо приложить к поверхностям, ограничивающим тонкую пленку, чтобы ее толщина оставалась постоянной или могла быть обратимо изменена в термодинамически равновесном процессе.
Положительное расклинивающее давление возникает, когда:
«+» Р в слое < Ро, π>0. Это препятствует вытеканию из него жидкости, т.е. сближению частиц;
«расклинивающее давление», т.е. раздвигает, расклинивает:
Отрицательное расклинивающее давление π<0
«-« когда давление в слое растет, что способствует сближению частиц
Рассмотрим случаи сближения частиц дисперсной фазы на разные расстоняия:



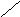
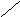
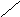
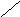


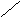
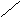
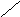
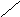


 нет
расклинивающего давления, h > 2δ
нет
расклинивающего давления, h > 2δ
(толщина диффузного слоя)
h
 Ро
Ро 

 Ро «+»
- Р < Ро, жидкость из объема стремится
Ро «+»
- Р < Ро, жидкость из объема стремится
 в
тонкую прослойку,
в
тонкую прослойку,


 «-»
- жидкость будет вытекать из зазора, а
«-»
- жидкость будет вытекать из зазора, а
Р 
 Р частицы
сближаться
Р частицы
сближаться

«+» «-»
Рис.6.1. Образование расклинивающего давления в тонких слоях
До перекрывания диффузных слоев энергия Е свободных дисперсных систем была неизменной, а Р в зазоре = Ро (давление внутри свободной жидкости).
После перекрывания свободная энергия изменяется, а в прослойке жидкости возникает направленное в сторону соприкасающихся тел Р.д.
Представление о расклинивающем давлении – одно из фундаментальных в физико-химии дисперсных систем. Расклинивающее давление возникает всегда, когда между частицами дисперсной фазы (твёрдыми, жидкими или газообразными) образуется тонкая прослойка жидкости. В слое воды толщиной 1 мкм, заключённой между двумя поверхностями слюды, расклинивающее давление равно 430 Па. При толщине прослойки воды 0,04 мкм расклинивающее давление существенно выше и составляет 1,88104Па2.
Для изучения строения пленки и измерения ее толщины обычно используют оптические и, прежде всего, интероферометрические методы.
Интенсивность I отраженного света вследствие интерференции сложным образом зависит от отношения толщины пленки к длине падающей световой волны.
 I
I






1/4 3/4 5/4 7/4 h/λ
Рис. 6.2. Зависимость I отраженного монохроматического света от относительной толщины пленки.
У толстых пленок: h=(k+½)λ/2n.
k – порядок интерференции
n – показатель преломления.
В белом свете тонкие пленки окрашены в различные цвета. Тонкие пленки с h≤ λ/10 кажутся в отраженном свете – серыми, а более тонкие – черными.
Для серых и черных пленок измерение интенсивности I позволяет определить их h, а зависимость I=f(t) – кинетику утончения.
Силы отталкивания в тонких пленках носят электростатический характер:
Еотт=А е – h/δ (6.1)
Еотт ↓ при
1) ↑ Z и С противоионов
2) при ↓φ и дзета-потенциалов
Силы притяжения между частицами имеют природу ван-дер-ваальсовых сил, энергия притяжения выражается уравнением:
![]() (6.2)
(6.2)
Здесь A*- т.н. константа Гамакера(71), объединяющая свойства молекул среды и частиц фазы. Тогда зависимость суммарной потенциальной энергии взаимодействия частиц от расстояния между ними x имеет вид:
U(h)
=А е – h/δ
- ![]() (6.3)
(6.3)
и графически передается кривой на рис.6.3.
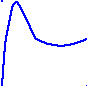
Как видно из рис.6.3, на больших (h > 1 мкм) и очень малых расстояниях (h < 1 нм) преобладает энергия притяжения частиц (U < 0); на средних расстояниях (h 100 нм) преобладает энергия отталкивания (U > 0). Максимум потенциальной энергии соответствует барьеру электростатического отталкивания частиц U, препятствующему агрегации частиц.
Е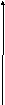
 отт
отт


 1 2 3 h
1 2 3 h
Епр
Рис.6.3.Потенциальная энергия взаимодействия двух одноименно заряженных частиц в зависимости от расстояния между ними
Анализ кривой позволяет выделить на ней следующие характерные участки:
1 – первичный потенциальный минимум возникает на малых расстояниях из-за возрастающих сил притяжения, которые вызывают коагуляцию системы
2 – потенциальный максимум на пути сближения частиц, который препятствует сближению частиц и их агрегации. Его наличие говорит об устойчивости дисперсной системы к агрегации.
3 – вторичный минимум связан с процессом флокуляции.
Устойчивость лиофобных систем, стабилизированных электролитами, зависит от соотношения величины электростатического барьера и кинетической энергии частиц EК, участвующих в броуновском движении.
Состояние коллоидной системы зависит от баланса энергии притяжения и отталкивания. преобладание Еотт приводит к устойчивости системы. преобладание Еприт вызывает коагуляцию.
при малых h (h → 0; Еотт→const; Епр→-∞)
при больших h , т.к. экспоненциальная зависимость убывает быстрее, между частицами преобладает Епр
на средних расстояниях – Еотт.
Частицы дисперсной фазы обладают определенной кинетической энергией Екин = кТ, за счет которой они могут сближаться. В зависимости от соотношения величины ∆U(max) и глубины потенциальных ям (Еmin) возможны следующие состояния дисперсных систем:
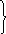
∆U(max) » кТ
∆U(min2) ≤ кТ система агрегативно устойчива
и неглубокий вторичный
минимум
Оставаясь неустойчивой термодинамически, такая система устойчива кинетически. Кинетическая устойчивость может быть повышена также разбавлением коллоидного раствора, т.е. уменьшением числа соударений частиц системы.
∆U(max) ≈ ∆U(min2) ≤ кТ – броуновское движение может сблизить частицы до таких расстояний, что они попадут в первую потенциальную яму, возможна коагуляция.
Такая система и кинетически, и термодинамически неустойчива.
при умеренно глубоком вторичном минимуме
∆U(min2) » кТ
и заметном барьере ∆U(max) = 5-10 кТ
возникает дальнее взаимодействие – образуются флокулы, возможно структурообразование
Именно так образуются гели, имеющие т. н. коагуляционные структуры (см. раздел 6). Их вязкость значительно превышает вязкость систем в свободнодисперсном виде. Между частицами дисперсной фазы при этом сохраняются прослойки среды.
Приведенные закономерности хорошо согласуются с поведением гидрофобных золей.
