
- •Коллоидная химия
- •1.Коллоидные системы и предмет коллоидной химии
- •1.1. Коллоидные системы
- •1.2. Предмет коллоидной химии
- •Первый вариант количественной оценки - основной
- •Например, у частицы кубической формы с размером ребра
- •1.3. Классификация дисперсных систем
- •Классификация коллоидных систем по агрегатному состоянию фаз
- •2. Физическая химия поверхностных явлений
- •2.1. Межмолекулярные связи
- •Отличия молекулярных сил притяжения от химических:
- •Вклад различных видов энергии в общую энергию притяжения молекул
- •2.2.1. Определения поверхностного натяжения
- •1. Поверхностное натяжение численно равно работе обратимого изотермического образования единицы поверхности
- •2.2.3. Факторы, влияющие на величину поверхностного натяжения
- •1. Температура т
- •Поверхностное натяжение веществ на границе с воздухом
- •3) Природа контактирующих фаз
- •2.2.4. Экспериментальные методы определения поверхностного натяжения
- •2.3. Внутренняя (полная) удельная поверхностная энергия
- •Термодинамические характеристики поверхности некоторых жидкостей на границе их с воздухом
- •2.4. Адсорбция
- •2.4.1. Основные понятия и определения
- •2.4.2.1.Уравнение Ленгмюра(*)
- •Основные положения теории Ленгмюра:
- •Экспериментальное определение констант уравнения Ленгмюра
- •Правило Дюкло — Траубе:
- •Экспериментальное определение геометрических размеров молекулы пав
- •2.4.2.3. Изотермы адсорбции на неоднородной поверхности
- •А) теория Поляни(*)
- •Основные положения теории Поляни:
- •Основные положения теории бэт
- •Основные характеристики адсорбентов
- •Классификация адсорбентов:
- •2. По полярности
- •3. По размеру пор
- •2.4.5.2. Влияние кривизны поверхности на равновесие фаз
- •2.4.5.3. Капиллярные явления
- •2.4.5.4.Теория капиллярной конденсации
- •Условия действия капиллярных сил
- •2.4.5.5. Классификация изотерм адсорбции
- •2.4.6. Адсорбция из растворов на твердых адсорбентах
- •2.4.6.1. Молекулярная адсорбция
- •2.4.6.1.2. Основные закономерности адсорбции из растворов неэлектролитов на поверхности твердых адсорбентов)
- •2. Природа растворителя
- •3. Влияние природы адсорбента
- •4. Влияние природы адсорбтива
- •2.4.6.1.2. Основные закономерности адсорбции из растворов электролитов на поверхности твердых адсорбентов.
- •2.4.6.1.3. Ионно-обменная адсорбция
- •2.5. Смачивание. Адгезия. Когзия
- •2.5.1. Адгезия. Когзия
- •Механизм процесса адгезии
- •Несколько механизмов и теорий адгезии
- •2.5.2. Краевой угол смачивания и работа адгезии
- •2.5.3. Избирательное смачивание
- •2.5.4. Инверсия смачиваемости поверхности
- •2.5.5. Количественные характеристики процесса смачивания поверхности.
- •Qсм и b порошкообразных веществ
- •2.5.6. Измерение краевого угла смачивания
- •Использование пав для изменения смачиваемости поверхности
- •Избирательное смачивание
- •3. Молекулярно-кинетические свойства дисперсных систем
- •3.2. Диффузия в коллоидных системах
- •3.3. Седиментация суспензий
- •3.3. Седиментационно-диффузионное равновесие. Седиментационная устойчивость
- •Седиментационная устойчивость
- •4. Модель реального тела. Модель Бингама(*) – вязкопластическое тело
- •Лекция 9. .4.3. Реологические свойства реальных тел
- •Классификация тел по их реологическим свойствам
- •Вязкость агрегативно устойчивых дисперсных систем
- •4.3.2.Реологические свойства структурированных жидкообразных систем
- •Электрические свойства коллоидных растворов (золей)
- •5.1. Электрокинетические явления
- •5.2. Механизм образования дэс
- •4. Поляризация поверхности за счёт внешнего электрического поля.
- •5.3. Строение дэс
- •5.4. Факторы, влияющие на величину ζ-потенциала:
- •5.5.3. Влияние температуры на электрокинетический потенциал
- •5.5.4. Влияние рН среды
- •5.5.5. Экспериментальное определение - потенциала
- •6.Коагуляция и устойчивость дисперсных систем
- •6.1. Устойчивость дисперсных систем
- •6.2. Факторы агрегативной устойчивости
- •6.3. Ионный фактор стабилизации дисперсных систем Теория устойчивости лиофобных золей длфо
- •6.4. Коагуляция лиофобных дисперсных систем
- •6.4.1. Основные закономерности электролитной коагуляции
- •6.4.2. Кинетика электролитной коагуляции
- •6.4.3. Частные случаи электролитной коагуляции
- •6.4.4. Коллоидная защита
- •7. Лиофильные дисперсные системы. Коллоидные поверхностно-активные вещества
- •Классификация и общая характеристика пав
- •Коллоидные пав
- •2. Гидрофильно-липофильный баланс
- •Групповые числа атомных группировок
- •Применение пав
- •3. Строение мицелл пав. Солюбилизация
- •Факторы, влияющие на ккм
- •1) В растворах ипав ↑ Сэл-та ↓ ккм.
- •2) Добавление органических веществ в водные растворы пав по-разному влияет на ккм:
- •3). Влияние температуры т.
- •Значение мицеллярных растворов
- •Лиофобные дисперсные системы. Эмульсии
- •Классификация
- •Устойчивость и стабилизация эмульсий
- •Эмульгаторы
- •Механизм стабилизации:
Основные характеристики адсорбентов
Удельная поверхность - Sуд – это общая поверхность (поверхность всех пор) единицы массы или единицы объёма адсорбента, измеряется в м2/г или м2/см3. Некоторые сорта активированного угля имеют удельную поверхность больше 1000 м2/г. Трудно поверить, но в одном грамме такого адсорбента заключён целый гектар поверхности.
Пористость – отношение суммарного объёма пор к общему объёму адсорбента (в %) – П = Vпор/V. (2.98)
Средний радиус пор (распределение пор по радиусам) - r. В зависимости от среднего радиуса пор адсорбенты классифицируют на макро-, мезо- и микропористые. Распределение пор по радиусам характеризуют дифференциальной функцией распределения
 .
.
Величина
![]() определяет долю пор адсорбента с
радиусами в пределах отr
до (r
+ dr).
определяет долю пор адсорбента с
радиусами в пределах отr
до (r
+ dr).![]() На
рис.2.28 приведены функции распределения
пор по радиусам для адсорбента с
монодисперсными порами (кривая 1) и
полидисперсными порами (кривая 2).
На
рис.2.28 приведены функции распределения
пор по радиусам для адсорбента с
монодисперсными порами (кривая 1) и
полидисперсными порами (кривая 2).
Р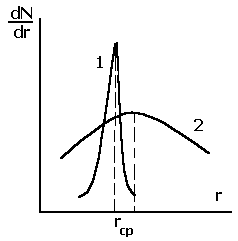 ис.2.28.
Дифференциальные функции распределения
пор адсорбента по радиусам: монодисперсное
- (1); полидисперсное - (2) распределение
пор.
ис.2.28.
Дифференциальные функции распределения
пор адсорбента по радиусам: монодисперсное
- (1); полидисперсное - (2) распределение
пор.
Форму пор (цилиндрическая, «бутылкообразная», щелевидная, сфероидальная и т.д.) того или иного адсорбента устанавливают, проведя исследование капиллярной конденсации (см. раздел 3.2.5). Для каждой формы пор имеется свой тип петли гистерезиса. Распределение пор по радиусам получают обычно из данных ртутной порометрии. Ртуть не смачивает стенки капилляров практически всех адсорбентов и может проникнуть внутрь них только под действием внешнего давления. Ртуть вдавливают в образец адсорбента, постепенно увеличивая давление. При этом регистрируют зависимость объёма вдавленной ртути от давления. Сначала заполняются ртутью макропоры, затем – мезопоры и, наконец, - микропоры. Путём математической обработки данных порометрии получают дифференциальные кривые, аналогичные изображенным на рис 2.28.
Классификация адсорбентов:
1. По структуре
а) корпускулярные — структуры из сросшихся между собой мельчайших частиц (корпускул – греч. «частиц»),связанных химическими или физическими силами — корпускул.
Наиболее прочные структуры образуются при срастании частиц в результате процессов поверхностной или объемной диффузии или отложения материала, поступающего из другой фазы, у точек контакта частиц. Поры в корпускулярных структурах образованы промежутками между частицами. Их размеры и форма зависят от размеров и формы частиц и плотности их упаковки. Чем крупнее частицы и чем рыхлее они упакованы, тем больше размер пор. Форма аморфных частиц обычно сферическая. Кристаллические частицы имеют самую различную форму в зависимости от их кристаллографического строения и дефектности структуры.
Подавляющее большинство промышленных адсорбентов и носителей для катализаторов имеет корпускулярное строение. Примерами могут служить силикагель, алюмосиликатный катализатор, аморфный гидроксид алюминия и другие пористые тела, состоящие из аморфных частиц. Из глобул состоят такие известные адсорбенты и наполнители, как сажа, аэросилы, аэрогели. Очень часто первичные частицы таких адсорбентов образуют более крупные вторичные агрегаты.
Получение:
Синтетические получают по схеме:
Синтез гидрозоля → коагуляция (гель) → сушка, дробление
(гель — более или менее жёсткие пространственные сетки, каркасы)
Например, получение силикагеля — поликонденсация кремниевой кислоты, коагуляция → гель (силикагель) с размером зерен 0,1 - 7мм.
Природные: уголь, древесина, картон, бумага, ткани, зерно, кожа, глина, почвы, грунты
б) кристаллические
Цеолиты — алюмосиликаты, обладающие строго регулярной кристаллической структурой.
Каркас состоит из тетраэдров SiO44- AlO45-:
окна полостей 0,4 — 1,1 нм соизмеримы с размерами молекул. На цеолитах адсорбируются вещества, молекулы которых имеют размер, меньший диаметра окон полостей, поэтому цеолиты называют по-другому «молекулярными ситами», они жадно поглощают воду, при нагревании камня вода испаряется («кипящий камень»)
в) губчатые структуры — массивные тела, пронизанные порами.
Большая часть этих структур имеет ячеистое строение, в котором пустоты-ячейки соединены друг с другом более узкими проходами - горлами (бутылкообразные поры). Каждая пора в такой структуре имеет одно или несколько горл, ведущих в соседние поры.
Губчатые структуры образуются при химическом воздействии реагентов на непористое твердое тело. В результате избирательного удаления части вещества в нем образуются поры. Так, при активировании угля в окислительной атмосфере при температуре 1300К часть углерода выгорает и образуется разветвленная система пор. Воздействием кислот на натриево-боросиликатное стекло удаляется натриево-боратный компонент и остается кремнеземный остов, пронизанный бутылкообразными порами. Аналогично получают никель Ренея выщелачиванием алюминия из никель-алюминиевого сплава.
Получение — обработка крупнопористых материалов агрессивными газами или жидкостями.
Активированные угли получают из различного сырья — каменного угля, торфа, дерева, животных костей, ореховых косточек следующим образом:
1. удаляют летучие вещества при нагревании без доступа воздуха:
активизируют уголь окислением О2, СО2, Н2О или химическими реагентами.
Так получают катализатор — никель Рэнея:
NiAl сплав + NаОН → Ni губчатый
